特发性肺纤维化患者血清外泌体microRNA表达谱的变化及临床意义
2022-06-10石卓林杨晓花袁晓梅
石卓林,杨晓花,袁晓梅
(1.新乡医学院第一附属医院全科医学,河南 卫辉 453100;2.新乡医学院第一附属医院呼吸内科,河南 卫辉 453100)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种慢性、进行性呼吸系统疾病,临床表现以呼吸困难、肺功能逐渐恶化,病理变化以肺泡上皮细胞损伤、成纤维细胞过度增殖、肺泡结构破坏为主要特征[1-2]。IPF的发病机制目前尚不明确,临床尚无理想的治疗手段,患者预后较差,多进展为呼吸衰竭[3]。对IPF发病机制的深入研究,有望实现早期干预,进而改善临床治疗效果。
外泌体是一类直径80~100 nm的磷脂膜包被囊泡,内含蛋白质、脂质、DNA、RNA等多种物质,广泛存在于机体血液、唾液、尿液、脑脊液、羊水等体液中[4]。外泌体microRNAs表达谱受到外界环境刺激、疾病状态不同产生相应变化,外泌体microRNA被认为是细胞间信息传递的“信使”,参与机体功能调控。外泌体microRNA在肿瘤、代谢性疾病、自身免疫性疾病、神经系统疾病等发生发展中起到了明确的作用[5-7]。本研究应用高通量测序技术,对比了健康人群与IPF患者血清外泌体microRNA表达谱的差异,旨在探讨IPF发生的可能机制及IPF干预的新靶点。
1 资料与方法
1.1 一般资料选择2019年1月至2021年1月就诊于新乡医学院第一附属医院呼吸内科的24例初诊IPF患者作为IPF组,其中男13例,女11例;年龄47~69(59.79±5.99)岁,有吸烟史者9例。病例纳入标准:(1)符合2016年《特发性肺纤维化诊断和治疗中国专家共识》中IPF诊断标准[8];(2)首次确诊的IPF患者;(3)年龄18~70岁;(4)临床资料完整。另选择同期健康体检者24名为对照组,其中男10例,女14例;年龄47~70(57.83±6.72)岁,有吸烟史者5例。对照组纳入标准:(1)既往体健,入组时未合并临床明确诊断的急慢性疾病;(2)年龄18~70岁;(3)临床资料完整。IPF组及对照组均排除患有严重心脏疾病、感染、肝肾疾病、血液系统疾病、自身免疫性疾病、糖尿病、肿瘤等疾病者。2组研究对象性别、年龄、吸烟史比例比较差异无统计学意义(P>0.05),具有可比性。所有研究对象签署知情同意书,本研究经新乡医学院第一附属医院伦理委员会审核批准。
1.2 方法
1.2.1 2组受试者肺功能相关指标检测分别于IPF患者入院后第2天、对照组受试者体检日使用肺功能检测仪器(德国Cortex Matamax 3B)进行肺功能相关指标检测。受试者戴上呼吸面罩后,先用嘴巴正常呼吸 3~5次,待测试界面中呼吸曲线趋于稳定后,受试者深吸一口气,然后快速吐气,吐气时间根据设备界面提示,连续2次满足要求即为完成,记录受试者肺总量 (total lung capacity,TLC)、第1 秒用力呼气容积占预计值百分比(forced expiratory volume in one second/predict value,FEV1% pred) 、一氧化碳弥散量占预计值百分比(carbon mon-oxide diffusing capacity /predict value,DLCO%pred)。
1.2.2 血清外泌体分离提取及鉴定于清晨空腹状态下采集2组受试者静脉血15 mL,于4 ℃下3 000×g离心10 min,分离血清;将上清液移入50 mL 离心管,放入高速离心机中,12 000×g离心45 min 去除细胞碎片及细胞器成分;取上清液,再次放入高速离心机,110 000×g离心2 h,弃上清保留沉淀物;用 l mL 磷酸盐缓冲溶液(phosphate buffer saline,PBS)将沉淀物重悬,经0.22 μm无菌滤器过滤后移入50 mL离心管中; 110 000×g再次离心70 min,弃上清,得到的沉淀即为提纯后的外泌体。用200 μL PBS将沉淀重悬后置于-80 ℃冰箱保存。使用透射电镜鉴定分离出的外泌体形态。
1.2.3 外泌体microRNA的提取及cDNA文库构建采用TRIzol法提取外泌体总RNA。提取出的总RNA使用锐博公司microRNA实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒进行反转录构建cDNA文库。
1.2.4 microRNA测序及生物信息学分析构建好的cDNA文库由广州锐博生物公司使用 Agilent 2100 Bioanalyzer 和 ABI StepOnePlus RT-PCR 系统进行质控。通过质控后的样本借助公司Illumina HiSeqTM2500高通量测序平台进行测序。应用Target Scan 7.0、miRDB及 miRanda软件预测靶基因,对靶基因进行京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路注释。
2 结果
2.1 2组受试者肺功能相关指标比较结果见表1。IPF组患者的TLC、FEV1% pred、DLCO%pred均显著低于对照组,差异有统计学意义(P<0.05)。

表1 2组受试者肺功能相关指标比较
2.2 2组受试者血清外泌体microRNA表达谱比较透射电镜下可见外泌体为直径100 nm左右的囊泡(图1)。2组受试者间共有168种差异表达的microRNA。与对照组比较,IPF组有64种microRNA表达上调,104种microRNA表达下调(图2)。
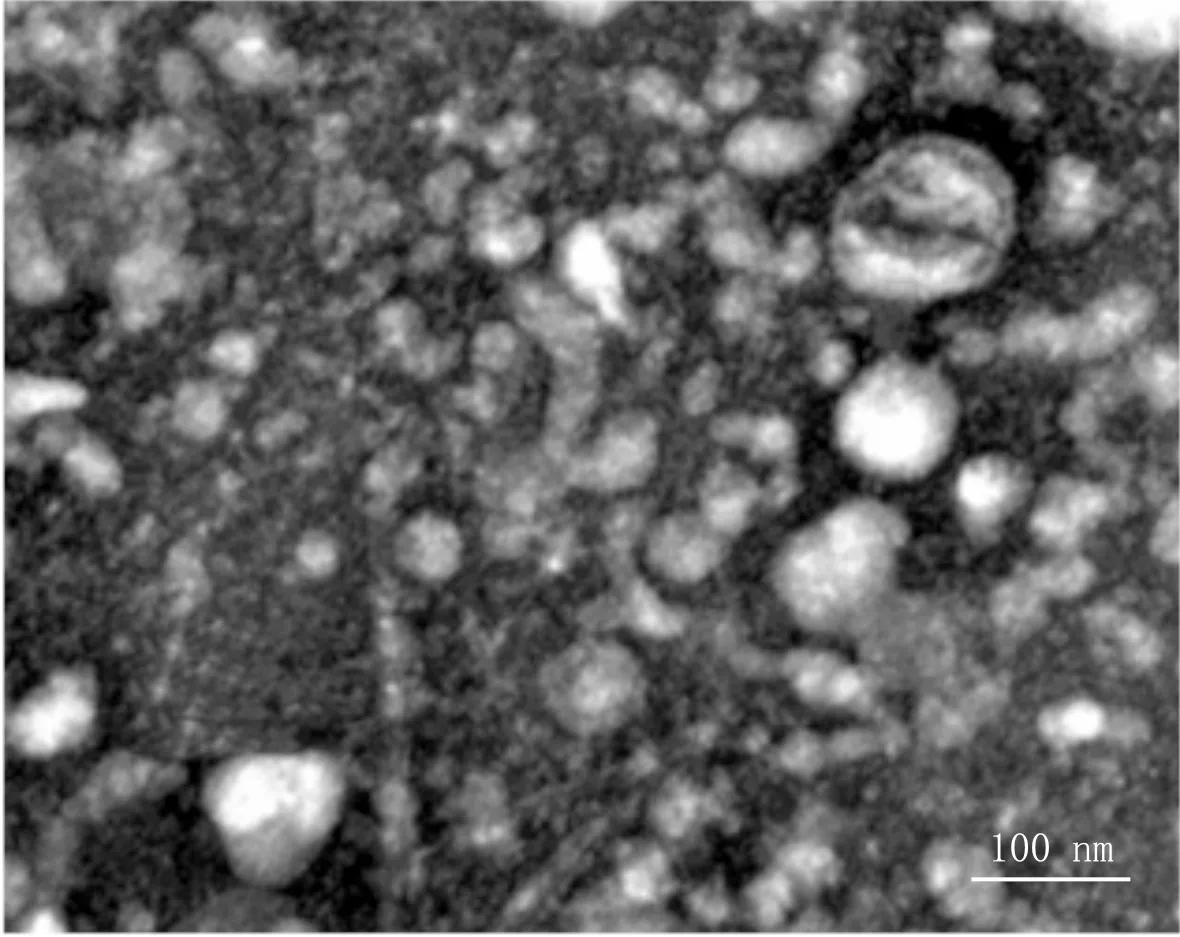
图1 外泌体形态结构(透射电镜,×20 000)
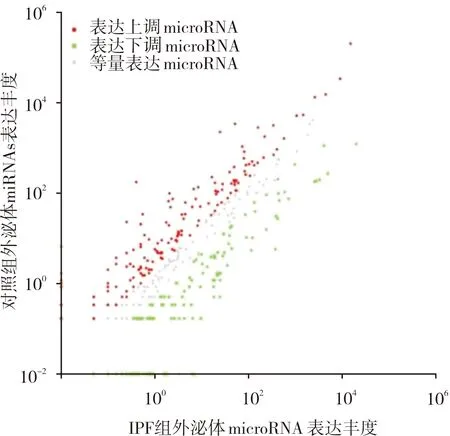
图2 2组受试者外泌体中microRNA的表达
2组受试者血清外泌体中microRNA按表达量由高到低排序,对照组中表达量最高的前5种microRNA分别为miR-1-3p、miR-148a-3p、miR-99a-5p、miR-126a-3p和miR-1b,分别涉及磷脂酰肌醇激酶/丝氨酸/苏氨酸激酶/哺乳动物雷帕霉素靶蛋白信号通路(phosphatidylinositol-3-kinase/Akt/mammalian target of rapamycin signaling pathway,PI3K/Akt/mTOR)信号通路、丝裂原活化蛋白激酶(mitogenactivated protein kinases,MAPK)信号通路、mTOR信号通路及柠檬酸循环。IPF组中表达量最高的前5种microRNA分别为miR-148a-3p、miR-206-3p、miR-126a-3p、miR-3596a和let-7a-5p,分别涉及MAPK信号通路、醚类脂质代谢、柠檬酸循环、环磷腺苷(cyclic adenosine monophosphate,cAMP)信号通路以及Notch 信号通路。与对照组相比,IPF组中有3种microRNA(miR-1-3p、miR-99a-5p、miR-1b)的表达量发生了变化,该3种microRNA涉及PI3K/Akt/mTOR信号通路。IPF组患者血清外泌体中miR-1-3p、miR-99a-5p的表达显著低于对照组,差异有统计学意义[log2(fold change)分别为-3.98和-3.78,P<0.05];2组间miR-1b表达量比较差异无统计学意义[log2(fold change)=1.36,P>0.05]。
将2组受试者血清外泌体中microRNA按照表达差异倍数由高到低排序,差异最大的前5种microRNA分别为miR-672-5p(涉及肿瘤坏死因子信号通路)、miR-466b-3p(涉及炎症介质对瞬时受体电位的调控)、miR-204-5p(涉及磷脂酰肌醇信号系统)、miR-215(涉及核黄素代谢)、miR-411-5p(涉及PI3K/Akt/mTOR信号通路)。
2组受试者血清外泌体中microRNA的表达模式相近,反映出样本质控良好(图3)。
图3 2组受试者外泌体microRNA热图
2.3 差异表达的microRNA与IPF患者肺功能的关系结果见图4。将按表达量由高到低排序筛选出的2种差异表达且涉及PI3K/Akt/mTOR信号通路的microRNA(miR-1-3p、miR-99a-5p)和按照表达差异倍数由高到低筛选出的1种差异表达且涉及PI3K/Akt/mTOR信号通路的microRNA(miR-411-5p)与IPF患者肺功能指标进行相关性分析,结果显示,miR-1-3p、miR-99a-5p、miR-411-5p与IPF患者 DLCO%pred呈正相关(r=0.575、0.617、0.825,P<0.05);3种microRNAs与IPF患者的TLC、FEV1% pred无相关性(rTCL=0.324、0.24、0.396,rFEV1%pred=0.411、0.389、0.474;P>0.05)。
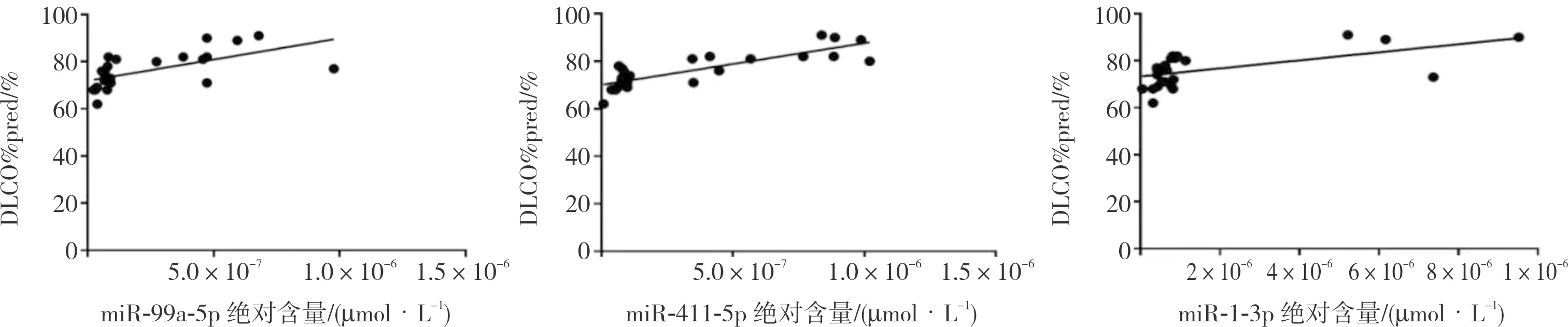
图4 血清外泌体miR-1-3p、miR-99a-5p、miR-411-5p与IPF患者DLCO%pred的相关性
3 讨论
IPF以肺组织成纤维细胞异常增殖、细胞外基质沉积及炎症细胞浸润为特点,最终引起肺功能进行性下降,目前尚无理想的治疗药物,确诊患者的平均生存周期仅3 ~ 5 a,针对IPF发病机制及新治疗药物的探索一直是呼吸系统疾病研究领域的热点[2,9]。
近年来,外泌体在细胞间信息传递中的作用得到了广泛的证实,其中关于外泌体microRNA的作用研究最为成熟。供体细胞受机体疾病状态影响,产生的外泌体microRNA表达谱发生变化,被下游的接收细胞摄取后作用于microRNA的靶基因,调节下游细胞的生物学行为。研究发现,外泌体microRNA参与了代谢性疾病、自身免疫性疾病、肿瘤转移等病理过程。外泌体microRNA在组织纤维化发展中起到了重要作用。WANG等[10]研究发现,外泌体miR-425及miR-744参与了心肌纤维化的发展,且其表达量的下降程度与心力衰竭进展密切相关。LV 等[11]研究发现,外泌体miR-29c 和miR-21的表达异常可能参与了肾脏纤维化,并且miR-29c和miR-21的表达量可用于预测肾脏纤维化程度。此外,还有研究表明,外泌体microRNA参与了腹膜及肝脏的纤维化[12-13]。
还有研究发现,外泌体microRNA有望成为纤维化病变的诊断标志物,可为疾病的分期、预后判断提供新的手段[14-15]。MAKIGUCHI等[15]研究发现,血清外泌体miR-21-5p水平与IPF患者肺功能密切相关,高水平的miR-21-5p是IPF患者肺功能快速下降、高病死率的预测指标。GUIOT 等[16]研究发现,IPF患者唾液外泌体miR-142-3p的表达量与肺功能呈负相关,异常表达的microRNA可通过Wnt信号通路促进间充质干细胞异常增殖,促进肺组织纤维化。本研究发现,IPF组患者血清外泌体microRNA表达谱与对照组比较有差异,2组受试者外泌体microRNA种类及含量不同。对照组受试者血清外泌体中microRNA丰度最高的前5种microRNA中,包含3种与PI3K/Akt/mTOR信号通路相关的microRNA(miR-1-3p、miR-99a-5p、miR-1b),而这些microRNA在IPF组中表达下降。此外,比较2组受试者表达差异倍数最为明显的5种microRNA,涉及PI3K/Akt/mTOR信号通路的miR-411-5p在IPF组中表达显著降低。这提示,与对照组比较,涉及PI3K/Akt/mTOR信号通路的microRNA表达量在IPF患者中显著降低。
mTOR是一种丝氨酸/苏氨酸蛋白激酶,mTOR可将其下游蛋白磷酸化,参与调控蛋白质及脂类合成、细胞生长、细胞自噬等过程。mTOR 信号通路的上游受多种信号通路调控,其中PI3K/Akt/mTOR 信号通路是调节细胞生长、增殖和存活的核心信号通路。异常的PI3K/Akt/mTOR信号通路参与心肌、肾脏及肝脏等多种脏器和组织的纤维化过程[17-19]。动物实验表明,活化的PI3K/Akt/mTOR信号通路可促进成纤维细胞增殖及纤维化进程,抑制PI3K/Akt/mTOR信号通路可促进成纤维细胞凋亡,减少细胞外基质沉积,延缓肺组织纤维化[20-21]。此外有研究发现,PI3K/Akt/mTOR信号通路是参与细胞自噬的重要通路,激活PI3K/Akt/mTOR信号通路可抑制自噬发生[22]。肺泡上皮损伤导致的上皮间质转分化(epithelial-mesenchymal transition,EMT)与IPF的发生密切相关,而自噬活性下降是导致EMT发生的重要分子机制[23-24]。由此推测,活化的PI3K/Akt/mTOR信号通路参与了IPF的发生。本研究发现,血清外泌体miR-1-3p、miR-99a-5p、miR-411-5p表达量与患者肺功能呈正相关性,miR-1-3p、miR-99a-5p、miR-411-5p表达量越低,患者肺功能越差。microRNA的经典作用机制为通过与信使RNA 3′端非翻译区的microRNA调控元件结合,导致信使RNA降解,起到负向调控靶基因表达的作用。因此推测,IPF患者血清中外泌体microRNA表达量降低可能使得PI3K/Akt/mTOR信号通路被异常活化,从而参与IPF的发生。
目前外泌体的治疗作用已在多个领域内得到证实,干细胞或正常个体来源的外泌体可通过传递功能性microRNA在肿瘤、神经系统疾病、慢性炎症等疾病领域发挥治疗作用。本研究的不足为仅对3种差异表达的外泌体microRNA表达趋势与IPF患者肺功能进行了相关分析。3种差异表达的microRNA在IPF发生、发展中的确切作用以及外泌体microRNA对IPF的治疗作用还有待进一步的体内外实验验证。
