扶正抗癌方通过miR155-C/EBP-β途径逆转M2型巨噬细胞极化❋
2022-06-09李龙妹王苏美廖桂雅吴万垠
李龙妹, 王苏美, 唐 青, 廖桂雅, 吴万垠
(广州中医药大学第二附属医院, 广州 510370)
肿瘤细胞与肿瘤微环境之间的交叉对话在肿瘤发展中扮演着重要角色,与中医的“整体观”不谋而合。扶正抗癌方(fuzheng kang-ai decoction, FZKA)正是在中医整体观念和辨证论治的指导下总结的经验方,目前已广泛应用于临床。前期研究发现,扶正抗癌方联合吉非替尼可延长非小细胞肺癌患者中位疾病无进展生存时间以及中位生存时间[1,2];基础研究发现,对于非小细胞肺癌细胞,扶正抗癌方可抑制细胞增殖[3-5],逆转上皮间质转化(epithelial-mesenchymal transition, EMT),进而抑制细胞转移[6-8],诱导细胞凋亡[9],逆转细胞对吉非替尼的耐药[10]。肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)是肿瘤微环境的重要组成部分,诱导TAMs由M2型向M1型极化转变是抑制肿瘤转移的一个重要靶点。为此,本文以小鼠巨噬细胞RAW264.7细胞为对象,检测扶正抗癌方对巨噬细胞极化的影响,并探讨其作用分子机制,进一步探明扶正抗癌方治疗肿瘤的机理。
1 材料
1.1 细胞株
小鼠巨噬细胞RAW264.7细胞株购自中国医学科学院基础医学研究所细胞资源中心。细胞培养及传代:RAW264.7细胞培养环境为37 ℃、5% CO2,用DMEM高糖培养基+10%胎牛血清进行培养及传代。M2型巨噬细胞的诱导:加入重组白细胞介素-4(interleukin-4, IL-4, 20 ng·mL-1),培养48 h。
1.2 药物、试剂与仪器
扶正抗癌方是广东省名中医吴万垠教授的协定方,现已制备成颗粒剂。扶正抗癌方组成:太子参15 g,白术15 g,黄芪30 g,炒薏苡仁30 g,甘草10 g,山慈菇30 g,白花蛇舌草30 g,龙葵30 g,石见穿30 g,八月札30 g,蛇泡簕30 g,莪术15 g。颗粒剂由广东一方制药制备完成,按照《中华人民共和国药典》2010版颗粒剂项下常规项目进行质量控制。制备步骤:药材加水浸泡30 min,加热至沸煎2 h分离煎液,药渣继续加水煎煮合并煎液,低温减压浓缩,喷雾干燥制成干粉后压制成颗粒分装,每剂分2袋装,每袋15 g,1 g=10.33 g生药。本文实验过程中,将颗粒加入1640培养基充分震荡超声,37 ℃水浴加热,离心取上清后0.22 μm滤器过滤制备成20 mg·mL-1母液,4 ℃保存。本文测定加入扶正抗癌方后培养基的pH值为7.2~7.4,显微镜下观察细胞形态未发生变化,排除扶正抗癌方药液加入对细胞生长环境的pH值及细胞渗透压的影响。
蛋白质印迹法iNOS抗体、TGF-β抗体、C/EBP-β抗体(美国CST公司,货号13120 s、3711 s、3087);流式细胞术的荧光CD 206抗体和荧光CD163抗体(美国BioLegend公司,货号141705、155307);蛋白质印迹法CD206(美国R&D公司,货号AF2535);二抗(美国Bio-Rad公司,货号1706515);胎牛血清、胰酶(美国Gibco公司,货号10270-106、25200-072);microRNA 逆转录试剂盒、定量PCR检测试剂盒(南京诺唯赞生物科技股份有限公司,货号MR101-02、Q711-02);miR155引物及内参U6引物、miR155 inhibitor 及nc-inhibitor(广州锐博生物科技公司)。miR155 inhibitor主要作用序列:5′-ACCCCUAUCACGAUUAGCAUUAA-3′,nc-inhibitor主要作用序列:5′-CAGUACUUUUG UGUAGUACAA-3′。
5430R型冷冻离心机,德国Eppendorf公司;ABI7500荧光定量PCR仪,美国Applied Biosystems公司;NovoCyte流式细胞仪,美国Agilent公司;ChemiDoc XRS+型化学发光凝胶成像系统,美国Bio-Rad公司;1658033型垂直电泳系统及1703940型半干转印系统,美国Bio-Rad公司。
2 方法
2.1 分组
探究扶正抗癌方对miR155、C/EBP-β mRNA和蛋白、巨噬细胞表型影响的实验中,设Mφ组(RAW264.7细胞组)、Mφ+IL-4组(经IL-4诱导的M2型巨噬细胞组)和Mφ+IL-4+FZKA组(给予FZKA作用的M2型巨噬细胞组):取对数生长的RAW264.7细胞加入重组IL-4(20 ng·mL-1),培养48 h诱导为M2型巨噬细胞,接种于六孔板,24 h后分别加入含不同浓度扶正抗癌方培养基,继续培养24 h,收集样品行流式细胞术、蛋白质印迹法及实时荧光定量PCR(quantitative real-time PCR, qPCR)法检测,其中流式细胞术另设同型对照组(Isotype组,RAW264.7细胞组),目的是消除由于抗体非特异性结合到细胞表面而产生的背景染色。探究miR155模拟物和抑制物对miR155表达的影响以及miR155抑制物对C/EBP-β mRNA表达影响的实验中,设nc-mimic组(空转模拟物组)、nc-inhibitor组(空转抑制物组)、miR155-mimic组(转染miR155模拟物组)和miR155-inhibitor组(转染miR155抑制剂组):将M2型巨噬细胞接种于六孔板,24 h后分别将miR155模拟物和抑制物以及相应的阴性对照瞬时转染至M2型巨噬细胞中,48 h后收集样品行qPCR检测。探究miR155抑制剂抑制扶正抗癌方对M2型巨噬细胞极化的逆转实验中,设Isotype组、Mφ组、Mφ+IL-4组、Mφ+IL-4+FZKA组、Mφ+IL-4+miR155 inhibitor组(转染miR155抑制剂的M2型巨噬细胞组)和Mφ+IL-4+miR155 inhibitor+ FZKA组(给予FZKA作用的转染miR155抑制剂的M2型巨噬细胞组):取对数生长的RAW264.7细胞加入重组IL-4,培养48 h诱导为M2型巨噬细胞,接种于六孔板,24 h后在相应组中瞬时转染miR155inhibitor,48 h后在相应组中加入含2.0 mg·mL-1扶正抗癌方培养基,24 h后收集样品行流式细胞术。
2.2 流式细胞术
收集样品至流式管离心去上清,PBS缓冲液洗3次,加入相应的抗体避光孵育30 min后上机操作,检测巨噬细胞的标志物CD206和CD163的表达(抗体稀释终浓度为1.25 μg/mL),采用Novo Express软件分析数据并导出实验结果。
2.3 实时荧光定量PCR
收集样品用RNA提取试剂盒提取总的RNA,按照逆转录试剂盒说明书逆转录成cDNA,再分别用相应的PCR引物(见表1)和内参(U6和GAPDH)进行PCR扩增,2-△△Ct法计算目的基因相对表达量。

表1 引物设计
2.4 蛋白质印迹法
收集样品提取总蛋白,BCA测定蛋白浓度、电泳、转膜、孵育抗体,iNOS、TGF-β、C/EBP-β抗体均按照1∶1000稀释;ECL化学发光法成像,Image Lab显影并进行数据分析。
2.5 瞬时转染法
RAW264.7细胞转染效率较低,选用广州锐博生产的riboFECT CP转染。取对数生长的细胞,以新鲜的完全培养基(无抗生素)重悬,接种于六孔板。第2天转染,配制1×CP buffer:以PBS溶液将10×CP buffer稀释为1×,每个EP管加入120 μL 1×CP buffer;在EP管中加入inhibitor溶液20 μL/孔,轻轻混匀,室温孵育10 min;再加入CP reagent, 12 μL/孔轻轻混匀,室温孵育10 min;取137 μL inhibitor和转染试剂的混合溶液加入含1863 μL培养基的六孔板中轻轻摇匀,培养箱中继续培养24~48 h,再进行后续处理。
2.6 统计学方法
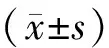
3 结果
3.1 RAW264.7细胞向M2型巨噬细胞的极化
蛋白质印迹法检测iNOS、CD206、TGF-β的蛋白表达(如图1表2);与Mφ组比较,Mφ+IL-4组中iNOS表达降低,CD206和TGF-β表达增加,差异有统计学意义(P<0.01,P<0.05)。流式细胞术检测CD206和CD163的表达(如图2表3);与Mφ组比较,Mφ+ IL-4组中CD206和CD163表达增加,差异有统计学意义(P<0.01)。结果显示,经IL-4诱导的RAW264.7细胞极化为M2型巨噬细胞。

注:A. Mφ组(RAW264.7细胞组);B. Mφ+IL-4组(经IL-4诱导的M2型巨噬细胞组)图1 蛋白质印迹法检测一氧化氮合成酶(iNOS)、巨噬细胞甘露糖受体(CD)206和转化生长因子-β(TGF-β)蛋白的表达
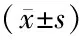
表2 蛋白质印迹法检测一氧化氮合成酶(iNOS)、巨噬细胞甘露糖受体(CD)206和转化生长因子-β(TGF-β)蛋白的表达
3.2 扶正抗癌方对巨噬细胞表型的影响
流式细胞术检测CD206和CD163的表达(如图2)。表3示,与Mφ+IL-4组比较,Mφ+IL-4+FZKA组(2.0 mg·mL-1)中CD206和CD163的表达降低,差异有统计学意义(P<0.01)。qPCR和蛋白质印迹法分别检测iNOS、CD206、TGF-β的mRNA和蛋白表达(如图3表4);与Mφ+IL-4组比较,Mφ+IL-4+FZKA组中iNOS mRNA和蛋白表达增加,CD206和TGF-β mRNA和蛋白表达降低,差异有统计学意义(P<0.01)。结果显示,加入扶正抗癌方药液后可逆转M2型巨噬细胞的极化且呈浓度依赖性。
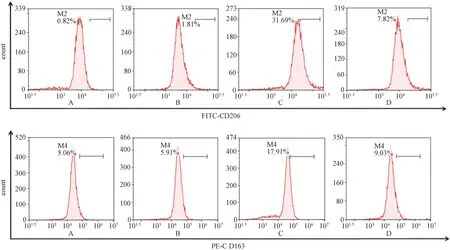
注:A. Isotype组(RAW264.7细胞组);B. Mφ组(RAW264.7细胞组);C. Mφ+IL-4组(经IL-4诱导的M2型巨噬细胞组);D. Mφ+IL-4+FZKA组(给予FZKA作用的M2型巨噬细胞组);FZKA为扶正抗癌方图2 流式细胞术检测M2型标志物巨噬细胞甘露糖受体(CD)206和CD163表达比较
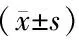
表3 流式细胞术检测M2型标志物巨噬细胞甘露糖受体(CD)206和CD163表达比较
3.3 扶正抗癌方对C/EBP-β mRNA和蛋白表达的影响
qPCR和蛋白质印迹法检测C/EBP-β mRNA和蛋白的表达(如图3表4);与Mφ+IL-4组比较,Mφ+IL-4+FZKA组(2.0 mg·mL-1)中C/EBP-β mRNA和蛋白表达降低,差异有统计学意义(P<0.01)。结果显示,扶正抗癌方能够在基因及蛋白质水平呈浓度依赖性,并抑制C/EBP-β的表达。

注:A. Mφ+IL-4组(经IL-4诱导的M2型巨噬细胞组);B. Mφ+IL-4+FZKA 1.5 mg·mL-1组(给予1.5 mg·mL-1FZKA作用的M2型巨噬细胞组);C. Mφ+IL-4+FZKA 2.0 mg·mL-1组(给予2.0 mg·mL-1FZKA作用的M2型巨噬细胞组);白细胞介素-4(IL-4);FZKA为扶正抗癌方 图3 扶正抗癌方对一氧化氮合成酶(iNOS)、巨噬细胞甘露糖受体(CD)206和转化生长因子-β(TGF-β)、转录因子CCAAT增强子结合蛋白β(C/EBP-β)蛋白表达的影响
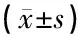
表4 扶正抗癌方对一氧化氮合成酶(iNOS)、巨噬细胞甘露糖受体(CD)206、转化生长因子-β(TGF-β),转录因子CCAAT增强子结合蛋白β(C/EBP-β)mRNA和蛋白表达的影响
3.4 扶正抗癌方对miR155表达的影响
qPCR检测miR155的表达(如表5),与Mφ+IL-4组比较,Mφ+IL-4+FZKA组(1.5, 2.0 mg·mL-1)中miR155表达增加且呈浓度依赖性,差异有统计学意义(P<0.01)。结果显示,扶正抗癌方以浓度依赖性促进miR155的表达。
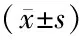
表5 扶正抗癌方对miR155表达的影响
3.5 miR155模拟物和抑制物对M2型巨噬细胞miR155表达的影响
qPCR检测miR155的表达(如表6),与nc-mimic组比较,转染miR155模拟物组(miR155-mimic组)中miR155的表达增加,差异有统计学意义(P<0.01);与nc-inhibitor组比较,转染miR155抑制物组(miR155-inhibitor组)中miR155的表达降低,差异有统计学意义(P<0.01)。结果显示,miR155 mimics和inhibitors在M2型巨噬细胞中转染成功。
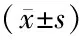
表6 转染miR155模拟物和抑制物后M2型巨噬细胞中miR155的表达
3.6 miR155对C/EBP-β mRNA表达的影响
qPCR检测miR155的表达(如表7),与nc-inhibitor组比较,miR155-inhibitor组C/EBP-β mRNA表达增加,差异有统计学意义(P<0.01)。结果显示,miR155能够靶向抑制C/EBP-β mRNA的表达。
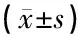
表7 miR155对转录因子CCAAT增强子结合蛋白β(C/EBP-β)mRNA表达的影响
3.7 miR155 inhibitor抑制扶正抗癌方对M2型巨噬细胞极化的逆转
流式细胞术检测CD206和CD163的表达(如图4表8),与Mφ组比较,Mφ+IL-4组中CD206和CD163表达增加,差异有统计学意义(P<0.01),结果显示巨噬细胞向M2型极化成功;与 Mφ+IL-4组比较,Mφ+IL-4+FZKA组中CD206和CD163表达降低,差异有统计学意义(P<0.01),结果显示扶正抗癌方逆转M2型巨噬细胞的极化;与Mφ+IL-4+FZKA组比较,Mφ+IL-4+miR155 inhibitor + FZKA组中CD206和CD163表达增加,差异有统计学意义(P<0.01,P<0.05)。结果显示,miR155 inhibitor抑制扶正抗癌方对M2型巨噬细胞极化的逆转。
4 讨论
TAMs是位于肿瘤间质中的巨噬细胞,由外周血单核细胞或组织中巨噬细胞循环至肿瘤部位分化而成,占肿瘤组织的50%以上[11]。在不同微环境下,TAMs可分化为M1型或M2型。在恶性肿瘤中,受Th2型细胞因子调控,如IL-4、IL-13,TAMs倾向于分化为M2型。临床研究发现,高TAMs密度肿瘤患者的无复发存活率及总存活率均显著低于低TAMs密度患者,表明TAMs是一个不良预后因素,可能是一个潜在的临床预后指标[12]。
M1型巨噬细胞的特征之一是表面标志物CD80和CD86高表达,且能够分泌大量诱导型iNOS、IL-12、IL-23和肿瘤坏死因子α(tumor necrosis factor α, TNF-α)等促炎因子,抑制肿瘤增殖并破坏肿瘤血管内皮,发挥抗肿瘤免疫功能[13]。M2型巨噬细胞特征之一是表面标志物CD206和CD163的高表达,且能够分泌IL-4、IL-10、TGF-β等抑炎因子,降解细胞外基质,促进血管生成,发挥逃脱免疫监视功能[14,15]。当以IL-4诱导RAW264.7细胞后,流式细胞术检测CD206和CD163表达增加,同时蛋白质印迹法检测iNOS表达降低,TGF-β表达增加,表明IL-4可诱导巨噬细胞向M2型极化。加入扶正抗癌方后,流式细胞术检测CD206和CD163表达下降,qPCR和蛋白质印迹法分别在基因和蛋白质水平检测iNOS表达增加,TGF-β表达降低,表明扶正抗癌方可逆转M2型巨噬细胞的极化。前期研究发现,扶正抗癌方的主要活性成分为绿原酸、隐绿原酸等。文献报道也提示,绿原酸通过Janus激酶-信号传导和转录激活子(the janus kinase/signal transducer and activator of transcription, JAK/STAT)信号通路抑制肝癌相关巨噬细胞M2极化,通过抑制巨噬细胞向M2型极化,进而抑制胶质母细胞瘤的生长等[16,17],也与本文研究结果吻合。考虑扶正抗癌方在逆转M2型巨噬细胞极化时有可能绿原酸起重要作用。
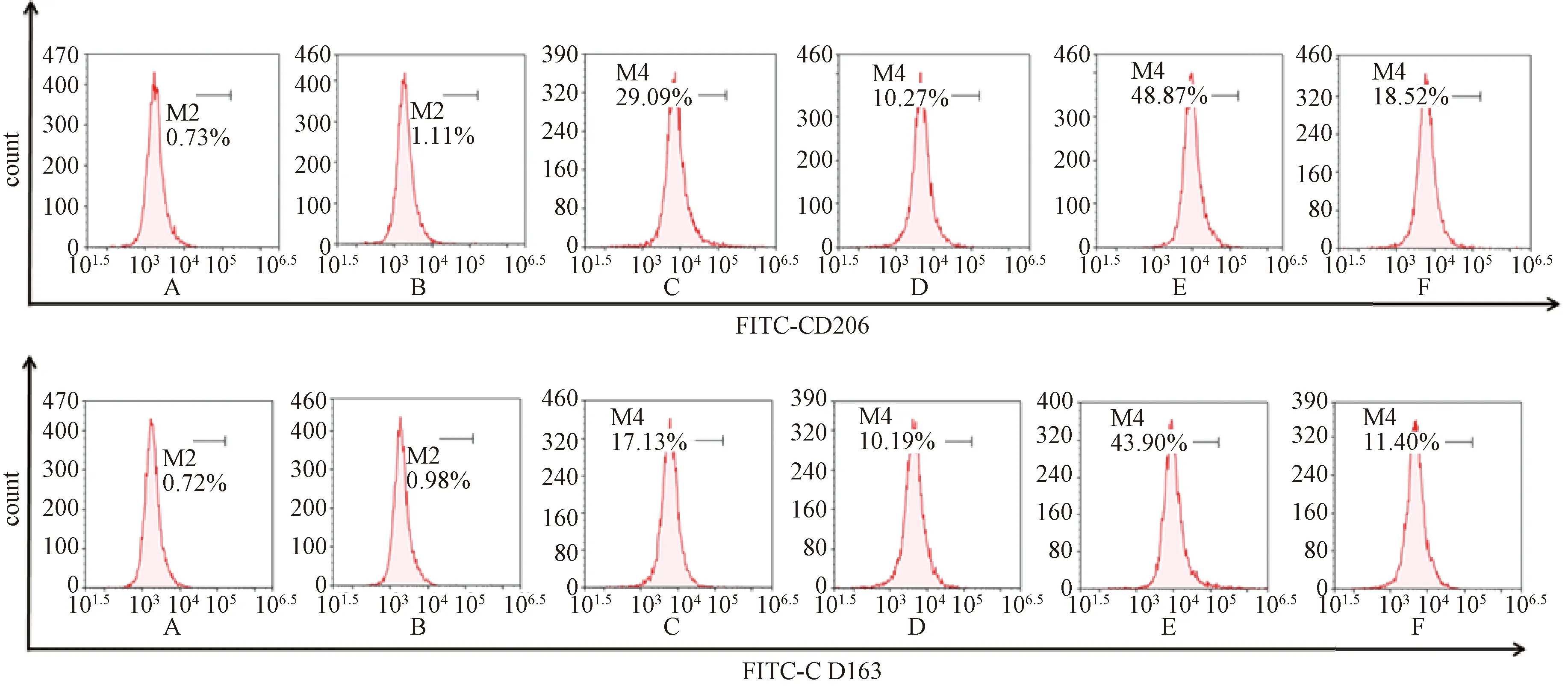
注:A. Isotype组(RAW264.7细胞组);B. Mφ组(RAW264.7细胞组);C. Mφ+IL-4组(经IL-4诱导的M2型巨噬细胞组);D. Mφ+IL-4+FZKA组(给予FZKA作用的M2型巨噬细胞组);E.Mφ+IL-4+miR155 inhibitor组(转染miR155抑制剂的M2型巨噬细胞组);F. Mφ+IL-4+miR155 inhibitor + FZKA组(给予FZKA作用的转染miR155抑制剂的M2型巨噬细胞组);FZKA为扶正抗癌方图4 流式细胞术检测M2型标志物巨噬细胞甘露糖受体(CD)206和CD163的表达
表8 流式细胞术检测M2型标志物巨噬细胞甘露糖受体(CD)206和CD163的表达
巨噬细胞的极化受磷脂酰肌醇3激酶-苏氨酸激酶(phosphoinositide 3-kinase/protein kinase B, PI3K/Akt)、JAK/STAT等多条通路调控[18]。研究发现,转录因子C/EBP-β具有调控细胞分化、激活巨噬细胞等作用,在M2型巨噬细胞中高表达,是一类调控巨噬细胞向M2型极化的重要转录因子[19]。研究发现,扶正抗癌方能够在基因和蛋白层面上抑制C/EBP-β的表达。miRNAs是一类长度约22个核苷酸的内源性非编码RNA,主要通过与靶基因的3′UTR区域结合,降解靶基因mRNA或抑制靶基因mRNA翻译,从而抑制靶基因表达。而研究发现,扶正抗癌方能够促进miR155 的表达。为进一步验证miR155与C/EBP-β的关系,当抑制miR155的表达时,C/EBP-β mRNA表达增加,表明miR155 能够靶向抑制C/EBP-β mRNA的表达。前人研究也发现,miR155-5p可靶向调控 C/EBP-β介导巨噬细胞表型转换[20]。最后发现,miR155 inhibitor能够抑制扶正抗癌方对M2型巨噬细胞极化的逆转,进一步证明扶正抗癌方通过miR-155逆转M2型巨噬细胞的极化。
综上,扶正抗癌方可通过上调miR155的表达,进而靶向抑制C/EBP-β基因的表达,并进一步通过下调M2型巨噬细胞标志物CD206、CD163和TGF-β,上调M1型巨噬细胞标志物iNOS的表达,逆转M2型巨噬细胞的极化。由此看出,扶正抗癌方在调节肿瘤微环境方面有重要意义,在临床防治恶性肿瘤方面有重要发展前景。
