结核分枝杆菌EsxV亚单位疫苗黏膜免疫诱导的免疫应答
2022-06-08宁唤唤谢燕玲彭钰君张婧瑶路延之柏银兰
白 鹭,宁唤唤,康 健,梁 璇,谢燕玲,彭钰君,张婧瑶,路延之,柏银兰
结核病(Tuberculosis,TB)是由结核分枝杆菌(Mycobacteriumtuberculosis,Mtb)经呼吸道感染引起的危害严重的慢性传染病。据WHO最新报道,2020年全球新发TB病例为1 000万,引起约140万人死亡[1]。卡介苗(BacillusCalmette-Guerin,BCG)是牛分枝杆菌连续传代后获得的减毒活疫苗,是惟一获得批准的TB预防性疫苗。但是接种BCG对成人TB的保护作用不完善[2]。此外,BCG是减毒活疫苗,在免疫低下人群接种可能造成播散性感染。因此,研发安全、有效的疫苗是TB防治领域的重要内容。
BCG在基因传代中发生一些基因丢失,丢失的基因片段称为差异区域(Region of difference,RD)[3]。RD区编码的免疫优势抗原丢失被认为是BCG保护作用不完善的主要原因之一[4]。如RD1区Rv3875编码的6 kDa早期分泌靶抗原(6 kDa early secretory antigen target,ESAT-6)具有多个T、B细胞以及迟发型超敏反应的抗原表位,可诱导特异性体液免疫,刺激T细胞产生IFN-γ[5]。ESAT-6是WXG100蛋白家族中第一个发现的蛋白[6],WXG100蛋白家族一般由约100个氨基酸组成,区域中心含有保守的Trp-X-Gly(WXG)基序,共有23个成员(EsxA-EsxW)。WXG100家族蛋白的编码基因大多位于ESAT-6分泌系统(ESAT-6 secretion system,ESX)的基因座上,是Mtb特有的VII型分泌系统(type VII secretion system,T7SS)典型的分泌底物。WXG100蛋白家族不仅参与Mtb致病机制,而且大多数是可诱导T细胞免疫应答的抗原[7]。
Rv3619c基因编码的WXG100蛋白家族EsxV是一种分泌蛋白,位于RD9区[8],也是Mtb和BCG之间的差异蛋白。研究表明,EsxV重组蛋白经肌肉免疫兔,可诱导机体产生抗体[9]。EsxV经皮下接种可诱导小鼠Th1型细胞免疫应答[8]。由脂质体包裹EsxV制备的纳米疫苗经皮下接种小鼠,可刺激产生Th1型细胞免疫应答,且能够诱导长效的免疫记忆,接种后可降低Mtb感染小鼠脏器的荷菌数[10]。EsxV皮下免疫豚鼠,Mtb感染后可引发迟发型超敏反应,表明其可用于诊断试剂的研制[11]。因此,EsxV免疫可诱导宿主抗Mtb感染的免疫力,可用于TB新疫苗的研制。
Mtb主要经呼吸道传播,所以黏膜免疫在抵抗Mtb感染中发挥重要作用[12]。细菌第二信号分子环二腺苷酸(Cyclic dimeric adenosine monophosphate,c-di-AMP)能够激活I型IFN[13]、自噬、炎症小体[14-15]等多种固有免疫调控机制。同时,c-di-AMP可作为黏膜佐剂,增强抗原诱导的细胞免疫应答[16]。课题组前期研究发现,c-di-AMP作为黏膜佐剂,可显著提高ESAT-6诱导的免疫应答水平[17]。表明c-di-AMP可作为黏膜佐剂用于亚单位疫苗的研制。本研究在原核表达系统中诱导表达并纯化EsxV重组蛋白,以EsxV和/或以c-di-AMP为佐剂构建亚单位疫苗,对EsxV为基础的亚单位疫苗黏膜免疫小鼠诱导的体液和细胞免疫应答进行了研究。本研究将为EsxV用于TB疫苗的研制提供一定的理论和实验依据。
1 材料与方法
1.1 试剂 分子生物学试剂:DNA聚合酶、限制性内切酶均购自Takara公司,PCR回收试剂盒、质粒提取试剂盒、凝胶回收试剂盒购自Axygen公司。Ni Sepharose购自GE公司;BCA蛋白定量试剂盒购自Thermo公司;PVDF膜购自Millipore公司;异丙基β-D-硫代半乳糖苷(Isopropyl beta-D-thiogalactoside,IPTG)购自Sigma公司;Total RNA Kit I试剂盒购自OMEGA公司;HiScript II Q RT SuperMix for qPCR试剂盒购自Vazyme公司。
免疫学试剂:6×His单克隆抗体购自Abcam公司;Mtb H37Rv小鼠感染血清为本室制备保存;HRP标记的山羊抗小鼠IgG、IgG 1、IgG 2a、IgG 2b和IgG 3购自北京中杉金桥生物技术有限公司;ECL发光液购自Selleck公司;c-di-AMP购自InvivoGen公司;细胞增殖MTS检测试剂盒购自Promega公司;小鼠细胞因子检测试剂盒购自Invitrogen公司。
1.2 菌株与实验动物 大肠杆菌(Escherichiacoli,E.coli)DH5α、BL21菌株为本室保存。6~8周龄雌性无特定病原体(Specific pathogen free,SPF)BALB/c小鼠,购自空军军医大学实验动物中心。实验动物使用3R原则给予人道关怀。实验操作根据《实验动物饲养管理与使用指南》的建议进行。
1.3 方 法
1.3.1 引物设计及目的基因获取 从NCBI GenBank数据库获取Mtb H37Rv株的esxV编码序列,设计一步克隆法引物序列,由擎科生物科技有限公司合成引物(表 1)。以Mtb H37Rv株DNA为模板,PCR扩增目的基因esxV。1%琼脂糖凝胶电泳分析PCR产物,回收目的基因片段。

表1 PCR引物序列Tab.1 Primer sequences for PCR
1.3.2 原核表达载体的构建 pET 28a(+)质粒以NdeI/Hind III酶切,37 ℃反应3 h。1%核酸电泳后回收线性化载体。线性化pET 28a(+)和纯化的PCR产物进行重组反应,37 ℃ 30 min。重组产物转化DH5α感受态细胞,用含25 μg/mL卡那霉素(Kan)的抗性LB平板筛选转化子。挑取阳性克隆接种于液体培养基扩大培养,提取重组质粒。NdeI/Hind III酶切鉴定阳性质粒进一步序列测定(擎科生物)。
1.3.3 EsxV的诱导表达及鉴定 将测序正确的重组质粒转化E.coliBL21菌株,挑取阳性克隆于含25 mg/mL卡那霉素的LB培养基培养16 h,按照1∶1 000的比例将细菌培养物转接至5 mL新鲜培养基中,37 ℃、220 r/min震荡培养至OD600=0.6,加入IPTG至终浓度为0.5 mmol/L,37 ℃继续培养4 h。制备诱导菌蛋白样品,15% SDS-PAGE电泳观察目的蛋白的表达情况。
菌体蛋白样品SDS-PAGE电泳后,100 V电压转印PVDF膜;PBST洗膜后,加入5%脱脂牛奶封闭1 h,分别加入6×His单克隆抗体(1∶500)和Mtb H37Rv小鼠感染血清(1∶500)4 ℃孵育过夜;PBST洗膜后,加入HRP标记的山羊抗鼠IgG(1∶5 000)37 ℃孵育45 min;PBST洗膜后,ECL化学发光法显色,观察蛋白表达。
1.3.4 EsxV的大量纯化 重组菌大量诱导表达,采用Ni-NTA agarose亲和层析法纯化目的蛋白。用50 mL的Lysis buffer(40 mmol/L NaPO4,0.5 mol/L NaCl,0.5% Trtion-X 100,0.5 mg/mL Lysozyme,1 mmol/L PMSF,pH8.0)重悬菌体沉淀,室温摇床孵育1 h,冰浴下超声10 min,5 s ON,10 s OFF。12 000 r/min 4 ℃离心30 min,将上清移入Binding buffer(40 mmol/L NaPO4,0.5 mol/L NaCl,10 mmol/L imidazole,pH8.0)平衡后的纯化Ni-NTA agarose柱中,4 ℃旋转仪上结合2 h,分别以50 mL Binding buffer和Wash buffer(40 mmol/L NaPO4,0.5 mol/L NaCl,50 mmol/L imidazole,pH8.0)洗涤。Elution buffer(40 mmol/L NaPO4,0.5 mol/L NaCl,250 mmol/L imidazole,pH8.0)分段洗脱,分别流出液于1.5 mL EP管。收集包含目的蛋白的洗脱液以尿素梯度PBS透析,最后在10%甘油+PBS缓冲液透析30 min,分装后-80 ℃保存。
在本实验教学中,教师先创设情境,展示过氧化氢溶液,提出问题:“在哪些条件下可以加快过氧化氢分解?”以问题引导学生回忆其分解过程,调动已有知识基础,思考、分析并得出结论:过氧化氢在加热、加入催化剂FeCl3溶液和过氧化酶时均能加快分解,且不同条件下分解速率不同。由此明确实验课题——比较过氧化氢在不同条件下的分解速率。
1.3.5 动物免疫 6~8周龄SPF级雌性BALB/c小鼠20只,随机分成4组,即正常对照组(Naïve)、佐剂组(c-di-AMP)、蛋白组(EsxV)、联合免疫组(EsxV:c-di-AMP)。各组小鼠分别滴鼻给予50 μL/只的PBS、c-di-AMP 5 μg、EsxV 30 μg、EsxV 30 μg+c-di-AMP 5 μg,间隔2周,免疫4次。第3和第4次免疫EsxV蛋白剂量减半,佐剂剂量不变。
1.3.6 小鼠血清抗体及亚类检测 免疫完成6周后,取小鼠眼静脉血,分离血清。用10 μg/mL的EsxV抗原包被96孔ELISA酶标板,分别加入经倍比稀释的小鼠血清,37 ℃孵育1 h;PBST洗涤,分别加入HRP标记的山羊抗小鼠IgG、IgA、IgG 1、IgG 2a、IgG 2b、IgG 3、IgM二抗(1∶5 000)100 μL/孔,37 ℃孵育1 h;TMB显色,酶标仪检测OD450值。
1.3.7 小鼠脾细胞增殖检测 处死小鼠,无菌取脾脏,制备脾细胞悬液,调整浓度至1×107个/mL,接种96孔板100 μL/孔;刺激组加入去除内毒素的EsxV蛋白或者ConA终浓度分别为5 μg/mL和2.5 μg/mL,阴性对照孔加入100 μL完全培养基,并设置空白对照孔。置细胞于37 ℃、5% CO2培养68 h后,加入MTS 20 μL/孔,继续培养4 h,检测OD490值,计算脾细胞刺激指数(Stimulated Index,SI)=OD490(刺激组OD490-空白对照OD490)/(阴性对照OD490-空白对照OD490)。
1.3.8 组织RNA的提取及实时定量PCR 取小鼠肺脏和脾脏部分组织,Total RNA Kit I试剂盒提取组织RNA。使用HiScript II Q RT SuperMix for qPCR试剂进行逆转录,实时定量PCR检测IFN-γ、IL-2、IL-10转录水平,以GAPDH作为内参。检测基因引物序列见表1。
1.3.9 脾细胞分泌细胞因子检测 取1.3.7中的脾细胞悬液,接种96孔板为1×106个/100 μL/孔,刺激组加入去除内毒素的EsxV蛋白至终浓度5 μg/mL,阴性对照孔加入100 μL完全培养基,并设置空白对照孔。培养72 h,收集细胞培养上清。按照ELISA试剂盒说明书,检测小鼠脾细胞上清中细胞因子IFN-γ、IL-2、IL-10、IL-17的含量。

2 结 果
2.1 载体构建esxV基因大小为285 bp,PCR扩增出与目的片段大小一致的特异条带(图1A)。将目的基因亚克隆入pET28a(+)载体,重组质粒NdeI/Hind III酶切鉴定结果显示,可切出esxV片段大小一致条带(图1B)。测序结果表明,插入序列与Mtb H37Rv株esxV公布序列完全一致。表明pET28a(+)-esxV原核表达载体建成功。

A:esxV的PCR扩增; B:重组载体酶切鉴定; M:marker;1:pET28a(+)-esxV图1 原核表达载体构建Fig.1 Construction of the prokaryotic expression vector
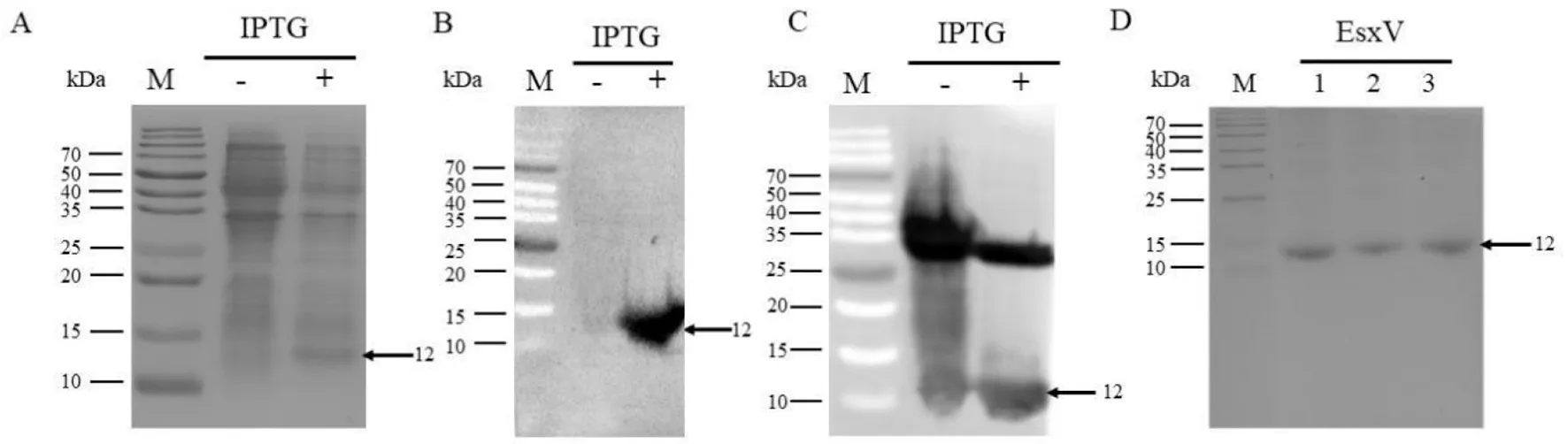
A: EsxV蛋白诱导表达;B: Western Blot鉴定EsxV蛋白(一抗为6xHis单克隆抗体);C: Western Blot鉴定EsxV蛋白(一抗为H37Rv感染小鼠血清);D: EsxV蛋白亲和层析纯化图2 EsxV蛋白的表达与纯化Fig.2 Expression and purification of EsxV
2.3 小鼠血清抗体检测 ELISA检测血清中特异性抗体水平,结果显示EsxV免疫小鼠血清中抗原特异性IgG的滴度为1.6×103(稀释度为1∶1 600),EsxV:c-di-AMP免疫组特异性IgG滴度为3.2×103(稀释度为1∶3 200)(图3A)。表明EsxV抗原经黏膜免疫可诱导特异性抗体的产生,c-di-AMP作为佐剂可一定程度上提高抗原免疫诱导的体液免疫应答。小鼠血清抗体以IgG为主(图3B),同时抗体亚类检测结果表明,在1∶200稀释度下,EsxV诱导产生的抗体以IgG 1为主(图3C),EsxV一定程度上抑制IgM水平。
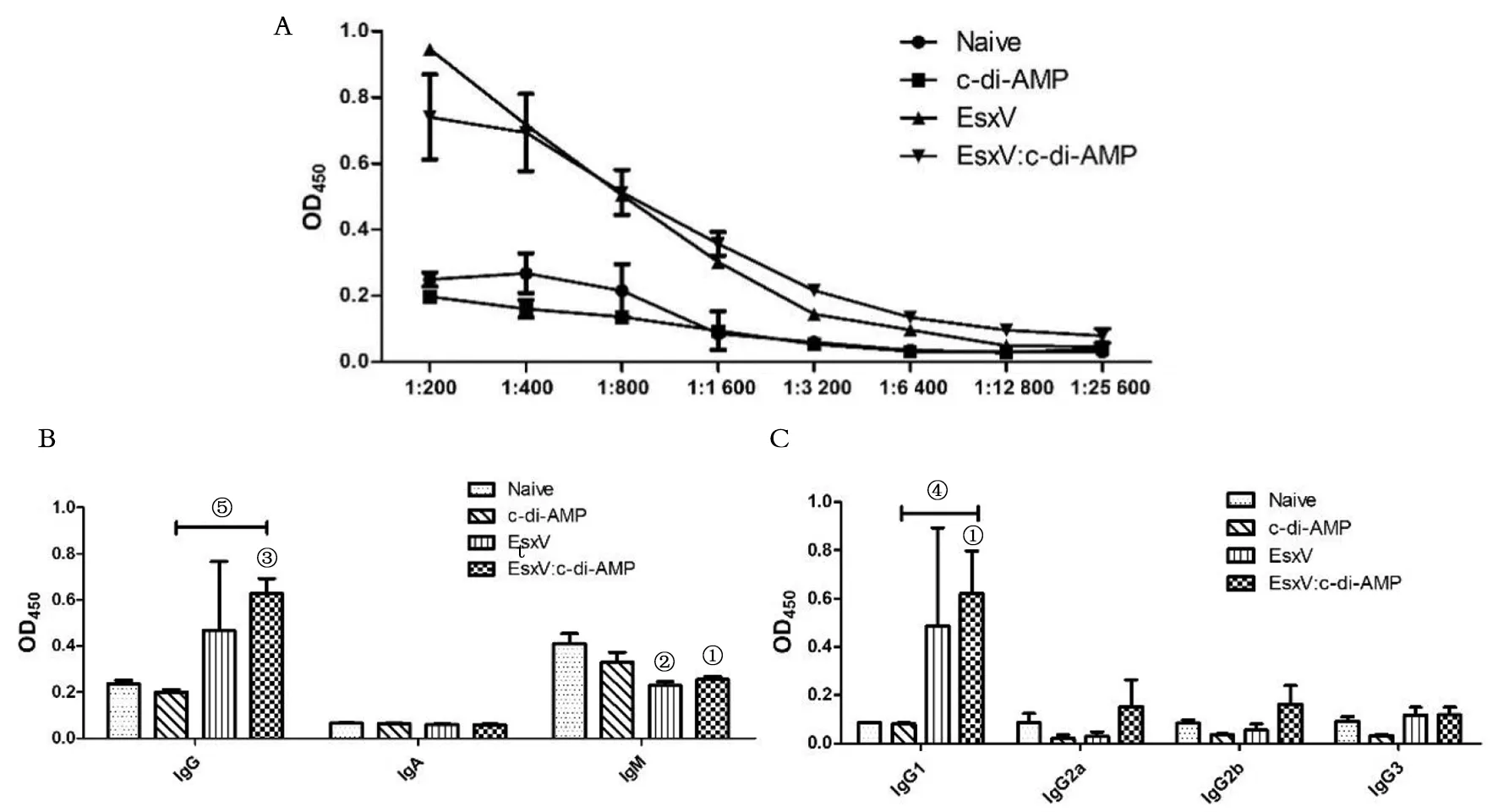
A:抗体效价检测;B:抗体亚类检测(小鼠血清1∶200稀释);C:IgG亚类检测(小鼠血清1∶200稀释);与对照组比较,①为P<0.05,②为P<0.01,③为P<0.001;④为P<0.05,⑤为P<0.01图3 体液免疫应答水平和抗体亚类检测Fig.3 Humoral immune response level and antibody subclass detection
2.4 小鼠脾细胞增殖检测 免疫小鼠脾细胞以ConA、EsxV体外刺激后,MTS法检测细胞增殖情况,结果表明,非特异性抗原ConA可刺激所有组免疫小鼠脾细胞增殖,各组间差异无统计学意义(图4A)。与对照组比较,EsxV免疫小鼠后脾细胞增殖呈增加趋势,但差异无统计学意义(t=2.243,P>0.05);EsxV:c-di-AMP免疫小鼠脾细胞增殖显著(t=6.743,P<0.001)(图4B)。表明c-di-AMP可增强EsxV经黏膜免疫诱导抗原特异性的脾细胞增殖能力。
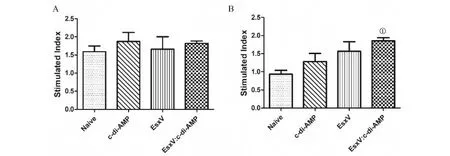
A:ConA蛋白刺激脾细胞;B:EsxV蛋白刺激脾细胞;与对照组比较,①为P<0.001图4 免疫小鼠脾细胞增殖Fig.4 Splenocyte proliferation in immunized mice
2.5 免疫小鼠脾和肺细胞因子转录水平检测 qRT-PCR检测细胞因子转录水平结果显示,在脾脏,与对照组比较,EsxV免疫组IL-10转录水平下降(t=6.422,P<0.01)。EsxV:c-di-AMP免疫组IFN-γ转录水平较对照组升高(t=6.359,P<0.01)(图5A);在肺部,与对照组比较,EsxV免疫组IFN-γ(t=2.605,P>0.05)、IL-2(t=2.504,P>0.05)转录水平差异无统计学意义;IL-10转录水平下降(t=3.292,P<0.05)。EsxV:c-di-AMP免疫组IFN-γ转录水平较对照组升高(t=7.829,P<0.01),且高于EsxV免疫组(t=5.627,P<0.05);IL-2和IL-10转录水平与对照组和EsxV免疫组差异无统计学意义(图5B)。上述结果表明,EsxV免疫诱导脾和肺细胞因子表达水平不高,而c-di-AMP可增强EsxV经黏膜免疫诱导的IFN-γ表达,但对EsxV诱导的IL-2和IL-10水平影响不大。
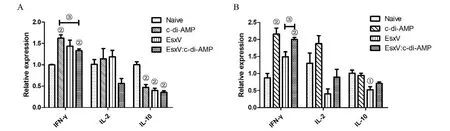
A:小鼠脾组织IFN-γ、IL-2和IL-10转录水平检测;B:小鼠肺组织IFN-γ、IL-2和IL-10转录水平检测;与对照组比较,①为P<0.05,②为P<0.01;③为P<0.05图5 小鼠脾和肺细胞因子转录水平Fig.5 Cytokine transcription levels in mouse lung and spleen
2.6 脾细胞分泌细胞因子检测 脾细胞体外抗原刺激后,ELISA法检测细胞因子的分泌水平。结果显示,EsxV免疫组各细胞因子的分泌水平与对照组相当。相比于EsxV免疫组,EsxV:c-di-AMP免疫组脾细胞的IFN-γ(t=8.818,P<0.001)、IL-2(t=8.061,P<0.001)、IL-10(t=6.588,P<0.001)和IL-17(t=2.632,P<0.05)分泌水平都增加(图 6A-D)。结果表明,EsxV经鼻免疫诱导细胞免疫应答的能力不强,而c-di-AMP能够增强EsxV诱导的脾Th1(IFN-γ、IL-2)、Th2(IL-10)和Th17(IL-17)型细胞免疫应答。炎症因子分泌水平检测结果显示,各组间的TNF-α(F=0.667,P>0.05)、IL-6(F=1.270,P>0.05)分泌水平差异无统计学意义(图 6E-F)。
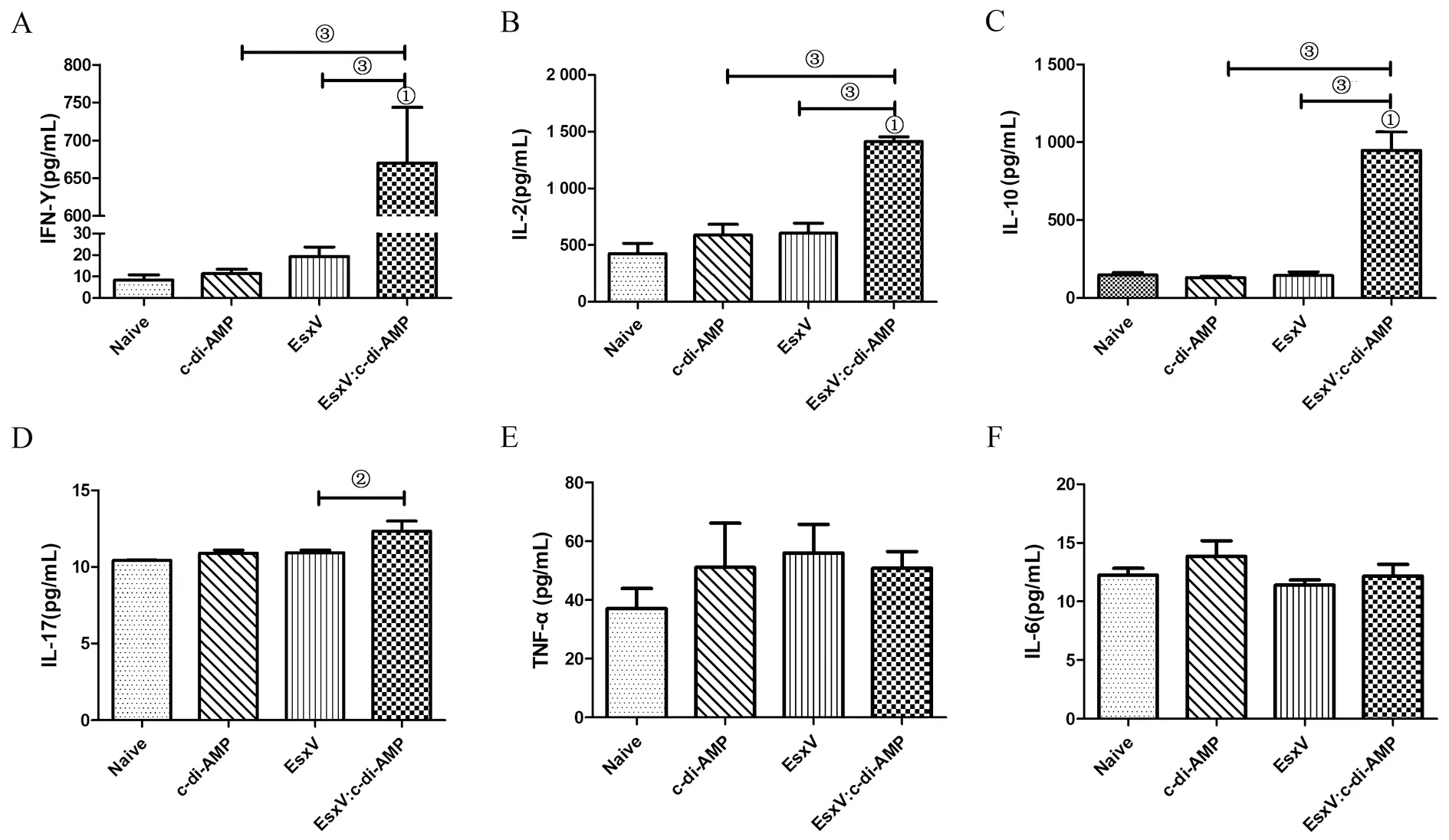
注:特异蛋白EsxV刺激小鼠脾细胞后IFN-γ(A)、IL-2(B)、IL-10(C)、IL-17(D)、TNF-α(E)、IL-6(F)的分泌水平。与对照组比较,①为P<0.001;②为P<0.05,③为P<0.001。图6 小鼠脾细胞的细胞因子分泌水平Fig.6 Cytokine secretion by splenic lymphocytes in immunized mice
3 讨 论
亚单位疫苗具有成份明确、安全性良好和诱导高水平的免疫应答等优点,是疫苗的重要种类之一。亚单位疫苗可将多个抗原有机组合起来,在适宜的佐剂辅助下诱导高水平抗Mtb感染的免疫应答,且安全性好。增加抗原谱可有效提高亚单位疫苗的保护效率,筛选新的特异性Mtb抗原也是目前TB疫苗研制的重要方向之一。
WXG100蛋白大多具有免疫原性。ESAT-6是目前WXG100蛋白家族中研究最深入的蛋白,多项研究已证实其作为TB疫苗候选抗原的潜能[5]。EsxW、Rv2608以及Mtb潜伏感染蛋白Rv1813的融合蛋白组成的ID83亚单位疫苗与Toll样受体激动剂联合免疫小鼠,可诱导Th1型细胞免疫应答,并对低剂量Mtb呼吸道感染具有保护力[18]。表达EsxH(Rv0288)与Ag85B的重组BCG免疫小鼠,可诱导Th1 CD4+细胞的增殖并且产生显著的抗Mtb感染保护力[19]。EsxV经肌肉免疫兔,可诱导特异性的抗体产生[9]。此外,有研究报道,EsxV经黏膜接种能够预防小鼠哮喘[20]。本研究成功构建并原核表达WXG100家族蛋白Esx,重组EsxV蛋白经鼻黏膜免疫小鼠,血清IgG效价可达到1∶1 600,以IgG 1亚类为主(图3)。表明重组EsxV蛋白经黏膜免疫,可诱导特异性的体液免疫应答。EsxV蛋白经鼻免疫小鼠,对脾和肺组织的Th1(IFN-γ、IL-2)型细胞因子的转录影响不大,但能抑制脾细胞Th2(IL-10)型细胞因子转录(图5)。EsxV蛋白体外刺激免疫小鼠脾细胞,脾细胞增殖并不显著,而且脾细胞分泌细胞因子水平也无变化。表明EsxV蛋白经鼻黏膜免疫诱导的细胞免疫应答水平并不高。课题组前期研究发现,ESAT-6单独免疫诱导的体液免疫和细胞免疫应答水平均不高,需要加入佐剂提高ESAT-6 的免疫原性[21]。因此,采用合适的佐剂可提高EsxV诱导的免疫应答水平。
目前,用于临床的疫苗佐剂有铝佐剂,主要介导体液免疫,对细胞免疫的诱导效果不佳[22]。研究表明,加强小鼠黏膜免疫水平可提高抗Mtb感染能力[23]。c-di-AMP作为细菌的信号分子,可作为黏膜佐剂,与半乳糖苷联合经鼻黏膜接种,能够诱导小鼠黏膜免疫及Th1/Th2/Th17型细胞免疫应答[16]。c-di-AMP可增强流感抗原诱导的Th1/Th2/Th17和炎症因子应答[24]。课题组前期研究发现,c-di-AMP作为内源性佐剂能够增强重组BCG诱导的免疫应答水平[25]。c-di-AMP作为黏膜佐剂与ESAT-6联合免疫时,可诱导较高水平的固有和适应性免疫应答,并且具有抗Mtb的保护作用[17]。因此,c-di-AMP可增强Mtb抗原的免疫原性,并可用于黏膜免疫,可用于TB黏膜疫苗佐剂。课题组前期研究发现,ESAT-6:c-di-AMP免疫组的抗体效价为1∶1 600,高于ESAT-6单独免疫组的1∶800,同时发现较ESAT-6免疫组,ESAT-6:c-di-AMP免疫小鼠后可显著提高肺泡灌洗液中的sIgA水平[17]。本研究中,EsxV:c-di-AMP免疫组特异性IgG抗体效价为1∶3 200,高于EsxV单独免疫组的1∶1 600。本研究虽未检测sIgA的水平,但血清IgG水平检测获得了与前期结果相似的结论[17]。
在小鼠脏器脾和肺中,c-di-AMP免疫后可诱导IFN-γ、IL-2以及IL-10的转录水平增加,表明c-di-AMP可增强机体Th1/Th2的免疫反应。EsxV单独免疫诱导的脾和肺Th1/Th2细胞因子转录水平不高,而EsxV:c-di-AMP经鼻黏膜接种后诱导的细胞因子转录水平均低于c-di-AMP免疫组(图5)。研究表明,c-di-AMP能够激活干扰素基因刺激分子(stimulator of interferon genes,STING)介导的I型干扰素应答,同时c-di-AMP的持续刺激能够引发钙蛋白酶对STING的降解[26]。因此,推测c-di-AMP在胞浆内自限性、不连续的免疫调控机制,限制了其与EsxV抗原联合免疫诱导的细胞因子表达水平,这与前期研究ESAT-6:c-di-AMP免疫后小鼠肺组织细胞因子转录水平比c-di-AMP单独免疫组有所降低的结果相似[17]。EsxV:c-di-AMP诱导小鼠脾细胞显著的Th1/Th2/Th17型细胞免疫应答,但并不能增强炎症因子(TNF-α、IL-6)的转录水平(图6),且IL-1β分泌水平均低于检测下限。表明c-di-AMP不仅可增强EsxV诱导的免疫应答,而且不引起可能的炎症病理损伤,因此,c-di-AMP作为黏膜免疫佐剂也具有安全性。
综上,本研究获得的EsxV:c-di-AMP亚单位疫苗组合免疫小鼠,可诱导体液和细胞免疫应答,可用作TB亚单位新疫苗的研制。本课题组将进一步建立呼吸道感染动物模型,评价EsxV:c-di-AMP亚单位疫苗诱导的黏膜免疫应答,并评价该疫苗对Mtb感染的免疫保护效率。
利益冲突:无
引用本文格式:白鹭,宁唤唤,康健,等. 结核分枝杆菌EsxV亚单位疫苗黏膜免疫诱导的免疫应答[J].中国人兽共患病学报,2022,38(5):379-386. DOI:10.3969/j.issn.1002-2694.2022.00.051
