小白菊内酯及其衍生物抗实体瘤作用机制的研究进展
2022-06-08史胜利徐会敏马利刚郑晓珂武慧敏
史胜利,徐会敏,马利刚,郑晓珂,安 娜,武慧敏
河南中医药大学,郑州 450046
小白菊内酯(parthenolide)是小白菊(Tanacetumparthenium)和艾菊(TanacetumvulgareL.)等药用植物的重要活性成分,属倍半萜内酯类化合物,分子式为C15H20O3(见图1),相对分子质量为248.3,可用于治疗炎症和风湿等疾病,还可通过抑制上皮间充质化(EMT)、阻滞细胞周期、诱导细胞凋亡和自噬等多种机制抗肿瘤。本文对近年来小白菊内酯及其衍生物抗肝癌与胰腺癌等多种实体瘤机制的研究进展进行综述,为小白菊内酯抗肿瘤研究和应用提供参考。

图1 小白菊内酯及其衍生物的分子结构
1 肝癌
1.1 小白菊内酯抗肝癌机制
①小白菊内酯通过刺激细胞产生活性氧(ROS),诱导细胞自噬、死亡,也可阻滞细胞于G1/S期,抑制SMMC 7721肝癌细胞和BT549乳腺癌细胞增殖[1-2]。②抑制核因子κB(NF-κB)活性、P-糖蛋白(P-gp)、多耐药相关蛋白(MRP)、B细胞淋巴瘤/白血病-2蛋白(Bcl-2)和Wnt家族配体1(Wnt1),增加p53表达,逆转BEL-7402/5-氟尿嘧啶(5-Fu)细胞对5-Fu的耐药性,抑制其增殖[3]。③下调Bcl-2及细胞增殖基因Ki-67表达,上调caspase-3、caspase-9、p53和Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)蛋白表达,诱导其自噬和凋亡,抑制HepG2细胞增殖[4]。④上调p53、p27和p21表达,下调细胞周期蛋白D1(cyclin D1)与E1(cyclin E1)表达,阻滞HepG2细胞于G1期,升高细胞内ROS水平,使线粒体膜电位下降,导致其功能障碍。上调caspase-3、caspase-9、凋亡诱导因子(AIF)、巨噬细胞迁移抑制因子(MIF)等蛋白表达,下调Fas相关死亡区域样白细胞介素-1β转换酶抑制蛋白(FLIP),使聚ADP核糖聚合酶1(PARP-1)裂解而失活,诱发AIF介导细胞凋亡。⑤上调微管相关蛋白轻链3A/B(LC3 A/B)和自噬相关基因6(Atg6)同源蛋白Beclin-1,下调自噬蛋白p62表达,诱导HepG2细胞自噬,抑制其增殖、迁移[5]。上调caspase-3表达,降低NF-κB表达,阻滞细胞于G0/G1期,诱导HepG2细胞凋亡,抑制其增殖[6-7]。⑥共价修饰Janus激酶2(JAK2)的Cys178、Cys243、Cys335和Cys480等半胱氨酸残基,阻断信号转导及转录激活因子3(STAT3)信号通路。⑦抑制白细胞介素-6(IL-6)诱导的癌细胞迁移,抑制因STAT3异常激活而致的HepG2细胞增殖,也可用相似方式作用于肿瘤细胞内其它JAKs激酶[8]。⑧升高Ca2+水平,激活caspase-3、caspase-9,上调微管相关蛋白轻链3 Ⅱ(LC3 Ⅱ)和Beclin-1蛋白表达,升高ROS水平,降低线粒体膜电位及谷胱甘肽(GSH)水平,下调长型FLIP(FLIPL)、短型FLIP(FLIPS)和p62蛋白表达,诱发HepG2细胞凋亡和自噬[9]。
1.2 衍生物抗肝癌机制
衍生物1抗肿瘤活性约为小白菊内酯的5.8倍:①抑制多药耐药1基因(MDR1)、三磷酸腺苷(ATP)结合盒式亚家族C成员1(ABCC1)和ATP结合盒G亚家族成员2转运蛋白(ABCG2),逆转Bel-7402/5-Fu肿瘤细胞对5-Fu的耐药性。②上调Bax与B细胞淋巴瘤/Bcl-2相互作用的细胞死亡中介物(Bim)表达,下调Bcl-2和B细胞淋巴瘤/白血病xl(Bcl-xl)表达,升高细胞色素C(Cyt C)水平,激活caspase-3、caspase-9,诱发线粒体介导的Bel-7402/5-Fu细胞凋亡[10]。
2 乳腺癌
2.1 小白菊内酯抗乳腺癌机制
在MDA-MB-231三阴性乳腺癌(TNBC)细胞中,microRNA-29b-1-5p过表达增加ROS,抑制细胞生长,而核因子NF-E2相关因子(Nrf2)可下调microRNA-29b-1-5p表达。Nrf2激活可减少ROS,刺激细胞生长。①小白菊内酯可诱导microRNA-29b-1-5p表达,抑制蛋白激酶B(PKB or Akt)致Nrf2失活,抑制DNAN-甲基转移酶1/3A/3B(DNMT1/3A/3B)、结合珠蛋白家族3A成员1(HIN1)、Ras关联域家族成员1(RASSF1A)和cyclin D2等表达,升高ROS水平,抑制癌细胞增殖[11]。②共价修饰黏着斑激酶1(FAK1)的Cys427,抑制FAK1活性及三磷酸肌醇激酶(PI3K)的磷酸化,干扰Akt/蛋白激酶C(PKC)信号通路,抑制MDA-MB-231细胞增殖和迁移[12]。③抑制波形蛋白基因(Vim)表达,降低延长因子α1(EFLα1)蛋白水平,使细胞阻滞于G0/G1期,诱导其凋亡,抑制肿瘤细胞迁移[13]。④促进同源性磷酸酶-张力蛋白(PTEN)表达,降低PI3K、Akt和Bcl-2表达,升高caspase-3表达,诱导MCF-7和MDA-MB-231肿瘤细胞凋亡,抑制其增殖[14]。⑤升高自噬调节因子LC3 Ⅱ蛋白表达,使细胞外信号调节激酶(ERK)发生磷酸化而活化,激活ERK/丝裂原活化蛋白激酶(MAPK)信号通路,使MCF-7细胞自噬[15]。⑥与c-myc原癌基因启动子的G-四链体结构结合,抑制c-myc转录和表达,抑制MCF-7细胞增殖和迁移[16]。⑦与NF-κB抑制因子(IκB)激酶(IKK)结合可抑制IκBα分解,阻碍NF-κB途径;降低组蛋白脱乙酰化酶(HDAC)活性,下调缺氧诱导因子1α(HIF-1α)表达。通过上述2种作用,小白菊内酯下调HIF-1α表达,抑制MDA-MB-231-BCRP细胞增殖[17]。
2.2 衍生物抗乳腺癌机制
①衍生物2(dimethylaminoparthenolide,DMAPT)可激活NADPH氧化酶(NOXs),减少肿瘤干细胞(CSCs)内抗氧化物和游离的NADPH。使Nrf2蛋白泛素化而降解,降低其含量,下调锰-超氧化物歧化酶(MnSOD)和过氧化氢酶(catalase)等抗氧化酶类表达,过度消耗硫醇,使羟自由基、超氧阴离子和H2O2等水平升高,导致线粒体功能障碍,诱使MDA-MB-231细胞坏死[18]。②衍生物3和衍生物4对MDAMB-231、SUM159、BT574和4T1等肿瘤细胞的抑制率是小白菊内酯的15倍。衍生物3(DMOCPTL)升高Bax和Bim水平,释放Cyt c至细胞质,激活caspase-9,阻滞细胞于G1期,诱导SUM-159细胞凋亡[19]。与谷胱甘肽过氧化物酶4(GPX4)蛋白结合,使其泛素化,上调早期生长反应因子1(EGR1)表达,诱发线粒体介导的TNBC细胞凋亡,且对正常细胞无明显毒性[20]。③衍生物5(1β,10α-Epoxyparthenolide)可抑制TNF-α,下调p65和X染色体连锁凋亡抑制蛋白(XIAP)表达,阻止NF-κB激活,阻断NF-κB信号通路,抑制MDA-MB-468、MDA-MB-231、AGS、HCT116和Hela等肿瘤细胞增殖[21]。④衍生物6及水溶性衍生物7结合于IKKβ上的不同位点。衍生物6与IKKβ的激酶结构域(KD)结合,阻断Ser181磷酸化,使IKKβ的IκB激酶γ亚基(IKKγ或NEMO)结合位点的α-螺旋解构,抑制IKKβ活化,抑制IκB和p65磷酸化。衍生物7与IKKβ亚基的激酶结构域(KD)和骨架/二聚体结构域(SDD)位点之间的连接处结合,阻止IKKβ寡聚化和激活。衍生物6和衍生物7均可抑制IKKβ介导的IκB和p65磷酸化,阻止NF-κB从IκB(p65/p50)复合物中释放,降低NF-κB与DNA的结合能力,抑制NF-κB活化,使组成性IκBα蛋白水平升高,抑制TMD-231乳腺癌细胞增殖和迁移。此外,衍生物6可降低GSH水平而诱发氧化应激,抑制细胞增殖,但效果不如小白菊内酯。衍生物7则无此作用[22]。⑤利用氮杂共轭加成法,抗癌药物阿糖胞苷(cytarabine)或美法仑(melphalan)与小白菊内酯a-亚甲基-C-内酯基反应,分别合成的衍生物8(parthalan)和衍生物9(parthabine)对MCF-7、LNcaP和HepG2等肿瘤的细胞毒性强于小白菊内酯、阿糖胞苷或美法仑,但其具体作用机制尚不清楚[23]。
3 结直肠癌(CRC)
小白菊内酯抗CRC机制:细胞内低氧环境可活化NF-κB,激活HIF-1α信号通路,促进肿瘤组织血管再生和EMT。①小白菊内酯下调HIF-1α并促使其降解,抑制IκBα和NF-κB磷酸化而使其失活,阻断PI3K/Akt和MAPK途径,降低葡萄糖转运蛋白1(GLUT1)和己糖激酶2(HK 2)表达,使糖酵解减速,使肿瘤细胞对缺氧环境敏感,抑制肿瘤组织血管再生和EMT,启动细胞凋亡,抑制HT-29、DLD-1和HCT116等肿瘤细胞增殖和迁移[24]。②下调E-钙黏蛋白(E-cadherin)、β-连环蛋白(β-catenin)、波形蛋白(vimentin)、锌指转录因子Snail、环氧合酶-2(COX-2)、基质金属蛋白酶2/基质金属蛋白酶9(MMP-2/MMP-9)等蛋白表达,抑制肿瘤细胞迁移和侵袭。③下调Bcl-2和Bcl-xl表达,激活caspase-3,诱导其凋亡,抑制SW620细胞增殖[25]。④转化生长因子-β(TGF-β)抑制早期肿瘤增殖,而在肿瘤晚期,TGF-β则诱导肿瘤细胞转移。TGF-β1诱导EMT是CRC细胞迁移和侵袭的机制之一。小白菊内酯增强E-cadherin表达,抑制β-catenin、vimentin、Snail和Snail2(Slug)等EMT标志蛋白表达,抑制TGF-β1诱导的HT-29和SW480结肠癌EMT,虽不能诱导HT-29细胞凋亡却可抑制其增殖,但不影响SW480细胞增殖[26]。⑤过量表达Sma和Mad相关蛋白(Smad4)可抑制MDR1表达,使小白菊内酯在HCT-116、HT-29和Caco-2等细胞内累积,促进caspase-3和Bax表达,抑制Bcl-2表达及NF-κB p65磷酸化,逆转肿瘤细胞对小白菊内酯的耐药性,诱导其凋亡,抑制肿瘤细胞增殖和迁移[27]。⑥核糖体蛋白(RPL10)可特异性结合p65和IKKγ,调节其在细胞中的翻译和表达,干扰NF-κB信号通路,影响细胞代谢。小白菊内酯与RPL10结合,抑制T细胞因子4(TCF4)/淋巴增强因子1(LEF1)蛋白合成,阻断Wnt/β-catenin信号通路,抑制HEK293细胞增殖。抑制裸角质膜同源蛋白(NKD1),干扰Wnt信号通路,抑制SW480、Caco2和HT29等细胞增殖[28]。⑦下调NADPH氧化酶4(NOX4)表达,干扰PI3K/Akt信号通路,降低MMP-2/9、β-catenin和cyclin D1等蛋白水平,抑制SW480细胞增殖和侵袭[29]。⑧轴抑制基因-2(axis inhibitor-2,Axin2)和c-Myc是Wnt信号通路的2个重要靶基因,而β-catenin是Wnt信号通路的重要转录因子。小白菊内酯共价修饰泛素特异性蛋白酶7(USP7)的Cys90、Cys315和Cys334等残基,抑制其活性,阻滞细胞于G2/M期,下调Axin2和c-Myc表达,使β-catenin泛素化而加快降解,活化caspase-8、caspase-9,使多聚ADP-核糖聚合酶(PARP)裂解而失活,阻断Wnt信号通路,诱导SW480细胞凋亡,抑制其增殖[30]。
4 甲状腺癌
小白菊内酯抗甲状腺癌机制:①小白菊内酯可降低线粒体膜电位,加速ROS合成,上调Bax表达,下调Bcl-2表达,加强氧化应激,抑制ATP合成,使氨基酸、胆碱和脂质等物质代谢失衡,减少能量供应,促进细胞凋亡,抑制TPC-1细胞增殖[31]。③上调LC3 Ⅱ和Beclin-1等凋亡蛋白的表达,抑制mTOR、PI3K和Akt表达及其磷酸化,干扰mTOR/PI3K/Akt信号通路,并上调Bax,下调Bcl-2,诱导MDA-T32和BCPAP肿瘤细胞自噬和凋亡[32-33]。④上调E-cadherin表达,下调vimentin、MMP-9、TGF-β、N-cadherin和p-Smad3等蛋白表达,遏制Smad3磷酸化,逆转EMT,抑制TPC-1肿瘤细胞的增殖、迁移和侵袭[34]。
5 胰腺癌
5.1 小白菊内酯抗胰腺癌机制
①小白菊内酯可降低Bcl-2表达,升高Bax表达,使Bcl-2/Bax比例失衡,抑制Panc-1细胞的增殖、迁移和侵袭,促进其凋亡[35]。②降低cyclin D1水平,阻滞细胞于G1期,升高p62/sequestosome-1(SQSTM1)、Beclin-1和LC3 Ⅱ等自噬标志蛋白表达,激活caspase-3,失活PARP,诱导Panc-1细胞自噬和凋亡[36]。③抑制细胞周期蛋白激酶4(CDK4)和E-cadherin,下调MMP-2/MMP-9表达,抑制SW1990细胞迁移和侵袭[37]。
5.2 衍生物抗胰腺癌机制
衍生物2与RPL10结合后,降低其表达,致核糖体功能障碍,促进RPL10与p65或IKKγ直接结合,下调p65或IKKγ表达,抑制NF-κB信号通路,阻滞Panc-1细胞于S/G2期,诱导部分MiaPaca-2细胞凋亡[38]。
6 宫颈癌
小白菊内酯抗宫颈癌机制:①小白菊内酯可降低真核翻译起始因子4E结合蛋白(4EBP1)水平,提高ROS水平,下调LC 3和p62蛋白表达,促进细胞自噬和凋亡,抑制Hela细胞增殖[39-40]。②上调caspase-3、Bax、Beclin-1和自噬相关基因5(Atg5)等蛋白,下调自噬相关基因3(Atg3)、Bcl-2和mTOR等蛋白,诱发线粒体介导细胞自噬和凋亡。③上调同源性磷酸酶-张力蛋白(PTEN)表达,下调PI3K和Akt表达,升高ROS水平,致线粒体去极化,诱导细胞自噬和凋亡,抑制Hela细胞增殖[41]。④降低Bcl-2和p-Akt等蛋白水平,升高Bax、caspase-3、caspase-8和PTEN等蛋白水平,抑制PTEN/Akt通路,促细胞凋亡,抑制宫颈癌Hela细胞增殖[42]。⑤小白菊内酯与硒受损硫氧还蛋白还原酶衍生凋亡蛋白(SecTRAPs)类似,可作用于胞质硫氧还蛋白还原酶1(TrxR1)和线粒体硫氧还蛋白还原酶2(TrxR2)的硒代半胱氨酸(Sec)残基,抑制硫氧还蛋白还原酶(TrxRs),促进ROS积累和氧化型硫氧还蛋白的产生,致细胞抗氧化能力下降,诱导氧化应激介导细胞凋亡[43]。
7 前列腺癌
7.1 小白菊内酯抗前列腺癌机制
①小白菊内酯可抑制NF-κB,上调Bax表达,下调Bcl-2表达,诱导细胞凋亡,抑制PC-3细胞增殖[44]。②降低层黏连蛋白(laminin)、Ⅳ型胶原(collagen Ⅳ)、MMP-2和β1整联蛋白(integrinβ1)的表达,抑制TRAMP细胞增殖和迁移[45]。
7.2 衍生物抗前列腺癌机制
①衍生物2可显著降低MMP-2和层黏连蛋白的表达,抑制TRAMP肿瘤细胞增殖、迁移[45]。②抑制组成型或辐射诱导的NF-κB,阻止修复断裂双链DNA,增加X射线对肿瘤细胞的杀伤,诱导其凋亡,抑制PC-3和DU145等肿瘤细胞增殖[46]。③降低正常组织中的氧化应激水平,降低辐射诱导的细胞凋亡。但在C57BL/6J小鼠和转基因前列腺癌小鼠(TRAMP)细胞中,衍生物2可提高细胞氧化应激水平,诱导其凋亡[47]。
8 胃癌
小白菊内酯抗胃癌机制:①小白菊内酯下调NF-κB p65的转录和翻译,抑制SGC-7901/DDP细胞增殖[48]。②上调细胞周期蛋白依赖性激酶抑制剂1(CDKN1)、caspase-3、caspase-9、Bax和p53等表达,下调cyclin D1、Bcl-2和Bcl-xl等表达,失活STAT3,干扰STAT3信号通路,阻滞SGC-7901/DDP细胞于G1期,诱导其凋亡,抑制其增殖、迁移和侵袭[49]。③下调cyclin D1和Cyclin E1等表达,阻滞细胞于G1期,上调caspase-3、caspase-8、caspase-9、p53和p21等蛋白表达,升高ROS水平,显著增加细胞凋亡率。④下调c-Myc、E2F1和NF-κB等核蛋白,降低p-STAT3蛋白水平,干扰STAT3-c-Myc-E2F1轴,抑制BGC-823细胞增殖[50]。⑤上调葡萄糖调节蛋白78(GRP78)、生长抑制和DNA损伤诱导基因153(GADD153)等表达,下调Bcl-2表达,诱导GIST细胞凋亡。⑥升高活化的GRP78-水平,增多IER1、PERK、ATF6等3种膜蛋白的解离,使GADD153表达增加,随后被激活并转运至细胞核,增强内质网应激(ERS),诱导GIST细胞凋亡,抑制其增殖[51-52]。
细胞内信号分子功能或含量异常,以及信号通路失调会导致细胞增殖或凋亡异常,是细胞癌变的重要机制,不同类型肿瘤细胞内发生异常的信号通路也不尽相同[53]。作为一种潜在的广谱、高效和低毒的抗肿瘤新药,小白菊内酯可作用于NF-κB、STAT3、PI3K、TGF-β、Smad4、p53和MAPK等多种信号通路(见表1),其亚甲基γ-内酯环和环氧基团能与生物靶点相互作用,诱导细胞氧化应激,发挥抗肿瘤作用。

表1 小白菊内酯及衍生物的作用靶点及抗肿瘤机制
小白菊内酯因其在体内溶解度低而影响其药效发挥。为改善其药效,用多种方法对其结构进行修饰,产生多种衍生物[54]。这些衍生物可作用于肿瘤增殖相关蛋白,如衍生物1可抑制MDR1、ABCC1、ABCG2、Bcl-2和Bcl-xl等蛋白表达,上调Bax和Bim表达,升高Cyt C水平,激活caspase-3、caspase-9,诱导Bel-7402/5-Fu细胞凋亡,逆转其耐药性。衍生物2、5、6、7均可抑制NF-κB信号通路,抑制MDA-MB-468和TMD-231等肿瘤细胞的增殖、迁移。衍生物3可上调Bax和Bim水平,释放Cyt C至细胞质,激活caspase-9,阻滞细胞于G1期,且使GPX4泛素化,上调EGR1,诱发线粒体介导的SUM-159细胞凋亡。
小白菊内酯衍生物的抗肿瘤机制与小白菊内酯基本一致,但其活性大小有所变化(见表2)。例如,衍生物1对Bel-7402/5-Fu细胞的半抑制浓度或半抑制率(IC50)约是小白菊内酯的五分之一,说明其对该肿瘤细胞的毒性约是小白菊内酯的5倍,可逆转该肿瘤细胞的耐药生,诱导其凋亡。衍生物2的溶解度比小白菊内酯大,对PANC-1的细胞毒性强于对MiaPaca-2和AsPC-1等。衍生物3对MDA-MB231和4T1等肿瘤细胞的IC50是小白菊内酯的十几分之一,表明其对上述肿瘤细胞的毒性是小白菊内酯的十几倍。衍生物6和衍生物7对MCF-7、MDA-MB-231和MDA-MB-436等细胞的毒性强于小白菊内酯。衍生物8和衍生物9对Hep G2和MCF-7等细胞的IC50是小白菊内酯的几分之一至十几分之一,说明其对上述肿瘤细胞的毒性是小白菊内酯的几倍至十几倍,毒性强于小白菊内酯。然而,衍生物5对MDA-MB-468和Hela等肿瘤细胞的IC50约是小白菊内酯的几倍,表明其对上述肿瘤细胞的毒性明显减小。针对不同肝癌、胰腺癌等类型实体瘤的小白菊内酯衍生物虽然目前仅有9种,但其细胞毒性增强或溶解度增大,临床应用潜力较大,见表2。
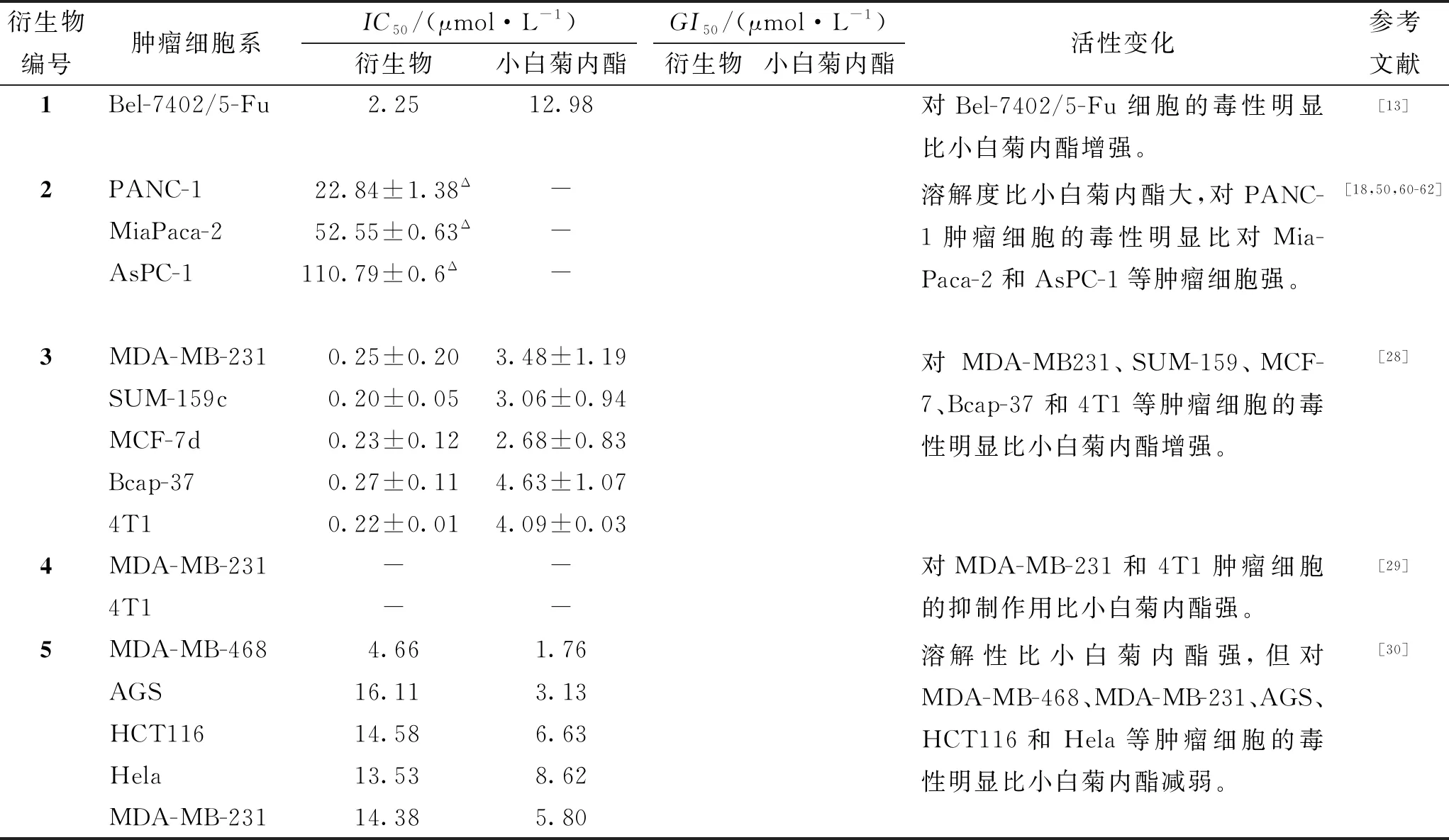
表2 小白菊内酯及其衍生物活性变化

表2(续) 小白菊内酯及其衍生物活性变化
总之,小白菊内酯及其衍生物抗肝癌和胰腺癌等实体瘤的主要作用机制为抑制PI3K/Akt/mTOR、NF-κB和STAT3等多种信号通路,具体机制还有待深入研究。对小白菊内酯关键的药效基团和构效关系研究也有待深入,对其结构的修饰、改造也需要探索,以待合成抗肿瘤效果好的新药。关于小白菊内酯抗肿瘤作用机制的研究对有效利用我国传统中药资源以及对肿瘤的临床治疗均具有重要意义。
