定点医院新型冠状病毒肺炎患者核酸检测工作的实践和探索
2022-06-08陈长强金佩佩
陈长强,孟 俊,金佩佩,戴 菁
(上海交通大学医学院附属瑞金医院检验科,上海 200025)
2022 年3 月以来,以奥密克戎变异株为主要流行株的新型冠状病毒(新冠)感染在上海流行,截至5 月22 日,已有62 余万例感染者。为彻底、快速阻断疫情传播,尽早实现社会面清零,部分医疗机构紧急转型为定点医院、增建方舱医院。
核酸检测工作作为新冠肺炎临床诊疗和疫情防控中的重要一环,其检测质量是保障疫情防控工作顺利进行的关键。国家卫生健康委员会(卫健委)办公厅和国家中医药管理局办公室于2022 年3 月14 日颁布了《新型冠状病毒肺炎诊疗方案(试行第九版)》(下称第九版方案)[1],其中对感染者的解除隔离标准和出院标准进行了更新,使新冠核酸检测循环阈值(cycle threshold,Ct 值)作为重要的临床诊疗转归指标,被广泛提及。然而,Ct 值受分析前、分析中和分析后的多种因素影响,涵盖了受检者准备、样本采集、样本运输、样本处理及结果审核等各个环节[2-5]。加之实验室诊断标准与第九版方案中解除隔离及出院标准不一致,对临床和实验室都产生了较大的困扰。在此背景下,新冠肺炎患者的核酸检测工作在结果审核、复检流程及报告方式等方面,均应与人群筛查时有所不同。上海交通大学医学院附属瑞金医院瑞金医院北部院区作为较早转型的定点医院之一,经过一段时间的实践和探索,对于新冠肺炎患者的核酸检测工作积累了相关经验,现总结如下。
材料与方法
一、材料
选取2022 年4 月1 日至10 日期间,瑞金医院北部院区收治的新冠肺炎患者共462 例,统计其入院时核酸检测的基础Ct 值,分析患者住院期间Ct值随时间变化的规律。整理分析3 月20 日至3 月31 日(转型前期)和4 月1 日至4 月10 日(转型后期)2 个时间段内的核酸检测记录和复检记录,统计分析因样本采集不合格导致检测结果假阴性的情况。
二、方法
1.比较试剂A 和试剂B 检测性能的差异:选取213 份住院新冠肺炎患者的核酸检测样本,采用2 种不同试剂进行平行检测,由不同实验人员、不同仪器,分3 d 完成实验。观察真实工作场景中2 种试剂的应用情况,分析比较2 种试剂的差异。2 种试剂的基本参数见表1。

表1 2 种检测试剂的基本参数
2.制定临床样本复检的标准作业程序(standard operation procedure,SOP)文件:根据相关规章要求,结合临床工作实际,制定本实验室临床样本复检的SOP 文件。
3.制备弱阳性质控品,加强室内质量控制:根据国家和上海市临床检验中心的相关要求,结合实际工作情况,本实验室将阳性质控品用样本保存液进行稀释,使其检测Ct 值在35 左右。将该自制的弱阳性质控品分装后,置于-20 ℃下冷冻保存,每天复融后分别检测5 次,连续检测4 d,获得20 组数据。
结果
一、新冠肺炎患者住院期间Ct 值变化趋势
462 例新冠肺炎患者入院时的核酸检测基础Ct 值见表2 和图1A。患者ORF1ab 和N 基因Ct值<30 的比例分别为69.26%(320 例) 和70.78%(327 例)。分析184 例ORF1ab 和N 基因Ct 值均<30 的患者,发现其Ct 值升至30 以上所需的时间为4~8 d,中位时间为6 d(见图1B)。63.04%(116 例)的患者在6 d 内ORF1ab 和N 基因Ct 值即开始>30,转阴时间与基础Ct 值成负相关(见图1C、1D)。

图1 462 例患者入院基础Ct 值和184 例患者Ct 值随时间变化情况

表2 462 例患者入院时ORF1ab 和N 基因Ct 值基本情况[中位数(P25~P75)]
二、样本采集不合格率
在我院转型前期,工作人员相对人手不足,工作任务重,压力大,各病区的样本采集不合格率较高。且由于不同病区间的工作任务差异,人员配置不同等,不同病区间的采样不合格率差异有统计意义(P<0.05)。转型后期随着采样相关标准化培训工作的开展及工作人员的补充,各病区的采样不合格率均明显下降(P<0.01)(见表3)。

表3 不同病区间样本采集不合格率的差异
三、2 种试剂检测临床样本间的差异
将213 份住院新冠肺炎患者的核酸检测样本分别用2 种不同的检测试剂进行检测,结果见表4、5。对于ORF1ab 和N 基因Ct 值<30 的样本,2 种试剂检测结果间的一致性较好,R 值分别为0.959 8和0.959 4(见图2A、2B)。但对于Ct 值在30~40 范围内的样本,两者检测结果间的一致性下降。尤其Ct 值在35~40 的样本,试剂B 检测ORF1ab 和N基因均存在20 余例漏检的情况(见图2C、2D)。

图2 213 份临床核酸检测样本用2 种试剂检测的结果分析

表4 2 种试剂检测213 份样本ORF1ab 基因Ct 值的比较
四、弱阳性质控品的检测结果
实验室自制弱阳性质控品和2 个商品化弱阳性质控品的检测结果见表6。自制弱阳性质控品ORF1ab 和N 基因Ct 值在35 左右,2 个商品化质控Ct 值均在31 左右,能较好覆盖临床上弱阳性样本的检测范围。
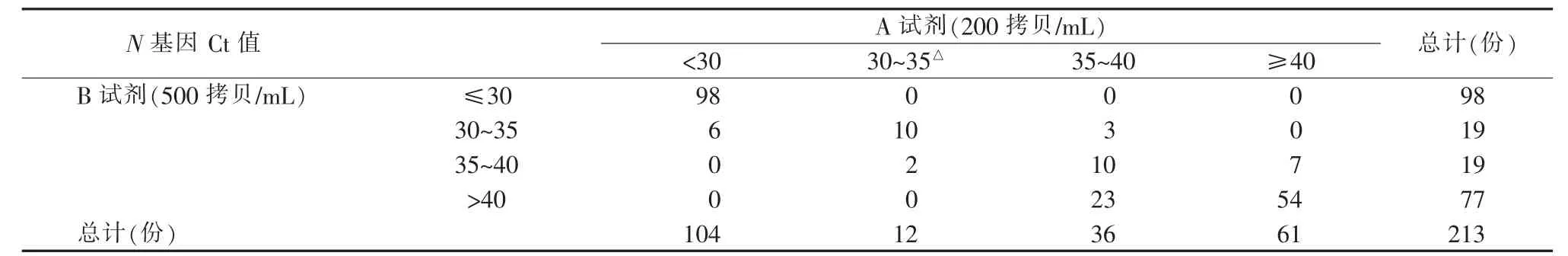
表5 2 种试剂检测213 份样本N 基因Ct 值的比较
表6 3 个弱阳性质控品ORF1ab 和N 基因Ct 值统计()

表6 3 个弱阳性质控品ORF1ab 和N 基因Ct 值统计()
讨 论
一、规范样本采集、转运流程,合理安排患者检测频次
研究表明,在疾病的不同阶段和机体不同部位存在的病毒载量有所不同,多种样本类型均可用于新冠肺炎的核酸检测,如肺泡灌洗液、深咳痰、鼻咽拭子、口咽拭子、唾液、血液及粪便等[2-6]。但考虑到实际工作中操作的方便性和患者的接受度,以及现有实验室检测方法的灵敏度对于非上呼吸道标本的不适用性等,目前呼吸道样本(口咽拭、鼻咽拭)应用最为广泛。
样本采集的质量是保证后续检测结果准确与否的关键。由不规范的采样程序(如使用错误的拭子、采样部位不准确、分泌物吸取量不足,交叉污染等)获得的不合格样本是产生假阴性、假阳性检测结果的主要原因[2-4]。经过初步统计分析发现,在我院转型前期,工作人员人手不足,工作任务重,压力大;核酸阳性患者呼吸道样本的采集过程中会增加采样人员的暴露风险,采样人员难免会有心理负担,也是导致部分患者样本采集不合格产生假阴性的原因。各病区间工作任务的差异,工作人员配置的差异等,同样也会导致样本采集不合格率的差异,宜应引起足够的重视。随着后期相关培训工作的开展,工作人员的补充,各病区的样本采集质量显著提高,不合格率明显降低。
实验室方面,核酸阳性样本的检测量越大,实验室污染的风险越高,假阳性率越高。尤其部分实验室还承担着大量的社区筛查任务,需引起足够的重视。另外,还要兼顾到社会医疗资源的经济性,所以,新冠阳性患者合理的核酸检测频次,在降低实验室污染风险、保证检测质量、节省社会医疗资源等方面,具有重要的意义。通过对部分患者入院基础Ct 值和时间变化规律的分析,患者ORF1ab 和N基因的基础Ct 值与转阴间隔呈负相关,与其他研究[6-7]相似,建议可将此类患者(Ct 值<30)的核酸检测频次定为3 d 或4 d 检测1 次,Ct 值大于30 以后可每2 d 检测1 次。
二、评估检测试剂性能,制定复检规范和流程
实验室检测环节(分析中)是整个核酸检测工作中的重中之重,检测试剂的稳定性能、仪器设备的良好运转,是保证检测结果准确可靠的前提。根据国家卫健委的相关要求,实验室应常备2 种及以上的检测试剂用于初检和复检。实验室在选用前,都应对检测试剂的性能进行验证,包括但不限于精密度、准确度及灵敏度等。但实验室往往受限于真实临床样本的不足,性能验证样本一般选用科研质粒或质控品等,很难对检测试剂的检测性能进行全面的评价。
目前,市面上可供选择的试剂越来越多,试剂质量也较疫情初期有明显提升,但不同品牌试剂间的差异仍然存在[8]。Evans 等[9]的研究也表明,对于同一室间质评样本,使用不同检测试剂,在不同的实验室,测得的Ct 值会有明显差异。本研究发现,2 种试剂对病毒载量较高的阳性样本的检测结果间一致性较好,而试剂B 对病毒载量处于临界值的弱阳性标本检出能力欠佳,试剂A 在此范围内更有优势。在质量控制方面,试剂A 采用的外源性内标,若实验过程中出现人员操作失误、核酸提取仪器故障或检测试剂扩增效率下降等问题,扩增结束后可观察到内标曲线的离散度增大、荧光峰值降低、检测Ct 值相较以往偏倚较大等,能够帮助实验人员及时发现问题。而试剂B 的内源性内标(RNase P 基因)除具有上述监测效果外,还能更好地监控样本采集过程。事实上,本实验室中发现的因样本采集不合格而导致的假阴性,也多是通过试剂B 内源性内标的监控。所以,实验室在选择试剂前应充分对其进行性能验证,了解各试剂盒的优缺点,综合评估,不同的试剂盒在临床工作中可相互补充,更好地完成检测任务。
鉴于样本采集差异、实验室人员操作差异及不同试剂差异等对检测结果影响,实际工作中应严格对可疑样本进行复检。扩增反应结束后,工作人员先对阴性质控和弱阳性质控的检测结果进行审核,如无失控情况,则进一步分析各样本检测结果,重点观察样本检测的荧光曲线是否典型。将检测Ct值导入LIS 系统中,结合该患者历次检测结果,对本次检测结果进行审核发放。对于新冠肺炎患者检测Ct 值首次出现≥35 或NoCt 的样本,为排除假阴性,需结合历次检测结果判断是否应进行复检,复检时优先选择试剂A(见图3)。而对于患者前次检测Ct 值≥35 或阴性(NoCt),而本次检测Ct 值<35的样本,更应慎重审核,以排除假阳性,复检时采用试剂A 和试剂B 平行检测(见图4)。

图3 阳性患者阴性样本的复检流程
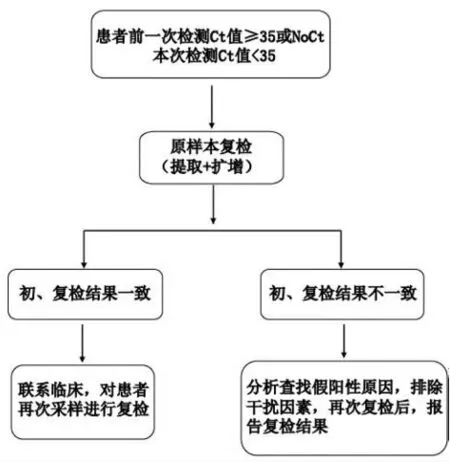
图4 患者疑似假阳性样本的复检流程
三、规范工作流程,加强室内质量控制、仪器设备的管理和人员培训考核
目前,虽然核酸检测的自动化程度越来越高,各种仪器设备层出不穷,一定程度上缓解了实验室工作人员的压力。但大部分实验室的核酸检测工作,从反应试剂的配制,到原始样本整理和提取核酸产物的加样,再到检测结果的分析、检验报告的审核等全过程仍高度依赖于工作人员的手工操作。所以,实验室应规范操作流程,严格设置室内质控的同时,还应加强对实验室工作人员的培训和考核。
实验室工作人员的操作能力,很大程度上影响了核酸检测的质量。我科定期对工作人员进行培训,包括但不限于理论知识、操作技能等,更结合实际工作中的情况,及时反馈沟通存在的问题,不断提升实验室工作人员的理论知识水平和实践操作技能。
根据国家和上海市临床检验中心的相关要求,每块反应板中室内质控设置3 个阴性和2 个弱阳性。第九版诊疗规范出台后,临床上对Ct 值35 范围内的检测结果更为关注。目前,本实验室购买的2 个品牌弱阳性质控品ORF1ab 和N 基因检测Ct值均在31~32 范围内。为保证实验室检测结果的一致性,更好地监控Ct 值在35 左右的样本检测结果。本实验室加入了自制的弱阳性质控品,将每块反应板的弱阳性质控增加为3 个,参考定量试验的室内质控方法,在LIS 系统质控软件中导入弱阳性质控检测结果,实时对2 个水平的弱阳性质控进行监控。当然,此质控方式的实际应用效果,还要经过大量的实验数据进行验证和优化,也是本实验室以后工作中需要不断探索的内容[10]。
四、严格审核分析检测结果,及时发现并解决问题
扩增反应结束后,实验结果的判读是核酸检测质量保证的最后一道关卡,宜由经验丰富的工作人员进行,必要时需2 人对结果进行审核判读[10]。阴性和弱阳性质控均在控的情况下,逐一对样本的检测结果进行审核。需重点关注每批反应的基线设置,每份样本各靶基因通道的荧光曲线情况。对于实验结果中出现的不同问题,应根据实际情况分析可能原因,排除干扰因素后,根据复检规则对可疑的样本结果进行复检。
此区工作人员应对整个实验过程具有较深的理解,熟练掌握本实验室所用检测试剂的性能和优缺点,合理应用室内质控和试剂盒内标监控实验过程,并能娴熟地分析处理实验过程中的异常结果。实际工作中,往往会存在某些不易及时发现并排除的问题,如工作人员不规范的操作习惯、核酸提取仪和扩增仪系统性故障等。在对检测结果进行分析时,不应只关注扩增曲线是否检出,其他如内标扩增曲线的离散度、各靶基因扩增曲线的荧光峰值、指数期的斜率、同一样本各靶基因Ct 值的差异等,也应着重关注。如此才能及早发现问题,避免对检测结果产生更大的影响。
五、结语与展望
目前,新冠肺炎核酸检测主要依赖实时荧光定量PCR 技术在专用的基因扩增实验室中完成。作为定性试验,检测结果易受分析前、分析中和分析后多种因素影响。第九版诊疗规范颁布以来,检测Ct 值的概念广为人知,核酸检测也因此在新冠肺炎患者的临床诊断和转归判读中扮演着越来越重的角色。实验室面临着巨大的压力和挑战,如何降低样本检测结果的假阴性率和假阳性率,如何实现新冠核酸检测的标准化,保证实验室检测结果的一致性,如何解决目前实验室诊断标准和临床判读标准不一致等问题,将是未来一段时间内,国家相关机构、临床实验室和试剂生产厂商需要尤为关注的问题。
