MCC950对脑出血大鼠神经损伤的作用*
2022-06-02郭亚净李亭亭
郭亚净,任 静,刘 寒,李亭亭,张 帅,王 洪
(河北中医学院,石家庄 050200)
脑出血(intracerebral hemorrhage,ICH)具有很高的死亡率和致残率,幸存者会遗留不同程度的神经功能障碍[1,2]。大量研究表明,除了ICH后血肿压迫引起的原发性脑损伤之外,血脑屏障破坏、脑水肿、炎症反应、凝血酶毒性效应等继发性脑损伤是导致神经功能障碍,造成不良预后的主要原因。
核苷酸结合寡聚化结构域样受体蛋白3(the pyrin domain-containing protein 3,NLRP3)炎性小体被激活后,促进半胱天冬酶-1(cysteiny aspartate specific proteinase-1,caspase-1)的活化,caspase-1在介导炎症反应的同时,还介导细胞焦亡[3]。有研究显示,ICH后NLRP3炎性小体被激活,并通过GSDMD在细胞膜上形成的小孔释放IL-1β和IL-18等炎性因子,促进血肿周围组织中性粒细胞的浸润和炎症反应,进而加重脑水肿和神经功能障碍[4]。
本研究利用自体血注射大鼠模型,给予NLRP3炎性小体选择性抑制剂MCC950,观察抑制NLRP3炎性小体激活是否可以改善ICH后的神经损伤,为寻找有效改善ICH预后的措施提供理论依据。
1 材料与方法
1.1 动物
健康成年雄性Sprague Dawley(SD)大鼠72只,体重约250~300 g,购于北京维通利华实验动物技术有限公司,动物许可证号:CSXK[京]2016-0006。饲养条件,温度恒定为(22±1)℃,湿度为(50±20)%,光照条件为昼夜各12 h,自由饮食水。动物实验操作严格遵守河北中医学院实验动物伦理委员会的相关规定。
1.2 主要试剂
MCC950(APExBIO公司);Fluoro-Jade®C(Millipore公司);TUNEL检测试剂盒(Roche公司);苏木精染液、伊红染液、BCA蛋白浓度测定试剂盒(武汉塞维尔生物科技有限公司);抗NLRP3抗体(Novus公司);抗ASC、caspase-1、GSDMD抗体(Santa Cruz公司);抗IL-1β、IL-18抗体(Abcam公司)。
1.3 主要设备
全自动脑立体定位仪(51700,stoelting公司,美国);烘箱(UF160,MEMMERT公司,德国);正置荧光显微镜(DMEB5300,Leica公司,德国);全自动酶标分析仪(EPOCH,Thermo Fisher公司,美国);电泳仪(PowerPac Universal,Bio-Rad公司,美国);半干转印槽(Trans-BLot Smidry,Bio-Rad公司,美国);多功能成像系统(Vilber Fusion FX5 Spectra,Vilber Lourmat,法国)。
1.4 动物分组与模型建立方法
将SD大鼠随机分为3组(n=24):sham组、ICH组和MCC950组。参考相关文献,建立ICH模型[4]。ICH组和MCC950组大鼠,1%戊巴比妥钠,100 μl/g腹腔注射麻醉后,将其固定于全自动脑立体定位仪上。剪开头部正中皮肤约1 cm,以前囟作为原点,向前0.12 mm,向右旁开3.8 mm,标记为穿刺点。用颅钻钻开直径约1 mm的小孔。取100 μl尾尖非抗凝血至微量注射器中,将微量注射器向下5.5 mm穿刺进入纹状体,以10 μl/min的速度注入血液,结束后停针20 min,缓慢退针。骨蜡封闭小孔,缝合切口。sham组除不注入血液外,其余操作均相同。手术时,房间内温度维持在24℃,同时监测动物的体温、血氧、血压等。造模结束后,将MCC950溶解于PBS中,浓度为2 mg/ml。腹腔注射MCC950(10 mg/kg)[5],在相同时间点连续注射3 d。sham组和ICH组仅注射等体积的PBS。
1.5 神经功能评价
(1)前肢放置实验用于评价大鼠的感觉运动功能。测试者握住大鼠背部皮肤使四肢悬空,将大鼠胡须接触桌面边缘诱导其将前肢放置于桌面上,纹状体受损大鼠,其受损对侧肢体将出现不同程度的放置能力缺失。大鼠每侧受测10次,左侧前肢成功放置的百分率反应损伤情况。(2)转角实验用于评价大鼠肢体协调功能。将大鼠放入一个两块板所形成的30°夹角内,使其转身,观察并记录大鼠向左侧转身的次数。每只大鼠重复放置10次,每次间隔至少30 s。左侧转身次数百分率反应损伤情况。(3)mNSS神经功能评分用于评价大鼠的运动、感觉、平衡和反射功能。评分范围为0~18分,分值越高,其神经损害越严重。评分方法参考相关文献[6]。
1.6 新鲜脑组织切片
快速分离大鼠脑组织,以进针点冠状切面为起点,分别向前后以2 mm的厚度,将脑组织进行切片,然后与标尺同时拍照记录。用Image J软件测量各切片的血肿面积,血肿面积乘以切片厚度的总和得到血肿体积(mm3)。
1.7 干湿比重法
将脑组织分为病灶侧皮质、病灶侧基底、病灶对侧皮质、病灶对侧基底及小脑五部分,分别放入锡纸中,称量湿重。然后,将烘烤后的脑组织取出称量干重。利用公式:(湿重-干重)/湿重×100%,计算得到脑组织水含量。
1.8 标本的留取和制备
暴露大鼠胸腔,用冰冷的PBS溶液将心血管系统内的血液冲洗干净。取出大脑,以进针点冠状面为基准,分别向其前后延伸1 mm距离,切取厚约2 mm脑组织。用于病理学检测的组织放入4%组织细胞固定液进行固定、蜡块包埋和组织切片;留取患侧脑组织用于Western blot检测,液氮中存放24 h后,转入-80℃冰箱备用。
1.9 苏木精-伊红(HE)染色
用于观察血肿周围脑组织病理学变化及水肿情况。正置显微镜下,每张切片选取4个视野,每只动物观察3张切片。
1.10 Fluoro-Jade®C(FJC)染色
脑组织石蜡切片脱蜡至水后,用PBS冲洗3次,将切片浸入0.06%的髙锰酸钾溶液中(在摇床上轻摇),10 min后取出,PBS冲洗3次。在避光环境下,将切片浸入0.0001%的FJC染色液中染色。30 min后用蒸馏水冲洗3次。干燥后,将切片置于二甲苯中进行透明,用抗荧光淬灭封片剂封片。荧光显微镜下,每张切片选取血肿周围组织4个视野,并进行FJC阳性细胞计数。
1.11 TUNEL染色
石蜡切片脱蜡至水后,蛋白酶K修复,然后用破膜工作液破膜,滴加buffer室温平衡10 min后,滴加含有TDT酶、dUTP和buffer的反应液(1∶5∶50),37℃孵育2 h。最后,DAPI染核、抗荧光淬灭封片剂封片。在正置荧光显微镜下进行观察并采集图像,每个切片在血肿周围选取3个视野,每个脑组织选取3个切片。
1.12 Western blot
用RIPA裂解液将脑组织匀浆后,在4℃下,12 000 r/min离心15 min,取上清,BCA法检测蛋白浓度。将蛋白进行SDS-PAGE电泳,然后转移到PVDF膜上,5%脱脂牛奶封闭PVDF膜后,孵育NLRP3、ASC、caspase-1、GSDMD、IL-1β、IL-1β和β-actin抗体,于4℃过夜。TBST洗涤后孵育二抗,随后进行ECL显影,在多功能成像系统(Fusion FX5 Spectra,Vilber,Paris,France)上进行拍照。用Image J软件进行灰度值分析,将目的蛋白与内参蛋白β-actin的比值作为蛋白的相对表达量。
1.13 统计学处理
2 结果
2.1 MCC950对ICH大鼠神经功能的影响
2.1.1 前肢放置实验 与sham组比较,ICH大鼠左侧前肢放置成功百分比显著下降(P<0.01);与ICH组比较,MCC950组大鼠左侧前肢放置成功百分比显著升高(P<0.05,表1)。
2.1.2 转角实验 与sham组比较,ICH大鼠左侧转身的百分比显著下降(P<0.05);与ICH组比较,MCC950组大鼠左侧转身的百分比显著升高(P<0.05,表1)。
2.1.3 mNSS评分 与sham组比较,ICH大鼠的mNSS评分显著升高(P<0.01);与ICH组比较,MCC950组大鼠mNSS评分显著下降(P<0.01,表1)。

Tab. 1 The results of forelimb placement test,corner test and mNSS neurological function n=12)
2.2 MCC950对ICH大鼠神经损伤的影响
2.2.1 新鲜脑组织切片 与sham组比较,ICH大鼠脑内存在较大体积的血肿(0.00±0.00 mm3vs26.37±1.65 mm3,P<0.01);与ICH组比较,MCC950组大鼠血肿的体积显著减小(26.37±1.65 mm3vs13.80±1.82 mm3,P<0.01,图1)。

Fig. 1 Representative images of changes in hematoma volume in each group of rats
2.2.2 干湿比重 与sham组比较,ICH大鼠病灶侧基底含水量显著增多(P<0.05);与ICH组比较,MCC950组大鼠病灶侧基底含水量显著减少(P<0.05)。然而,在病灶侧皮质、病灶对侧皮质、病灶对侧基底及小脑,脑组织含水量没有明显变化(表2)。
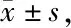
Tab. 2 Water content of brain tissue in Ipsi-BG,Ipsi-CX,Con-BG,Con-CX and cerebellum(%, n=6)
2.2.3 FJC染色 与sham组比较,ICH大鼠血肿周围脑组织中FJC阳性细胞数量显著增加(623.90±99.92 cells/mm2vs894.20±112.30 cells/mm2,P<0.05);与ICH组比较,MCC950组大鼠FJC阳性细胞的数量显著减少(894.20±112.30 cells/mm2vs637.10±82.950 cells/mm2,P<0.05,图2)。

Fig. 2 Representative images of changes in the number of FJC positive cells in each group of rats (FJC ×400)
2.2.4 HE染色 Sham组大鼠血肿周围脑组织神经细胞数排列整齐,分布匀称,细胞组织结构染色均匀。ICH组大鼠血肿周围脑组织小胶质细胞数量增加,神经元数量减少,神经细胞肿胀,排布不均,部分细胞固缩性坏死,染色加深。MCC950组大鼠脑组织中神经细胞肿胀明显减轻,固缩坏死细胞数量减少(图3)。

Fig. 3 Representative images of histopathological changes in each group of rats (HE ×400)
2.3 MCC950对NLRP3炎性小体介导的细胞焦亡及炎症的影响
2.3.1 TUNEL染色 与sham组比较,ICH大鼠血肿周围脑组织中TUNEL阳性细胞数量显著增加(546.10±115.81vs1059.00±126.50 cells/mm2,P<0.05);与ICH组比较,MCC950组大鼠TUNEL阳性细胞的数量显著减少(1059.00±126.50 cells/mm2vs665.70±76.44 cells/mm2,P<0.05,图4)。

Fig. 4 Representative images of changes in the number of TUNEL positive cells in each group of rats (TUNEL ×400)
2.3.2 Western blot 与sham组比较,ICH大鼠脑组织中NLRP3、ASC、pro-caspase-1、caspase-1、caspase-1/pro-caspase-1比值、GSDMD-N、GSDMD、GSDMD-N/GSDMD比值、IL-1β和IL-18均显著升高(P<0.05,P<0.01);与ICH组比较,MCC950组大鼠脑组织中NLRP3、ASC、pro-caspase-1、caspase-1、caspase-1/pro-caspase-1比值、GSDMD-N、GSDMD、GSDMD-N/GSDMD比值、IL-1β和IL-18均显著降低(P<0.05,P<0.01,图5,表3,表4)。
3 讨论
脑出血(intracerebral hemorrhage,ICH)是神经外科常见的脑血管疾病,具有致残率高和致死率高的特点。ICH占所有脑卒中的比例,在美国、欧洲及澳大利亚约为10%~15%,在亚洲地区高达到20%~30%[7]。并且,仅有20%患者的神经功能可在6个月内完全恢复。随着我国老年人口数量的逐渐增加,ICH发病人数也随之增加,给众多家庭带来沉重的经济负担[8]。目前,尽管针对ICH的临床治疗方法有了明显的改进,但对于病人的预后并没有明显的改善。造成不良预后的原因主要是ICH后的脑组织损伤,通常在出血后数小时内发生原发性脑损伤,主要由不断增大的颅内血肿压迫周围组织造成,逐渐诱发脑水肿和神经损伤[9]。继发性损伤是导致神经功能障碍,造成不良预后的主要原因,包括血液成分溶解和血管中炎症因子释放的造成的血脑屏障破坏、脑水肿、炎症反应、凝血酶毒性效应等[10]。

Tab. 3 Comparison of the expressions of proteins in brain tissue of each group by Western n=6)

Tab. 4 Comparison of the expressions of proteins in brain tissue of each group by Western n=6)

Fig. 5 Expressions of NLRP3 inflammasome-mediated pyroptosis and inflammation-related proteins in each group of rats brain tissues (n=6)
NLRP3炎性小体由模式识别受体蛋白NLRP3,凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)和半胱天冬酶-1前体(pro-caspase-1)组成。当NLRP3受体与其配体结合后被激活,pro-caspase-1自体水解为具有活性的P20和P10大小的两个caspase-1亚基,亚基可形成异二聚体并进一步形成四聚体,最终形成具有活性的caspase-1。活化的caspase-1进一步促进白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-18(interleukin-18,IL-18)的成熟[11,12]。NLRP3炎性小体在介导炎症反应的同时,还可介导细胞焦亡[4]。细胞焦亡是一种依赖炎症性caspase的细胞程序性死亡方式。活化的caspase-1切割GSDMD,形成含有氮端活性域的GSDMD肽段,与细胞膜融合,诱导其穿孔,使细胞发生破裂,释放IL-1β、IL-18炎性因子等内容物,引起周围组织更加强烈的炎症反应[13]。同时,焦亡细胞出现核固缩,DNA断裂,所以焦亡细胞TUNEL染色为阳性[14]。
NLRP3炎性小体介导的炎症反应被证实参与多种中枢神经系统疾病。在蛛网膜下腔出血和脑缺血再灌注模型中,抑制NLRP3炎性小体激活或敲除NLRP3基因可减少IL-1β和IL-18的分泌,改善早期脑损伤,发挥神经保护作用[15-17]。在胰岛素抵抗小鼠,抑制NLRP3炎性小体可以降低海马内焦亡相关蛋白和炎症因子的表达[18]。有研究显示,ICH后NLRP3炎性小体被激活并促进炎性反应[19]。因而,抑制NLRP3炎性小体的激活可能是改善ICH后神经损伤和神经功能的重要机制。
本研究利用大鼠自体血注射ICH模型,观察NLRP3炎性小体抑制剂MCC950对ICH后神经损伤和神经功能的影响。研究结果显示,抑制NLRP3炎性小体显著增加ICH大鼠前肢放置实验中左侧前肢的放置成功百分比、转角实验中左侧转身的百分比,降低ICH大鼠的mNSS评分,表明抑制NLRP3炎性小体可以改善ICH大鼠的神经功能障碍。同时,抑制NLRP3炎性小体显著减小ICH大鼠血肿的体积,改善组织病理学变化和脑组织水肿,减少FJC阳性细胞数量,表明抑制NLRP3炎性小体可以有效改善ICH大鼠的神经损伤。进一步研究发现,ICH大鼠脑组织中NLRP3、ASC和caspase-1的表达及激活水平显著升高,抑制NLRP3炎性小体有效地降低NLRP3、ASC、caspase-1、IL-1β和IL-18的表达及激活水平,表明抑制NLRP3炎性小体激活有效的抑制其介导的炎症反应。另外,抑制NLRP3炎性小体显著降低GSDMD的表达及激活并减少脑组织中TUNEL阳性细胞数量,表明抑制NLRP3炎性小体激活有效的抑制其介导的细胞焦亡。
综上所述,NLRP3炎性小体选择性抑制剂MCC950可以通过抑制NLRP3炎性小体介导的炎症反应和细胞焦亡改善ICH后的神经损伤和神经功能障碍。为有效改善ICH病人的预后提供理论依据。
