不同密度铜锈环棱螺对沉水植物生长和水质的影响
2022-05-31胡淑芳刘金福陈宇炜丁惠君代涛涛钟家有
李 威,胡淑芳,陈 楠,刘金福,陈宇炜,丁惠君,代涛涛,楼 倩,钟家有
(1. 南昌工程学院江西省退化生态系统修复与流域生态水文重点实验室,江西 南昌 30099;2. 江西省水利科学院江西省鄱阳湖水资源与环境重点实验室,江西 南昌 330029)
淡水螺类属于软体动物门,腹足纲,分为前鳃亚纲和肺螺亚纲,前者一般具有厣和鳃,活动于水底,只能借助基质或水草等靠近水面,几乎不牧食沉水植物,如铜锈环棱螺(Bellamyaaeruginosa);后者无厣和鳃,以外套膜壁上密生血脉网的假肺呼吸,借体内空气泡可以浮上水面,有些种类直接取食沉水植物叶片,如椭圆萝卜螺(Radixswinhoei)[1-2]。淡水螺类广泛分布于我国的湖泊、河流、沟渠和池塘中, 为底栖动物群落的重要组成部分,在我国许多水体中为优势底栖动物[3-4]。
前鳃亚纲的铜锈环棱螺由于能够絮凝水体悬浮物,滤食水体浮游植物,刮食附着藻,并且几乎不牧食沉水植物,因此常被用来与沉水植物一起净化水体。Mo等[5]的研究表明沉水植物苦草(Vallisnerianatans)和铜锈环棱螺单独作用均能够降低水体总氮浓度、附着藻和底栖藻的生物量,二者结合在一起能够取得更显著的水体修复效果;郑有飞等[6]的研究表明不同密度环棱螺(Bellamyasp.)处理组苦草表面附着生物的生物量明显低于无螺组,螺处理组苦草根状茎生物量均大于对照组。然而,铜锈环棱螺对水质的影响并不总是正面的,铜锈环棱螺的新陈代谢作用和对底泥生物的扰动作用能够改变水体的物理化学特性和藻类群落,如Zhu等[7]的研究表明铜锈环棱螺的存在降低了水体的氮磷比,降低了绿藻的生物量,但是提高了蓝藻的生物量;Yang等[8]的研究表明铜锈环棱螺的生物扰动作用显著增加了水体可溶性活性磷和不稳定磷的浓度,使泥-水界面磷通量比无螺组增加了2倍以上。此外,铜锈环棱螺对沉水植物的影响具有一定的种间差异性,Li等[9]的研究表明铜锈环棱螺对苦草生长的促进作用大于轮叶黑藻(Hydrillaverticillata)和金鱼藻(Ceratophyllumdemersum)。以上研究表明,铜锈环棱螺对水生态系统的影响兼具正向和负向作用,有关椭圆萝卜螺牧食作用的研究表明,螺类的密度效应可能是驱动两种作用转化的关键因子[10-11]。然而,有关不同密度铜锈环棱螺对水质和不同沉水植物影响的研究并不是很充分。本研究通过构建两种沉水植物与不同密度铜锈环棱螺共存的环境,旨在阐明不同密度铜锈环棱螺对沉水植物生长率和水质指标的影响,以及铜锈环棱螺对不同沉水植物影响的差异,以期为联合使用沉水植物和铜锈环棱螺净化水体的生态工程提供科学依据。
1 材料与方法
1.1 试验材料
苦草和金鱼藻是水生态修复中常用的沉水植物,苦草属于莲座型沉水植物,叶片和根发达,金鱼藻是无根沉水植物,能够断枝生长,二者形态差异较大[12],因此具有典型代表性,不同密度铜锈环棱螺对二者的影响可能有较大差异。沉水植物采自赣抚平原六干渠南昌工程学院校内河段(28°41′28.14″N,116°1′26.48″E),采集后在实验室预培养1个月,选取生长良好、无分枝的苦草和金鱼藻植株。苦草每株保留4~5个健康叶片,修剪至地上部分9.0 cm、地下部分3.0 cm作为备用苗种,其鲜重为(0.43±0.05)g。金鱼藻修剪顶端12.0 cm作为苗种,鲜重为(0.45±0.05) g。试验前植物苗种均用晾晒过的自来水和去离子水轻轻洗去表面泥沙和附着物。试验所用铜锈环棱螺取自鄱阳湖国家自然保护区,选择大小一致、生长良好、重量为(1.80±0.20) g的个体,用软毛刷轻轻去除表面附着物,放入晾晒过的自来水中曝气暂养3 d。
试验用水取自赣抚平原六干渠南昌工程学院河段,使用浮游生物网过滤后使用,水质指标初始值:溶解氧质量浓度为8.92 mg/L,氧化还原电位为213 mV,pH值为6.95,电导率为473 μS/cm,叶绿素质量浓度为54.89 μg/L,水体可溶性总氮质量浓度为1.423 mg/L,水体可溶性总磷质量浓度为0.135 mg/L。
采用容积为5 L、高25 cm、直径为16 cm的圆形玻璃缸种植沉水植物,玻璃缸底铺设4 cm淘洗干净的细砂(粒径为1~2 mm)用以固定沉水植物,缸内添加试验用水至23 cm处。
1.2 试验设计
铜锈环棱螺设置3个密度处理组:对照组,放置0个螺;低密度组,放置4个螺,密度约为200个/m2;高密度组,放置8个螺,密度约为400个/m2。3个处理组分别种植4株苦草(约为86 g/m2)和4株金鱼藻(约为90 g/m2)。共6个处理组,每个处理组设置3个系统重复。
试验于2017年6月初开始,共进行15 d。试验中光照采用9 W的人工光照,光照时间为每天12 h(07∶00—19∶00)。试验期间每隔3 d采用便携式水质分析仪(美国哈希公司,HQ 40d)测定一次水体温度、溶解氧质量浓度、氧化还原电位、pH值和电导率;采用叶绿素分析仪(福州普贝斯智能科技有限公司,PCH-800)测定叶绿素质量浓度。
试验开始前和结束后采用HJ 636—2012《水质 总氮的测定 碱性过硫酸钾消解紫外分光光度法》方法测定水体总氮质量浓度和GB 11893—89《水质 总磷的测定 钼酸铵分光光度法》方法测定水体总磷质量浓度,用以计算装置氮和磷去除率,计算公式为
(1)
(2)
式中:RN、RP分别为总氮、总磷的去除率;ρN0、ρN1分别为水体初始氮、试验结束氮质量浓度;ρP0、ρP1分别为水体初始磷、试验结束磷质量浓度。
试验结束测定每个玻璃缸苦草和金鱼藻总鲜重和株高,用以计算沉水植物相对生长率和相对伸长率,计算公式为
(3)
(4)
式中:RG、RL分别为植物相对生长率、相对伸长率;W0、W1分别为沉水植物初始鲜重、试验结束鲜重;L0、L1分别为沉水植物初始株高、试验结束株高;t为试验时间。
1.3 统计分析
试验数据采用SPSS18.0软件分析。水体氮、磷去除率和沉水植物相对生长率不同处理间的差异分析采用单因素方差分析进行,多重比较采用q检验的方法;不同因子(文中分别指沉水植物物种、铜锈环棱螺密度、交互作用和残差)对水体氮、磷去除率的影响采用多因素一般线性模型的方法分析,并采用方差分解的方法量化各因素对影响因子变异的相对贡献[13-14],其计算公式为
(5)
式中:σx为因子x的方差百分比;Sx为因子x的方差平方和;Sx1、Sx2、Sx1,x2、SC分别为因子沉水植物物种、铜锈环棱螺密度、交互作用、残差的方差平方和。
2 结果与分析
2.1 水质指标
图1为苦草组水质随时间变化情况。试验期间水体温度为(27.4±0.5)℃,由图1可见,苦草组水体溶解氧质量浓度和氧化还原电位随着铜锈环棱螺密度的增加而降低;试验结束时,溶解氧质量浓度和氧化还原电位高密度组相对于对照组分别降低了33.0%和12.1%。电导率随着螺密度的增加而升高;试验结束时,电导率高密度组相对于对照组升高了20.6%。低密度组pH值则要高于对照组和高密度组。
图2为金鱼藻组水质随时间变化情况。由图2可见,水体溶解氧质量浓度在前9 d随铜锈环棱螺密度的增加而降低,在后6 d低密度组溶解氧质量浓度高于对照组和高密度组。金鱼藻组水体电导率随时间的变化规律与苦草组相似,试验结束时,高密度组电导率相对于对照组升高了22.2%。pH值和氧化还原电位的变化则随时间有一定波动。
图3为不同处理组水体叶绿素质量浓度随时间变化情况,由于仪器故障第3天的水体叶绿素质量浓度没有测定。由图3可见,苦草组水体叶绿素质量浓度是试验前期对照组最高,试验结束时低密度组最高;而金鱼藻组在试验结束时高密度组最高。

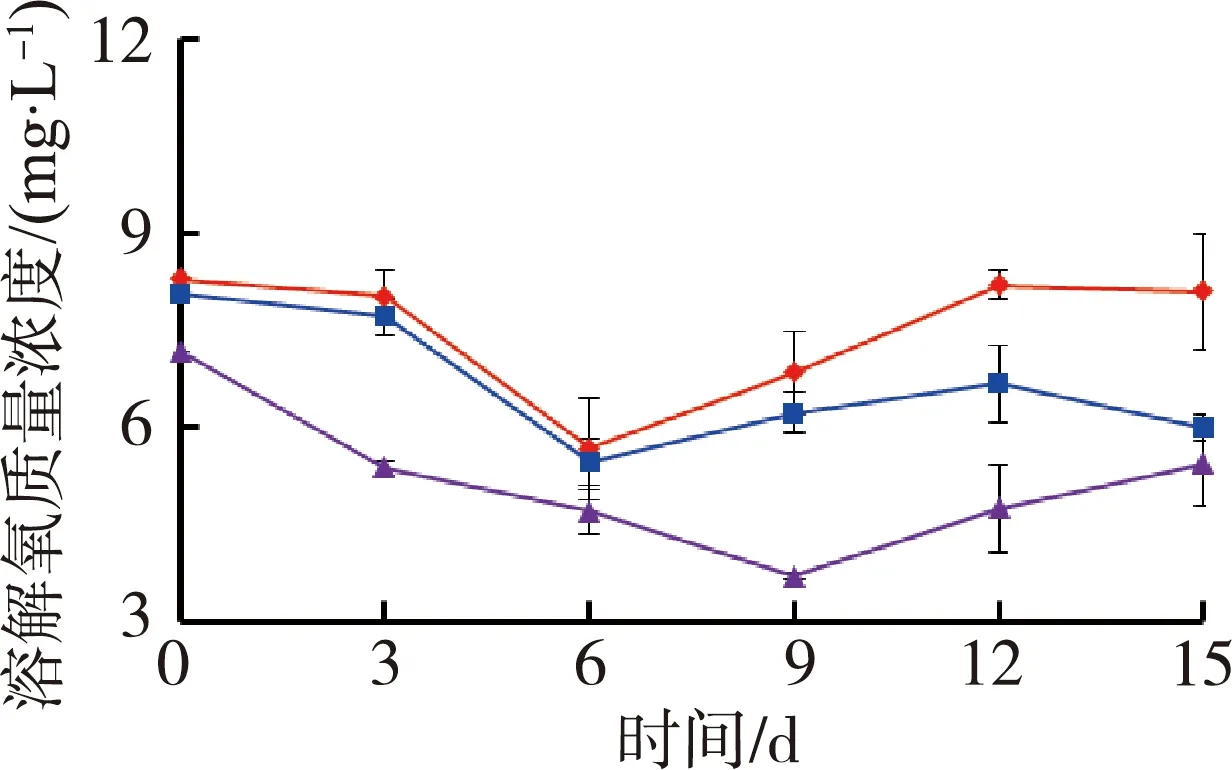
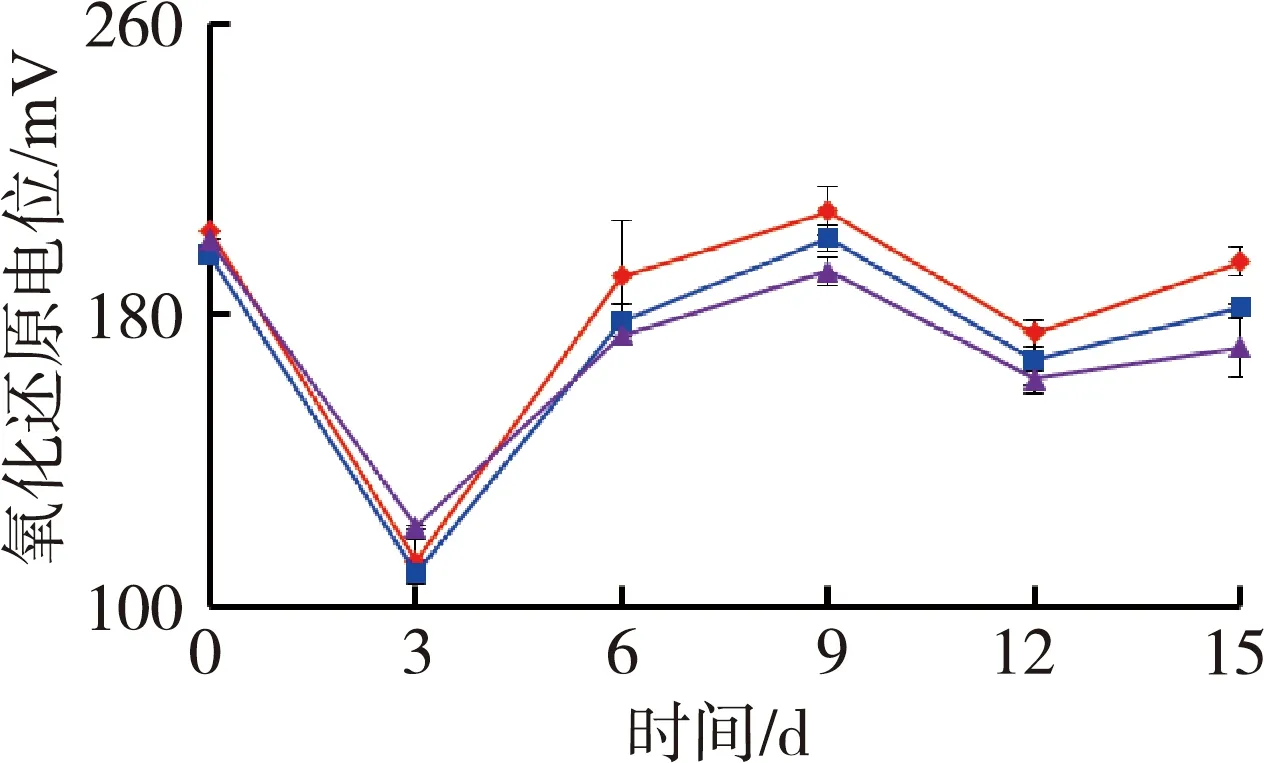
(a)溶解氧 (b)氧化还原电位
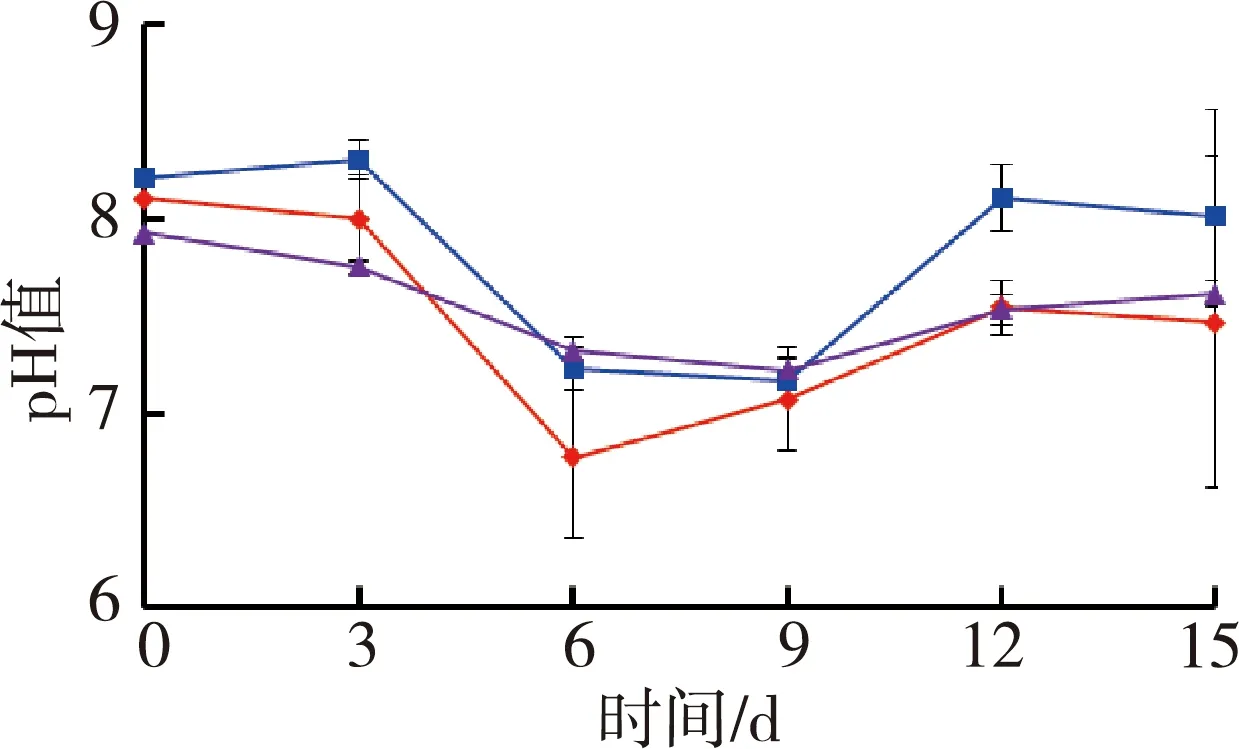
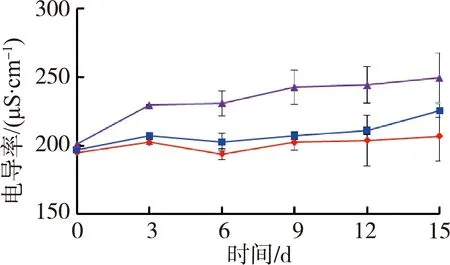
(c)pH (d)电导率
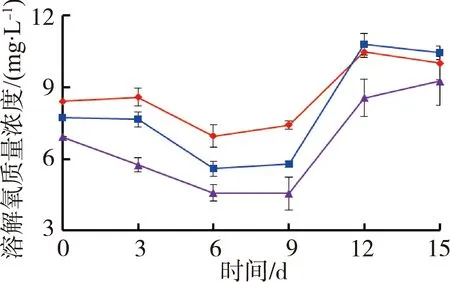
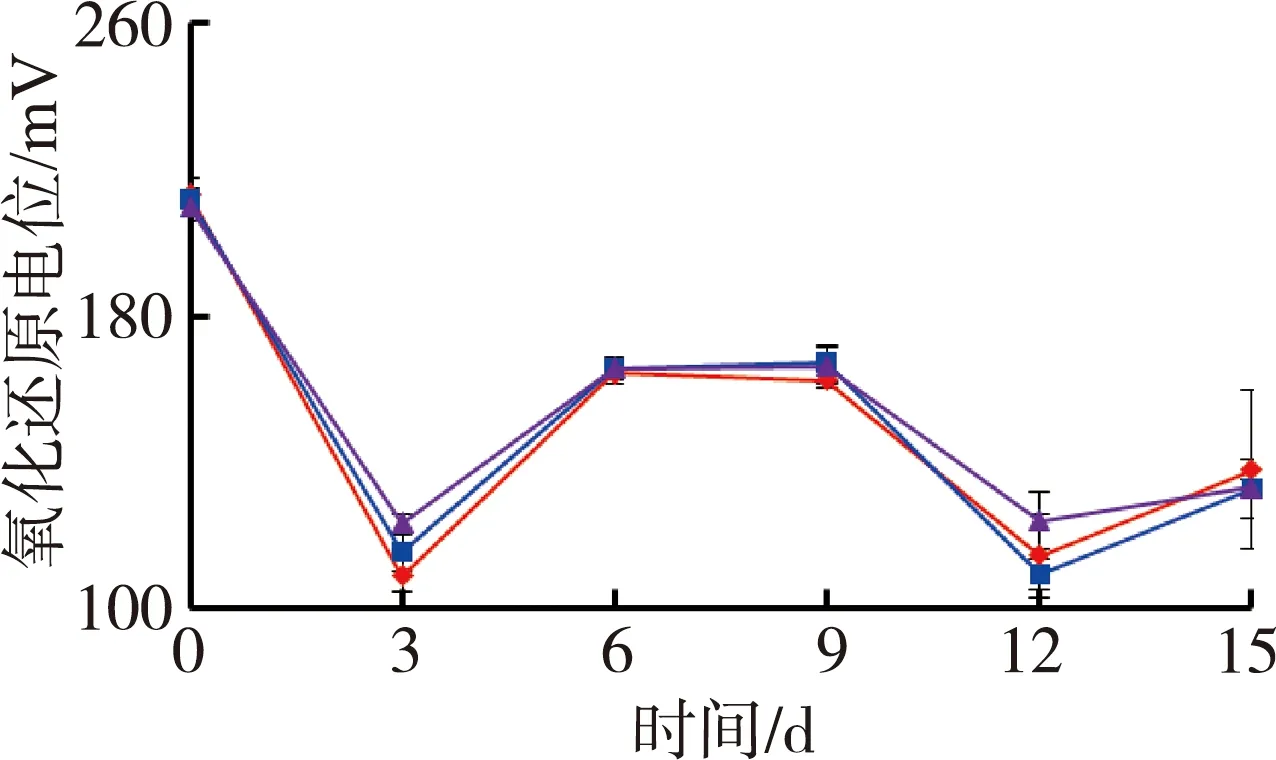
(a)溶解氧 (b)氧化还原电位
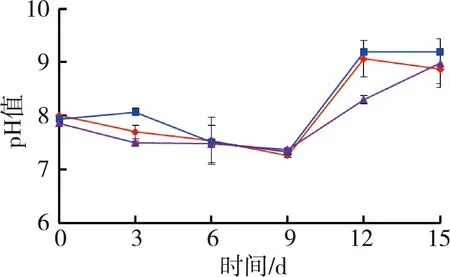
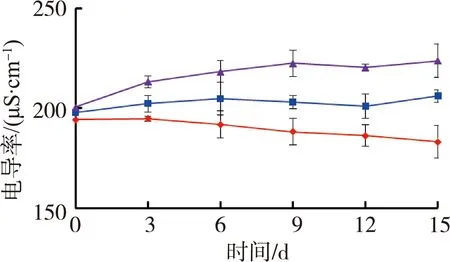
(c)pH值 (d)电导率
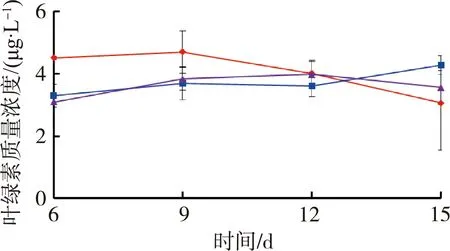
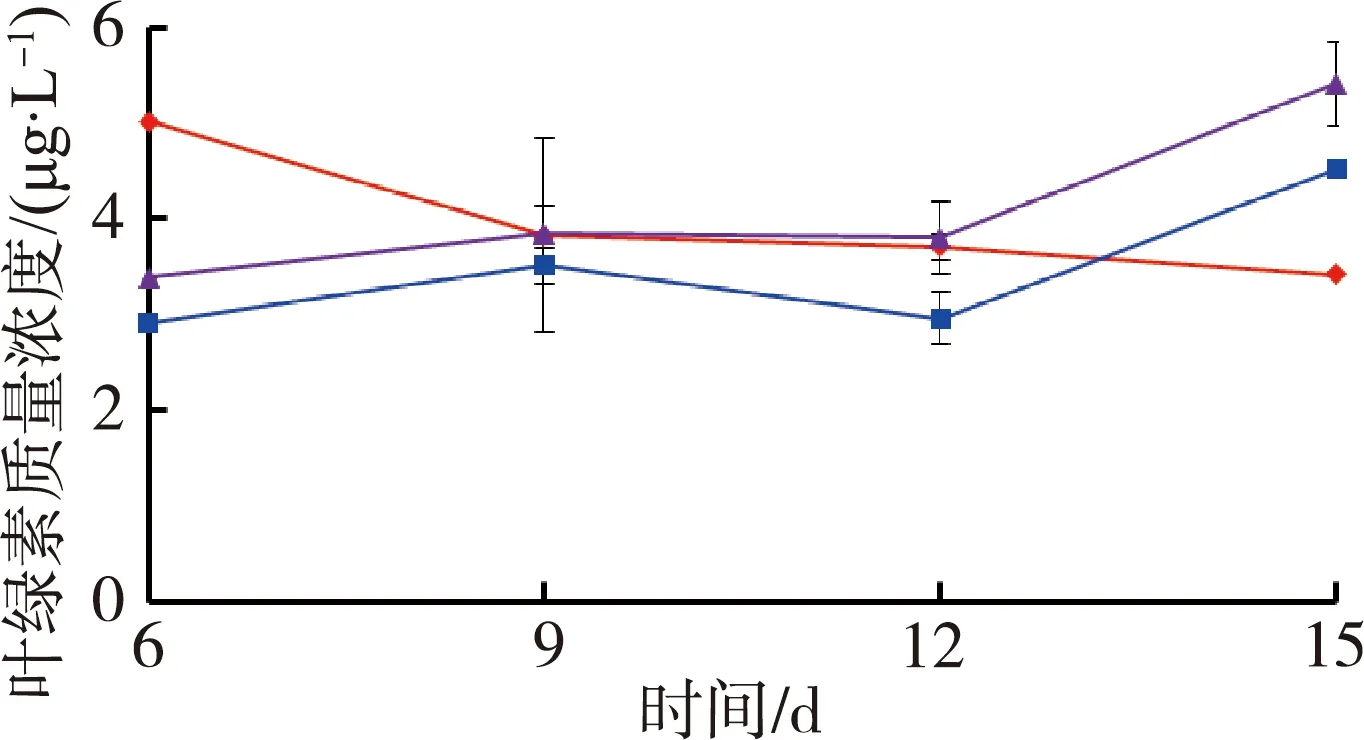
(a)苦草组 (b)金鱼藻组
2.2 沉水植物生长和水体氮磷去除率
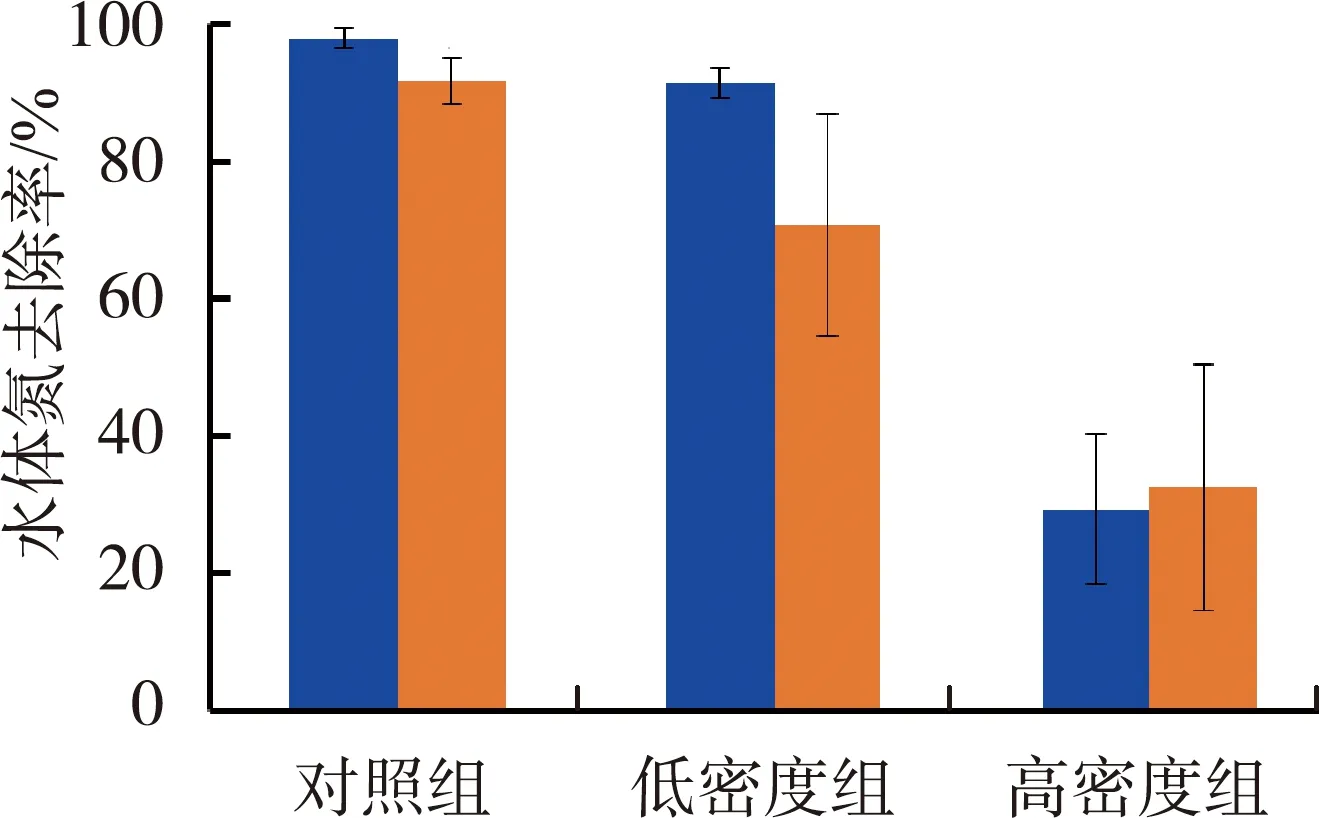
图4为不同处理组对沉水植物相对生长率、相对伸长率、水体氮去除率和水体磷去除率的影响。由图4(a)(b)可见,对照组、低密度组和高密度组均为金鱼藻组相对生长率最高,苦草组相对生长率最低,各组金鱼藻相对生长率分别是苦草的3.1、1.6和2.4倍。沉水植物相对生长率随螺密度增加呈升高趋势,高密度组的苦草组和金鱼藻组相对生长率是对照组的2.16和1.66倍。各处理组金鱼藻的相对伸长率均高于苦草,两种植物对照组和低密度螺处理组间相对伸长率没有显著差异,高密度组苦草和金鱼藻的相对伸长率显著高于对照组,其数值分别是对照组的1.18和1.25倍。
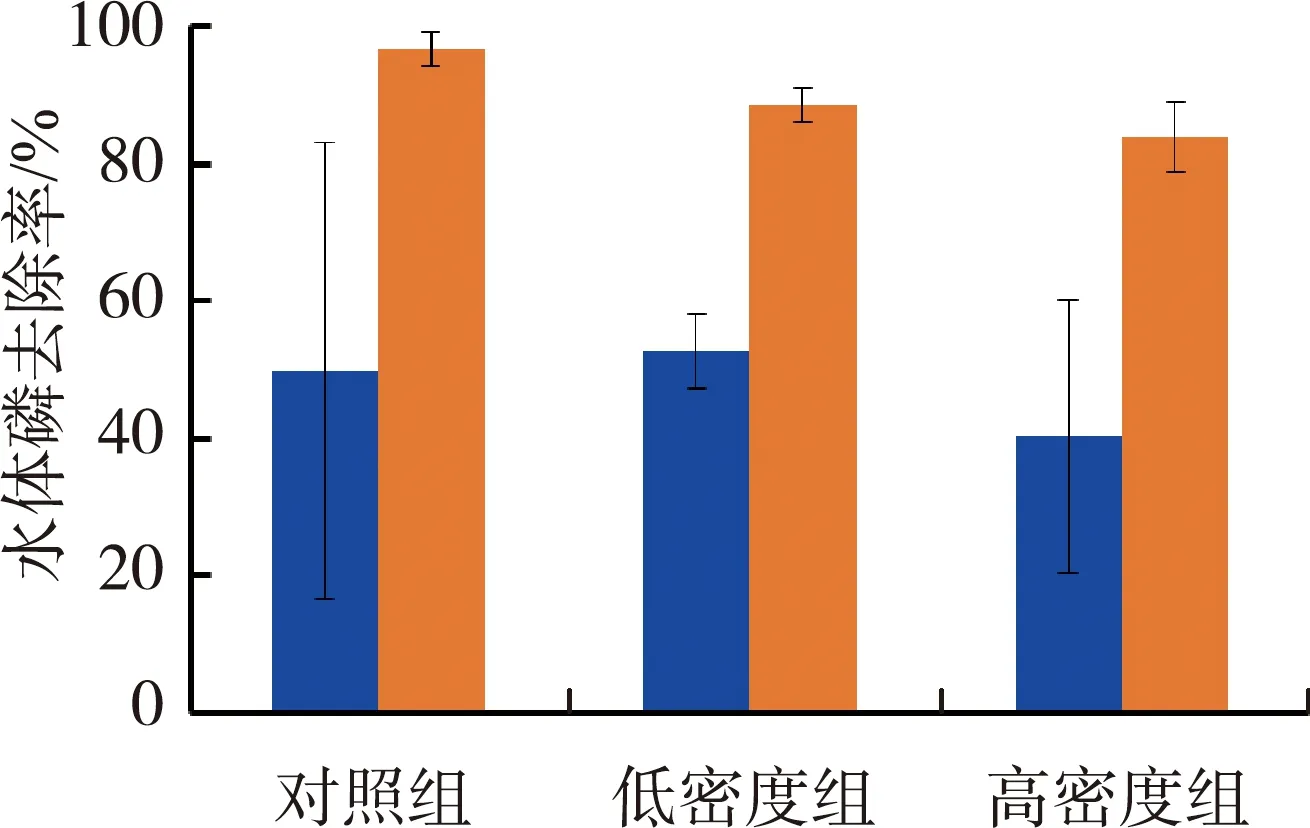
由图4(c)(d)可见,水体氮的去除率随螺密度的增加呈下降趋势,高密度组苦草组和金鱼藻组水体氮的去除率相对于对照组分别下降了70.0%和64.5%,苦草组低密度组和对照组氮的去除率没有显著差异。金鱼藻组对水体磷的去除率要显著高于苦草组,平均值约为苦草组的1.8倍,不同密度螺组间没有显著差异。
表1为沉水植物物种、铜锈环棱螺密度及二者交互作用对水体氮磷去除率的影响。由表1可见,沉水植物物种、螺密度及二者交互作用均对水体氮去除率产生显著影响,其中螺密度的方差占比为64.42%,沉水植物物种和二者交互作用的方差占比分别为8.99%和16.74%。沉水植物物种对水体磷去除率有显著影响,方差占比为72.54%,而螺密度和二者交互作用则对水体磷去除率没有显著影响。

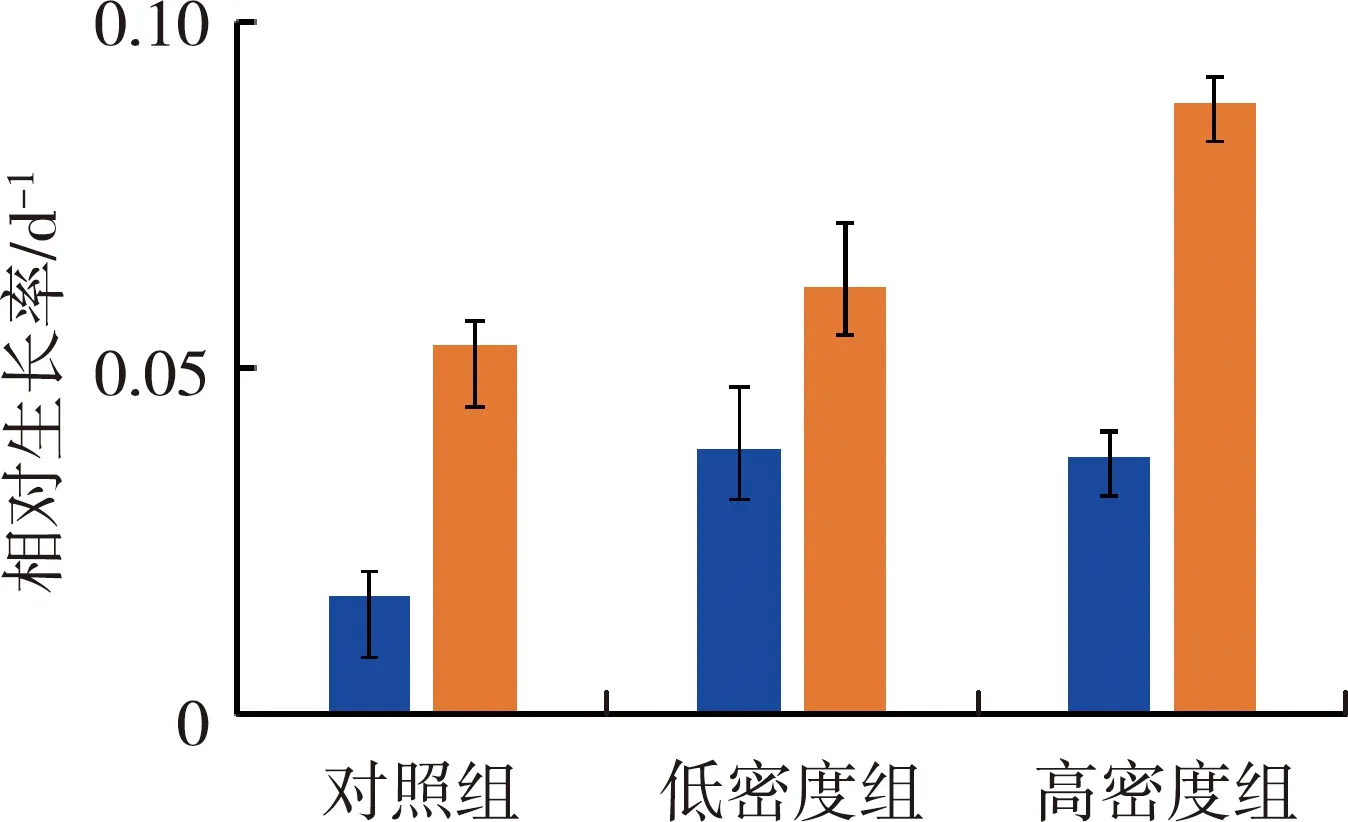
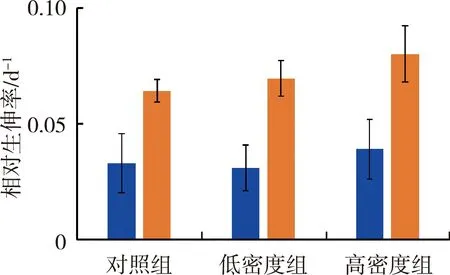
(a)相对生长率 (b)相对伸长率
(c)水体氮去除率 (d)水体磷去除率
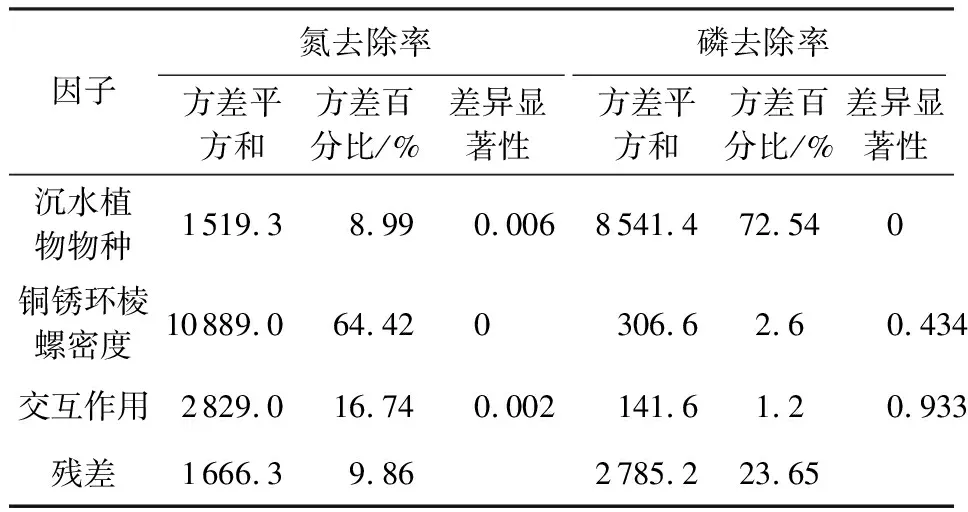
表1 沉水植物物种、铜锈环棱螺密度及二者交互作用对水体氮磷去除率的影响
3 讨 论
沉水植物作为水生态系统的初级生产力,对于水体氮磷具有很强的吸收去除作用[15-16],金树权等[17]的研究表明,苦草和金鱼藻对水体总氮的去除率分别为72.0%和79.3%,对水体总磷的去除率分别为58.5%和67.7%。而铜锈环棱螺作为水生动物,其新陈代谢作用则向水体释放氮磷,李宽意等[18]的研究表明,环棱螺的氨氮和磷酸盐释放率分别为0.51 mg/(g·d)和18.42 μg/(g·d),因此可以推测铜锈环棱螺的存在可能会降低沉水植物对水体氮磷的去除率,本研究结果验证了这一推测,并且进一步表明铜锈环棱螺密度与沉水植物物种两因素对水体氮和磷去除率的影响有较大差异。不同密度铜锈环棱螺对水体氮浓度变化起主要作用,方差占比为64.42%,而不同沉水植物物种虽然也显著影响水体氮浓度,但方差占比为8.99%,二者的交互作用对水体氮浓度变化的方差占比则为16.74%。而对于水体磷浓度的变化,不同沉水植物物种起主要作用,方差占比为72.54%,铜锈环棱螺及二者交互作用对水体磷的变化没有显著影响。本研究表明铜锈环棱螺的存在显著提高了沉水植物苦草和金鱼藻的相对生长率,这与李宽意等[18]和何虎等[19]的研究结果一致。这可能是因为铜锈环棱螺能够刮食沉水植物表面的附着藻类和滤食水体浮游藻类从而提高沉水植物竞争能力,并且螺的新陈代谢作用也提高了水体氮磷浓度。
综上可知,铜锈环棱螺一方面通过新陈代谢作用降低了水体氮磷的去除率,另一方面通过与沉水植物的“互利作用”提高了沉水植物的相对生长率和相对伸长率。根据本研究所得结果,对于苦草,低密度组与对照组水体氮的去除率没有显著差异,这可能是因为低密度组苦草和铜锈环棱螺的多重作用使水体氮的去除率达到了一定的平衡,而高密度组氮的去除率显著低于低密度组和对照组,可能是因为高密度组螺的新陈代谢释放的氮磷占了较大比例。对于金鱼藻,高密度组、低密度组和对照组水体氮的去除率各组间均有显著差异,表明铜锈环棱螺的新陈代谢作用可能对金鱼藻的影响要大于对苦草的影响,这在相关研究[9]中也得到证实。
此外,本研究还表明铜锈环棱螺对水体氮浓度的影响要大于对磷浓度的影响,水体氮磷比随铜锈环棱螺密度的增加而升高,这与Zhu等[7]的研究结果相反,这可能是水体的初始条件或底质条件不同导致的[20],水体初始氮磷比对于浮游藻类的生长有很大影响,铜锈环棱螺是底栖动物,会对底质有一定程度的扰动,进而影响底质营养盐的释放速率[20-21]。相关研究表明,螺类新陈代谢氮的释放速率要远大于磷的释放速率[18,22-23],Pinowska[23]的研究表明25℃时螺类氨氮的释放速率是磷释放速率的6.7倍。
4 结 语
本文研究了不同密度铜锈环棱螺对苦草和金鱼藻生长及水质的影响,结果表明不同密度铜锈环棱螺与沉水植物共存对水体溶解氧、pH值、氧化还原电位、电导率和叶绿素质量浓度均有一定影响。铜锈环棱螺的存在降低了水体氮磷的去除率,铜锈环棱螺不同密度对水体氮浓度变化起主要作用,方差占比为64%,不同沉水植物物种对水体磷浓度起主要作用,方差占比为72.54%,铜锈环棱螺促进了沉水植物的生长,不同密度铜锈环棱螺对金鱼藻的促进作用要大于苦草。
