家蝇蛹多肽的制备及促伤口愈合活性评价
2022-05-31张思晨孙婷婷赵志敏何国瑞杨得坡
张思晨,孙婷婷,赵志敏,,何国瑞,杨得坡,
(1.中山大学 药学院,广州510006; 2.广东省现代中药工程技术研究开发中心,广州510006)
家蝇(MuscadomesticaL.),为环裂亚目丽蝇科蝇属完全变态昆虫,一生经历卵、蛹、幼虫和成虫四个阶段,其幼虫和蛹富含油脂、蛋白质等营养成分[1]。家蝇与其他近缘昆虫的干燥幼虫和蛹壳合称为五谷虫。据《本草求原》等传统中医典籍记载,五谷虫经干燥研磨后,可外用治疗臁、痈等感染创面[2]。目前,国内外均有将五谷虫用于伤口愈合治疗的基础研究和临床研究,研究对象涵盖五谷虫活蛆[3]、多肽[4]、溶菌酶[5]、脂肪酸[6]等。另外,其他来源的肽如墨西哥黄唇鱼肉寡肽[7]、青蛙抗菌肽[8]、大豆蛋白源肽[9]、神经肽[10]等活性肽都被证实具有促进伤口愈合的活性。
伤口愈合是一个复杂的生物学过程,是恢复皮肤屏障完整性的关键。愈合过程分为止血、炎症、增殖和重塑四个阶段,这四个阶段相互重叠、高度协调[11]。伤口形成后不久,凝血形成,在血小板迅速聚集的过程中释放生长因子如转化生长因子β1(TGF-β1),生长因子在伤口早期迅速招募炎症细胞[12-13],炎症细胞表达关键的生长因子和介质,不断促进修复过程。伤口形成后几小时内,角质形成细胞开始迁移并增殖以愈合伤口[14]。因此,角质形成细胞的迁移与增殖、生长因子等的表达,对于促进伤口愈合十分重要。鉴于多肽生物活性和安全性高的优点,一些多肽类药物在促伤口愈合方面的研发成为近年来的热门领域之一。家蝇蛹与幼虫相似,含有十分丰富的生物活性肽类物质。但家蝇蛹多肽(peptides from housefly pupa,PHP)是否也具有促伤口愈合活性还未见报道,故本研究以家蝇蛹为对象,利用酶解法制备PHP并评价PHP的促伤口愈合活性,以期为家蝇蛹的高效资源开发提供科学依据。
1 材料与方法
1.1 实验材料
家蝇蛹,广东盈亨生物科技有限公司提供。碱性蛋白酶、中性蛋白酶、酸性蛋白酶、菠萝蛋白酶、胰蛋白酶、风味蛋白酶、胃蛋白酶、木瓜蛋白酶、α-糜蛋白酶、复合蛋白酶,北京索莱宝科技有限公司;邻苯二甲醛,上海麦克林生化科技有限公司;人永生化角质形成细胞株(HaCaT),武汉大学中国典型培养物保藏中心;小鼠单核巨噬细胞株(RAW264.7),中国科学院上海生物化学与细胞生物学研究所;DMEM高糖培养基、胎牛血清、青霉素及链霉素,赛默飞世尔科技(中国)有限公司;表皮生长因子(epidermal growth factor,EGF),派普泰克生物科技(苏州)有限公司;酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒,欣博盛生物科技有限公司;其他试剂均为分析纯。
油浴锅;pH 计;冷冻干燥机,德国 Christ 公司;多功能酶标仪,德国BMG公司;UltrafleXtreme MALDI-TOF/TOF 基质辅助激光解析飞行时间质谱仪(配备 355 nm Nd:YAG 激光器),德国Bruker Daltonics公司。
1.2 实验方法
1.2.1 PHP的酶解法制备及得率计算
以正己烷为溶剂,采用索氏提取法对家蝇蛹进行脱脂得到脱脂家蝇蛹粉。准确称量10 g脱脂家蝇蛹粉于锥形瓶中,按料液比1∶20加入双蒸水混匀,于4℃冷提10 min,随后于100℃油浴锅中加热10 min使蛋白质变性,冷却至酶解温度后,使用NaOH溶液/HCl溶液调节至一定pH,立即加入一定量的蛋白酶,酶解一定时间。酶解结束后于100℃灭酶活10 min,冷却至室温后转移提取液至离心管中,于5 000 r/min离心5 min,取上清液,冷冻干燥,即得PHP。PHP得率按照下式计算。
R=(m1-m2)/m0×100%
(1)
式中:R为PHP得率;m1为干燥的多肽质量,g;m2为加酶量,g;m0为脱脂家蝇蛹粉质量,g。
1.2.2 PHP中多肽含量及水解度测定
采用邻苯二甲醛(OPA)法测定多肽含量及水解度。OPA法的原理是在碱性介质中OPA能与游离的氨基发生反应生成具有荧光性的异吲哚衍生物,在340 nm处有特征吸收[15]。OPA试剂配制参考Church等[16]的方法。
通过谷胱甘肽标准曲线测定多肽的含量。具体方案为:配制系列梯度质量浓度的谷胱甘肽标准溶液(0.500、0.250、0.125、0.063、0.031、0.016、0.000 mg/mL),分别取20 μL谷胱甘肽标准溶液与150 μL OPA试剂混匀,精确控制反应时间为2 min,在340 nm波长处检测吸光度,以去离子水作为对照,绘制谷胱甘肽质量浓度(x)-吸光度(y)标准曲线,拟合得到标准曲线方程(y=1.599x+0.039,R2=0.999 9);将待测样品配成1 mg/mL的溶液,检测方法同谷胱甘肽标准溶液组,再根据标准曲线方程计算多肽含量。
通过丝氨酸标准溶液测定水解度[15]。具体方案为:准确配制质量浓度为1 mg/mL的丝氨酸标准溶液,取20 μL丝氨酸标准溶液与150 μL OPA试剂混匀,精确控制反应时间为2 min,在340 nm波长处检测吸光度,以去离子水作为对照;将样品配制成1 mg/mL的溶液,检测方法同标准溶液组,按照下列公式计算水解度。
D=h/htot×100%
(2)
h=[(A2-A0)/(A1-A0) ×0.951 6×1-β]/α
(3)
式中:D为水解度;h为多肽水解过程中裂解的肽键数;htot为总肽键数,取指定值7.6;A2、A1、A0分别为样品组、丝氨酸标准溶液组、对照组的吸光度;α、β分别取指定值1.00、0.40。
1.2.3 PHP对HaCaT细胞增殖的影响
将HaCaT细胞接种于含10%胎牛血清和1%青霉素、链霉素的DMEM培养基,在含有5% CO2及饱和湿度条件的37℃恒温培养箱里进行培养。取对数生长期细胞,以2 × 103个/孔的密度接种于96孔细胞培养板,待细胞完全贴壁生长后,实验组给予200 μg/mL PHP处理,空白对照组给予同体积的磷酸盐缓冲液(PBS)处理,以0.4 ng/mL EGF作为阳性对照。培养48 h后,采用MTT法检测细胞数。按照下式计算细胞增殖率。
R1=A1/A0×100%
(4)
式中:R1为细胞增殖率;A1为实验组吸光度;A0为空白对照组吸光度。
1.2.4 PHP对HaCaT细胞迁移的影响
采用经典划痕实验检测PHP对HaCaT细胞迁移的影响。取对数生长期的HaCaT细胞(细胞培养方法见1.2.3),以2 × 105个/孔的密度接种于12孔细胞培养板,待细胞完全贴壁生长后,弃掉旧培养基,加入含0.5%胎牛血清的培养基饥饿处理12 h。使用10 μL无菌枪头在细胞层垂直划痕,建立体外细胞创伤模型,用PBS反复冲洗至划痕区域干净。实验组给予200 μg/mL PHP处理,空白对照组给予同体积的PBS处理,以0.4 ng/mL EGF作为阳性对照。分别于给药后0、24、48 h于显微镜下拍照。利用Image J软件进行指定划痕区域愈合面积计算,按照下式计算迁移率。
R2=(S0-Sx)/S0×100%
(5)
式中:R2为细胞迁移率;S0为0 h时的划痕面积;Sx为24 h或48 h时的划痕面积。
1.2.5 PHP对RAW264.7细胞TGF-β1、TNF-α、IL-6表达的影响
RAW264.7细胞培养方法同HaCaT细胞(见1.2.3方法)。取对数生长期细胞,以5.5× 104个/孔的密度接种于96孔细胞培养板。待细胞贴壁后,实验组分别给与50、100、200 μg/mL的PHP处理,空白对照组给予同体积PBS处理,以0.4 ng/mL EGF作为阳性对照。培养12 h后收集细胞上清液,采用ELISA试剂盒检测TGF-β1、IL-6、TNF-α含量。
1.2.6 PHP分子质量分布分析
将样品溶于双蒸水,制成质量浓度为1 mg/mL的PHP溶液,采用基质辅助激光解析飞行时间质谱仪(MALDI-TOF-MS)检测分子质量分布。分析条件:离子源加速电压1为20.00 kV,加速电压2为17.85 kV,离子延时提取140 ns,正离子谱检测,质量扫描范围(m/z)为500~4 000、1 000~20 000。
1.2.7 数据分析
所有实验均重复3次,实验结果以“平均值±标准偏差”表示,用GraghPad Prism 7.0.4软件处理数据。以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 PHP制备酶的筛选
按1.2.1方法,采用不同的蛋白酶,在加酶量8 000 U/g、酶解时间1 h以及不同蛋白酶酶解温度和pH(具体见表1)条件下制备PHP,比较不同蛋白酶对PHP得率、多肽含量及水解度的影响,结果如图1所示。
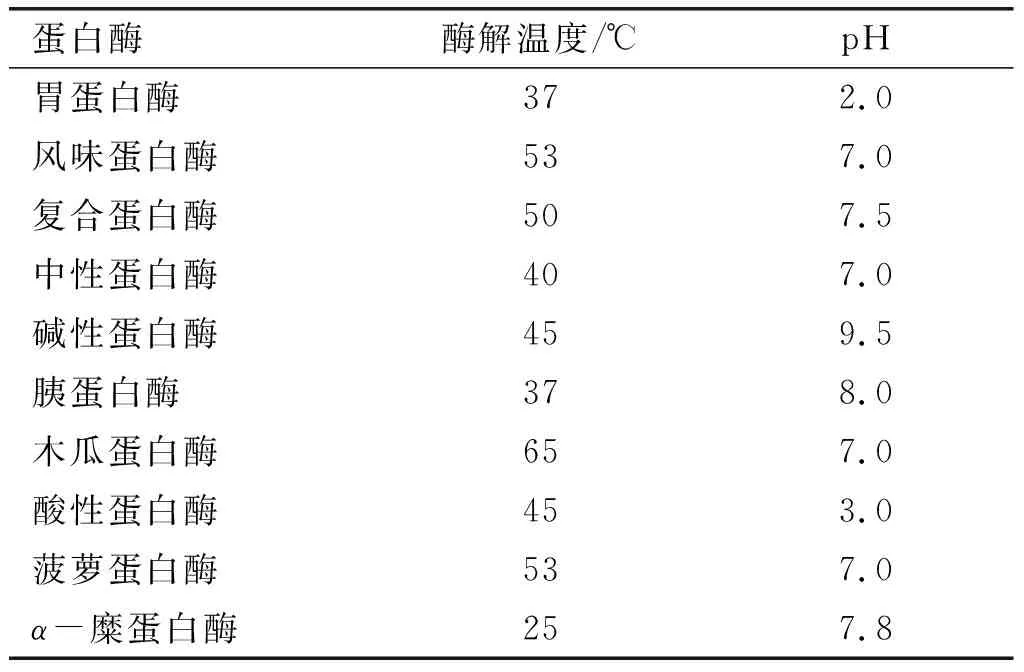
表1 不同蛋白酶酶解条件
注:A~J分别表示胃蛋白酶、风味蛋白酶、复合蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶、木瓜蛋白酶、酸性蛋白酶、菠萝蛋白酶、α-糜蛋白酶。
由图1A可见,胃蛋白酶酶解制备的PHP得率最高,为(74.71±2.11)%,其次是风味蛋白酶、复合蛋白酶、中性蛋白酶,PHP得率分别为(72.82±2.38)%、(62.19±1.31)%和(55.59±2.78)%。由图1B可见,风味蛋白酶酶解制备的PHP多肽含量及水解度最高,分别为(32.67±0.42)%和(15.79±0.25)%。另外,中性蛋白酶、碱性蛋白酶、复合蛋白酶及胃蛋白酶也能制备出较高多肽含量及水解度的PHP。综上,风味蛋白酶酶解法是一种能够制备高得率、高多肽含量及高水解度PHP的方法。
2.2 风味蛋白酶酶解制备家蝇蛹多肽(peptide hydrolyzed with flavourzyme from housefly pupa, PHF)工艺优化单因素实验
采用单因素实验,考察酶解温度、加酶量和酶解时间对PHF得率及水解度的影响,结果如图2所示。

注:固定条件为pH 7.0、酶解时间30 min、加酶量8 000 U/g、酶解温度60℃,优化时改变单一因素条件。
由图2A可见,酶解温度从30℃上升到60℃时,PHF得率及水解度显著增加,60℃时PHF得率及水解度分别为(73.27±2.48)%、(7.57±0.20)%,但当酶解温度升高至70℃时,PHF得率及水解度明显降低。这可能与酶的活性有关,反应温度过低会大大降低体系内分子运动程度,从而降低蛋白酶与底物的碰撞概率,反应温度过高会导致蛋白酶全部或部分丧失催化活性[17]。由图2B可见:当加酶量从4 000 U/g增加至8 000 U/g时,PHF得率及水解度增长迅速;当加酶量从8 000 U/g增加至12 000 U/g时,PHF得率增长缓慢,水解度基本不变。由图2C可见:酶解时间从1 h延长至4 h时,PHF得率从(74.85±2.08)%增加至(79.45±1.77)%,水解度从(11.47±0.37)%增加至(17.04±0.04)%;酶解时间从4 h延长至5 h时,PHF得率不变,水解度增加不足0.5百分点,可见酶解时间过长(>4 h)并不能使PHF得率更高。综上,确定制备PHF的最佳工艺条件为:酶解温度60℃,加酶量8 000 U/g,酶解时间4 h。在最佳条件下, PHF得率为(79.45±1.77)%,水解度为(17.04±0.04)%。
2.3 PHP对HaCaT细胞增殖的影响
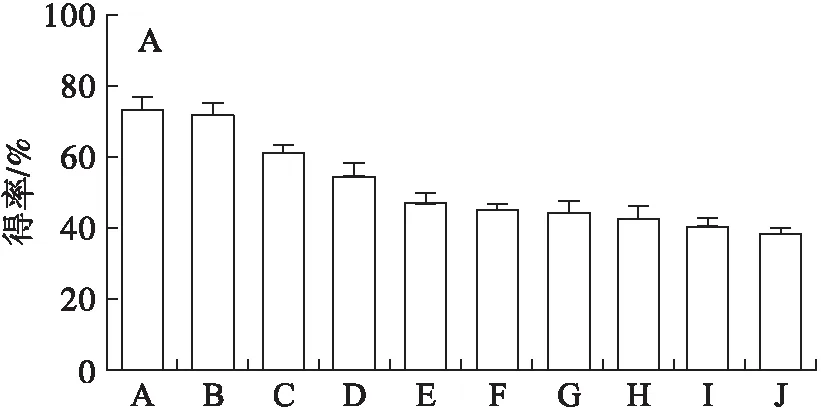
HaCaT细胞是伤口愈合过程中发挥重要功能的细胞,是再上皮化的关键细胞。不同蛋白酶酶解(酶解条件如表1所示)制备的PHP对HaCaT细胞增殖的影响如图3所示。
由图3可见,不同蛋白酶酶解制备的PHP对HaCaT细胞均无显著的毒性作用。与空白对照组比较,除复合蛋白酶、胰蛋白酶外,其余8种蛋白酶制备的PHP及EGF均能不同程度地促进HaCaT细胞的增殖(P<0.05)。其中,酸性蛋白酶酶解制备的PHP促进HaCaT细胞增殖的作用最强,增殖率为(121.85±8.07)%,其次是风味蛋白酶、胃蛋白酶酶解制备的PHP,HaCaT细胞增殖率分别为(118.38±2.36)%、(116.96±2.79)%。

注:A~J分别表示胃蛋白酶、风味蛋白酶、复合蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶、木瓜蛋白酶、酸性蛋白酶、菠萝蛋白酶、α-糜蛋白酶制备的PHP,下同。与空白对照组比较,*表示P<0.05。
2.4 PHP对HaCaT细胞迁移的影响
不同蛋白酶酶解制备的PHP对HaCaT细胞迁移的影响如图4所示。
由图4可见,与空白对照组比较,风味蛋白酶、胃蛋白酶、胰蛋白酶、复合蛋白酶酶解制备的PHP及EGF作用于HaCaT细胞24、48 h时,细胞迁移率均具有显著性的提升(P<0.05),α-糜蛋白酶、碱性蛋白酶、菠萝蛋白酶、酸性蛋白酶和木瓜蛋白酶酶解制备的PHP作用于HaCaT细胞24 h时,细胞的迁移率显著增加(P<0.05),而中性蛋白酶酶解制备的PHP处理组在24、48 h时的细胞迁移率均无显著变化。其中,PHF促进HaCaT细胞迁移的活性最佳,其作用的HaCaT细胞在24、48 h的迁移率分别为(50.59±2.68)%和(63.87±2.16)%。此时,空白对照组在24、48 h的迁移率分别为(35.93±3.97)%、(46.88±1.81)%。因此,后续对PHF进一步研究。

注:与空白对照组比较,*表示P< 0.05,**表示P<0.01,***表示P<0.001。
2.5 PHF对HaCaT细胞增殖与迁移的影响
为了进一步探究PHF的促伤口愈合活性,评估了PHF在不同质量浓度(PHF1,50 μg/mL;PHF2,100 μg/mL;PHF3,200 μg/mL)下对HaCaT细胞增殖与迁移的影响,结果如图5所示。

注:A、B分别为PHF对HaCaT细胞增殖、迁移的影响;C为PHF对HaCaT细胞迁移影响的定性分析,标尺1 000 μm;与空白对照组比较,*表示P<0.05,**表示P<0.01,***表示P<0.001。
由图5A可见,与空白对照组比较,100、200 μg/mL PHF处理组的HaCaT细胞增殖率均有显著提升(P<0.05),分别提升至(108.20±1.62)%和(117.26±1.20)%。由图5B可见,与空白对照组比较,PHF在24 h时以浓度依赖的方式促进HaCaT细胞的迁移,100、200 μg/mL PHF处理组HaCaT细胞在48 h时的迁移率均具有显著性的提升(P<0.01),且200 μg/mL PHF促HaCaT细胞迁移活性优于阳性对照组。由图5C可见,给药之后,HaCaT细胞逐步迁移至划痕部位,48 h时,200 μg/mL PHF处理组HaCaT细胞迁移至部分融合。以上结果表明PHF能有效促进伤口的愈合。
2.6 PHF对RAW264.7细胞TGF-β1、TNF-α、IL-6表达的影响
进一步检测了不同质量浓度的PHF对RAW264.7细胞活力及细胞因子TGF-β1、TNF-α、IL-6表达的影响,结果如图6所示。
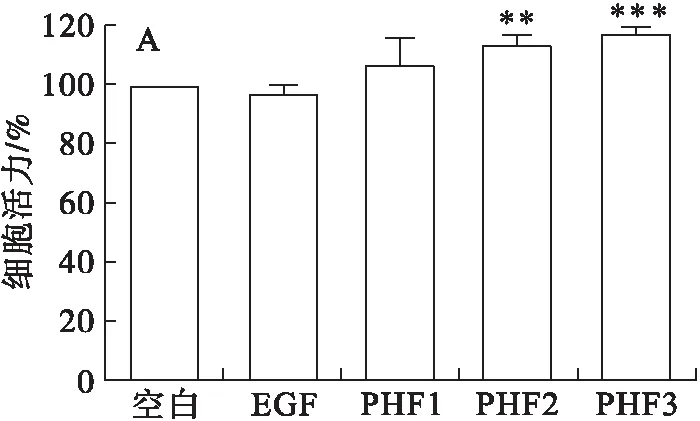
注:与空白对照组比较,*表示P<0.05,**表示P<0.01,***表示P<0.001。
由图6A可见,与空白对照组相比,50 μg/mL的PHF及EGF对RAW264.7细胞的活力无显著影响,而中、高质量浓度(100、200 μg/mL)的PHF可显著提升RAW264.7细胞的活力。
TGF-β1是皮肤伤口愈合的关键转化生长因子。已有研究表明,由T细胞释放的TGF-β通过调节细胞增殖、迁移、分化、细胞外基质产生和免疫调节,对伤口愈合产生多效作用[18-19]。He等[20]报道蛙类来源的肽在巨噬细胞中通过诱导TGF-β1的表达,显著激活下游依赖TGF-β的Smad信号通路,进而促进伤口愈合。由图6B可见,PHF以浓度依赖的方式显著促进RAW264.7细胞中TGF-β1的表达,200 μg/mL的PHF给药后,细胞上清液中TGF-β1的水平增加至(304.00±8.00)pg/mL(空白对照组的水平为(214.77±5.82)pg/mL)。结果说明PHF可诱导TGF-β1的表达进而促进伤口愈合。
由图6C可见,PHF以浓度依赖的方式显著促进小鼠巨噬细胞中TNF-α的表达,50、100、200 μg/mL的PHF给药后,细胞上清液中TNF-α的水平分别增加至(3 003.94±14.37)、(5 788.39±6.74)、(6 384.50±26.23)pg/mL(空白对照组的水平为(53.94±2.55)pg/mL)。由图6D可见,与空白对照组相比,100、200 μg/mL的PHF显著促进了小鼠巨噬细胞中IL-6的表达,表达水平分别提升至4.42、21.52倍。然而,与空白对照组相比,阳性对照组EGF对炎性细胞因子TNF-α、IL-6的表达没有显著差异,表明EGF不影响伤口愈合过程中的炎症期。结果说明PHF促进了RAW264.7细胞中炎性细胞因子TNF-α、IL-6的表达,激活了伤口愈合过程中的炎症信号。
2.7 PHF的分子质量分布
采用MALDI-TOF-MS分析PHF的分子质量分布,结果如图7所示。由图7A可见,信号峰在m/z范围为500~1 300 时较为集中,信号最强的质子峰在m/z为560左右。由图7B可见,m/z在2 000及以上时,基本无信号峰。以上结果说明,PHF的分子质量主要集中在500~1 300 Da。按照氨基酸残基平均分子质量110 Da估算,PHF主要为含有4~11个氨基酸的多肽。

注:A.m/z范围为500~4 000;B.m/z范围为1 000~20 000。
3 结 论
本研究以家蝇蛹为原料,用10种不同蛋白酶酶解法制备家蝇蛹多肽(PHP),结果表明风味蛋白酶酶解法对于制备高得率、高水解度和高多肽含量的PHP具有较好的优势。细胞实验结果显示多种蛋白酶酶解制备的PHP对HaCaT细胞均有较好的促增殖活性及促迁移活性。其中,PHF(分子质量主要分布在500~1 300 Da之间)可能通过促进转化生长因子TGF-β1及炎性细胞因子TNF-α、IL-6的表达,以影响细胞增殖、迁移及炎症信号的传递从而加速伤口愈合。研究结果提示PHF具有被开发成新型天然促伤口愈合剂的潜力。今后将进一步对PHF进行纯化,以明确发挥活性的多肽单体。
