苦参碱对肿瘤坏死因子-α诱导胶原诱导性关节炎大鼠成纤维样滑膜细胞PI3K/AKT信号传导通路的影响
2022-05-30刘琼丁超华白菊芳关金花孙娜娜吕杨张乐王凤春杨永生
刘琼 丁超华 白菊芳 关金花 孙娜娜 吕杨 张乐 王凤春 杨永生


【摘 要】目的:探討苦参碱对肿瘤坏死因子-α(TNF-α)诱导胶原诱导性关节炎(CIA)大鼠成纤维样滑膜细胞(FLS)中磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(PKB/AKT)信号传导通路相关蛋白及基因表达的影响。方法:按照随机数字表法将40只SD大鼠分为正常对照组、炎症细胞组、苦参碱组、抑制剂组,每组10只。除正常对照组外,其余各组通过牛Ⅱ型胶原与不完全弗氏佐剂建立CIA大鼠模型。断椎法处死大鼠,剥离大鼠滑膜组织,提取FLS,并进行细胞培养、鉴定。正常对照组不加任何药物干预,炎症细胞组仅予TNF-α干预,苦参碱组予TNF-α及苦参碱干预,抑制剂组予TNF-α及LY294002干预。Western Blot测定各组CIA大鼠FLS中p-PI3K、p-AKT、AKT蛋白的表达程度,RT-PCR测定PI3K mRNA、AKT mRNA的表达程度。结果:与正常对照组比较,其余各组CIA大鼠FLS数量明显增多;免疫荧光测定显示绝大多数细胞染色呈阳性表达。与炎症细胞组比较,苦参碱组、抑制剂组p-PI3K、p-AKT蛋白表达程度下降(P < 0.01或P < 0.05),PI3K mRNA、AKT mRNA表达程度受到明显抑制(P < 0.01);各组间非活化AKT蛋白表达差异无统计学意义(P > 0.05)。结论:苦参碱对CIA大鼠FLS中PI3K/AKT信号传导通路的过度活化具有抑制作用。
【关键词】 类风湿关节炎;苦参碱;PI3K/AKT信号传导通路;成纤维样滑膜细胞;胶原诱导性关节炎
Effect of Matrine on PI3K/AKT Signaling Pathway of Fibroblast Like Synovial Cells of TNF-α Induced CIA Rats
LIU Qiong,DING Chao-hua,BAI Ju-fang,GUAN Jin-hua,SUN Na-na,LYU Yang,ZHANG Le,WANG Feng-chun,YANG Yong-sheng
【ABSTRACT】 Objective:To investigate the effect of matrine on PI3K/AKT signaling pathway of fibroblast like synovial cells of TNF-α induced CIA rats.Methods:According to the random number table,
40 SD rats were divided into a normal control group,an inflammatory cell group,a matrine group and an inhibitor group,with 10 rats in each group.Except the normal control group,the CIA rat models were established in the other groups by bovine typeⅡcollagen and incomplete Freund's adjuvant.The rats were killed by breaking push method,and the synovial tissue of the rats was stripped.FLS was extracted,and the cells were cultured and identified.The normal control group did not receive any drug intervention,the inflammatory cell group only received TNF-α intervention,the matrine group was given TNF-α and matrine intervention,and the inhibitor group was given TNF-α and LY294002 intervention.The expressions of p-PI3K,p-AKT and AKT proteins in FLS of CIA rats in each group were determined by Western Blot.The expressions of PI3K mRNA and AKT mRNA were determined by RT-PCR.Results:Compared with the normal control group,the number of FLS of CIA rats in other groups increased significantly.Immunofluorescence assay showed that most of the cells were positive.Compared with the inflammatory cell group,the expressions of p-PI3K and p-AKT protein in the matrine group and the inhibitor group decreased(P < 0.01 or P < 0.05),and the expressions of PI3K mRNA and AKT mRNA were significantly inhibited(P < 0.01).There was no significant difference in the expression of non activated AKT protein among the groups(P > 0.05).Conclusion:Matrine can inhibit the over activation of PI3K/AKT signaling pathway in FLS of CIA rats.
【Keywords】 rheumatoid arthritis;matrine;PI3K/AKT signaling pathway;fibroblast like synovial cells;
collagen induced arthritis
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性、炎症性自身免疫性疾病,以进行性骨、软骨及关节破坏为特征[1]。研究发现,磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(PKB/AKT)信號传导通路不仅参与成纤维样滑膜细胞(FLS)异常增殖和滑膜炎症,而且对破骨细胞的分化和生成也有影响[2]。胶原诱导性关节炎(CIA)大鼠是研究RA的经典模型,本实验通过建立CIA大鼠模型以模拟人类RA活动期,研究苦参碱对CIA大鼠FLS中PI3K/AKT信号传导通路的影响。
1 实验材料
1.1 实验动物 SPF级雄性SD大鼠40只,4~5周龄,均来自内蒙古医科大学实验动物中心,动物生产许可证号SCXK(京)2018-0010,动物使用许可证号SYXK(内)2016-0015。所有动物实验符合内蒙古医科大学动物伦理委员会标准。
1.2 药品与试剂 苦参碱(上海源叶生物技术公司,批号B20679),根据前期研究[3],选取苦参碱质量分数为0.75 mg·mL-1;LY294002(美国MCE公司,批号HY-10108),根据文献[4],选取体积分数20 μmol·L-1为本实验的观察浓度。牛Ⅱ型胶原(CⅡ)(美国Chondrex公司,批号110M7002V);不完全弗氏佐剂(美国SIGMA公司,批号SLBG5293V);抗PI3K抗体(Affinity公司,批号AF3241);抗AKT抗体(Affinity公司,批号AF4718);磷酸化AKT抗体(Affinity公司,批号AF3261);GAPDH(Proteintech公司,批号60004-1-LG);Real-time PCR试剂盒(全式金公司,批号AQ131-01)。
1.3 实验仪器 电泳仪(中国Tanon公司,EPS300);4 ℃离心机(德国Eppendorf公司,Centrifuge 5415R);全自动化学发光分析仪(中国Tanon公司,4600);PCR仪(德国Eppendorf公司,5333,53658);实时荧光定量PCR仪(德国Eppendorf公司,ABI 7500)。
2 实验方法
2.1 模型制备 所有大鼠正常饲养1周以适应环境,采用随机数字表法分为正常对照组、炎症细胞组、苦参碱组、抑制剂组,每组10只。参照文献[5]中方法,取牛Ⅱ型胶原20 mg在无菌条件下溶解于0.1 mol·L-1醋酸10 mL中,质量分数为
2 mg·mL-1,在4 ℃下搅拌过夜;次日将其与不完全弗氏佐剂等体积混合,在冰块上连续搅拌至完全融合并乳化。将其作为诱导剂,以滴入水中不扩散为度。除正常对照组外,对炎症细胞组、苦参碱组、抑制剂组大鼠进行初次免疫。于尾根部1 cm处多点肌内注射,每只注射诱导剂剂量为0.3 mL,注射当天记为第1天。在第7天重复上述步骤同部位进行二次免疫以激发炎症,诱导剂配制及注射剂量同第1次。二次免疫中正常对照组大鼠于同时同处注射同体积生理盐水,大鼠自由进食、饮水。
二次免疫后对关节肿胀程度进行评分,依据大鼠关节炎指数(AI)评分≥4分,认定模型达到实验使用标准。
按照文献[6]进行AI评分:0分,关节无肿胀;1分,个别足趾轻度肿胀;2分,小脚趾关节及足趾关节肿胀;3分,膝关节以下关节部分肿胀;4分,膝关节及足部全部肿胀。计算出AI(AI = 关节肿胀分数之和,最低为1分,最高为16分),评分与关节肿胀程度呈正相关,AI值 > 4分,认定造模成功。
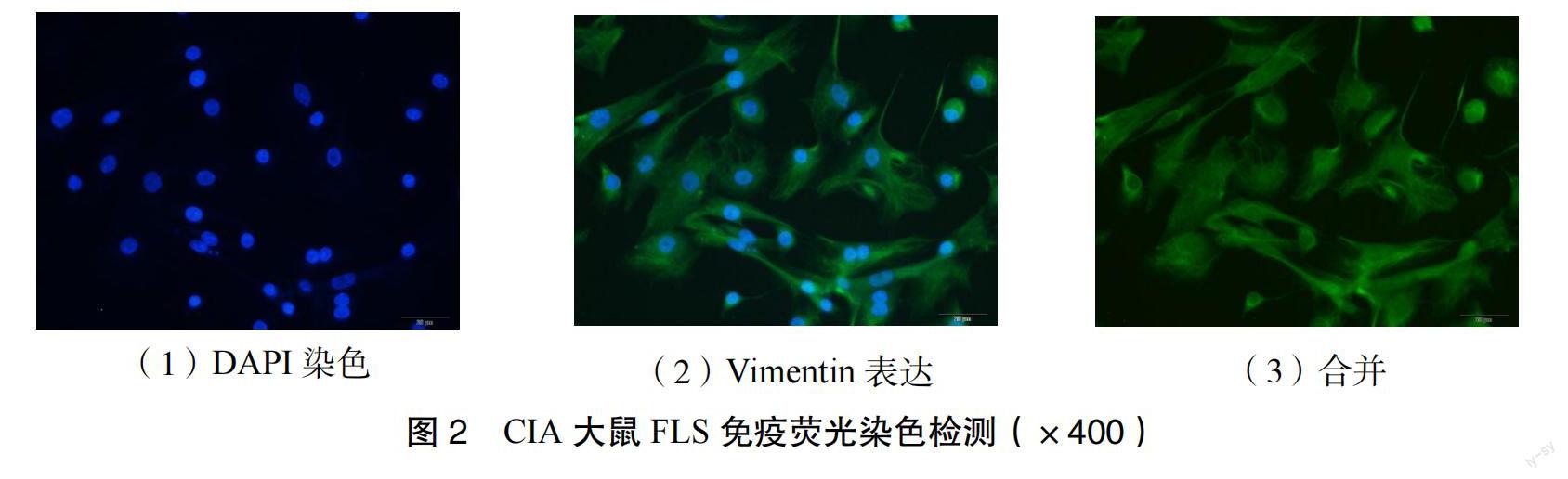
2.2 大鼠FLS分离、培养及鉴定 二次免疫6周后,经鉴定模型达到实验使用标准,以断椎法处死大鼠,无菌环境下剥离膝关节滑膜组织,胶原酶消化法培养FLS,以质量分数为4%的多聚甲醛进行固定、质量分数为0.5%的triton溶液进行通透、体积分数为10%山羊血清进行封闭,滴加一抗稀释液Vimentin antibody(1∶1000);过夜后,滴加二抗稀释液山羊抗鸡IgY H&L(1∶200);再次过夜后,DAPI染核,免疫荧光染色鉴定、拍照。
2.3 细胞分组及药物干预 经形态和免疫荧光鉴定后,FLS选取3~5代,分组及药物干预条件如下:正常对照组不加任何药物及试剂干预,炎症细胞组仅肿瘤坏死因子-α(TNF-α)干预,苦参碱组TNF-α加0.75 mg·mL-1苦参碱干预,抑制剂组TNF-α加20 μmol·L-1 LY294002干预。
2.4 Western Blot测定各组大鼠FLS中p-PI3K、p-AKT、AKT蛋白表达 将配制好的裂解液加入到各组细胞中裂解完毕后离心,按照BCA蛋白浓度测定试剂盒说明测定蛋白浓度然后进行电泳,转膜至PVDF膜;用含质量分数为5%的脱脂奶粉的TBST(封闭液)封闭,TBST洗膜3次,滴加相应一抗稀释(GAPDH为1∶5000、p-AKT为1∶100、p-PI3K为1∶100、AKT为1∶200),TBST充分洗涤PVDF膜3~4次洗去多余一抗;用封闭液稀释HRP标记二抗(1∶1000稀释),37 ℃摇床孵育2 h;TBST洗去多余二抗,放入全自动化学发光分析仪中曝光,拍照并分析其灰度值。
2.5 RT-PCR测定各组大鼠FLS中PI3K mRNA、AKT mRNA表达 按照商品说明书,用TRIzol方法提取总RNA。在随机引物和无酶双蒸水条件下,用第一链cDNA合成试剂盒将RNA反转录,GAPDH作为内参对照,见表1。对PCR进行扩增,扩增条件:首先95 ℃下预变性、变性,时间分别为3 min、30 s;然后55 ℃下退火,最后72 ℃下延伸;退火与延伸时间均为20 s,总计40个循环。qRT-PCR系统分析PCR产物,使用2-ΔΔCT方法计算mRNA的相对表达量。
2.6 统计学方法 采用SPSS 20.0软件进行统计分析。全部实验进行3次独立重复,计量资料以表示,结果采用单因素方差(ANOVA)分析,方差不齐采用Games-Howell法检验,2组间比较采用LSD分析。以P < 0.05为差异有统计学意义。
3 结 果
3.1 FLS的培养 传代至第3代时,倒置显微镜下观察各组细胞,可见炎症细胞组、苦参碱组、抑制剂组与正常对照组比较,细胞数量明显增多,排列密集、形态均一、呈椭圆形。見图1。
3.2 FLS的鉴定 Vimentin是FLS特异性表达蛋白,通过免疫荧光测定CIA大鼠膝关节FLS中Vimentin表达情况,以确保所提取的细胞为FLS,结果显示,绝大多数细胞染色为亮蓝色,呈阳性表达,提示FLS纯度达到99%以上。见图2。
3.3 苦参碱对各组大鼠FLS中p-PI3K、p-AKT、AKT蛋白表达的影响 药物干预后,与正常对照组比较,炎症细胞组p-PI3K、p-AKT蛋白表达程度明显升高(P < 0.01);与炎症细胞组比较,苦参碱组及抑制剂组均可下调p-PI3K、p-AKT蛋白的表达程度(P < 0.01或P < 0.05);各组间非活化AKT蛋白的表达比较,差异无统计学意义
(P > 0.05)。见图3、表2。
3.4 苦参碱对各组大鼠FLS中PI3K mRNA、AKT mRNA表达的影响 药物干预后,与正常对照组比较,炎症细胞组PI3K mRNA、AKT mRNA表达程度明显增强(P < 0.01);与炎症细胞组比较,苦参碱组、抑制剂组对PI3K mRNA、AKT mRNA表达程度抑制效果显著(P < 0.01);与抑制剂组比较,苦参碱组PI3K mRNA、AKT mRNA的表达程度下调(P < 0.01)。见表3。
4 讨 论
目前,临床上应用于治疗RA的药物虽然能有效缓解患者的疼痛,抑制体内炎症反应,但严重的肝肾毒性、心血管疾病等不良反应限制了其临床应用。新兴的药物靶向治疗在RA中发挥了重要作用,但由于易导致严重感染和过度激活免疫效应,以及昂贵的价格,使这些药物的使用受到限制[7]。传统中药具备不良反应小、价格低、效果良好的优势,值得深入研究。
滑膜是一种覆盖于关节囊内表面的结缔组织,具有润滑关节的作用,是RA发病的靶器官[8]。FLS是滑膜细胞的重要组成部分,在RA病理状态下,FLS受到致炎因子刺激而过度激活,导致滑膜组织炎性增生[9]。RA的FLS呈现“肿瘤样”特征,如凋亡减少、过度增殖和异常迁移,活化的FLS侵袭软骨和骨,导致滑膜血管翳形成和关节破坏[10]。炎性细胞因子是RA发病的关键性影响因素[11],常见炎性细胞因子如TNF-α和白细胞介素的分泌增加,与RA的进展密切相关[12]。
RA的发病机制尚未明确,近年来发现与某些信号通路激活密切相关,激酶抑制剂作为RA治疗的安全有效选择受到越来越多的关注[2]。研究发现,在RA病理状态下,FLS中PI3K/AKT信号传导通路被过度激活[13]。高度活跃的PI3K/AKT信号传导通路介导了RA-FLS的增殖、凋亡及炎症反应等过程[14]。研究发现,高、中、低度活动期的RA患者滑膜细胞中PI3K mRNA、AKT mRNA表达程度同正常人相比升高较为明显[15],提示PI3K、AKT基因与RA发展关系重大。有文献报道,
RA-FLS中的细胞因子具有启动PI3K/AKT信号传导通路的能力,从而促进滑膜细胞的迁移和侵袭;而且该文献中实验还显示,与对照组相比,经TNF-α干预的RA滑膜细胞中PI3K和p-AKT表达水平显著升高[16]。PI3K属于脂类激酶家族,是调节细胞内信号的关键因子,于RA滑膜细胞中高度活跃[17],激活后的PI3K对RA-FLS的增殖和存活具有促进作用[18]。AKT是一种蛋白激酶,具有调节细胞存活的作用,同时也是PI3K的下游关键靶蛋白。活化后的AKT可磷酸化大量的下游底物从而引发级联反应,调控细胞的存活、增殖、凋亡等[19],AKT通路已被证实与RA患者关节肿胀及炎症反应关系密切[20]。研究发现,RA-FLS中磷酸化AKT水平高于骨关节炎,用TNF-α处理RA-FLS后,AKT磷酸化增强,细胞增殖能力被强化,提示活化的AKT参与了RA滑膜增生的病理、生理变化过程[21]。
苦参在中医、蒙医临床应用中占有重要地位,有清热燥湿、利尿、杀虫等作用。蒙药忠伦阿汤是蒙医临床治疗RA常用方,苦参是忠伦阿汤的组成药物之一。苦参碱是苦参的重要成分,有抗炎、抗菌、抗氧化、抑制肿瘤细胞增殖、转移及诱导其自噬、凋亡等作用[22];前期的研究证实了苦参碱对CIA大鼠肿胀的关节具有缓解作用,可通过抑制JAK/STAT信号传导通路的活化诱导CIA大鼠FLS凋亡[3]。研究证实苦参碱有抑制人FLS生长的作用[23],可下调基质金属蛋白酶-3、TNF-α及白细胞介素-1β的表达水平,同时抑制核转录因子-κB p65的表达[24],能明显减轻RA大鼠模型的炎症反应和严重程度(足体积和关节指数评分)[25];通过抑制核转录因子-κB通路促炎细胞因子和蛋白的释放,对CIA大鼠表现出抗炎作用[26]。
在本研究中,通过TNF-α对CIA大鼠FLS进行刺激,模拟RA活动期的状态,结果显示,CIA大鼠FLS经过TNF-α干预后,炎症细胞组p-PI3K、p-AKT蛋白及PI3K mRNA、AKT mRNA表达程度均得到显著增强,提示PI3K/AKT信号传导通路被过度激活。进一步的药物干预后发现,与炎症细胞组比较,苦参碱组及抑制剂组p-PI3K、p-AKT蛋白表达程度均降低,而各组间非活化AKT蛋白表达无差异,苦参碱组及抑制剂组PI3K mRNA、AKT mRNA的表达均被明显抑制,而且苦参碱的抑制效果优于抑制剂LY294002。
綜上所述,本研究从体外实验证实苦参碱对CIA-FLS中PI3K/AKT信号传导通路的过度活化呈现出抑制作用,故而推测苦参碱可能通过抑制PI3K/AKT信号传导通路的活化干预RA的发生、发展。
参考文献
[1] MOUSAVI MJ,JAMSHIDI A,CHOPRA A,et al.Implications of the noncoding RNAs in rheumatoid arthritis pathogenesis[J].J Cellr Physiol,2019,234(1):335-347.
[2] LIU S,MA H,ZHANG H,et al.Recent advances on signaling pathways and their inhibitors in rheumatoid arthritis[J].Clin Immunol,2021,230(1):108793.
[3] YANG Y,DONG Q,LI R.Matrine induces the apoptosis of fibroblast-like synoviocytes derived from rats with collagen-induced arthritis by suppressing the activation of the JAK/STAT signaling pathway[J].Int J Mol Med,2017,39(2):307-316.
[4] XU B,WANG G,ZHANG J,et al.Resveratrol decreases FoxO protein expression through PI3K-AKT-dependent pathway inhibition in H2O2-treated synoviocytes[J].Histol Histopathol,2017,32(12):1305-1315.
[5] SUN Y,YAO Y,DING CZ.A combination of sinomenine and methotrexate reduces joint damage of collagen induced arthritis in rats by modulating osteoclast-related cytokines[J].Int Immunopharmacol,2014,18(1):135-141.
[6] LI S,LI F,CHEN WJ,et al.Autophagy inhibitor regulates apoptosis and proliferation of synovial fibroblasts through the inhibition of PI3K/AKT pathway in collagen-induced arthritis rat model[J].Am J Transl Res,2017,9(5):2065-2076.
[7] LIN YJ,ANZAGHE M,SCH?LKE S.Update on the pathomechanism,diagnosis,and treatment options for rheumatoid arthritis[J].Cells,2020,9(4):880-955.
[8] BARTOK B,FIRESTEIN GS.Fibroblast-like synoviocytes:key effector cells in rheumatoid arthritis[J].Immunol Rev,2010,233(1):233-255.
[9] KARAMI J,ASLANI S,TAHMASEBI MN,et al.Epigenetics in rheumatoid arthritis;fibroblast-like synoviocytes as an emerging paradigm in thepathogenesis of the disease[J].Immunol Cell Biol,2020,98(3):171-186.
[10] YU FY,XIE CQ,JIANG C,et al.MiR-92a inhibits fibroblast-like synoviocyte proliferation and migration in rheumatoid arthritis by targeting AKT2[J].J Biosci,2018,43(5):911-919.
[11] XIAO F,GRIFFITH JF,HILKENS AL,et al.ERAMRS:a new MR scoring system for early rheumatoid arthritis of the wrist[J].Eur Radiol,2019,29(10):5646-5654.
[12] KACZY?SKI T,WRO?SKI J,G?USZKO P,et al.Salivary interleukin 6,interleukin 8,interleukin 17A,and tumour necrosis factor α levels in patients with periodontitis and rheumatoid arthritis[J].Cent Eur J Immunol,2019,44(3):269-276.
[13] WANG DD,JIANG MY,WANG W,et al.Paeoniflorin-6'-O-benzene sulfonate down-regulates CXCR4-Gβγ-PI3K/AKT mediated migration in fibroblast-like synoviocytes of rheumatoid arthritis by inhibiting GRK2 translocation[J].Biochem Biophys Res Commun,2020,526(3S):805-812.
[14] YAN X,LIU Y,KONG X,et al.MicroRNA-21-5p are involved in apoptosis and invasion of fibroblast-like synoviocytes through PTEN/PI3K/AKT signal[J].Cytotechnology,2019,71(1):317-328.
[15] 劉琼,李永乐,董平,等.PI3K/AKT信号通路与类风湿关节炎相关性探讨[J].风湿病与关节炎,2021,10(3):62-66.
[16] LI S,CHEN JW,XIE X,et al.Autophagy inhibitor regulates apoptosis and proliferation of synovial fibrolasts through the inhibition of PI3K/AKT pathway in collagen-induced arthritis rat model[J].Am J Transl Res,2017,9(5):2065-2076.
[17] REEDQUIST KA,LUDIKHUIZE J,TAK PP.Phosphoinositide 3-kinase signalling and FoxO transcription factors in rheumatoid arthritis[J].Biochem Soc Trans,2006,34(5):727-730.
[18] KIM G,JUN JB,ELKON KB.Necessary role of phosphatidylinositol 3-kinase in transforming growth factor β-mediated activation of AKT in normal and rheumatoid arthritis synovial fibroblasts[J].Arthritis Rheum,2002,46(6):1504-1511.
[19] JR JP,JANKU F.Molecular targets for cancer therapy in the PI3K/AKT/mTOR pathway[J].Pharmacol Ther,2014,142(2):164-175.
[20] KUULIALA K,KUULIALA A,H?M?L?INEN M,et al.
Impaired AKT phosphorylation in monocytes of patients with rheumatoid arthritis[J].Scand J Immunol,2016,85(2):155-161.
[21] ZHANG HG,WANG Y,XIE JF,et al.Regulation of tumor necrosis factor alpha-mediated apoptosis of rheumatoid arthritis synovial fibroblasts by the protein kinase AKT[J].Arthritis Rheum,2001,44(7):1555-1567.
[22] YOU L,YANG C,DU Y,et al.A systematic review of the pharmacology,toxicology and pharmacokinetics of matrine[J].Front Pharmacol,2020,16(11):1-43.
[23] 蒋红,雷佳红,何城,等.苦参碱对人成纤维样滑膜细胞生长的影响[J].检验医学与临床,2014,11(18):2510-2512.
[24] 赖永旭.苦参碱对类风湿关节炎滑膜成纤维细胞生物学活性的影响[J].四川医学,2015,36(1):21-24.
[25] NIU Y,DONG Q,LI R.Matrine regulates Th1/Th2 cytokine responses in rheumatoid arthritis by attenuating the NF-κB signaling[J].Cell Biol Int,2017,41(6):611-621.
[26] PU J,FANG FF,LI XQ,et al.Matrine exerts a strong anti-arthritic effect on typeⅡ collagen-induced arthritis in rats by inhibiting inflammatory responses[J].Int J Mol Sci,2016,17(9):1410-1415.
收稿日期:2022-03-06;修回日期:2022-04-28
