金线莲苷的硅胶柱层析分离
2022-05-30苑歆石帆侯轶赖敏婷胡松青
苑歆,石帆,侯轶,赖敏婷,胡松青*
(1.华南理工大学食品科学与工程学院,广东广州 510640) (2.华南理工大学轻工科学与工程学院,广东广州 510640)(3.广东雁归来养生产业有限公司,广东梅州 514700)
金线莲[Anoectochilus roxburghii(Wall.) Lindl.] 又名金线兰,是一种珍贵的多年生兰科开唇兰属植物,主要分布于中国、日本、泰国以及其他东南亚国家和地区,在我国福建、台湾和广东等地人们的日常生活中具有传统食用习惯,属于地方特色食品。金线莲作为一种重要的经济作物,不仅具有极高的观赏价值,还具有广泛的药用价值。金线莲在我国被视为传统珍稀的中药材,有清热凉血、平肝、祛湿、解毒等功效[1,2],民间誉之为“金草”、“神药”、“药王”。研究表明,金线莲具有降血压[3]、降血糖[4]、抗肿瘤[5]、保肝[6]等多种生理活性,且毒副作用低,使用安全,是治疗糖尿病、高血脂、肝炎等疾病重要的潜在药物[7]。它的活性成分丰富,包括内酯苷类、黄酮类、多糖类、三萜类等[8]。
金线莲苷(kinsenoside),化学名3R-β-D-吡喃葡萄糖氧基-γ-丁内酯,是金线莲独有的特质性成分[9],含量为6.37%~22.66%[10]。据文献报道,金线莲苷具有降血糖[11]、降脂[12]、保肝护肝[13-16]、抑制炎症[17,18]等多种药理活性。目前,从金线莲中分离纯化金线莲苷普遍处于实验室初步研究阶段,常见流程包括溶剂萃取、大孔树脂吸附分离、制备色谱纯化等。Liu等[19]采用石油醚、乙酸乙酯和正丁醇对金线莲苷乙醇提取物(1314 g)进行萃取,得到的正丁醇萃取物经HPD 100型大孔树脂和硅胶柱层析分离后,最终得到800 mg金线莲苷。整个分离纯化流程长且步骤繁琐,金线莲苷得率低,难以实现规模化生产。
本课题组前期以深度共熔溶剂为提取溶剂结合柱提取法得到高含量的金线莲苷粗提液,但粗提液中仍含有多酚、糖类等杂质。因此,有必要对粗提液采取进一步的分离纯化以获得高纯度的金线莲苷。本文探讨并比较了大孔树脂法、硅胶柱层析法对金线莲苷分离纯化的效果,建立了一种简单高效的金线莲苷分离纯化流程,为金线莲苷的分离制备工艺奠定了一定的理论基础。
1 材料与方法
1.1 材料与试剂
金线莲干品由广东梅州雁归来养生产业有限公司惠赠;薄层层析硅胶板,青岛海洋化工有限公司;柱层析硅胶,上海源叶生物公司;大孔树脂NKA-9、AB-8、D101、DM130,上海源叶生物科技有限公司;乙酸乙酯,上海泰坦科技公司;乙醇,天津百世化工有限公司;氯仿、甲醇、冰醋酸,天津大茂化学试剂厂;高锰酸钾、碳酸钾、氢氧化钠,广州化学试剂厂;二硝基苯甲酸,上海源叶生物科技有限公司;氢氧化钾,国药集团化学试剂公司;茚三酮,上海伯奥生物科技有限公司。以上试剂均为分析纯。
1.2 主要仪器设备
BSZ-160F电脑自动部份收集器,上海精科实业有限公司;恒流泵,保定雷弗流体科技有限公司;真空干燥箱,上海一恒科学仪器有限公司;Agilent 1260Infinity II高效液相色谱仪,美国安捷伦科技公司;Agilent 1260 Infinity II 蒸发光散射检测器,美国安捷伦科技公司。
1.3 试验方法
1.3.1 金线莲苷的提取
干燥的金线莲材料经粉碎机粉碎,过筛,收集物料粒径在250~830 μm之间的金线莲粉末,准确称取5 g的金线莲粉末,加入20 mL的由氯化胆碱和苹果酸按照1:1摩尔比组成的深度共熔溶剂(含水量40%),室温下静置3 h,以径高比1:10装入玻璃层析柱,使用提取溶剂以40 mL/h的流速进行洗脱,收集前60 mL洗脱液,即为金线莲苷粗提液。
1.3.2 金线莲苷的定性分析
采用薄层层析硅胶对金线莲苷进行快速定性分析。在距离层析板底部约1 cm处,吸取样液点样,样点直径不超过0.5 cm,吹干样点后放入装有展开剂(乙酸乙酯:乙醇:冰醋酸=5:5:0.2,V/V/V)的层析缸中,当展开剂前端距离层析板顶部1 cm时,完成层析。用kedde试剂进行显色,计算金线莲苷的Rf值。
1.3.3 金线莲苷的定量分析
1.3.3.1 色谱条件
色谱柱为Diamonsil Plus C18(250 mm×4.6 mm,5 μm),流动相为甲醇-水(2:98,V/V),等度洗脱,流速0.6 mL/min,柱温30 ℃,进样量为10 μL。蒸发光散射检测器雾化温度和漂移管温度均为60 ℃,载体为氮气,流速1.7 L/min。
1.3.3.2 标准曲线及线性范围
将金线莲苷标准品用超纯水配置为浓度分别为59.17、118.33、177.50、236.66、295.83、591.66 μg/mL的标准系列溶液,按照色谱条件进样,记录峰面积。以峰面积积分值的对数值(log A)为纵坐标,以标准品溶液浓度的对数值(log C)为横坐标,绘制标准曲线。如图1所示。经计算,金线莲苷含量的回归方程为y=1.6639x-1.2298(R2=0.9996),在59.17~591.66 μg/mL浓度范围内线性关系良好。该方程可用于后续研究中金线莲苷含量的测定。
1.3.4 金线莲苷的稳定性研究
将待测液置于冰箱冷藏室(4 ℃)中,分别在0、2、4、6和12 h时通过高效液相色谱-蒸发光散射检测器(HPLC-ELSD),记录峰面积并计算RSD值。
1.3.5 大孔树脂分离金线莲苷的研究
1.3.5.1 大孔吸附树脂的筛选
本实验中所使用的4种大孔树脂的类型和性质如表1所示,称取5 g预处理过的大孔树脂于锥形瓶中,加入20 mL金线莲苷粗提液,室温下于摇床中吸附24 h后过滤,测定滤液中金线莲苷浓度,计算吸附量。大孔树脂过滤后,加入20 mL蒸馏水,振摇12 h以充分洗去深度共熔溶剂,随后再加入20 mL 80%乙醇溶液,振摇12 h后,过滤,测定解析液中金线莲苷的浓度,计算解析率。

表1 不同类型大孔树脂的性质Table 1 Properties of different types of macroporous resins
1.3.5.2 DM130型大孔吸附树脂动态吸附曲线
称取适量DM130型湿树脂填充入直径为2 cm的玻璃层析柱中,填充高度20 cm,加入浓度为1 mg/mL的金线莲苷提取液,以2 BV/h的流速上样,分别测定流出液在1、2、3、4、5、6、7、8、9、10、11、12 BV时金线莲苷的浓度。以流出液体积为横坐标,对应的金线莲苷浓度为纵坐标,绘制DM130型大孔吸附树脂动态吸附曲线。
1.3.6 硅胶柱层析分离金线莲苷的研究
1.3.6.1 洗脱溶剂比例对金线莲苷分离的影响
分别选择不同的展开剂体系对金线莲苷标准品和分离纯化中间产物样品进行展开,根据样品在薄层硅胶板上的显色斑点的比移值Rf值和拖尾情况选择最佳展开剂,从而确定最佳洗脱溶剂,Rf值的计算公式如下:
式中:
Rf——比移值;
a——原点到斑点的距离;
b——原点到展开剂前沿的距离。
1.3.6.2 上样量对金线莲苷分离的影响
根据单因素实验确定了最佳洗脱溶剂比例,现考察金线莲苷的上样量对金线莲苷分离纯化的影响。将干燥的硅胶采用湿法装柱法填入直径为2 cm的玻璃层析柱,装柱径高比为1:10,分别称取上样量0.30、0.40、0.50、0.60、0.70 g加载到硅胶床层顶面,设置洗脱流速为1 mL/min,采用自动部分收集器以10 mL/管收集洗脱液,将收集的洗脱液进行薄层硅胶层析,将显示含有金线莲苷显色反应的收集管经真空干燥(50 ℃)除去有机溶剂后,用蒸馏水复溶,通过HPLC-ELSD检测并计算金线莲苷的回收率。
1.3.6.3 洗脱速率对金线莲苷分离的影响
根据上述实验确定了最佳洗脱溶剂比例和上样量。现考察洗脱速率对金线莲苷分离纯化的影响。将干燥的硅胶采用湿法装柱法填入直径为2 cm的玻璃层析柱,装柱径高比为1:10,称取金线莲苷粗品0.6 g加载到硅胶床层顶面,设置洗脱速率分别为0.50、0.75、1.00、1.25、1.50 mL/min。采用自动部分收集器以10 mL/管收集洗脱液,将收集的洗脱液进行薄层硅胶层析,将显示含有金线莲苷显色反应的收集管经真空干燥(50 ℃)除去有机溶剂后,用蒸馏水复溶,通过HPLC-ELSD检测并计算金线莲苷的回收率。
1.3.7 金线莲苷的分离制备
采用Agilent 1260半制备型高效液相色谱-蒸发光检测器对金线莲苷进行分离制备。半制备色谱柱为YMC-Pack ODS-A(250×10 mm,5 μm);流动相为甲醇-水(2:98,V/V),等度洗脱,流速2.0 mL/min,柱温30 ℃,进样量为100 μL。ELSD雾化温度和漂移管温度均为60 ℃,载体为氮气,流速1.7 L/min。收集样品峰,真空冷冻干燥后得到金线莲苷纯品。
1.3.8 数据统计与分析
实验数据均为三组平行,采用SPSS 22对数据进行统计分析,显著性水平为p<0.05,不同的字母表示具有显著差异,采用Origin 8.6软件作图。
2 结果与讨论
2.1 金线莲苷的定性分析
薄层层析硅胶法可用于金线莲苷分离纯化过程中间产物样品的快速检测。如图2所示,样品1为金线莲苷标准品,样品2为金线莲提取液,经kedde试剂显色均为紫色斑点,计算两者的Rf值均为0.51。该方法可根据薄层层析硅胶板上斑点的位置及大小实现样品中金线莲苷的快速检测。
2.2 金线莲苷的稳定性研究
随着储存时间的延长,金线莲苷可能发生自降解或其他反应,导致其含量降低。实验结果如表2所示,在4 ℃条件下,0~12 h内金线莲苷的稳定性良好。故金线莲苷样品可在4 ℃下,12 h内完成进样测定。

表2 金线莲苷的稳定性研究Table 2 Study on the stability of kinsenoside
2.3 大孔树脂分离金线莲苷的研究
2.3.1 大孔树脂的筛选
大孔树脂对化合物的分离受树脂极性、比表面积和孔径大小等多种因素影响[20],其性能主要体现在吸附和解吸两个方面,一般来说,吸附量越大,解吸越容易,则大孔树脂的性能越好。本实验通过比较吸附量和解吸率两个参数来选择适宜的大孔树脂,用于金线莲苷粗提液的分离精制。
4种不同型号大孔树脂对金线莲苷粗提液的静态吸附效果及80%乙醇对各树脂的解吸效果如图3、4所示,四种大孔树脂的吸附、解吸效果表现并不优良,但DM130型大孔树脂的吸附效果和解吸效果均优于其他三种树脂,其吸附量可达24.69 mg/g,解吸率为17.89%。原因可能是大孔树脂对于目标化合物的吸附作用与树脂的极性、孔径比表面积和目标化合物之间形成的静电作用力、氢键和尺寸共同作用的结果。因此,选择DM130型大孔树脂用于后续研究。
2.3.2 DM130型大孔树脂动态吸附曲线
DM130型大孔树脂对金线莲苷的动态吸附曲线如图5所示,当流出液体积由1 BV增至3 BV时,金线莲苷的浓度由0.04 mg/mL迅速升至0.15 mg/mL,但当流出液体积逐步增至12 BV时,金线莲苷浓度在0.12~0.16 mg/mL范围内波动,无明显变化。故易知DM130型大孔吸附树脂对金线莲苷无选择性吸附作用,分离效果较差,后续实验选择硅胶柱层析法用于金线莲苷的分离。
2.4 硅胶柱层析分离金线莲苷的研究
2.4.1 洗脱溶剂比例对金线莲苷分离的影响
配制不同比例组分的洗脱溶剂进行实验[21],各种洗脱溶剂对金线莲苷的分离结果如表3所示,前6种展开剂不含乙酸,斑点的拖尾现象比较严重,而后6种展开剂均加入了少量乙酸,斑点圆整清晰。拖尾严重的现象说明此种展开剂分离效果欠佳。虽然含有氯仿的洗脱溶剂体系分离效果较好,但其毒性较大,不适宜用于金线莲苷的分离纯化。7号和9号展开剂能使金线莲苷展开充分,且Rf值在0.40~0.60之间比较合适,故本实验选择9号展开剂做硅胶柱分离的洗脱溶剂,洗脱溶剂乙酸乙酯/乙醇/乙酸比例为6:4:0.2(体积比)。
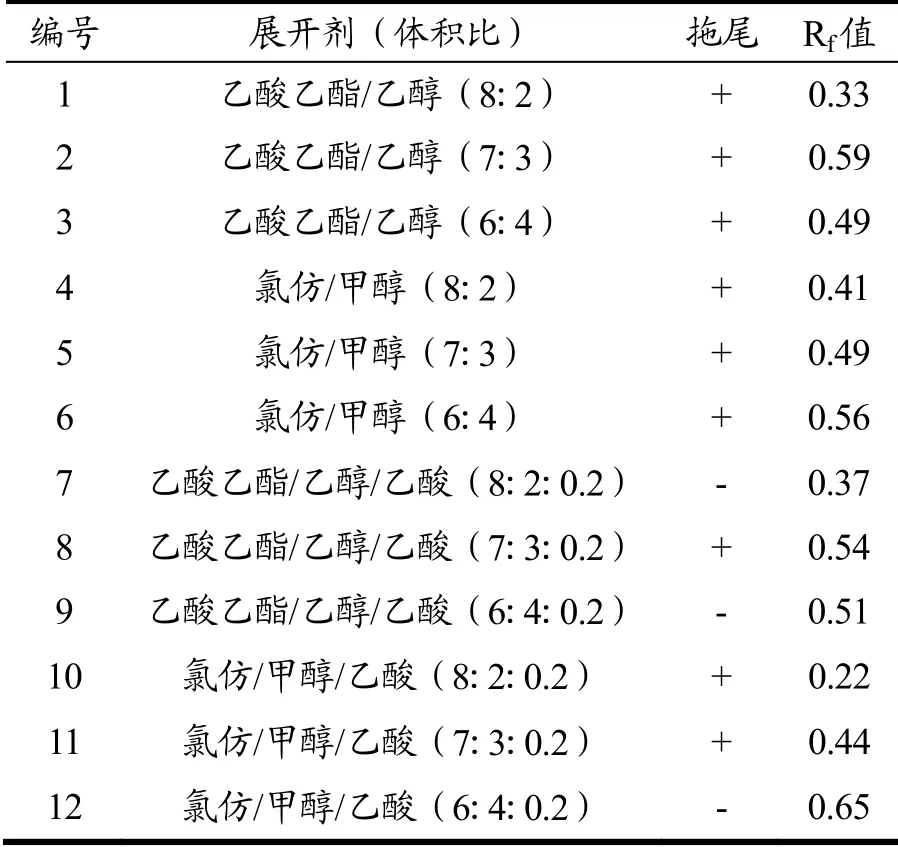
表3 洗脱溶剂比例对金线莲苷分离的影响Table 3 Effect of eluting solvent ratio on the separation of kinsenoside
2.4.2 上样量对金线莲苷分离的影响
硅胶柱层析的分离效率会受到上样量的影响[22]。分别称取金线莲苷粗品0.30、0.40、0.50、0.60、0.70 g,探究上样量对分离纯化的影响,结果如图6所示,在0.40~0.60 g的上样量变化范围内,上样量不断增加,纯化效果逐渐变好;当上样量为0.60 g时,回收率最高可达69.12%,但当上样量继续增加时,纯化效果逐渐变差,推测其原因可能为层析柱填料洗脱能力有限,已达到层析上限;当上样量为0.30 g时,回收率也可达到60%左右,推测其在可洗脱样品质量范围内,金线莲苷纯化率与上样量的关系为多极值型曲线。
2.4.3 洗脱速率对金线莲苷分离的影响
硅胶柱的分离过程中,洗脱速率的影响是比较明显的。洗脱速率过快,目标化合物在未被分离的情况下便被洗脱,分离效果不佳,而洗脱速率过慢,目标化合物可能会出现扩散现象,从而导致分离效率较低。本实验选取了0.50、0.75、1.00、1.25、1.50 mL/min五个流速点进行实验,结果如图7所示,在0.5~1.25 mL/min的流速范围内,随着洗脱速率的不断增大,金线莲苷的回收率不断增大;当流速为1.25 mL/min时,金线莲苷的分离纯化效果最佳,回收率最高可达79.29%;当流速继续增大时,纯化效果变差。
在乙酸乙酯/乙醇/乙酸比例为6:4:2(体积比)、上样量为0.60 g、洗脱速率为1.25 mL/min的硅胶柱层析条件下获得的硅胶柱层析洗脱组分,经半制备型高效液相色谱-蒸发光检测器进一步纯化,在洗脱时间10 min时收集目标组分,真空冷冻干燥后得到金线莲苷纯品,纯度大于99.00%。因此,硅胶柱层析法分离结合半制备型高效液相色谱制备得到的金线莲苷纯度较高,该方法切实有效。
3 结论
本实验首先采用NKA-9、AB-8、D101、DM130四种大孔树脂对金线莲苷深度共熔溶剂粗提液进行分离,结果表明四种大孔树脂分离效果较差,均不适用于金线莲苷的分离。最终确定采用硅胶柱层析方法分离金线莲苷,最佳条件为:洗脱溶剂比例为乙酸乙酯:乙醇:乙酸=6:4:0.2(V/V/V),上样量0.60 g,洗脱速率1.25 mL/min,在此优化条件下,采用半制备型高效液相色谱-蒸发光检测器对金线莲苷进行分离制备,可以获取纯度大于99.00%的金线莲苷纯品。本研究通过硅胶柱层析分离金线莲苷并结合半制备型高效液相色谱-蒸发光检测器对其进行制备,分离纯化流程操作简单高效,步骤少,纯化效果佳,为金线莲苷分离纯化工艺的研究打下坚实基础。
