阻塞性睡眠呼吸暂停综合征患者左室几何构型与肺动脉僵硬度的相关性
2022-05-30冯晓丽康彩虹
田 云 水 雯 张 勇 冯晓丽 康彩虹 崔 桐 王 健
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea,OSAS)是由于睡眠时上气道反复塌陷导致低通气和呼吸暂停的临床综合征,与多种心血管系统疾病密切相关[1],因此分析OSAS与各心室功能的关系成为当前研究的热点。肺动脉僵硬度(pulmonary artery stiffness,PAS)可反映肺血管床状态,早期发现 PAS 的变化可及早对OSAS 患者进行干预,提高患者治疗的依从性[2]。研究[3]证实,PAS 与 OSAS 患者右心功能相关,而“右心-肺循环-左心”作为一个整体[4],OSAS 也会引起左心功能的改变,进一步导致患者左室几何构型发生改变[5-6]。研究[7]发现 OSAS 患者 PAS 增加与左室舒张功降低相关,而左室几何构型异常是心血管疾病发生和预后的独立危险因素[8]。基于此,本研究拟探讨OSAS 患者PAS 与左室几何构型异常的关系,旨在为其制订个体化治疗方案提供依据。
资料与方法
一、研究对象
选取2018年12月至2020年1月我院呼吸科睡眠诊疗中心经多导睡眠呼吸监测确诊的OSAS患者137例,其中男 110 例,女 27 例,年龄 29~68 岁。依据左室质量指数(LVMI)和相对室壁厚度(RWT)[9]将其分为4 组:正常构型组69 例(LVMI 和 RWT 均正常),其中男51 例,女18 例,平均年龄(45.58±12.99)岁;向心性重构组29 例(LVMI 正常,RWT 大于临界值),其中男25 例,女4 例,平均年龄(45.72±12.84)岁;离心性肥厚组21例(LVMI 大于临界值,RWT 正常),其中男18例,女 3 例,平均年龄(46.19±13.20)岁;向心性肥厚组18 例(LVMI 和 RWT 均大于临界值),其中男16 例,女2 例,平均年龄(47.50±12.61)岁。LVMI 临界值为男性108 g/m2,女性 99 g/m2;RWT 临界值为男性 0.51,女性0.49[10]。排除标准:①心肌梗死、心力衰竭、心肌病、心律失常、中或重度瓣膜病、肺部疾病、曾接受持续性正压通气治疗或行腭垂腭咽成形术者;②左室射血分数(LVEF)≤50%者;③图像质量差者。另选同期性别、年龄与之匹配的健康志愿者35 例作为对照组,其中男 24 例,女 11 例,年龄 25~70 岁,平均(44.89±14.34)岁。本研究经我院医学伦理委员会批准,所有受试者均签署知情同意书。
二、仪器与方法
1.超声心动图检查:使用Philips EPIQ 7C 彩色多普勒超声诊断仪,S5-1 探头,频率1~5 MHz。受试者取左侧卧位,平静呼吸,连接心电图,严格按照美国超声心动图学会操作规范[11],将取样线垂直于室间隔及左室后壁,于左室长轴切面二尖瓣腱索水平应用M 型超声测量左室舒张末期内径(LVDd)、舒张末期室间隔厚度(IVSd)和左室后壁厚度(LVPWd),并计算LVMI和RWT。于心尖四腔心和两腔心切面应用双平面Simpson 法测量LVEF。应用脉冲多普勒测量二尖瓣舒张早晚期血流速度峰值比值(E/A),获取肺动脉瓣血流频谱,测量肺动脉血流最大频移(MFS)和肺动脉加速时间(PAcT),并计算PAS,公式为:PAS=MFS/PAcT[12]。
2.一般资料的采集及多导睡眠呼吸监测:记录患者身高、体质量、血压、心率等一般临床资料;对服用降压药且血压<140/90 mm Hg(1 mm Hg=0.133 kPa)的OSAS 患者,以140/90 mm Hg 作为患者校正后的血压值进行统计[13]。清晨空腹抽血检测血糖、胆固醇、甘油三酯等。采用SOMNO 多导睡眠监测仪,对因打鼾疑为OSAS 的患者行整晚(≥7 h)睡眠监测,由同一呼吸科医师分析睡眠监测报告,并记录夜间呼吸暂停低通气指数(AHI)、最低血氧饱和度(Lowest SaO2)、平均血氧饱和度(Mean SaO2)。
三、统计学处理
结 果
一、各组一般资料及多导睡眠呼吸监测参数比较
与对照组比较,OSAS 各组体质量指数、体表面积、收缩压、舒张压、胆固醇、甘油三酯、AHI 均增加,Lowest SaO2、Mean SaO2均减少,差异均有统计学意义(均P<0.05);与正常构型组比较,离心性肥厚组和向心性肥厚组收缩压均增加,差异均有统计学意义(均P<0.05)。各组性别、年龄、心率、空腹血糖比较差异均无统计学意义。见表1。

表1 各组一般资料及多导睡眠呼吸监测参数比较
二、各组超声心动图参数比较
各组 LVDd、RWT、LVMI、E/A、MFS、PAcT、PAS 比较,差异均有统计学意义(均P<0.05);与对照组比较,OSAS各组PAS均增加,向心性重构组、离心性肥厚组、向心性肥厚组PAcT 均减小,差异均有统计学意义(均P<0.05);与正常构型组比较,向心性重构组RWT、LVMI、MFS、PAS 均增加,离心性肥厚组和向心性肥厚组LVDd、LVMI、MFS、PAS 均增加,E/A 均减小,差异均有统计学意义(均P<0.05);与向心性重构组比较,离心性肥厚组和向心性肥厚组LVDd、LVMI 均增加,离心性肥厚组RWT 减小,向心性肥厚组E/A 减小、PAS增加,差异均有统计学意义(均P<0.05);与离心性肥厚组比较,向心性肥厚组RWT 和PAS 均增加,LVDd减小,差异均有统计学意义(均P<0.05)。各组LVEF比较差异无统计学意义。见表2和图1。

图1 各组肺动脉瓣血流频谱图
表2 各组超声心动图参数比较()

表2 各组超声心动图参数比较()
与对照组比较,aP<0.05;与正常构型组比较,bP<0.05;与向心性重构组比较,cP<0.05;与离心性肥厚组比较,dP<0.05。LVDd:左室舒张末期内径;RWT:相对室壁厚度;LVMI:左室质量指数;LVEF:左室射血分数;E/A:二尖瓣舒张早晚期血流速度峰值比值;MFS:肺动脉血流最大频移;PAcT:肺动脉加速时间;PAS:肺动脉僵硬度
PAS(kHz/s)19.67±4.52 21.49±4.69a 23.59±4.59ab 24.17±3.21ab 25.62±3.56abcd 7.897<0.001组别对照组正常构型组向心性重构组离心性肥厚组向心性肥厚组F值P值LVDd(mm)47.61±4.99 47.51±4.21 45.63±7.13 53.13±7.92abc 51.37±7.55abcd 6.767<0.001 RWT 0.39±0.07 0.38±0.05 0.51±0.01ab 0.41±0.04c 0.53±0.03abd 72.735<0.001 LVMI(g/m2)75.05±17.92 78.07±14.22 85.72±9.74ab 111.06±7.04abc 113.00±7.38abc 49.693<0.001 LVEF(%)66.85±4.76 66.09±6.11 65.66±5.10 65.88±7.52 66.49±5.42 0.205 0.935 E/A 1.16±0.08 1.08±0.43 1.00±0.35 0.90±0.23ab 0.80±0.18abc 4.951 0.001 MFS(kHz)2.30±0.12 2.31±0.14 2.49±0.26ab 2.56±0.14ab 2.57±0.12ab 21.991<0.001 PAcT(ms)122.40±26.03 112.40±24.09 109.63±24.90a 107.96±16.43a 102.00±14.47a 2.859 0.025
三、单因素相关性分析
PAS 与年龄、体质量指数、收缩压、舒张压、AHI、LVMI、RWT、左室几何构型均呈正相关(r=0.154、0.166、0.253、0.153、0.336、0.276、0.286、0.433,均P<0.05),与Lowest SaO2呈负相关(r=-0.158,P<0.05)。见表3。
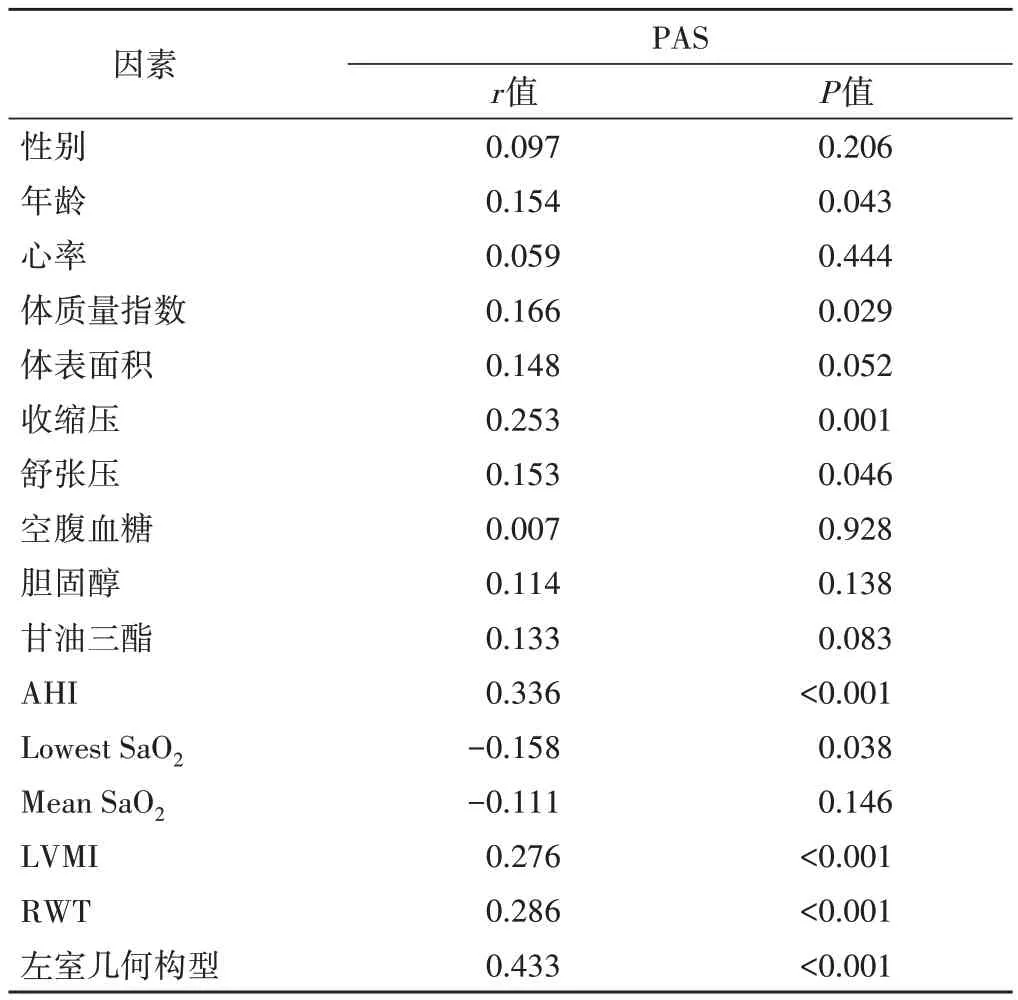
表3 PAS与各参数的单因素相关性分析
四、多元线性回归分析
多元线性回归分析结果显示,在调整了体质量指数、收缩压、舒张压、Lowest SaO2等混杂因素后,PAS与年龄、AHI、左室几何构型均独立相关,是其变化的影响因素。见表4。
讨 论
PAS由Görgülü等[12]首次提出,是反映肺血管床状态的重要指标。OSAS 因慢性间断性缺氧会引起氧化应激和炎性反应,使中性粒细胞活化,进而损害肺小动脉内皮细胞的结构和功能,导致PAS增加[3];同时患者因间断性缺氧导致交感神经兴奋,促使外周动脉阻力增加,夜间上呼吸道阻塞,用力吸气使得胸腔负压和左室透壁压增加,氧化应激与炎性因子刺激心肌细胞等还可使左室几何构型发生异常改变[6]。异常左室几何构型患者发生冠状动脉粥样硬化性心脏病、心力衰竭、猝死的风险明显增加[5,13],而 OSAS 不同左室几何构型患者临床预后不同,其中向心性肥厚患者预后最差,其次为离心性肥厚、向心性重构、正常构型[8,10]。因此依据左室几何构型对OSAS 患者进行分层管理及个体化治疗,对临床早期干预意义重大。本研究结果发现,向心性肥厚组PAS较其他组均增加(均P<0.05),提示临床应密切关注向心性肥厚患者PAS 变化,以便及早干预;向心性重构组与离心性肥厚组PAS 比较差异无统计学意义,分析原因可能与离心性肥厚OSAS患者肺动脉弹性功能尚处于代偿状态有关,提示临床不能忽视对此类人群的动态观察。OSAS 患者肺动脉弹性功能逐渐降低,导致右室前负荷增大,而总血容量保持不变,因此右室收缩期射血时限缩短,肺动脉流速及频移增加,虽然本研究中向心性重构组、离心性肥厚组、向心性肥厚组PAcT 依次呈降低趋势,MFS依次呈增高趋势,但三组间两两比较差异均无统计学意义,提示临床相对于单独使用MFS、PAcT,二者计算获得的PAS 可更好地综合性评价肺动脉弹性功能。本研究中向心性肥厚组LVDd 较离心性肥厚组减小(P<0.05),与既往研究[9]结果一致,分析原因可能与两种左室肥厚类型不同的血流动力学改变有关,与压力负荷超载的向心性肥厚不同,容量负荷过大的离心性肥厚可引起心肌细胞延长、心肌纤维化、肌节串联[13]等改变,导致左室内径扩大。
本研究结果显示,PAS 与 LVMI 相关(r=0.276,P<0.05),与Altiparmak等[7]研究结论一致。此外,本研究还发现PAS 与RWT 相关(r=0.286,P<0.05),且PAS与左室几何构型独立相关(向心性重构:β=2.263,离心性肥厚:β=2.547,向心性肥厚:β=3.554,均P<0.05),表明OSAS 患者肺动脉弹性功能与左室结构功能可相互影响。分析原因为:OSAS 患者胸腔压力波动可使右室前负荷增加,室间隔左移从而导致左室空间缩小,阻碍血液从左房流入左室,故左房充盈压增高;此外,OSAS 患者慢性间断性缺氧刺激交感神经,外周血管收缩导致左室后负荷增加,左室排空阻力增大,充盈压增高,左心压力从肺静脉逆向传导至肺动脉,导致肺动脉损伤,而左室负荷及压力的变化是导致左室几何构型改变的重要原因。由此可见,动态监测PAS可在一定程度上预测患者左室构型异常改变。研究[3,7,14]表明,PAS 增加与右室功能失调及左室舒张功能降低密切相关,心室间的相互依赖性及PAS 与左、右心室密切相关提示临床需将“右心-肺循环-左心”视为一个整体[4],在重视左心系统的同时也应关注肺循环的变化,建立整体心脏观。
本研究还发现,AHI、年龄也是影响PAS 变化的独立因素。既往研究[3]通过 AHI 将 OSAS 患者分为轻、中、重度组,并发现PAS 随着OSAS 病情严重程度增加而增加,虽然分组方法与本研究不同,但均证实AHI与PAS 密切相关。表明随着OSAS 患者呼吸暂停和低通气频次增加,间断性缺氧程度逐渐加重,肺小动脉收缩,管壁增厚,肺循环压力增高,长期恶性循环可能引起肺动脉高压及右室功能障碍。本研究中各组年龄比较差异无统计学意义,且单因素相关性分析发现,PAS 与年龄仅呈弱相关(r=0.154,P<0.05),但 Dawes等[14]和杨飞[15]研究发现肺动脉弹性功能随着年龄增加而增加,考虑年龄可能是影响PAS 的混杂因素,本研究将其纳入回归分析,结果发现年龄是影响PAS 变化的独立因素,这可能与老年OSAS 患者肺动脉血管壁弹性纤维减少,胶原含量增加,从而使动脉弹性降低,功能发生减退有关,因此临床更应注意监测老年OSAS患者的PAS。但马晨瑶等[2]研究认为PAS与年龄无相关性,可能与病例组的年龄分布范围差异有关。
本研究的局限性:①评估左室的超声指标较单一,未来可加入斑点追踪等新技术更全面地量化左室功能;②对血压值进行了校正,原因是OSAS 患者常合并高血压病,其中服用降压药的患者测得的血压值虽然正常,但可能会低估长期的高血压病对左室构型及PAS的影响;③样本量有限且缺乏相关的机制研究,未来将增加样本量,并加入一些血实验室检查指标,进一步分析PAS与左室几何构型关系的相关机制。
综上所述,OSAS患者左室几何构型与PAS独立相关,是其独立影响因素之一;提示临床在治疗OSAS 等心血管疾病时,不仅应关注PAS 的发展变化,同时还应建立“右心-肺循环-左心”的系统观念,对疾病进行综合性评价,有助于建立个体化治疗方案。
