酵母对亚急性瘤胃酸中毒绵羊缓解效果及作用机制研究
2022-05-30韩郭皓高晓莎段晋伟张慧琴何金鑫丁建安霍乃蕊裴彩霞李红丽古少鹏
韩郭皓,高晓莎,段晋伟,张慧琴,郑 岩,何金鑫,丁建安,霍乃蕊,裴彩霞,李红丽,古少鹏*
(1.山西农业大学动物医学学院,太谷 030801;2.朔州职业技术学院生物工程系,朔州 036002;3.山西农业大学动物科学学院,太谷 030801)
反刍动物养殖中,为达最大生产性能常饲喂大量高精饲粮,高精饲粮在瘤胃内发酵导致酸性有机物大量产生并积累,瘤胃pH长期处于较低水平,引起亚急性瘤胃酸中毒(subacute ruminal acidosis,SARA)。SARA临床症状常不明显,预防和诊断比较困难,常造成巨大的经济损失。瘤胃pH是判断SARA的关键指标,瘤胃pH于5.2~5.6持续3 h以上可诊断发生SARA。目前,SARA发生机制包括乳酸中毒学说以及内毒素组胺中毒学说。近年来,许多学者都致力于寻找一种高效、无毒副作用缓解瘤胃酸中毒的方法,如使用包括缓冲剂、电子受体、乳酸菌临床疫苗和莫能菌素等方法来阻止或缓解瘤胃中毒的发生和发展。但上述方法效果欠佳,在一些大型牧场,SARA仍是当前反刍动物养殖中的主要疾病之一。
酵母在反刍动物饲养中可以起到促进瘤胃发育、促进营养物质消化和吸收、调控瘤胃菌群结构、加强机体免疫力等作用。研究表明,酿酒酵母CNCM I-4407可缓解荷斯坦奶牛SARA,提升瘤胃pH、降低瘤胃液乳酸积累、改善瘤胃菌群。但酿酒酵母CNCM I-1077并未显著提升高精料饲喂夏洛莱牛的瘤胃pH。不同结果可能与酵母菌种有关,因而寻找具有改善反刍动物瘤胃代谢,且有良好瘤胃内环境适应能力的酵母菌种十分重要。从瘤胃中分离和筛选的酵母具有更适应瘤胃内环境和更易在瘤胃内生长定殖的特点,可作为防治SARA的益生菌菌种,在反刍动物健康养殖中有重要的应用价值。
在本课题组前期研究中,成功分离鉴定并筛选出两株牛瘤胃源褶皱假丝酵母(),经体外发酵试验证实具有一定防治反刍动物SARA作用。为进一步阐明瘤胃源酵母对SARA的防治效果,本研究通过对SARA绵羊灌服上述两株瘤胃源褶皱假丝酵母和1株酿酒酵母,研究3种酵母对瘤胃菌群、瘤胃与血液异常代谢产物和血气指标影响,进一步探究酵母对SARA绵羊缓解效果及其机制,为研制防治反刍动物SARA微生态制剂提供菌株和理论依据。
1 材料与方法
1.1 酵母
褶皱假丝酵母N07、褶皱假丝酵母N09、酿酒酵母ACCC 21162为本实验室保存菌种。褶皱假丝酵母N07和褶皱假丝酵母N09的18S rRNA序列信息保存于GenBank,登录号分别为MW888912和MW888913。酵母液体培养基成分为:红糖5%、酵母提取物2%、硫酸铵1%、氯化钾0.2%。菌株接种后,置于39 ℃,180 r·min的苏州培英THZ-C型恒温震荡器中培养24 h,培养后的酵母菌数达到1×10CFU·mL。
1.2 试验动物与试验设计
选取60只2月龄同期断奶、平均体重(20.50±2.21)kg杜泊羊(♂)×湖羊(♀)F代作为试验动物,公母各半。预饲期30 d,饲喂精粗比50∶50基础饲粮。通过递增饲粮精粗比诱导绵羊发生SARA,饲粮精粗比依次为70∶30、80∶20、90∶10和100∶0,各比例饲粮饲喂7 d,第28天确认40只绵羊发生SARA。将40只SARA绵羊随机分为4组,分别为:SARA模型组(SARA,=10)、酿酒酵母组(SC,=10)、褶皱假丝酵母一组(DR1,=10)和褶皱假丝酵母二组(DR2,=10),均饲喂精粗比为90∶10饲粮,各酵母组于每日晨饲后分别灌服酿酒酵母ACCC 21162、褶皱假丝酵母N09、褶皱假丝酵母N07培养液100 mL。另设置对照组(CON,=10),饲喂精粗比50∶50饲粮。试验设计如图1所示。每日06:00和17:00饲喂,各饲粮组成见表1。
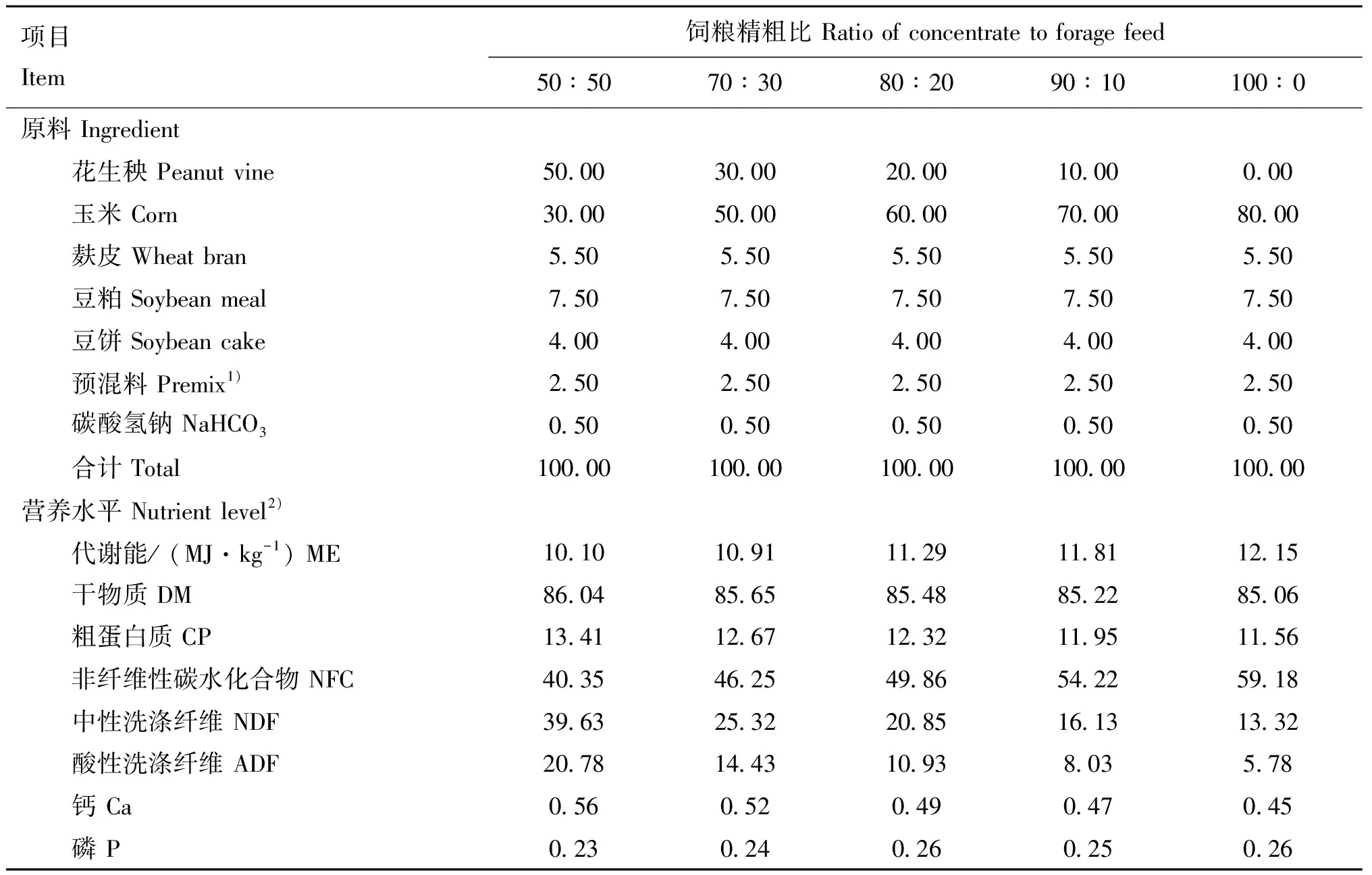
表1 饲粮组成及营养水平(风干基础)
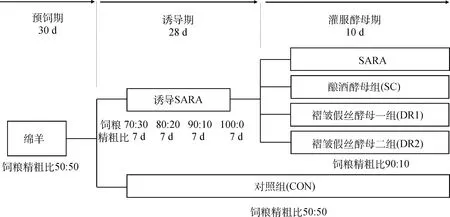
图1 试验设计
1.3 样品收集与测定
灌服酵母期第1、3、7天晨饲后3 h以及第10天晨饲后1、2、3、4、5、6、8 h使用科立博A1164K型瘤胃液口腔采样器抽取瘤胃液,每只50 mL,四层纱布过滤保存。灌服酵母期第10天,晨饲前用BD Preset采血器和含促凝剂的采血管采集颈静脉血液。
1.4 生物信息与统计分析
各样本菌群测序数据根据原始序列数据的条形码序列和PCR扩增引物序列分离得到。使用FLASH 1.2.7获得高质量的标签数据。Qiime 1.9.1用于标签截取和标签长度过滤。Vsearch 2.8.1用于去除嵌合序列并获得有效标签。利用Uparse 7.0.1001基于97%的序列一致性,将这些序列组合成可操作的分类单元(OTUs)。Mothur方法和SILVA 132的SSUrRNA数据库用于物种注释分析。使用Qiime 1.9.1和R 2.15.3进行alpha多样性分析和beta多样性分析。
使用SPSS 26软件的单因素方差分析和DUNCAN检验法的多重比较进行统计分析,相关性分析采用双变量Pearson相关分析。<0.05时有显著差异。数据以“平均值±标准差(Mean±SD)”表示。
2 结 果
2.1 酵母对SARA绵羊瘤胃pH的影响
由表2和表3可知,随灌服酵母时间延长,灌服酵母组瘤胃pH逐渐升高,第3天(<0.05)和第7天(<0.01)灌服酵母组pH均显著高于SARA组;第10天测定的7个时间点灌服酵母组pH均极显著高于SARA组(<0.01),说明SARA状态得到有效缓解。
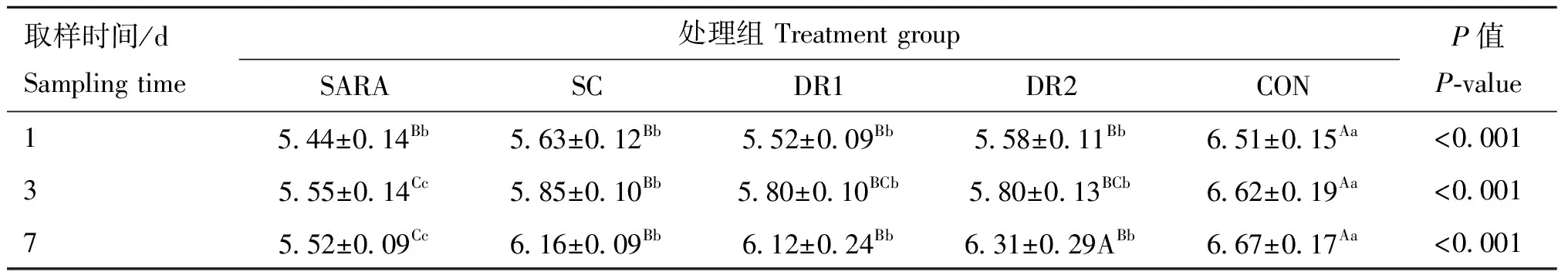
表2 酵母对SARA绵羊瘤胃pH的影响
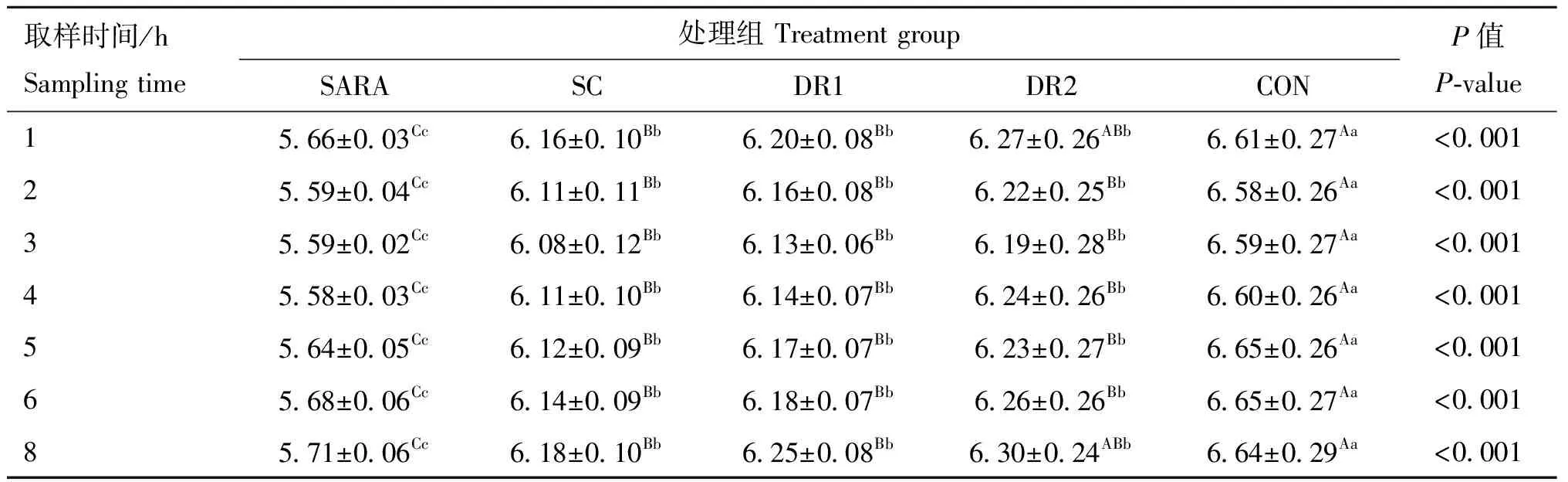
表3 灌服酵母期第10天瘤胃液pH
2.2 酵母对SARA绵羊瘤胃异常代谢的影响
由表4可知,灌服酵母组第10 天瘤胃液乳酸和组胺含量显著低于SARA组(<0.05),DR1组和DR2组瘤胃液组胺含量极显著低于SARA组(<0.01),灌服酵母组瘤胃液内毒素较SARA组有所下降,但差异不显著(>0.05)。
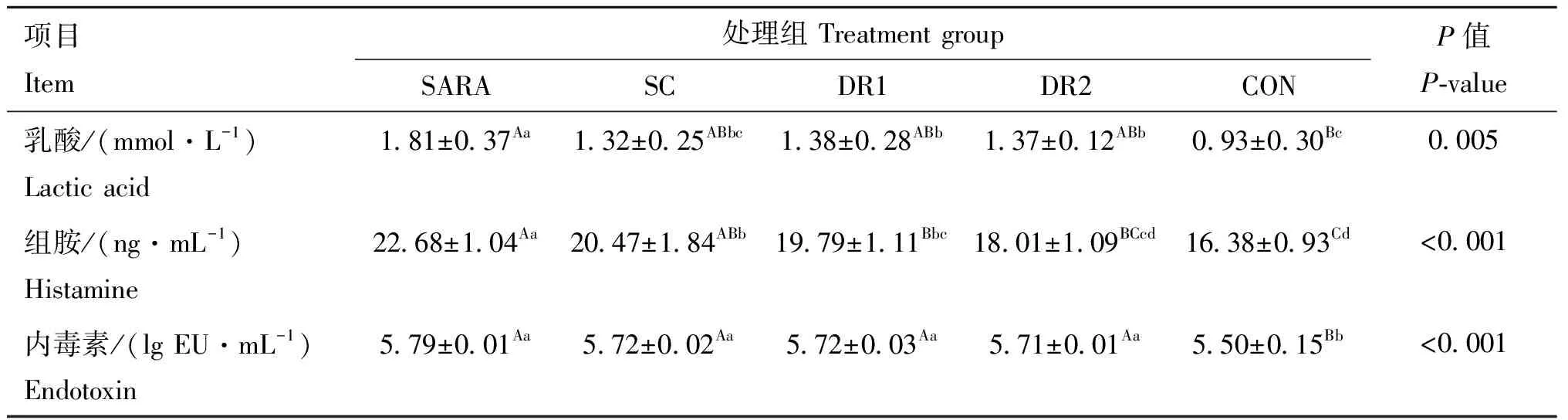
表4 不同酵母对绵羊瘤胃液乳酸、组胺、内毒素的影响
2.3 酵母对SARA绵羊瘤胃菌群的影响
由表5可知,各组间菌群Chao 1指数和Shannon指数差异不显著(>0.05),灌服酵母组瘤胃菌群Chao 1指数较SARA组有所提升,其中SC组最高;SC和DR2组Shannon指数较SARA组有所提升,其中DR2组最高。
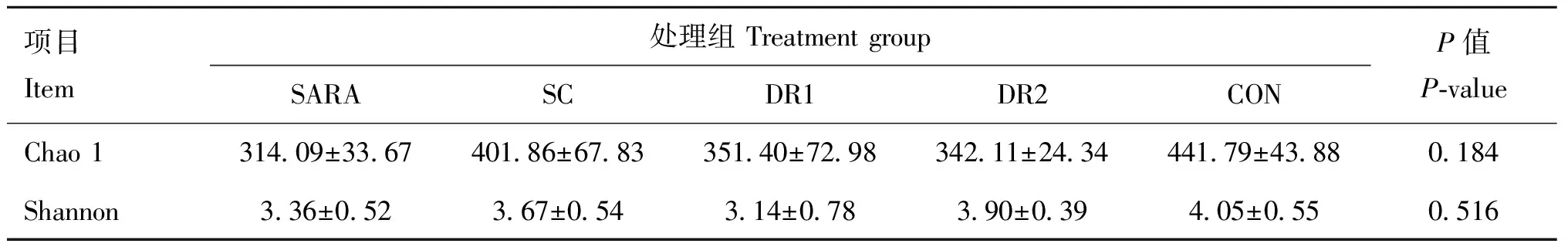
表5 不同酵母对绵羊瘤胃菌群Alpha多样性的影响
由图2可知,门水平下,主要菌门为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、软壁菌门(Tenericutes)。SC组和CON组最优菌门为拟杆菌门,SARA、DR1、DR2组最优菌门为厚壁菌门。与SARA组相比,SC、DR1、DR2组拟杆菌门(55.48%、29.46%、24.95%)相对丰度增加,厚壁菌门(38.69%、63.52%、60.55%)相对丰度减少。
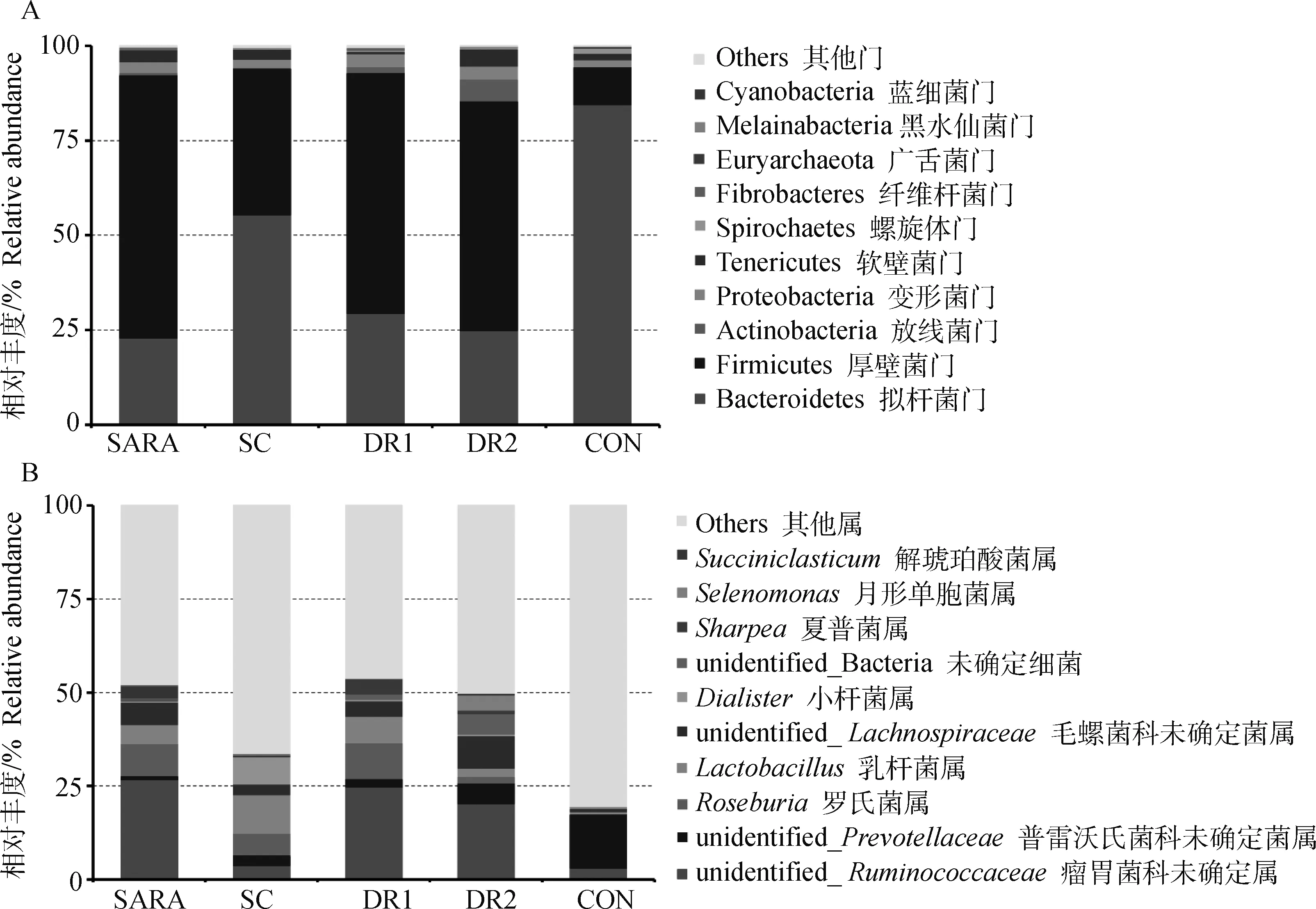
图2 不同酵母组绵羊瘤胃10个最丰富细菌门(A)和属(B)的相对丰度
属水平下,主要菌属为瘤胃菌科未确定属(unidentified)、普雷沃氏菌科未确定菌属(unidentified)、罗氏菌属()、乳杆菌属()、毛螺菌科未确定菌属(unidentified)、解琥珀酸菌属()。SC组最优菌属为乳杆菌属,CON组最优菌属为普雷沃氏菌科未确定菌属,SARA、DR1、DR2组最优菌属为瘤胃菌科未确定属。与SARA组相比,SC组乳杆菌属(10.29%)、普雷沃氏菌科未确定菌属(2.57%)相对丰度升高;罗氏菌属(5.89%)和瘤胃菌科未确定属(3.89%)相对丰度降低。与SARA组相比,DR1组乳杆菌属(7.03%)、罗氏菌属(9.66%)、普雷沃氏菌科未确定菌属(2.23%)相对丰度升高;瘤胃菌科未确定属(24.73%)和解琥珀酸菌属(1.94%)相对丰度降低。与SARA组相比,DR2组普雷沃氏菌科未确定菌属(5.41%)相对丰度升高,罗氏菌属(1.75%)、乳杆菌属(2.19%)、瘤胃菌科未确定属(20.42%)相对丰度降低。
由图3可知,SARA组相对丰度显著增加(<0.05),DR1组相对丰度显著增加(<0.05)。
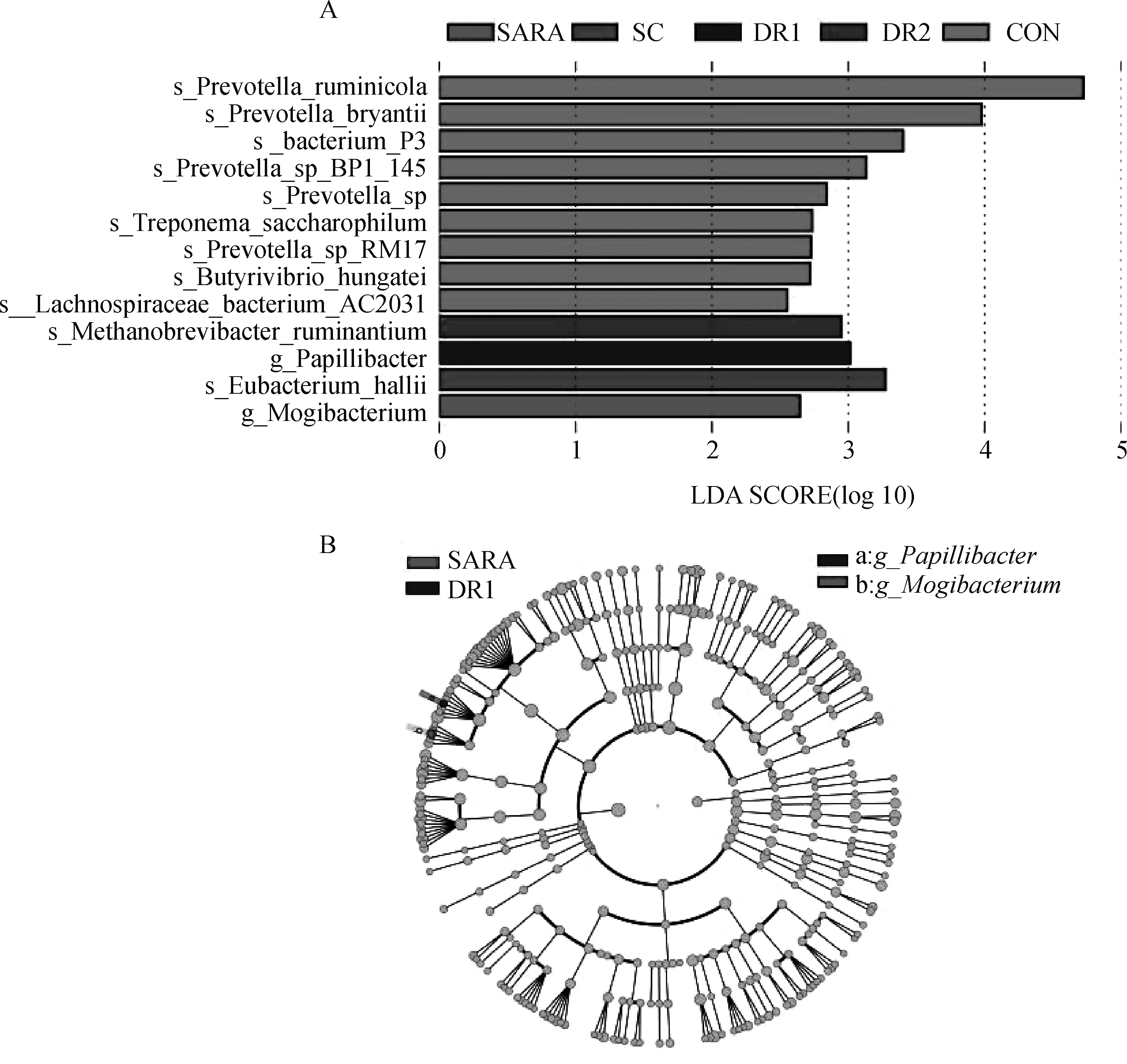
A.LDA值分布图;B.分支进化图
2.4 酵母对SARA绵羊血液代谢的影响
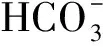
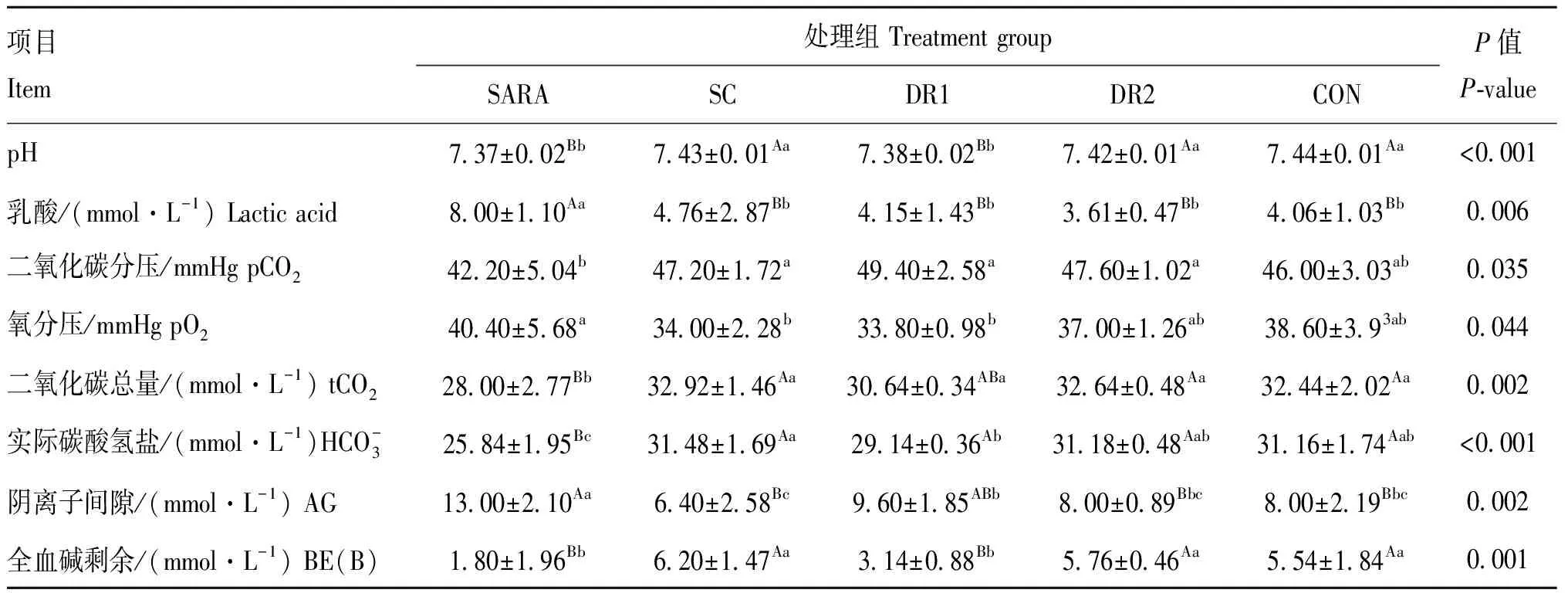
表6 不同酵母对绵羊血气分析的影响
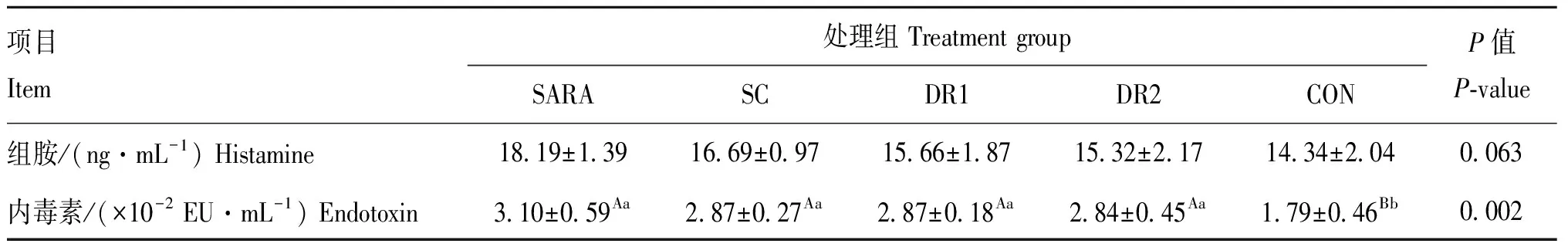
表7 不同酵母对绵羊血清异常代谢的影响
2.5 瘤胃液、血液和瘤胃菌群主要指标间相关性分析
由图4可知,瘤胃液pH与血清内毒素、血清组胺呈现显著负相关(<0.05),瘤胃液pH与瘤胃液内毒素、瘤胃液组胺、瘤胃液乳酸呈现极显著负相关(<0.01),瘤胃液pH与血液实际碳酸氢盐呈现显著正相关(<0.05);瘤胃液乳酸与菌群Chao 1指标呈现显著负相关(<0.05),瘤胃液乳酸与血清内毒素、血液乳酸呈现显著正相关(<0.05),瘤胃液乳酸与血清组胺、瘤胃液内毒素、瘤胃液组胺呈现极显著正相关(<0.01);血液实际碳酸氢盐与瘤胃液组胺、瘤胃液内毒素、血液乳酸呈现极显著负相关(<0.01)。
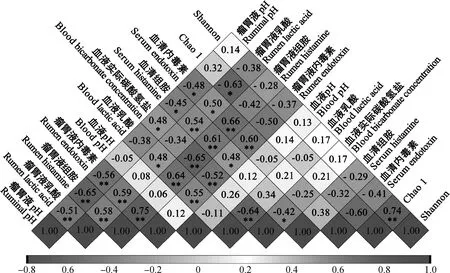
*.P<0.05;**.P<0.01
3 讨 论
反刍动物瘤胃内环境和微生物生态体系处于一个动态的平衡状态。瘤胃pH是最基本、最直接、最重要的生理指标。Alzahal等研究表明,活性酿酒酵母Y1242有助于提升反刍动物瘤胃pH。本研究显示3株酵母均可有效提升瘤胃pH,与上述研究结果一致。
瘤胃稳定的内环境为微生物活动及繁殖提供了良好的生存条件,瘤胃菌群通过参与瘤胃内营养物质代谢而影响瘤胃代谢。反刍动物长期采食高精料饲粮会导致瘤胃内环境和瘤胃菌群失衡,乳酸菌产生增加,导致瘤胃乳酸产生增多,乳酸积累,引起瘤胃酸中毒。本研究中,3种酵母均显著降低了瘤胃乳酸积累。相反地,Vyas等在牛饮食中添加活性干酵母并没有观察到瘤胃乳酸显著下降。不同结果可能与酵母菌种及饲粮组成相关。本研究显示,Chao 1与瘤胃乳酸浓度呈现显著负相关,瘤胃乳酸积累导致瘤胃内环境长期处于酸性状态,瘤胃内环境变化引起瘤胃细菌大量死亡,菌群丰富度降低。本研究显示,3种酵母均有助于维持瘤胃菌群数量,这可能因酵母代谢了瘤胃内异常发酵产生的乳酸,起到了维持瘤胃内环境稳定的作用。本研究显示,灌服酵母可提升瘤胃菌群丰富度和多样性,与Cao等的研究结果相似。瘤胃内毒素和瘤胃组胺呈现极显著正相关,SARA导致瘤胃内大量细菌死亡,死亡后的革兰阴性菌细胞壁释放出大量内毒素进入瘤胃,同时促进1种炎症介质组胺的产生。本研究中的3种酵母均降低了瘤胃组胺和内毒素含量,与Peng等研究一致,提示酵母可通过改善瘤胃内环境缓解酸中毒状态,减少瘤胃内细菌的死亡。褶皱假丝酵母N07组瘤胃组胺和内毒素含量最低,在减轻瘤胃炎症方面显示了优势。而Diaz等报道在羔羊饲料中添加1种商业活性酿酒酵母后对瘤胃内毒素含量并没有产生显著的影响。不同结果可能与动物品种和酵母菌种相关。
本研究中,灌服酵母组瘤胃液和血清内毒素、血清组胺与SARA组差异不显著,可能与绵羊发生SARA后仍以高精料饲喂、灌服酵母持续时间较短等因素有关。本课题组前期对处于SARA诱导过程的绵羊灌服3株酵母,发现灌服酵母组瘤胃液和血清内毒素均显著低于SARA组,表明防治绵羊SARA发生应以预防为主,防重于治。
4 结 论
本研究中3株酵母均可通过提升瘤胃菌群丰富度,降低瘤胃液和血液乳酸积累,减轻瘤胃炎症,提升机体碱储备,起到缓解绵羊SARA的作用,可为防治反刍动物SARA微生态制剂提供优良菌株和理论依据。
