破骨细胞中铁代谢的研究进展
2022-05-28倪硕袁音邝言斌禹宝庆
倪硕 袁音 邝言斌 禹宝庆*
1.上海市浦东医院(复旦大学附属浦东医院)骨科,上海 201301 2.浙江大学附属第一医院感染科,传染病诊治国家重点实验室,浙江 杭州 310003 3.上海交通大学附属仁济医院呼吸科,上海 200127
铁作为人体中重要的微量元素之一,其代谢的异常与多种疾病相关,导致许多骨科疾病的发生[1],尤其是骨质疏松症[2]。铁缺乏导致患者贫血[3];原发性铁超负荷(遗传性血色素沉着症)及继发性铁超负荷(地中海贫血、先天性贫血、贫血、铁粒幼细胞贫血、骨髓增生异常综合症等输血)引起的铁超载,造成患者肝脏[4]、内分泌[5]、心血管[6]、神经系统[7]及骨骼肌肉系统损伤[8]。铁代谢在疾病的病理生理或进展中发挥重要作用[9]。因此,了解铁代谢在破骨细胞中的作用机制,对预防及治疗破骨细胞过度激活导致的骨丢失疾病具有重要意义。
1 铁代谢的调控
人体铁代谢的调节,一方面通过膳食进行铁吸收以维持机体正常的铁需求,另一方面通过机体内的氧化还原系统防止铁过量所带来的潜在毒性氧化作用[10]。由于体内缺乏铁排泄的主要通道及途径,因此体内铁代谢吸收的调节显得格外重要[10]。通过膳食摄入的铁,在肠腔内被吸收,接着被释放入血液循环。在这些步骤中,铁通过肠道基底侧膜向血液循环释放铁,这种方式对全身铁代谢的影响最大。该步骤通过铁输出铁转运蛋白(Ferroportin,FPN)介导,并受到肝脏分泌的铁调素(Hepcidin)调节[11]。肠道基底侧释放的铁与转铁蛋白(Transferrin,Tf)结合后在血浆中运输。血液循环中转铁蛋白通常饱和度通常为30%[12]。转铁蛋白饱和度<16%表示铁缺乏,而>45%饱和度则是铁超负荷的迹象。当饱和度超过60%时,未结合转铁蛋白的铁开始在循环中蓄积并损害实质细胞[10]。在某些病理情况下,由肠道吸收并且被释放到血浆中的铁会超过转铁蛋白的结合能力,导致存在未与转铁蛋白结合的铁(non-transferrin bound iron,NTBI)[11]。这种非转铁蛋白结合的铁,被许多不同类型的细胞吸收,从而引起铁超负荷并因此导致细胞氧化损伤[13]。
人体内铁代谢的调控主要由铁调素(hepcidin)完成。铁调素是由肝细胞分泌的肽类激素,负责调节肠上皮细胞吸收铁以及调节铁从胞内(肝细胞和网状内皮巨噬细胞系统)释放到循环系统中[14]。人体细胞内铁代谢的调节主要依赖于铁调节蛋白1(iron regulate orotein 1,IRP1)和铁调节蛋白(iron regulate protein 2I,IRP2)的转录后调控。IRP1也称为顺乌头酸酶1(Aconitase-1,ACO1),IRP2也称为铁反应原件结合蛋白2(iron-response element-binding protein 2,IREB2)。细胞内富铁时,IRP2被泛素化降解;细胞内缺铁时,IRP2泛素化降解减少[10]。IRP1的调节依赖于线粒体内的铁硫簇。细胞内富铁时,IRP1与铁硫簇捆绑并阻止其余铁反应原件(IRE)的结合,并且充当顺乌头酸酶(Aconitase)的角色,因此在这过程中IRP1是双功能的。当细胞内缺铁时,IRP1失去铁硫簇及顺乌头酸酶的活性,与IRE相结合发挥铁调节的正向作用。线粒体铁硫簇的破坏刺激IRP的表达,并导致铁饥饿反应的发生。因此,IRP1的具体功能决定于线粒体铁的利用及铁硫簇的合成,而IRP2则主要感知细胞内铁水平。
2 铁与破骨细胞
2.1 铁与破骨细胞的分化
破骨细胞在分化过程中铁的需求增加,并且破骨细胞通过转录后调控升高IRP2并由此增加了转铁蛋白受体1(TfR1)的表达。因此,TfR1介导的铁摄取促进了破骨细胞的分化和骨吸收[15]。转铁蛋白受体1(transferrin receptor 1,Tfr1)与破骨细胞:转铁蛋白受体1(Tfr1)是一种广泛表达的细胞表面受体。TF-TFR1复合物被内吞,在细胞内体的酸性环境中,并在前列腺金属化还原酶六跨膜上皮抗原(six-transmembrane epithelial antigen of prostate,STEAP)还原酶的辅助下,三价铁被还原为亚铁。功能上,首先,Tfr1通过增加铁的摄入,向线粒体供应铁来增加线粒体呼吸能力。其次,摄入的细胞内铁通过活性氧(reactive oxygen species,ROS)产生促进cAMP反应元件结合蛋白(cAMP response element-binding protein,CREB)对过氧化物酶体增殖物激活的受体-γ共激活剂1β(peroxisome proliferator-activated receptor-γ coactivator 1β,PGC-1β)的转录诱导,由此促进破骨细胞的分化[15]。在这一过程中,ROS产量的增加进一步增强了破骨细胞的分化,暗示在铁介导的破骨细胞分化过程中存在着正反馈调节回路。许多文献报道Tfr1的表达与破骨细胞分化及功能正相关[16-19]。值得注意的是,尽管通过Tfr1依赖性途径摄取铁对于破骨细胞的分化至关重要,但是通过Tfr1介导的铁输入需要经过Steap4将其还原为亚铁以供细胞使用。Steap4作为破骨前体细胞中负责将三价铁转化为二价铁供细胞使用的亚铁还原酶,其表达与破骨细胞的分化相关[20]。FPN是目前唯一已知的细胞铁输出蛋白。FPN在与某些与全身铁稳态有关的细胞(例如巨噬细胞和肝细胞)中表达较多。FPN的表达减少不仅可以增加多发性骨髓瘤的生长,并且可以促进破骨细胞的分化[21-22]。通过FPN基因敲除小鼠,验证了FPN对破骨细胞分化的重要作用,并且认为升高的胞内铁可促进巨噬细胞增殖并激活活化的T细胞1(nuclear factor of activated T cells 1,Nfatc1)和PPARG共激活因子1β(PGC-1β)的核因子表达[23]。FPN突变小鼠(铁调素抵抗),中轴骨量降低,其原因为体内血浆铁增高所致的成骨形成减少,而破骨相关指标未见明显改变[24]。此项研究也提示了FPN作为破骨细胞负向调节蛋白的作用。但是,最近也有报道FPN条件敲除小鼠中具有高骨量表型,并且发现与体内OC形成减少有关[25]。FPN作为目前唯一已知的细胞铁输出蛋白,其受关注度正在增加[26]。
2.2 铁与破骨细胞的功能
铁代谢除了影响破骨细胞的分化外,也影响破骨细胞的功能。有报道Tfr1缺失的破骨前体细胞,虽然可以正常分化为破骨细胞,但是其能量代谢及形态异常,并且功能受到明显抑制[27]。铁蛋白(Ferritin H,FTH)是一种具有24个亚基的蛋白,可以存储多达4 500个铁原子。它由两个亚基类型组成,称为铁蛋白重链(ferritin heavy chain,FTH)和铁蛋白轻链(Ferritin L,FTL)亚基。已有文献报道血清中较高的铁蛋白与低骨量相关[28]。同时,也有临床研究血清铁蛋白水平升高是绝经后女性髋部骨折的独立预测因素[29]。这些证据暗示铁蛋白与骨代谢,尤其是与破骨细胞铁代谢相关。卵巢切除术小鼠骨量的变化要晚于铁蛋白的变化[30]。铁相关标志物与破骨细胞分化及功能的关系见表1。
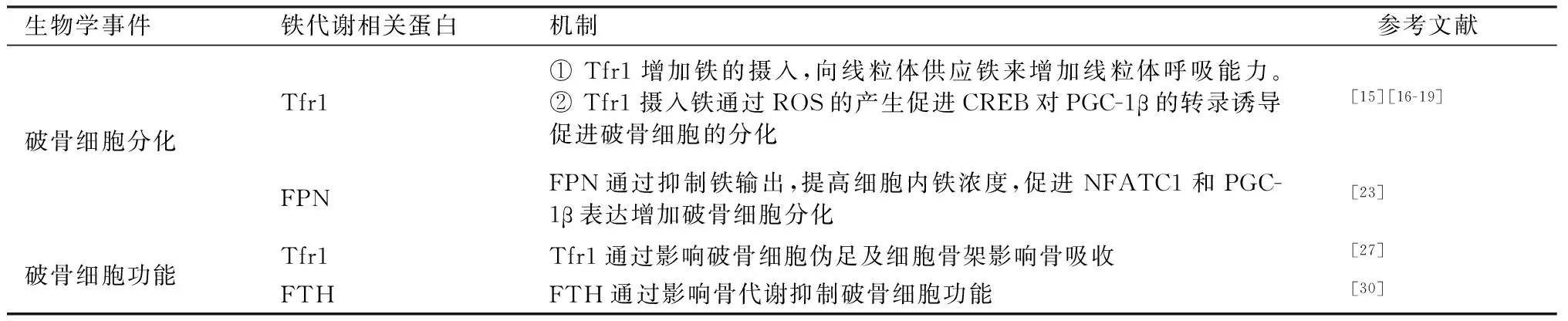
表1 铁相关标志物与破骨细胞分化及功能的关系Table 1 Relationship between iron related markers and osteoclast differentiation and function
3 铁与线粒体
线粒体的正常功能对于破骨细胞的成功分化至关重要[31]。在破骨细胞分化过程中,与线粒体生物发生和功能有关的一些因素对破骨细胞的分化起着根本性的作用,例如过PGC1β、过氧化物酶体增殖物激活的受体(peroxisome proliferator-activated receptor,PPAR)和雌激素相关受体α(ERRα)。这些因素通过不同途径在破骨细胞分化过程中调节骨重塑[32]。以上这些酶的合成与作用,与线粒体铁代谢有直接或者间接联系[33]。值得一提的是,破骨细胞的形成以及骨吸收功能的发挥是一个高耗能的过程,需要大量的ATP供能[31]。线粒体是产生这些ATP的主要场所,而线粒体内含铁蛋白的合成参与了ATP的合成。因此,通过靶向线粒体铁干预破骨细胞能量代谢抑制骨质疏松的发生在未来具有一定的研究及应用前景。
4 靶向铁代谢在骨质疏松中的治疗
降低细胞及机体铁水平被认为是治疗骨质疏松的潜在靶点。DFO被广泛应用破骨细胞过度激活相关疾病的基础及临床。尽管使用DFO对铁过载疾病的治疗具有良好的治疗效果,但由于DFO口服吸收差并且半衰期短,导致患者连续治疗的依从性很差[34]。去铁酮(DFP)是第一种批准的口服铁螯合剂,以3∶1的比例与三价铁结合。DFP与铁具有良好的亲和力,可以有效去除体内多余的铁。与传统的DFO相比,DFP可以口服,并且容易在胃肠道吸收。患者有良好的依从性。由于其亲脂的特性,较低的分子量和中性电荷的特征,DFP可以很容易地穿透膜,并有效去除组织中的细胞铁[35]。Deferasirox(DFX)是一种三齿口服螯合剂,以2∶1的比例与三价铁结合。DFX的半衰期很长,为8~12 h,可确保24 h内在治疗浓度范围内血浆中的DFX水平。因此,DFX可以每天口服一次。DFX可有效去除心脏和肝脏中过量的铁,并已被批准用于治疗输血相关性贫血患者的铁超载。DFX不会引起β地中海贫血严重患者内分泌失调的发生和发展,并且无论患者是否接受抗骨质疏松治疗,腰椎骨质疏松的情况显著改善[36]。目前临床靶向铁代谢治疗骨质疏松的药物见表2。

表2 目前临床靶向铁代谢治疗骨质疏松Table 2 Current clinical targeted iron metabolism in the treatment of osteoporosis
5 观点及展望
铁代谢的失调会干扰骨吸收与骨形成之间的平衡,进而导致骨质疏松的发生。有证据表明,铁代谢失调会导致骨吸收增加及骨形成减少[39]。目前,对于铁代谢与破骨细胞的基础研究聚焦于Tfr1与线粒体的生物发生[15,17],还有部分集中于铁输出蛋白FPN[21-22],但是对于靶向线粒体铁影响破骨细胞能量代谢的研究相对较少。因此,除了针对骨质疏松患者铁代谢及破骨细胞铁负荷,一些针对破骨细胞线粒体铁代谢的治疗靶点在未来具有极大的研究及应用前景。
