基因c06orf223通过PI3K/AKT/mTOR信号转导促进大肠癌进展的分子机制研究
2022-05-27焦璐熊鹰
焦璐 熊鹰
我国大肠癌的发病率和病死率均保持上升趋势。2015中国癌症统计数据显示,我国结大肠癌发病率、病死率在全部恶性肿瘤中均位居第5位,其中新发病例37.6万,死亡病例19.1万[1]。雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)是PI3K/AKT通路下游的一种重要的丝氨酸-苏氨酸蛋白激酶,其有整合细胞外多种信号刺激的作用,在体内参与多条信号通路的传导[2],其mTOR与细胞的生长以及凋亡等存在密切的关系。基因c06orf223与多种肿瘤的转移存在密切的相关性,c06orf223基因的高表达与肿瘤细胞的增殖、侵袭以及迁移的形成相关[3,4]。PI3K(磷脂酰肌醇3-激酶)通过肌醇脂质磷脂酰肌醇4,5-二磷酸[PI(4,5)P2]的磷酸化,形成第二信使分子磷脂酰肌醇(3,4,5)-三磷酸[PI(3,4,5)P3],其招募并激活包含pleckstrin同源结构域的蛋白质,导致下游信号事件对细胞凋亡至关重要扩散、生存和移徙。Akt亚型有一个N端PH(pleckstrin homology)结构域和一个激酶结构域,这两个结构域由39个氨基酸的铰链区分开。有催化活性的Akt调节多种底物的功能,这些底物参与细胞的存活、生长、增殖、代谢和蛋白质合成,其是细胞存活的关键介质,其失活与各种应激诱导的病理性细胞死亡和退行性疾病有关。PI3K/AKT/mTOR信号通路在细胞周期进程、细胞生长、存活、肌动蛋白重排和迁移以及细胞内囊泡转运等生物学过程中起着重要作用。本研究通过选取24例新鲜的大肠癌组织,从而探究基因c06orf223通过PI3K/AKT/mTOR信号转导促进大肠癌进展的机制。
1 资料与方法
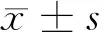
1.1 一般资料 选择2019年1月至2020年9月于我院进行手术切除的24例新鲜的大肠癌组织及其癌旁组织(全层肠壁),其中选择的癌旁组织距离癌组织约10 cm。患者中有男12例,女12例;年龄平均(46.82±5.42)岁;TNM分期均为Ⅲ~Ⅳ期57例。患者在手术切除前未做化疗和放疗治疗。实验所需的正常人肠上皮细胞系FHC均购自美国ScienCell研究实验室。大肠癌组织组(n=24)、癌旁组(n=24)、正常人肠上皮细胞组(n=24),其中大肠癌组织组又分为空白对照组(n=12)和抑制组(n=12),其中空白对照组不抑制PI3K/AKT/mTOR信号通路。抑制组则加入AKT抑制剂Honokiol。AKT抑制剂Honokiol浓度为100 μg/ml,与细胞数的比例是1∶0.01 μg/ml。
1.2 方法 收集的组织标本用无菌PBS洗涤,迅速放置于液氮冷冻,然后放在-80℃保存。将购买的细胞复苏后置于含有100 U/ml链霉素、100 U/ml青霉素、10%体积的胎牛血清的DMEM培养基中,于37℃,5.0%的CO2的细胞培养箱中培养,以备后续实验。
1.2.1 PI3K/AKT/mTOR信号通路在组织和细胞中激活情况的比较:采集患者大肠癌组织及其癌旁组织各5 g,研磨后3 000 r/min的条件下离心处理10 min,取上清液5 ml,Western blot检测蛋白的表达水平;提取总RNA并进行RT-PCR,20 g/L琼脂糖凝胶电泳50 min,紫外灯下用凝胶成像系统成像,用UVI图像分析处理系统进行吸光度扫描,以目的基因片段/GAPDH片段的条带灰度值比值来表示mTOR、PI3K与AKT mRNA相对含量。
1.2.2 过表达c06orf223促进PI3K/AKT/mTOR信号激活比较:取培养细胞转染过表达的c06orf223质粒,添加到培养基中,将细胞添加到上述培养基中,轻微晃动培养板,放置于培养箱中培养。按照1.2.1方法测定mTOR、PI3K与AKT蛋白和mRNA的相对含量。
1.2.3 下调c06orf223抑制PI3K/AKT/mTOR信号激活的比较:取培养细胞转染的c06orf223 siRNA质粒,添加到培养基中,将细胞添加到上述培养基中,轻微晃动培养板,放置于培养箱中培养。按照1.2.1方法测定mTOR、PI3K与AKT蛋白和mRNA的相对含量。
1.2.4 抑制PI3K/AKT/mTOR信号降低大肠癌细胞増殖能力的比较:将对数生长期的培养细胞加入96孔细胞培养板中,同时添加100 μl的细胞培养液和AKT抑制剂,将96孔板置于37℃,5.0%的CO2培养箱中培养,当培养时长达到0、24、48、72 h时取出细胞培养板。然后在每孔中添加10 μl的MTT溶液,于37℃环境中反应4 h。取上清溶液并添加150 μl的DMSO溶液,孵育10 min。在470 nm波长下测定OD值,OD值越大则表示细胞的增殖能力越强。
1.2.5 抑制PI3K/AKT/mTOR信号降低大肠癌细胞侵袭能力的比较:细胞侵袭能力通过Transwell小室进行测定。取100 μl浓度为3×105个/ml的培养细胞添加到Transwell小室上室中,于下室中添加500 μl的含血清的培养基和AKT抑制剂。分别在培养0、24、48、72 h后用浓度为4.0%的多聚甲醛溶液固定细胞20 min,通过结晶紫溶液染色20 min。于放大倍数为400的显微镜下观察细胞的侵袭数目。
2 结果
2.1 PI3K/AKT/mTOR信号通路在组织和细胞中激活情况比较 3组PI3K/AKT/mTOR信号通路相关蛋白表达情况比较,正常肠细胞系最高,大肠癌组织最低,差异有统计学意义(P<0.05)。见表1,图1、2。
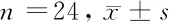
表1 PI3K/AKT/mTOR信号通路在组织和细胞中激活情况比较

图1 组织和细胞中PI3K/AKT/mTOR通路mRNA表达
2.2 过表达c06orf223促进PI3K/AKT/mTOR信号激活的比较 大肠癌细胞中转染c06orf223,Western blot检测检测细胞中PI3K/AKT/mTOR信号相关蛋白表达变化。结果发现,过表达大肠癌细胞中的PI3K、AKT和mTOR的磷酸化水平较大肠癌细胞升高(P<0.05)。见表2。

图2 组织和细胞中PI3K/AKT/mTOR通路蛋白表达
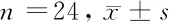
表2 过表达c06orf223促进PI3K/AKT/mTOR信号激活比较
2.3 下调c06orf223抑制PI3K/AKT/mTOR信号激活比较 大肠癌细胞中转染下调c06orf223,Western blot检测检测细胞中PI3K/AKT/mTOR信号相关蛋白表达变化。结果发现,下调基因大肠癌细胞中的PI3K、AKT和mTOR的磷酸化水平较大肠癌细胞降低(P<0.05)。见表3。
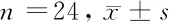
表3 下调c06orf223抑制PI3K/AKT/mTOR信号激活比较
2.4 抑制PI3K/AKT/mTOR信号大肠癌细胞増殖能力比较 大肠癌细胞经过1 μm的AKT信号抑制剂处理以后,经Transwell小室检测抑制组细胞増殖能力较空白对照组下降(P<0.05)。见表4。
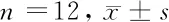
表4 抑制PI3K/AKT/mTOR信号大肠癌细胞増殖能力比较
2.5 抑制PI3K/AKT/mTOR信号大肠癌细胞侵袭能力比较 大肠癌细胞经过1 μm的AKT信号抑制剂处理以后,经Transwell小室检测抑制组细胞侵袭数目较空白对照组降低(P<0.05)。见表5。
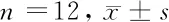
表5 抑制PI3K/AKT/mTOR信号大肠癌细胞侵袭能力比较
3 讨论
大肠癌是最常见的消化道恶性肿瘤之一,在我国发病率和病死率均呈上升趋势[5-7]。我国最常见的是大肠癌其发病率目前占到了消化道癌症总发病率的85%,临床上主要表现为便秘、腹泻和便血等症状,严重者可及机生命[8-10]。磷脂酰肌醇3激酶(P13K)是一种位于胞质的脂质激酶;AKT,又称蛋白激酶B,作为PI3K下游的一个重要的靶激酶,其是c-AKT表达编码的一种丝氨酸/苏氨酸蛋白激酶[11]。mTOR可以通过AKT发生直接或者间接的磷酸化反应,从而激活,磷酸化mTOR则不仅能够通过上调细胞周期素加速细胞周期,同时还可以通过清除泛素蛋白抑制自噬的发生[12]。基因c06orf223是近年来发现的与大肠癌发生发展存在相关行的基因,属于鼠源性基因启动子的转录抑制因子,该基因间接调控着PI3K/AKT/mTOR信号通路,最终抑制细胞的增殖以及侵袭能力[13]。本研究结果显示,过表达的c06orf223基因会促进PI3K/AKT/mTOR信号激活,而通过抑制PI3K/AKT/mTOR信号会降低大肠癌细胞侵袭和增殖能力。基因c06orf223可以通过调控PI3K/AKT/mTOR信号通路降低大肠癌细胞的増殖和侵袭能力。
本研究表明,PI3K/AKT/mTOR信号通路对大肠癌细胞的增殖和侵袭能力的形成至关重要,PI3KAkt信号通路会引发一系列的癌细胞的相关变化。PI3KAkt信号通路与Wnt/β-catenin信号通路存在较大的联系,因为Wnt/β-catenin信号通路是大肠癌细胞增殖和分化过程中重要的信号通路,该通路功能的强弱程度与癌细胞的形成量的多少有关[14]。当AKT的T308和Ser473位点被3-磷酸肌醇依赖性蛋白激酶1和mTORC2激活并磷酸化后,AKT便能够立即从胞质内转移到细胞膜上,进而被活化成P-AKT,而活化后的P-AKT蛋白能够再次通过调控多种细胞转录因子,从而发挥自身的作用,例如能够促进细胞的增殖和抵抗细胞凋亡现象的发生,同时还能促进细胞的侵袭转移等生物学作用[15]。磷酸化的AKT复合体可激活mTORC1,mTORC1磷酸化后又可激活其直接作用底物磷酸化核糖体蛋白S6激酶和真核生物始动因子4E结合蛋白1,进行下一级联反应,控制细胞翻译、核糖体生物合成、代谢等重要的生理功能。
肿瘤的发生发展是由于不同的基因在不同时期的表达以及功能出现紊乱而引起的复杂的病理性过程。许多促癌基因、抑癌基因以及与癌症发展存在相关性的基因的激活或者异常失活均是肿瘤发生的基础。因此,在研究肿瘤通路方面寻找新的相关基因对于阐明肿瘤的发病机制以及诊断、预防和治疗均有重要意义。有研究发现了AKT与c06orf223可能相互作用的证据并且其功能上可能与c06orf223协同,表明c06orf223可能为调控AKT的表达的重要[16-18]。并且通过研究与c06orf223直接和间接作用的蛋白所在信号通路,预测出c06orf223可能参与的PI3K/AKT/mTOR信号通路,且与大肠癌的发生发展密切相关[19,20]。
综上所述,基因c06orf223能够通过降低大肠癌细胞侵袭和增殖能力,进而缓解大肠癌的发生发展,其机制可能与PI3K/AKT/mTOR信号通路有关。而相关的基因功能序列以及作用靶位点仍有待进一步研究。
