激素对H型血管的抑制作用与骨质疏松症发病的探讨
2022-05-27张鑫张晓峰徐西林李小冬李志刚王政春张宁
张鑫 张晓峰 徐西林 李小冬 李志刚 王政春 张宁
1.黑龙江中医药大学研究生院,黑龙江 哈尔滨 150040 2.黑龙江省中医药管理局,黑龙江 哈尔滨 150040 3.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150040
骨质疏松症是一种成因复杂的慢性代谢性骨病,其特征是骨组织微结构的恶化、骨量减少,导致骨的脆性增加和骨折的易感性[1]。根据国际骨质疏松基金会的最新统计[2],目前在世界范围内骨质疏松症的患者大约有2亿多人。骨质疏松症是一种无声的疾病,在骨折发生前症状并不明显,到骨折发生时就会导致严重的继发健康问题,甚至死亡[3],给患者及其家庭乃至社会带来巨大负担,逐渐成为一个社会性问题。
骨质疏松症分为原发性和继发性骨质疏松症,原发性骨质疏松症多见于老年人和绝经后妇女,而继发性骨质疏松症最常见的病因之一则是糖皮质激素(glucocorticoid,GC)的使用[4]。使用GC治疗疾病的同时其对骨骼的不良反应与骨质疏松症的发生密切相关[5],虽然人们对糖皮质激素性骨质疏松症(glucocorticoid induced osteoporosis,GIOP)的认识有所增加,但仍然还有很多机制尚未阐明[6]。H型血管的概念及其成骨成血管作用的提出为GIOP发病机制的研究提供了新的方向。GC通过抑制调控H型血管形成的因素[7]如血小板衍生生长因子BB (PDGF-BB)、轴突导向分子(SLIT3)、缺氧诱导因子1-α(HIF-1α)、血管内皮生长因子(VEGF)以及Notch信号通路等,抑制其成骨成血管作用而导致GIOP。故本文将GC抑制H型血管形成进而抑制其成骨成血管作用最终导致骨质疏松症的可能机制系统综述如下。
1 H型血管的成骨成血管偶联作用
2014年Kusumbe等[7]提出一种新的与成骨相关的毛细血管亚型——H型血管,其主要表现为干骺端柱状管、弓形和内膜内皮细胞CD31(也称为PECAM1)和Emcn强阳性,因此将H型血管定义为CD31和内源性黏蛋白的高表达(CD31hiEmcnhi),其位于干骺端生长板以及骨干骨膜和骨内膜附近,被证实具有诱导骨形成的能力,在成骨和成血管偶联过程中的作用至关重要[8]。
H型血管概念的提出将调控骨代谢的“二元”调控理论(成骨细胞和破骨细胞)发展丰富为“三元”调控理论(新生血管-成骨细胞-破骨细胞)[9]。H型血管是骨内特殊亚型,被表达转录因子Osterix+(一种有效的骨形成启动子,可分化为成骨细胞和骨细胞)的骨祖细胞密集包围。H型血管可以通过产生刺激骨髓中骨祖细胞增殖和分化的因子,积极地指导骨形成[10-11]。并且H型血管可以调节骨骼的血管密度,维持存在于骨骼血管周围的骨祖细胞的活性,促进血管新生和骨形成。此外,H 型血管是骨再生重要的调控因素,具有调节成骨细胞分化促进骨形成的功能。骨骼特有的H 型血管将调节长骨生长、骨骼动态平衡的血管生成过程和H 型微血管内皮细胞分泌血管因子的过程联系起来,这种骨生成和骨血管生成之间在时间与空间上的密切关系被称为“成骨成血管偶联”[12],是骨稳态调节的关键因素之一。Zhu等[13]认为H型内皮细胞支持骨成熟和再生,为接近特殊亚型血管的骨祖细胞提供营养,维持骨祖细胞的生长、增殖和骨的发育。
目前已知调控H型血管形成的因素包括[7]PDGF-BB、SLIT3、HIF-1α、VEGF、Notch信号通路以及其他潜在的因素等。正向刺激这些因素就可能促进H型血管的形成。反之,抑制这些因素就可能抑制H型血管形成,使其成骨成血管偶联作用被限制,导致血管和骨生成减少,影响正常的骨代谢平衡而诱发骨质疏松症。
2 GC抑制H型血管的生成
GC能够抑制H型血管生成,抑制其成骨成血管偶联作用。Peng等[14]发现GC处理小鼠股骨远端时,H型血管受到显著抑制,随着时间的推移这种抑制作用更加明显。GC首先损害H型血管成熟,并在长期暴露后损害血管生成。通过CD31hiEmcnhi血管长度的量化发现,H型血管在GC处理后第2、4和6周分别减少51%、21%和42%,延长GC给药时间H型血管的生成被抑制的更为严重。此外,与对照组相比,GC使H型血管周围表达转录因子Osterix+的骨祖细胞数量明显减少。H型血管与Osterix+骨祖细胞的紧密结合使血管生成与骨生成紧密结合,而GC破坏了H型血管的稳定和成熟,抑制骨血管生成,导致骨形成减弱,与GIOP的发病密切相关。
至今已经确定了几个因素可以调节H型血管的形成和成骨[14]:破骨细胞、成骨细胞、软骨细胞和内皮细胞分泌的诱导内皮细胞增殖、血管聚集和稳定的因子,如PDGF-BB和SLIT3[9-10]等;ECs分泌的促进血管聚集、稳定和骨形成的因子,如HIF-1α、VEGF和Notch等。GC对H型血管的抑制作用已经明确,但是其具体机制尚未进行系统阐述,故本文第三部分从GC对调控H型血管形成因素的影响来阐述GC对H型血管生成的抑制作用。
3 GC对调控H型血管形成因素的影响
3.1 GC对PDGF-BB的影响
Xie等[9]发现CD31hiEmcnhi血管亚型(H型血管)的形成能够被破骨前体细胞(POC)分泌的PDGF-BB诱导。POC是旁分泌PDGF-BB的主要来源,在骨建模和重构过程中,PDGF-BB招募内皮细胞形成H型血管,刺激1-磷酸鞘氨醇(S1P,鞘氨醇激酶1磷酸化的产物)的分泌,继而刺激成骨细胞的分化和功能表达,促进骨形成,最终将骨膜环境中的血管生成与骨形成结合。
TRAP+细胞系中PDGF-BB的缺失会削弱其对H型血管形成的诱导作用,干扰血管生成与骨形成的耦合,减少骨髓和骨膜中的血管生成,从而减少骨形成[15]。Yang等[16]发现泼尼松龙给药后的小鼠初级和次级松质骨内的H型内皮细胞和成骨细胞的数量均减少。Peng等[17]研究发现,GC暴露小鼠与对照组小鼠相比,PDGF-BB阳性的TRAP+细胞百分比在GC暴露2周时开始下降,在4周和6周时进一步下降。Jia等[18]认为过量的GC会抑制破骨细胞生成,不仅降低了POC的数量,而且降低了PDGF-BB的转录,提示GC可能通过抑制破骨-血管生成耦合因子而影响血管生成。Chung等[19]和Chow等[20]认为NF-kB信号通路与PDGF-BB的产生有关,是诱导PDGF-BB表达的必要条件。GC与胞浆中的GC受体(GR)结合,形成GC/GR复合体并转运到细胞核调控基因转录。由于GC/GR的反抑制作用可由NF-kB或激活蛋白1 (AP-1)介导[21],因此,GR/NF-kB信号通路可能是GC抑制PDGF-BB的潜在机制。过量的泼尼松龙显著降低核因子NF-kB (P65)与Pdgfb启动子的结合和PDGF-BB的合成。POC是PDGF-BB形成内皮血管的主要来源,而PDGF-BB的合成被GR/NF-kB反抑制,则会进一步导致H型血管的形成被抑制。
近年来发现了一些化合物对PDGF-BB的合成有积极作用,进而促进H型血管的生成。这些化合物可以用来改善GC对PDGF-BB合成及H型血管生成的抑制作用,达到促进H型血管和骨生成治疗GIOP的目的,但距离临床应用还有待研究。如:核苷(Nuciferine,一种天然来源的生物活性化合物)[22]通过抑制丝裂原活化蛋白激酶保存TRAP+破骨细胞,减少多核破骨细胞的形成,使PDGF-BB 的浓度和H 型血管的数量增加。Harmine(一种β-卡波林生物碱)[23]可以增强POC分泌PDGF-BB,诱导H型血管的形成。Erk抑制剂NSC-87877[24]可以阻止POC分化为成熟的破骨细胞并增加PDGF-BB的产生,诱导H型血管的形成。此外,GIT1、卵磷脂以及骆驼蓬碱(一种β-Caroline 生物碱)都可以通过直接或间接调节破骨细胞以调控PDGF-BB的生成促进H型血管的成骨成血管偶联作用。
3.2 GC对HIF-1α、VEGF的影响
在血管生成-成骨耦合的过程中,HIF-1α及其靶基因VEGF是关键的调控因子。HIF-1α受缺氧信号调控,机体缺氧时,HIF-1α表达增加,使促血管生长因子以及VEGF的表达增加,诱导血管内皮细胞增殖促进血管生成[25-27]。H型血管内皮细胞和骨祖细胞增殖与HIF-1α的表达水平呈正相关。另外,HIF-1α信号调控 Gli1+细胞也影响H型血管形成[28]。MSC亚群Gli1+细胞与H型血管形成耦合并调节H型血管生成。在骨缺损或骨折愈合早期,愈合区 Gli1+细胞明显上调并引导H型血管形成。另一方面,VEGF作为HIF-1α的靶向基因,由HIF-1α直接调控,是最具特征的促血管生成因子,对血管生成有着不可替代的作用[29]。
HIF-1α在调节H型血管和骨形成过程中发挥关键作用,当HIF-1α的表达被抑制时H 型血管及骨形成同样被抑制。Weinstein等[30]证明GC过量可抑制HIF-1α和VEGF的表达,影响血管体积和表面积。HIF-1α和VEGF的下调使特定H型血管亚型对骨细胞的营养和氧供应减少,影响其成血管成骨偶联作用。Hata等[31]认为地塞米松对HIF-1α和HIF-1α-DNA结合活性均有明显抑制作用,并降低低氧和TNF-α依赖性诱导的透明细胞VEGF的表达。Lim等[32]认为GC诱导亮氨酸链(GILZ)的表达,而GILZ抑制缺氧诱导的COX-2和HIF-1α的表达。地塞米松上调GILZ的表达不仅抑制了缺氧诱导的COX-2表达,而且抑制HIF-1α的表达阻断了HIF-1通路。另一方面,GC抑制COX-2的表达,抑制了前列腺素E2 (PGE2)的产生。而PGE2是促进VEGF合成的关键物质,当PGE2的生成被抑制时VEGF的合成也被抑制[33-34]。因此,GC使HIF-1α及VEGF的表达均被抑制,阻碍了H型血管的生成,其成骨成血管偶联的作用难以发挥而导致GIOP。
Whitaker等[35]发现甲磺酸去铁胺(DFM)可以抑制脯氨酰-4-羟化酶对HIF-1α的降解,维持体内HIF-1α的水平,对H型血管生成有间接的促进作用。Gao等[36]通过研究发现川芎嗪局部给药通过AMPK-mTORC-HIF-1α信号通路直接诱导衰老小鼠H型血管形成及改善骨稳态;Yang等[37]研究发现miR-497~195通过增强内皮Notch和HIF-1α活性诱导H型血管形成。Peng等[38]研究结果表明缺氧模拟剂二甲基草酰甘氨酸激活了HIF-1α信号通路,进一步激活了Wnt/β-catenin 信号通路,并增强了MSC成骨分化,促进血管生成和成骨作用。这些药物及信号通路的发现对调控H型血管生成有重要意义,将来有可能是临床治疗GIOP新的药物靶点。
3.3 GC对SLIT3的影响
SLIT3的主要来源仍有争议,骨髓微环境中可能存在多种来源的SLIT3。成熟的成骨细胞和破骨细胞均可分泌SLIT3[7]。成骨细胞来源的SLIT3是诱导H型血管和骨形成强有力的调节因子,可以间接增加H型血管内皮细胞数量,是促进H型血管和骨形成的重要因素[15,39]。SLIT3基因缺失时骨骼H型血管内皮细胞减少,成骨细胞活性降低,骨形成减弱。
GC对SLIT3有无直接抑制作用继而抑制H型血管的成骨成血管偶联作用尚不明确。成骨细胞和破骨细胞均可分泌SLIT3,根据GC影响成骨细胞和破骨细胞分化的作用,有充分理由提出假设:GC通过抑制成骨细胞和破骨细胞的分化而抑制SLIT3的分泌,阻碍了H型血管的形成。但是该假设需要相关实验进行验证。GC对成骨细胞信号通路:如过氧化物酶体增殖激活受体γ2 (PPARγ2)、kruppel样因子15 (KLF15)、CCAAT/增强子结合蛋白-α(C/EBPα)、脂肪细胞蛋白2 (aP2)和典型WNT信号通路等,有几种直接影响[40-41]:GC上调PPARγ2、KLF15、C/EBPα和aP2导致多能前体细胞向脂肪细胞而不是成骨细胞分化,减少了成骨细胞数量。并且,高于生理剂量的GC不仅导致成骨细胞相关基因表达丧失和凋亡增加[42],也会抑制破骨细胞生成[20,43-44]。GC虽然可以提高破骨细胞的寿命,但是却会使破骨细胞的骨架被破坏,导致破骨细胞的活性降低而影响其分泌SLIT 3。
直接注射SLIT 3的重组片段-LRRD 2,可以通过提高SLIT 3的表达进而调控H型血管的生成[7]。此外,对成骨细胞及破骨细胞的生成及活性进行靶向调控促进SLIT3的表达也有可能成为调控H型血管生成的有效途径,但是仍需进一步研究。
3.4 GC对Notch信号通路的影响
Notch信号通路对血管发育和重构有重要的调节作用,其在成骨成血管偶联中的重要作用也被Ramasamy等[11]证实。Notch 信号通路在体内骨骼系统成骨和血管生成过程中发挥着关键作用[45],也是调控MSC向成骨细胞分化的重要机制。Notch信号除了通过VEGF受体调节血管生成之外[46],还作用于H 亚型血管内皮细胞,使其增殖并分泌形态蛋白拮抗剂(Noggin)。Noggin能促进骨祖细胞的增殖、分化以及软骨细胞的成熟、肥大。骨祖细胞和软骨细胞均可分泌大量的VEGF诱导血管出芽,促进内皮细胞的成熟和血管形成。当Notch 信号增强时,H型血管、Runx+骨祖细胞的数量以及Noggin的分泌随之增加。反之,在Notch 信号减弱时,H型血管、Runx+骨祖细胞的数量以及Noggin的分泌也随之减少。因此,Notch 信号通路在连接H 型血管内皮细胞和成骨作用之间有着关键作用[46]。
任广军等[47]发现,Notch 受体和配体突变的小鼠骨内血管构建和软骨细胞会发生异常。这些模型小鼠还会出现骨生成减少,骨小梁减少以及骨量缺失等变化。MSC的成骨分化可以被Notch 信号通络所激活,但是细胞内成骨相关基因的表达在Notch 信号通路被阻断后也随之减弱[48]。徐莹等[45]则通过实验验证了GC对Notch 信号通路的表达具有明显的抑制作用。Notch 信号通路被抑制后,其连接H型血管内皮细胞和成骨分化的关键作用难以发挥而成为GIOP发生的潜在机制之一。
Notch信号可以被血流调节,H型血管直径小,血流速度高,可刺激Notch信号的表达,而血流减少会降低对Notch信号的刺激使其表达降低,导致骨体积减少和血管生成缺陷[49]。以该理论作为基础,可以通过探讨GC对血流的影响从另一方面间接证明GC对notch信号的影响。GC导致骨内压升高、脂肪栓塞、血管内皮细胞损伤、血液高凝状态;诱导BMSC向脂肪细胞分化,导致骨内脂肪堆积,造成髓内血窦、毛细血管及静脉受压使血流受阻,引发微循环障碍,导致组织血流减少[50],血流速度减慢等。据此,可以科学地提出假设:GC导致血流减少和血流速度减慢等可能是导致notch信号减弱的另一原因。但该假设能否成立以及与GIOP的发病是否相关还需要进一步的研究来证实。
3.5 GC对其他影响H型血管形成潜在因素的影响
除了上述影响H型血管生成的因素外,还有一些潜在的因素对H型血管的生成有一定的影响。如糖原合成激酶3β(GSK-3β)通过其激酶活性作用,参与 Wnt信号通路,对成骨成血管进行调节[51];H型血管通过RANKL-RANK信号支持血管相关破骨细胞,而RANKL-RANK信号反过来调节H型血管的吻合[7];此外,基质金属蛋白酶(MMPs)可调节细胞外基质,调节血管生长或退行,从H型ECs中释放出来的MMP-9对于骨纵向生长过程中软骨的吸收至关重要。已经可以明确的是GC可以抑制Wnt信号通路抑制GSK-3β对H型血管形成的促进作用而抑制H型血管的形成。但是,GC对上述其他可以调控H型血管形成因素的影响以及这些因素与GIOP的发病是否有关还需要进一步研究来明确。
4 GC抑制H型血管与骨质疏松症
生理状态下,机体内的骨形成与骨吸收处于微妙的动态平衡中,而骨质疏松症的发生则是由于多种原因削弱了骨形成,增加了骨吸收,使骨形成与骨吸收的代谢失衡[52]。本文第一部分详述了H型血管在血管和骨生成中的重要作用;第二部分说明了GC抑制H型血管的形成;第三部分详述了与GC抑制H型血管形成相关的可能机制。将第一、二部分和第三部分结合起来,可以得出GC抑制H型血管形成,抑制其成骨成血管偶联作用,使血管和骨生成减少,破坏骨代谢平衡导致骨质疏松症发生的结论。见图1。
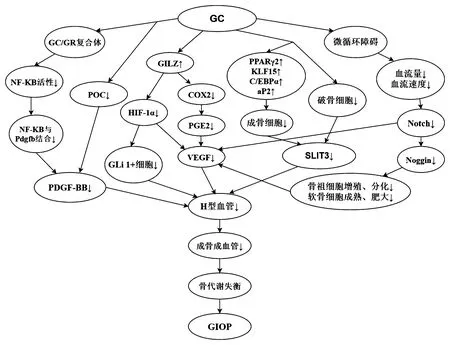
图1 GC影响H血管导致GIOP发病的机制Fig.1 The mechanism of GC affecting H-type vessels leading to GIOP
H型血管调控的血管生成与成骨耦合对骨稳态至关重要。Nakashima等[53]认为H型内皮细胞可能有利于骨质疏松症的治疗。但是当H型内皮细胞被抑制时,其成骨成血管偶联的作用难以发挥,随之导致骨质疏松症的发生。因此,GC对H型内皮细胞的抑制可能是GIOP发生的重要机制。王亮等[54]发现骨质疏松组患者的 H 型血管 CD31和 EMCN染色阳性极弱,且其H型血管分布呈点状、窦状,明显较正常组稀疏、凌乱。骨质疏松组患者骨切片中H 型血管的面积与总血管面积的比值较对照组明显降低。这些结果均能表明 H 型血管的面积与骨密度存在着密切关系,也进一步证明了 H 型血管的生成被抑制与骨质疏松症的发病有着重要联系。Kusumbe等[7]和Xie等[9]还发现,H 型血管与骨代谢之间存在着密切联系,即“偶联关系”。H 型血管减少后会使骨形成与骨吸收的代谢失衡,导致骨量下降,继而引发骨质疏松症,这被认为是对以往“骨量变化与成骨细胞和破骨细胞动态平衡、钙丢失、维生素 D 减少相关”等骨质疏松发病理论的重大补充[55]。Wang等[56]报道,H型血管的丰度是老年人和骨质减少患者骨丢失的一个重要指标[13]。骨质疏松症患者H型血管被骨祖细胞包围,数量减少,这些发现具有直接的临床意义。H型血管的丰度是骨丢失的早期标志,是通过诱导H型血管改善骨质量的潜在靶点。GC抑制了H型血管的形成,其成骨成血管偶联作用被削弱,骨生成减弱,骨代谢的平衡被破坏,造成骨量丢失,最终诱发GIOP。
综上所述,GC可以抑制破骨前体细胞释放PDGF-BB、抑制HIF-1α、VEGF的表达以及抑制Notch信号通路等直接影响H型血管的生成。另外,通过阅读大量文献基于现有理论可以有根据地认为GC通过抑制成骨细胞和破骨细胞的分化抑制SLIT3的分泌,最终导致了在该通路上H型血管的生成被抑制。此外,还有一些其他影响H型血管生成的潜在因素如GSK-3β、RANKL-RANK信号、MMPs等,GC对这些影响H型血管生成潜在因素的作用以及这些因素被抑制与GIOP的发病是否相关仍需要进一步研究。
GIOP是使用GC治疗疾病过程中一个棘手的并发症,GC对H型血管生成的抑制作用,影响到其成骨成血管偶联,导致血管生成和骨生成受到干扰,骨代谢的动态平衡被打破,是GIOP发病的重要因素。本文将GC对调控H型血管生成因素的作用进行了系统综述,得出了GC抑制H型血管形成导致骨质疏松症的结论。但是GIOP的机制复杂,目前还存在诸多假说,还需要进行更多的研究来明确。
目前大多数用于治疗骨质疏松症的药物是骨吸收抑制剂和骨量稳定剂,存在着一定的局限性,难以达到理想的治疗效果。因此,研究H型血管在GIOP中的作用是一个很有前途的方向。H 型血管可以促进成骨,对其成骨成血管耦联的深入研究可以为血管-骨骼代谢相关疾病提供新的治疗靶点,也为治疗GIOP提供新的思路。
