UDT1/TDR基因过表达对水稻育性的影响
2022-05-27宋露唐佳琦田晓杰卜庆云
宋露,唐佳琦,田晓杰,卜庆云
(1.中国科学院 东北地理与农业生态研究所,哈尔滨 150081;2.中国科学院大学,北京 100049)
0 引 言
水稻是重要的粮食作物,世界上一半以上人口都以其为主食。而水稻的产量与育性密切相关,其雄性生殖器官正常的形态结构和发育是水稻繁衍过程的关键保障[1]。水稻雄性不育(MS,male sterility)是雄性器官发育异常,花粉不具有受精活力,但雌性器官发育和功能均正常的现象[2]。
在水稻雄性生殖器官花药的结构中,花药壁由外到内分别由表皮层、药室内壁、中层和绒毡层这4层不同的细胞组成。绒毡层位于花药壁的最内层,直接与小孢子接触,绒毡层的正常发育能保障花粉母细胞减数分裂周期正常完成,在发育后期它分泌胼胝质降解酶来分解胼胝质,使小孢子释放出来,并为花粉粒的进一步成熟提供营养,绒毡层细胞向雄配子体运输物资的直接通道是乌氏体[3]。绒毡层的发育是一个连续的过程,主要分为2个阶段:分化形成[4]和退化降解[5]。绒毡层在小孢子母细胞形成期初步形成,由次级壁细胞经过两次分裂后形成于花药壁的最内层[4];从小孢子母细胞减数分裂初期至小孢子早期,绒毡层细胞质颜色开始逐渐加深,并出现细胞凋亡信号,在小孢子中期绒毡层开始退化降解,最终在成熟花粉期完全消失[5]。调控绒毡层发育的基因大多编码转录因子,通过直接或间接调控绒毡层的分化形成或退化降解,进而使绒毡层的生理功能出现异常,最终导致小孢子发育受阻,引起雄性不育。因此,解析相关转录因子的功能是了解水稻绒毡层发育调控的重要部分。
研究发现,bHLH(basic helix-loop-helix)转录因子是调控水稻绒毡层发育过程中重要的转录因子[6]。其中,bHLH类转录因子UDT1(UNDEVELOPEDTAPETUM1)是调控水稻绒毡层早期发育的关键基因,它参与次生壁细胞向成熟绒毡层的分化过程。在减数分裂前,突变体udt1-1的花药壁和小孢子母细胞发育相对正常,但减数分裂期绒毡层异常空泡化,小孢子不能生成,绒毡层细胞降解延迟,最终导致无花粉型雄性不育,且无法结出可育籽粒[7]。另一编码bHLH转录因子的TDR(TAPETUMDEGENERATIONRETARDATION)通过正向触发绒毡层细胞程序性死亡(Programmed cell death,PCD)来调控水稻绒毡层的发育和降解,突变体tdr表现为绒毡层和中层PCD滞后以及花粉壁的缺陷,进而导致雄性完全不育[9]。UDT1和TDR都通过调控绒毡层标记基因(OsC4、OsC6和OsCP1)的表达来调节绒毡层的发育和降解,这些基因在udt1和tdr突变体中显著下调[8-9]。EAT1(ETERNALTAPETUM1)同样是bHLH类转录因子,EAT1可以在转录水平调控天冬氨酸蛋白酶(Aspartic protease,ASP)的表达,并可与TDR相互作用,作用于TDR的下游。eat1-1突变体的绒毡层细胞增厚,乌氏体形状不规则,花药发育和小孢子形成过程异常终止,造成雄性不育[10]。编码bHLH类转录因子的TIP2(TDRINTERACTINGPROTEIN2)的突变体tip2影响了花药的早期发育,其花药壁内药室内壁、中层、绒毡层三层细胞不能正常分化形成,后期中层和绒毡层PCD中断,导致小孢子母细胞发育停滞,造成雄性完全不育[11-12]。这些研究结果表明,bHLH类转录因子影响水稻绒毡层的发育,对水稻花粉的育性产生了很大的影响。除编码bHLH类转录因子的基因外,参与水稻花药绒毡层发育调控的基因还有OsGAMYB[13-14]、PTC1(PERSISTENTTAPETALCELL1)[15]、DTC1(DEFECTIVETAPETUMCELLDEATH1)[16]、API5(APOPTOSISINHIBITOR5)[17]、EDT1(EARLIERDEGRADEDTAPETUM1)[18]、MTR1(MICROSPOREANDTAPETUMREGULATOR1)[19]、TIP3(TDRINTERACTINGPROTEIN3)[20]、BM1(BAYMAX1)[21]、OsMADS3[22]、OsMADS8[23]、OsAGO2[24]、OsALDH2b[25]等。
前人研究已经表明了UDT1/TDR功能的缺失会严重影响绒毡层的发育进而影响水稻的育性[7-9],然而,UDT1/TDR过表达植株是否会影响水稻的育性目前尚不清楚,为了进一步分析UDT1/TDR基因对水稻育性的影响,本研究利用植物基因过表达技术,分别对水稻UDT1和TDR基因进行过量表达,通过对获得的过量表达转基因株系进行表型观察,明确了UDT1和TDR的过表达会导致水稻育性降低,丰富了UDT1/TDR对水稻育性的调控机理,也为水稻高产、稳产育种奠定理论基础。
1 材料与方法
1.1 植物材料和菌株
本研究以粳稻“龙粳11”为实验材料,获得过表达转基因材料。植株在哈尔滨(北纬45°)的室外,以25 cm×25 cm的植物间距种植于盆栽盒,自然长日照条件下生长。实验所用大肠杆菌(Escherichiacoli)菌株TOP10,农杆菌(Agrobacteriumtumefaciens)菌株EHA105和植物载体PC1390U均由中国科学院东北地理与农业生态研究所水稻分子育种实验室保存。
1.2 UDT1/TDR基因的过表达载体构建
利用超纯总RNA提取试剂盒(杭州新景生物试剂开发有限公司)提取龙粳11幼穗的RNA,反转录成cDNA(逆转录试剂盒,Takara公司)作为PCR扩增模板。在Rice Genome Annotation Project网站(http://rice.uga.edu/)下载UDT1(LOC_Os07g36460)、TDR(LOC_Os02g02820)的基因序列并通过Primer 5设计引物序列。采用引物UDT1-CDS-F和UDT1-CDS-R(表1)扩增UDT1基因的编码区(coding sequence,CDS)序列;采用引物TDR-CDS-F和TDR-CDS-R(表1)扩增TDR基因的CDS序列,PCR扩增产物与经BamHI和KpnI酶切的PC1390U载体片段连接构建载体,转化大肠杆菌菌株TOP10,挑取单菌落于37 ℃,160 r·min-1振荡培养12 h后,利用快速质粒DNA小量试剂盒(杭州新景生物试剂开发有限公司)提取质粒,将酶切鉴定正确的质粒送交吉林库美生物有限公司测序,测序验证无误的即为成功构建的过表达载体。

表1 本研究中所用的引物
1.3 农杆菌介导的水稻遗传转化
将构建的UDT1、TDR过表达载体转化农杆菌EHA105,并利用农杆菌介导法对野生型龙粳11水稻愈伤组织进行遗传转化,经过浓度为60 mg·L-1的潮霉素(Hygromycin,Hyg)筛选抗性愈伤组织,分化获得T0代过表达转基因植株。
1.4 转基因植株分子生物学检测
将T0代转基因植株种植于室外盆栽盒中,对每株T0代植株提取叶片的全基因组DNA,通过潮霉素基因特异引物HPT(表1)进行PCR检测,产物大小为900 bp的植株为阳性转基因植株,种植并收获种子用于下一代种植。将T0代收获的种子室温浸种1 d,37 ℃催芽2 d,育秧后种植于室外盆栽盒中,在苗期提取T1代植株叶片基因组DNA,继续利用引物HPT鉴定,选择鉴定为阳性的株系用于后续试验。
1.5 T1代转基因植株UDT1/TDR基因转录水平表达检测
为了检测目的基因UDT1和TDR在野生型和过表达材料UDT1-OE/TDR-OE中的表达量,提取对照材料龙粳11和过表达转基因植株UDT1-OE/TDR-OE的RNA,逆转录成cDNA,采用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测目的基因表达量。实验设置3次技术重复。
1.6 转基因植株表型分析
颖花观察:水稻抽穗后开花前1 d,去掉小穗的颖壳,在显微镜(奥林巴斯SZX16)下观察雄蕊和雌蕊的颜色和形态。
花粉染色观察:水稻抽穗后开花前1 d,将样品固定在甲醛-乙酸-乙醇(FAA)溶液中,进行1% I2-KI(1%I2,8%KI,W/V)染色镜检,取穗部上中下各3个小穗进行观察。镜检时,打开颖壳,小心剥离出花药,置于载玻片上,滴加20 μL的I2-KI滴剂,用镊子捣碎花药,释放出花粉粒,于显微镜(奥林巴斯BX53)下观察花粉粒的活力。
成熟期穗部观察:成熟期观察水稻穗部的结实情况并统计结实率。
2 结果与分析
2.1 UDT1/TDR基因的过表达载体构建
采用PC1390U载体作为UDT1和TDR植物过量表达载体,该载体含有潮霉素植物选择标记基因,以组成型启动子CaMV35S驱动目的基因表达(图1A)。采用基因特异引物PCR(表1)分别扩增获得长度为704 bp(UDT1)和1659 bp(TDR)的目的条带,PCR产物与经BamHI和KpnI酶切的PC1390U载体片段连接,对重组质粒进行酶切检测,获得预期大小目的片段(图1B),表明目的片段已成功连入PC1390U空载体中。将构建成功的重组质粒进行测序验证后,转化到农杆菌EHA105中,用于后续的转基因实验。
2.2 水稻遗传转化及抗性植株分子生物学检测
采用农杆菌介导法转化野生型龙粳11,获得潮霉素阳性转基因T0代UDT1-OE植株15株,TDR-OE植株17株,对其中收获到种子的4个阳性UDT1株系和3个阳性TDR过表达株系继续繁殖进行实验(图1C),对4个阳性UDT1和3个阳性TDR过表达株系种植的T1代共90株进行潮霉素鉴定,其中阳性共76株,选择以上T1代阳性的植株进行后续的实验。
2.3 转基因植株UDT1/TDR基因转录水平表达检测
利用qRT-PCR方法检测野生型龙粳11和UDT1-OE/TDR-OE阳性过表达转基因株系T1代体内相应基因的表达水平,发现四个阳性UDT1过表达株系UDT1-OE-1、UDT1-OE-2、UDT1-OE-3、UDT1-OE-4体内UDT1表达水平均有不同程度的提高,分别提高了约6、10、44、54倍(图1D);三个阳性TDR过表达株系TDR-OE-1、TDR-OE-2、TDR-OE-3体内TDR表达水平均有不同程度的提高(图1E),分别提高了约90、150、210倍。

注:A:过表达重组载体PC1390U-UDT1/TDR示意图。LB为DNA左边界,Hyg为潮霉素抗性基因,CaMV 35S promoter为花椰菜病毒35S启动子,RB为DNA右边界;B:重组载体的双酶切鉴定(BamHI和KpnI)。1代表1390U-UDT1阳性单克隆,2代表1390U-TDR阳性单克隆,M为DNA标记;C:T0代植株转基因检测。1-4代表T0 代UDT1-OE阳性植株,5-7代表T0 代表TDR-OE阳性植株,8为阴性对照,9为阳性对照,M为DNA 标记;D-E:T1代表转基因阳性植株转录表达检测。LJ11为野生型,UDT1-OE-1~UDT1-OE-4为4个UDT1过表达转基因植株,TDR-OE-1~TDR-OE-3为3个TDR过表达转基因植株。
2.4 UDT1、TDR过表达转基因植株表型特征
2.4.1UDT1、TDR过表达转基因植株结实统计。观察UDT1-OE不同株系的结实率情况,发现UDT1过表达转基因植株结实率均有不同程度的降低。其中UDT1-OE-1、UDT1-OE-2结实率显著下降,分别为67.63%、63.54%,而UDT1-OE-3、UDT1-OE-4结实率几乎为0(图2A,B)。
观察TDR-OE不同株系的结实率情况,发现TDR-OE-1、TDR-OE-2、TDR-OE-3结实率均几乎为0(图2C,D)。因此,过表达UDT1、TDR会导致结实率的显著下降。
2.4.2UDT1、TDR过表达转基因植株花粉活力统计。I2-KI染色实验结果表明,野生型花药中充满饱满的深蓝色可育花粉,4个UDT1过表达UDT1-OE株系中,过表达倍数较低的UDT1-OE-1、UDT1-OE-2可育花粉粒比例显著下降,分别为73.6%、69.3%(图2E,F),而UDT1过表达倍数较高的UDT1-OE-3、UDT1-OE-4花药中无花粉粒释放(图2E,F),进而观察了其整个花药的染色情况,发现野生型花药中充满了深蓝色的可育花粉粒,而在UDT1-OE-3、UDT1-OE-4花药中观察不到任何花粉粒(图2E)。
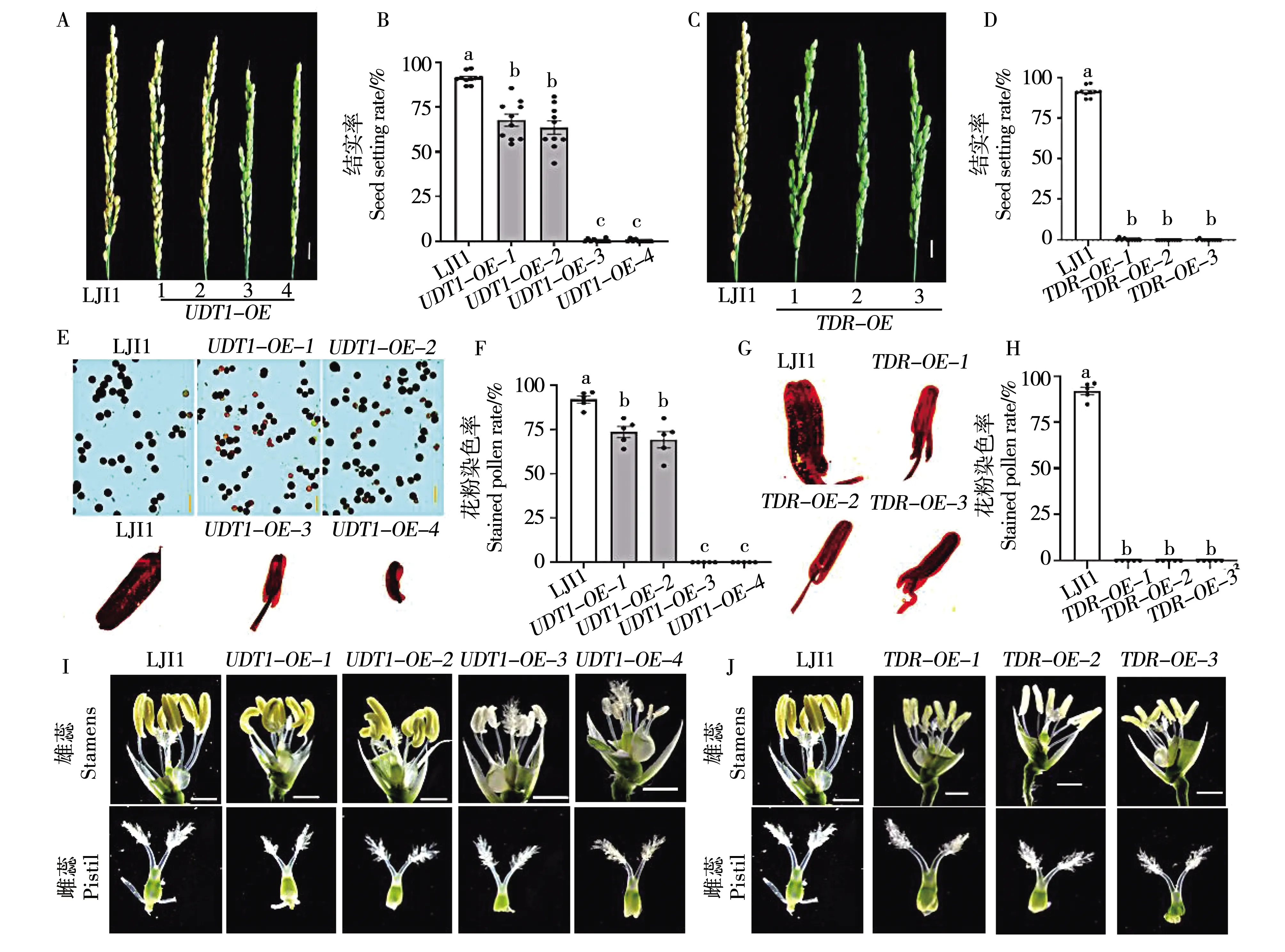
注:A-D,过表达转基因株系与野生型成熟穗部表型(A,C)及结实率(B,D)。标尺为1 cm,数据显示为平均值±标准误(n=10),统计学显着性差异用不同的小写字母表示(P<0.05,采用Tukey显着性差异检验的单因素方差分析)。E-H,过表达转基因株系与野生型的花粉育性(E,G)和花粉染色率(F,H)。(E,G),LJ11、UDT1-OE、TDR-OE的花粉或花药I2-KI染色,标尺为20 μm,数据显示为平均值±标准误(n=5),统计学显着性差异用不同的小写字母表示(P<0.05,采用Tukey显着性差异检验的单因素方差分析)。I-J,过表达转基因株系与野生型的颖花表型。上排图片为雄蕊表型,下排图片为雌蕊表型,标尺为1 mm。
观察TDR-OE不同株系的KI-I2染色情况,发现3个TDR过表达株系中均无花粉粒释放(图2G,H),随后观察了其整个花药的染色情况,发现野生型花药中充满了深蓝色的可育花粉粒,而在TDR-OE-1、TDR-OE-2、TDR-OE-3花药中均观察不到任何花粉粒(图2G)。UDT1、TDR的过表达会严重影响花粉活力进而影响水稻结实率。
2.4.3UDT1、TDR过表达转基因植株花药形态。在开花前1d取野生型及过表达株系UDT1-OE颖花,剥开内外颖壳,在解剖镜下进行花药形态特征观察。野生型花药饱满,直立于花丝上,长度较长,呈现为黄色(图2I);UDT1过表达转基因植株花药形态有不同程度的变化,其中UDT1-OE-1、UDT1-OE-2表现出明显的花药卷曲且变短,但颜色与野生型无明显差别(图2I),而UDT1基因表达量较高的UDT1-OE-3、UDT1-OE-4花药表现出严重的颜色发白,长度变短,皱缩卷曲,呈半透明的丝状(图2I)。而UDT1-OE雌蕊的表型与LJ11无区别(图2I),说明UDT1只对雄性生殖器官有影响。
同时观察过表达株系TDR-OE颖花,剥开内外颖壳,在解剖镜下进行花药形态特征观察。发现TDR过表达转基因植株花药颜色变浅,长度变短,表面皱缩,花药形态明显变差(图2J)。综上所述,过表达UDT1、TDR会对水稻花药的生长发育造成严重影响。
3 结论与讨论
本研究通过构建UDT1和TDR基因过量表达载体,以黑龙江优质粳稻品种龙粳11为背景材料,获得了的UDT1-OE及TDR-OE过量表达转基因水稻,通过I2-KI染色、花药形态观察及结实率统计明确了UDT1和TDR的过表达对水稻育性的影响。
水稻绒毡层的分化形成和退化降解是一个复杂的过程。根据前人对花粉产生过程的划分,将水稻花粉产生过程的时间节点分为小孢子母细胞形成期、小孢子母细胞减数分裂期、小孢子发育早期、小孢子发育中期、小孢子发育晚期、二胞花粉发育早期、二胞花粉发育晚期、成熟花粉发育期8个时期。在小孢子母细胞形成期,花药壁四层细胞分化形成;在小孢子母细胞减数分裂期,绒毡层的胞质开始形成浓缩状态;小孢子发育早期,绒毡层胞质呈完全浓缩状态;随着小孢子的逐渐发育,绒毡层逐渐变为带状,其在小孢子发育晚期呈瓦状;在二胞花粉发育早期,小孢子经过有丝分裂形成了生殖细胞和营养细胞,此时期的绒毡层仅余下残留组织;在成熟花粉发育期,淀粉粒等贮藏物完全充满了整个花粉粒,绒毡层完全退化消失,仅余下次生绒毡层壁[26-27]。绒毡层细胞的分化发育对小孢子的正常发育至关重要,且在小孢子和花粉发育后期,绒毡层细胞必须适时降解以便为小孢子提供充足的营养物质,促进小孢子和花粉粒的成熟,保证成熟花粉的释放。绒毡层的降解是一个细胞程序性死亡PCD的过程,PCD过程的提前或延迟都会造成雄性不育[5]。小麦中RAFTIN1基因的提前高表达会导致绒毡层PCD异常而提前降解,小孢子无法得到充足的发育所需营养而造成雄性不育[28]。水稻中OsGAMYB主要在花药原基和绒毡层细胞中表达,其突变体表现为小孢子发育早期绒毡层细胞开始异常肥大,PCD过程被抑制,小孢子解体,导致花粉不育[13-14]。
绒毡层细胞适时PCD是小孢子正常发育的重要保障[3]。UDT1主要参与次生壁细胞向成熟绒毡层的分化,处于减数分裂期的udt1绒毡层不能正常降解并呈空泡化,小孢子发育过程受阻、花粉囊内无法产生花粉细胞,从而影响花粉活力[7]。tdr突变体主要表现为绒毡层细胞质表现出染色不加深,不浓缩等PCD异常的超微结构特征,且TUNEL试验和彗星试验结果表明,tdr绒毡层PCD信号微弱,说明其未能降解;对小孢子发育阶段的tdr突变体花药进行转录分析时,发现编码半胱氨酸蛋白酶的OsCP1和编码半胱氨酸蛋白酶抑制剂的OsC6,而半胱氨酸蛋白酶与细胞凋亡密切相关,表明TDR与水稻花药绒毡层的 PCD过程密切相关[9]。绒毡层细胞的PCD对于其发育及降解过程十分重要,PCD过程的提前或延迟发生都会造成雄性不育[5]。前人的研究已经揭示了UDT1、TDR的功能缺失会引起花药绒毡层PCD的异常,从而导致雄性不育。而我们发现UDT1、TDR过量表达也能导致雄性不育的表型,这可能是由于UDT1、TDR在水稻花药中的表达是一个十分精细的过程,过高或过低的表达量都会对花药育性造成影响,UDT1、TDR的过表达植株绒毡层细胞PCD可能提前发生,从而导致了不育的表型。因此我们推测,UDT1、TDR亦可能是通过影响绒毡层PCD的适时发生来影响育性的。
本研究进一步揭示了UDT1、TDR在水稻中的功能,即UDT1或TDR过量表达植株花药发育受损,长度变短,颜色发白,质地变差,进而影响了可育花粉比例,导致了结实率的显著下降,甚至出现不育的表型。在UDT1-OE的4个株系中,雄性不育表型的严重程度随着UDT1表达量的提高而增大(图1D,1E,2A,2B,2E,2F,2I),三个TDR-OE表达倍数均在90以上,均表现出不结实、无花粉等雄性完全不育表型(图1D,1E,2C,2D,2G,2H,2J)。综上所述,UDT1、TDR在水稻雄性生殖发育中起着不可或缺的作用,本研究对丰富花粉发育新机制和创制新类型不育种质资源具有重要意义。
