木兰科8种植物和菊科23种植物叶片中小白菊内酯含量比较
2022-05-24乔思薇王奇志佟海英
周 倩, 乔思薇, 印 敏, 田 梅, 王奇志, 佟海英, 徐 曙,①, 冯 煦,①
〔江苏省中国科学院植物研究所(南京中山植物园): a. 江苏省植物资源研究与利用重点实验室,b. 江苏省中药材生态种植与高值化利用工程研究中心, 江苏 南京 210014〕
小白菊内酯(parthenolide)是一种来源于木兰科(Magnoliaceae)或菊科(Asteraceae)植物的倍半萜内酯类化合物[1],不仅具有多靶点抗肿瘤活性[2],也是第1个被发现的对癌症干细胞具有选择性的小分子成分[3]。此外,小白菊内酯还具有抗炎、抗菌等药理作用[4,5],且是一种潜在的植物源农药先导化合物[6,7]。植物源化合物生物活性丰富,但分离提取较为困难,尤其是低含量成分的分离提取成本较高,因此,针对目标成分筛选含量高、资源蕴藏量丰富、易栽培的植物种类,对植物源天然产物的开发利用具有重要意义。
木兰科和菊科许多种类含有小白菊内酯[8-12],但关于各种类中小白菊内酯的含量差异尚不明确。为此,作者选取华东地区常见的8种木兰科植物和23种菊科植物,采用液质联用(LC-MS)技术测定叶片中小白菊内酯的含量,以期为筛选小白菊内酯含量丰富的资源植物提供科学依据。
1 材料和方法
1.1 材料
供试木兰科8种植物为玉兰〔Yulaniadenudata(Desr.) D. L. Fu〕、星花玉兰〔Y.stellata(Maxim.) N. H. Xia〕、天目玉兰〔Y.amoena(W. C. Cheng) D. L. Fu〕、宝华玉兰〔Y.zenii(W. C. Cheng) D. L. Fu〕、荷花木兰(MagnoliagrandifloraLinn.)、厚朴〔Houpoeaofficinalis(Rehd. et E. H. Wils.) N. H. Xia et C. Y. Wu〕、含笑花〔Micheliafigo(Lour.) Spreng.〕和台湾含笑〔M.compressa(Maxim.) Sarg.〕;供试菊科23种植物为黑心金光菊(RudbeckiahirtaLinn.)、重瓣金光菊(R.laciniatavar.hortensiaL. H. Bailey)、牛膝菊(GalinsogaparvifloraCav.)、大丽花(DahliapinnataCav.)、硫磺菊(CosmossulphureusCav.)、松果菊〔Echinaceapurpurea(Linn.) Moench〕、金鸡菊〔Coreopsisbasalis(A. Dietr.) S. F. Blake〕、天人菊(GaillardiapulchellaFoug.)、白苞蒿(ArtemisialactifloraWall. ex DC.)、奇蒿(A.anomalaS. Moore)、蒌蒿(A.selengensisTurcz. ex Bess.)、野菊(ChrysanthemumindicumLinn.)、大滨菊〔Leucanthemummaximum(Ram.) DC.〕、云南蓍(AchilleawilsonianaHeimerl ex Hand.-Mazz.)、串叶松香草(SilphiumperfoliatumLinn.)、甜叶菊〔Steviarebaudiana(Bertoni) Hemsl.〕、红凤菜〔Gynurabicolor(Willd.) DC.〕、大吴风草〔Farfugiumjaponicum(Linn. f.) Kitam.〕、兔儿伞〔Syneilesisaconitifolia(Bunge) Maxim.〕、马兰(AsterindicusLinn.)、佩兰(EupatoriumfortuneiTurcz.)、泥胡菜〔Hemisteptialyrata(Bunge) Fisch. et C. A. Mey.〕和包果菊〔Smallanthusuvedalia(Linn.) Mackenzie〕。供试植物均分布于南京中山植物园,其中牛膝菊、野菊、马兰和泥胡菜为野生材料,其余植物均为人工栽培材料。木兰科植物样品均为当年生小枝中上部的成熟叶片;菊科植物中,白苞蒿、大滨菊、大吴风草、兔儿伞和泥胡菜样品为当年生基生叶,其余植物样品为当年生茎生叶。采集时间为2021年7月初,各种类均采集3个单株。所有供试材料均由江苏省中国科学院植物研究所袁昌齐研究员鉴定,并保存于该研究所天然产物化学研究中心。采集的叶片用清水洗净后于40 ℃烘干至恒质量,粉碎后过24目筛,4 ℃保存、备用。
主要仪器:Agilent 1260 UHPLC-DAD-6530ESI-QTOF MS液质联用仪(美国Agilent公司)。主要试剂:小白菊内酯对照品购自南京春秋生物工程有限公司(纯度≥98%);甲醇购自美国Tedia公司,甲酸购自美国Roe公司,均为色谱纯。
1.2 方法
1.2.1 LC-MS分析 色谱条件:Agilent ZORBAX Extend-C18色谱柱(4.6 mm×100 mm,1.8 μm)。流动相A为体积分数0.1%甲酸溶液,流动相B为甲醇。梯度洗脱流程:0~20 min,40%~80%B;20~25 min,80%~100%B。流速0.5 mL·min-1,柱温30 ℃,进样量5 μL;200~400 nm全波长扫描,检测波长210 nm。质谱条件:电喷雾离子源(ESI),正离子模式;质量扫描范围(m/z)100~500;毛细管电压4 000 V,碎裂电压150 V;干燥气(N2)流速10 mL·min-1,温度350 ℃;雾化气压力345 kPa。
1.2.2 对照品溶液制备及测定 取5.00 mg小白菊内酯对照品,精密称量后用体积分数70%甲醇溶解并定容至200 mL,即对照品溶液;用体积分数70%甲醇稀释至0.04、0.20、1.00、5.00和25.00 μg·mL-1,按上述分析条件进行测定。以小白菊内酯质量浓度为横坐标(x)、峰面积为纵坐标(y)绘制标准曲线,拟合方程为y=221 377.922 2x-124.158 7(r=0.999 1)。
1.2.3 样品溶液制备及测定 参照文献[8]的方法制备样品溶液。取各样品粉末0.40 g,精密称量后加入15 mL体积分数70%甲醇,称量质量后超声(40 ℃,100 kHz)提取45 min,冷却后再次称量质量,并用体积分数70%甲醇补足损失的质量;室温静置30 min,上清液用0.22 μm微孔滤膜过滤,即样品溶液,其中荷花木兰样品溶液用体积分数70%甲醇稀释5倍。按上述分析条件进行测定,根据标准曲线方程计算小白菊内酯含量。
1.2.4 方法学考察 按上述分析条件进行方法学考察,精密度、稳定性及重复性考察实验中小白菊内酯峰面积的RSD值分别为0.46%、0.67%及0.57%,表明测试仪器精密度、样品溶液稳定性及实验重复性均良好。
1.3 数据处理和统计分析
使用EXCEL 2010软件对测定数据进行处理,使用SPSS 20.0软件进行单因素方差分析(one-way ANOVA)。
2 结果和分析
检测结果显示:在供试的木兰科8种植物叶片中均可检出小白菊内酯,含量为20.90~3 498.31 μg·g-1。其中,荷花木兰叶片中小白菊内酯含量最高,厚朴次之(715.00 μg·g-1),其他6种植物叶片中小白菊内酯含量均低于400.00 μg·g-1(表1)。
在供试的菊科23种植物中,重瓣金光菊、牛膝菊、白苞蒿、野菊、大滨菊、甜叶菊、兔儿伞、马兰和包果菊的叶片中未检出小白菊内酯,其他14种菊科植物叶片中均检出小白菊内酯,含量为1.23~236.03 μg·g-1。结果显示:在含有小白菊内酯的14种菊科植物中,泥胡菜叶片中小白菊内酯含量最高,奇蒿次之(203.87 μg·g-1),其他植物叶片中小白菊内酯含量均低于50.00 μg·g-1(表2)。
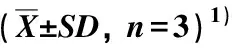
表1 供试木兰科植物叶片中小白菊内酯的含量
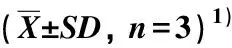
表2 供试菊科植物叶片中小白菊内酯的含量
3 讨论和结论
本研究结果表明:菊科和木兰科植物叶片中小白菊内酯的含量差异较大。其中,荷花木兰叶片中小白菊内酯含量最高,厚朴次之;其他木兰科植物叶片中虽然也检测到小白菊内酯,但含量均低于400.00 μg·g-1。菊科植物叶片中小白菊内酯含量总体低于木兰科植物,仅奇蒿和泥胡菜叶片中小白菊内酯含量达到200.00 μg·g-1以上,其他菊科植物叶片中小白菊内酯含量均低于50.00 μg·g-1。
综合来看,荷花木兰和厚朴的叶片均可作为小白菊内酯的原料植物。然而,虽然荷花木兰叶片的小白菊内酯含量最高,但该种主要作为常绿园林观赏植物,种植范围广却较为分散,尚未形成规模化生产和栽培,因此,若以小白菊内酯为目标,该种在资源量、栽培技术和栽培面积等方面均存在不足。厚朴作为传统中药材,集中种植面积较大,且厚朴的传统药用部位为干皮、枝皮和根皮,其叶片尚未得到充分利用,因此,若以小白菊内酯为目标,有利于厚朴植物资源的充分利用。
