基于高光谱3D成像技术的不同成熟度玉米种子表型特征分析研究
2022-05-24滕彩玲管俊娇黄清梅刘艳芳杨晓洪张建华
张 鹏,滕彩玲,管俊娇,黄清梅,刘艳芳,杨晓洪,毛 进,张建华
(1.云南省农业科学院 质量标准与检测技术研究所,云南 昆明 650205;2.云南省农业科学院 粮食作物研究所,云南 昆明 650205)
0 引言
玉米(Zea mays L.)是我国的主要粮食作物之一,其作为重要的粮、经、饲兼用的作物,对整个国民经济发展有着巨大的影响[1]。种子是作物生产的基础,种子水分是保持和控制种子生命活动的重要介质,其含量直接影响种子适时收获、安全加工、安全贮藏、安全运输、种子活力的正确测定等方面,也是种子能否正常萌动、发芽、出苗的重要依据[2]。深入开展种子成熟度、水分含量的研究,有助于控制种子的质量,提高种子的发芽率和壮苗率。有学者认为多数杂交品种马齿型的种子生理成熟可作为适宜收获期的标准[3-4]。由于玉米籽粒的成熟时间和成熟度不同,因此在相同时间收获玉米无法保证其水分含量达到统一标准,收获后玉米种子的活力也不尽相同。余志江等[5]研究认为,授粉后35 d收获的玉米杂交种子已具备正常活力和丰产能力。有研究证明,玉米高活力种子的适宜采收期开始于授粉后47~60 d,此时籽粒水分含量在40%左右[6]。相关报道指出具有生命力的干种子的生理活动是十分微弱的,但通过水分以及一系列代谢作用可以打破种子的休眠状态,促使种子萌发,可见水是种子萌发不可缺少的先决条件[7-8]。对种子质量的传统检测方法大多需要对种子进行破坏性分析,且检测时间长,过程复杂,难以满足现代农业对种子无损检测、快速生产的要求[9-10]。
有研究报道认为利用核磁共振弛豫谱技术可以对种子内部水分分布和含量变化进行有效的活体检测[11]。Vashisth等[12]利用NMR光谱研究了鹰嘴豆在萌发过程中的吸水特性,观测到种子吸水具有先快后慢再转快的特点。Manz等[13]利用核磁共振成像技术研究了烟草种子在萌发过程中水分分布的变化,并发现脱落酸对种子水分吸收具有抑制作用。但上述2种技术也存在成本高的缺点,普通的课题组因设备成本高昂而无法开展相关研究。近年来,很多学者针对种子水分含量的无损快速检测,利用高光谱技术做了很多尝试[14-15],并取得了一定的进展。芦兵等[16]利用高光谱技术对水稻种子含水量采用模拟退火算法-支持向量回归建立了定量检测模型,预测集测定系数为0.9286。张伏等[17]研究表明利用高光谱技术可以在紫外波段、可见光波段、近红外波段获取大量连续的光谱图像数据,其包含的图像信息和光谱信息不仅能从外观上反映被测样本的形态学特征,而且能从内部反映被测样本的物理结构和化学成分,进而可以实现对被测物内外部的综合评价。
笔者利用高光谱技术[18]对不同成熟度玉米种子的内部特征进行了快速无损检测,并结合LemnaTec表型平台中已经成熟的Lemnalauncher图像分析系统进行种子表型数据采集,以及种子内相关特征指标的测定,对不同类型玉米种子表型指标、内部特征的变化规律进行了研究,解析了不同成熟度玉米种子的特征变化规律、水分变化情况,以期为玉米种子质量控制的机理研究提供理论依据,奠定科学基础。
1 材料与方法
1.1 试验材料
试验材料选用云南地区主栽玉米品种收获后的种子,8个品种的详细信息见表1。表型分析系统使用实验室版高通量表型测量系统Scanalyzer HTS,该系统是一套具有高通量采集小型植物及其他样品材料表型数据功能的多功能表型系统,可以对不同品种、不同生命时期小型植物或者其他样品材料进行深入的表型数据采集,此系统可以根据测量样品数量选择不同配置版本,有红外(IR)、近红外(NIR)等多种传感器以及光源选择,以满足不同领域的表型研究。成像模块的具体规格:近红外(NIR),焦距50 mm,1450 nm带通滤波器,视野18°×14°,工作距离540 mm;可见光(VIS),焦距50 mm,视野20°×15°,工作距离485 mm。

表1 参试玉米品种的详细信息
1.2 试验方法
收集不同品种类型的玉米种子,然后进行田间种植,播种方式为穴播,每个小区种植40株,行距70 cm,株距30 cm,在5月20日播种。从籽粒初始灌浆期(2020年8月10日)开始第1次种子采样,此后每10 d采样收获种子1次,直至果穗期(2020年9月29日)。在不同时间段收获的种子的成熟度不同,以此作为不同成熟度梯度。每个品种每批次选取果穗中部1/3处的种子20粒,使用真空包装袋密封保存;在采样次日利用表型测量系统Scanalyzer HTS,在可见光(VIS)光源条件下测定种子的表型特征指标,包括长度、宽度、周长、面积、偏心率、紧密度、圆度等;另外在近红外(NIR)光源条件下测定种子的相对含水量,具体量化指标为蓝色均值、绿色均值、红色均值,蓝色均值越高,表示相对含水量越高;3个量化指标代表的相对含水量大小为蓝色>绿色>红色,即颜色越深,相对含水量越高。
1.3 数据处理、图像分析与统计
试验中的性状数据均通过表型测量系统Scanalyzer HTS获取。采用SPSS VER 16.0软件进行试验数据的标准化处理、相关性分析和统计分析;用邓肯氏检验法进行方差分析(P<0.05);使用本课题组自主研发的植物颜色性状分析系统进行成像图片颜色的分析。
2 结果与分析
2.1 不同成熟度玉米种子的表型特征
选择水平距离(mm)、最远两点距离(mm)、垂直距离(mm)、表面积(mm2)、周长(mm)、圆度这6个指标来表征供试种子的表型特征。特征值计算需由光谱图片成像后经过像素点数进行复杂的迭代计算,Scanalyzer HTS表型分析系统给定的距离/像素转换系数为0.0483871,各特征值的计算公式如下:水平距离=X轴面积(像素数)×转换系数;最远两点距离=卡尺长度(像素数)×转换系数;垂直距离=Y轴面积(像素数)×转换系数;面积=Area(像素数)×转换系数×转换系数;周长=Circumference(像素数)×转换系数;圆度由系统直接计算生成。
根据上述公式,计算获得各特征值,之后利用SPSS软件将数据标准化,便于在同一数量级进行不同表型特征值的分析,得到8个品种在不同时间段的表型特征雷达图谱(图1)。由图1可见:品种4、6、71为普通杂交玉米,其籽粒特征值在50 d或60 d时达到最大值,变化规律基本一致,随着时间的延长而逐渐增大;品种47、51、57、60、162为甜玉米或糯玉米,其籽粒表型特征值的变化与普通杂交玉米有所不同,各项特征值的最大值出现在30~40 d,且在60 d时各项值变小,尤其在甜质型玉米籽粒中较为明显,例如品种60在30 d时各项值已达到最大,在60 d收获时的各项值小于30、40、50 d时的各项值;品种162的生育期较短,在30 d时各项值达到最大,在40 d收获时的各项值小于20 d时的各项值。

图1 不同玉米品种种子表型特征的雷达图谱
2.2 不同成熟度玉米种子相对含水量的变化
Scanalyzer HTS表型分析系统通过对样品进行可见光(VIS)和近红外(NIR)成像,得到了不同玉米品种籽粒在10、20、30、40、50、60 d共6个时间点的可见光表型分析图像和相对含水量成像图片,最终获得的4号品种的VIS和NIR成像图片如图2所示(限于篇幅,其他品种的VIS和NIR成像图片在此省略)。通过表型系统,可以定性分析不同成熟度种子和同一成熟度种子不同部位的含水量差异。从图2可以直观地看出,随着种子的不断成熟,种子的颜色基本上呈现由深到浅的变化。就整体变化来说,前20 d基本上以深蓝色为主,表示含水量较高;20~40 d由蓝色向绿色过渡,表示含水量由高到低发生变化;40~60 d基本上以浅蓝色或绿色为主,表示含水量处于较低水平。此外,在20~50 d中间阶段(品种162为20~30 d)供试品种的部分种子出现了红色,表示在这一阶段这些种子的含水量处于较低水平,具体原因还有待分析。上述结果基于肉眼观测,还无法得知某种颜色所代表的水分相对占比情况,因此,还需要使用图像颜色分析软件进行分析后才能得出更为直观、准确的结果。

图2 4号品种在不同时间点的可见光(VIS)成像和近红外(NIR)成像
结合供试种子的近红外成像图片,利用本课题组自主研发的植物颜色性状分析系统,将10~60 d不同时间点种子内不同颜色面积量化,以4号品种为例,得到了如图3所示的种子内水分含量变化情况(其余品种在此省略)。由图3可见:4号品种在10 d和20 d时种子内水分含量变化不大;在30 d和40 d时出现了表示水分含量水平较低的颜色分布,占比分别为1.59%和3.94%;进入50 d和60 d时,以浅蓝色为主,占比分别为37.23%和34.33%,但60 d时的颜色比50 d时要浅,说明水分含量变低。

图3 4号品种不同成熟度种子内水分含量的变化
2.3 不同成熟度玉米种子表型特征与含水量变化的关系
基于上述种子表型特征和水分含量变化的分析结果,利用Scanalyzer HTS表型分析系统测定的蓝、绿、红色均值作图(图4)。结合8个供试品种来看,随着种子成熟度的增加,3个颜色均值均呈下降趋势,且表示水分含量较高的蓝色均值处于较低的水平;57号和60号品种为甜质型品种,在进入50~60 d时,表示水分含量最低的红色均值高于蓝色和绿色均值,这与甜质型玉米品种在收获后种子皱缩,其各项表型指标值明显小于30~40 d时的指标值相符。

图4 8个玉米品种种子蓝、绿、红色均值的变化
计算了供试玉米品种表型特征与蓝、绿、红色均值间的相关系数(皮氏积矩相关系数),结果如表2所示:在本研究所选取的5个表型特征值之间存在显著的线性相关,而圆度这一特征值与其他特征值相关不显著;在表示种子内水分含量的蓝、绿、红色均值之间也存在显著的线性相关;6个表型特征值与蓝、绿、红色均值之间均存在负相关关系,但相关性不明显。
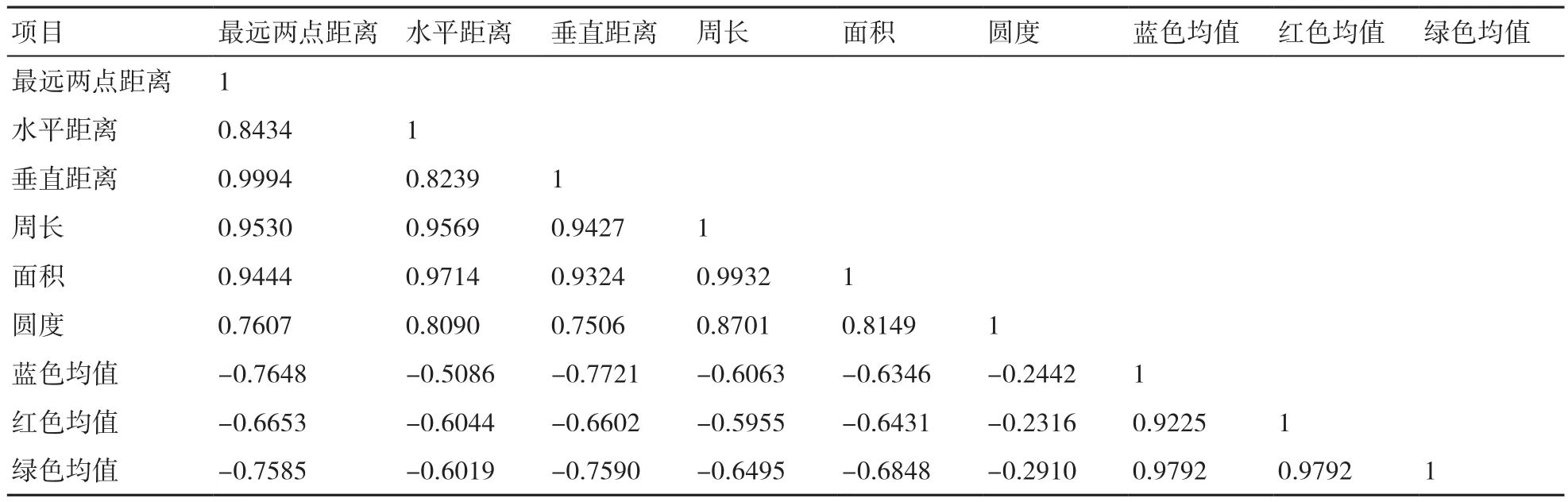
表2 供试玉米品种表型特征与蓝、绿、红色均值间的相关系数
3 结论与讨论
长期以来,人们根据感官评价或经验来判断作物种子的成熟度,而对种子内部特征的具体变化情况知之甚少。近些年来,表型组学研究以及图像分析技术的快速发展使得对作物种子质量的无损检测分析成为可能,尤其是光谱分析技术,其具有无污染、无损、成本低、便捷、无需预处理样本等优点,因而被广泛应用到种子质量检测、农产品检测、中草药鉴别、化工成分检测等领域中[19]。在玉米种子的发育过程中,其外部形态特征随成熟度的变化而变化;本研究选取的水平距离、最远两点距离、垂直距离、表面积、周长、圆度这6个表型特征值随着成熟度的增加而增大,变化规律基本一致,但甜质型和糯质型玉米有所不同,在30~40 d时各项值已达到最大。本研究发现圆度与其他5个表型特征值相关性不高,因此可以考虑用其他相关性较高的表型特征作为玉米种子的评价分析指标。通过分析Scanalyzer HTS表型分析系统测定的蓝、绿、红色均值发现,随着成熟度增加,3个均值均呈下降趋势,且甜质型品种在进入50~60 d时,表示水分含量最低的红色均值高于蓝色和绿色均值,这符合实际情况。
作物种子在发育的过程中,由胚胎发生期到种子形成期再到成熟休止期,在整个过程中主要是贮藏物质的积累,到一定阶段后贮藏物质的积累逐渐停止,种子含水量降低;在这一过程中含水量主要会影响SOD、CAT和MDA等酶的活性,从而影响物质积累[20],但不会出现水分含量先降低之后再增加的现象。本研究发现,在中间阶段供试玉米品种(尤其是57号和60号品种)的部分种子出现了红色,这可能是由取样导致的,可以在今后研究中加以验证。
