新塔花查耳酮合成酶基因克隆及表达分析
2022-05-24满尔哈巴海如拉
程 波,满尔哈巴·海如拉,何 江
• 药材与资源 •
新塔花查耳酮合成酶基因克隆及表达分析
程 波,满尔哈巴·海如拉,何 江*
新疆维吾尔自治区药物研究所 新疆维吾尔药重点实验室,新疆 乌鲁木齐 830004
克隆新塔花黄酮类化合物生物合成途径中关键酶查耳酮合成酶(chalcone synthase,)基因,对其进行组织表达特异性分析,构建原核表达载体并进行重组蛋白诱导表达。结合新塔花转录组数据设计特异性引物,通过RT-PCR克隆新塔花查耳酮合成酶基因,对其进行生物信息学分析,通过RT-PCR进一步分析其组织表达特异性,构建原核表达载体pET28a-chs,并转化至BL21(DE3)感受态细胞,经异丙基-β--硫代半乳糖苷(IPTG)诱导重组蛋白的表达。基因长1226 bp,包含一个长度为1176 bp的开放阅读框,编码319个氨基酸,其理论相对分子质量为42 848.37。该编码蛋白定位于细胞质中,不存在跨膜区及信号肽,为非分泌蛋白,有1个糖基化位点和31个磷酸化位点。α-螺旋是该蛋白多肽链中大量的结构元件,散布于整个肽链之中。系统进化树分析表明,新塔花基因与丹参、藿香、紫苏等亲缘关系最为接近。RT-PCR结果显示基因在各组织中均有所表达,在叶中表达量较高,花相对表达量次之,根、茎中表达量相对较低。原核表达载体pET28a-chs在BL21(DE3)感受态细胞表达系统中,经IPTG诱导后,有明显的重组蛋白表达,其相对分子质量为42 800,与预测相符合。通过对基因的全长cDNA克隆、组织表达特异性分析和原核表达载体的构建,为进一步研究基因在新塔花黄酮类化合物生物合成与基因调控提供依据,最终为该药材品质的提升奠定基础。
新塔花;查耳酮合成酶;基因克隆;RT-PCR;原核表达
新塔花Juz.为唇形科塔花属植物,多年生半灌木草本,又名唇香草、小叶薄荷,在我国仅产于新疆,资源较为丰富,是当地民族医传统习用药材,维语名为苏则,哈语名为滔加布孜[1]。具有强心利湿、理气化痰、消炎散结之功效,用于心脏病、气短多汗、水肿等疾患[2];也用于感冒发热、高血压、心悸失眠等症[3]。新塔花富含金合欢素、山柰素、槲皮素等黄酮类生物活性成分,在当地多用于心脏相关疾病的预防及治疗[4-6]。
查耳酮合成酶(chalcone synthase,CHS)在植物生长发育过程中有着重要的作用,是植物黄酮类化合物合成的第一个关键酶,催化1分子4-香豆酰辅A(4-coumaroyl-CoA)和3分子丙二酰辅酶A(malonyl-CoA)结合形成柚皮素查耳酮(naringenin chalcone),该产物进一步转化生成各种类型黄酮类化合物[7]。CHS在植物中广泛存在,其中人参[8]、百合[9]、红花[10]等多种药用植物CHS已经被成功克隆。
目前,对新塔花中黄酮类化合物的研究,主要集中在提取与分离等理化性质的研究上,新塔花查耳酮合成酶(zbCHS)在黄酮类生物合成中的重要作用及相关文献在国内外鲜见报道。本研究初次克隆了基因,分析了其在不同组织部位的表达,构建原核表达载体并诱导重组蛋白表达,初步了解了该酶的相关特性,为进一步研究该酶在黄酮类化合物生物合成以及相关基因调控方面奠定了坚实的科研基础。
1 材料与试剂
1.1 植物材料
2019年5月下旬,采自新疆乌鲁木齐南山向阳坡地初花期的新塔花植株,每个生物学重复3~5株,经75%乙醇搽洗洁净后,用灭菌医用剪将根、茎、叶、花等不同组织部位剪切成适宜小段,迅速置于液氮罐中暂存,−80 ℃冰箱中长期保存,备用。其样本种属鉴定由新疆维吾尔自治区药物研究所何江研究员鉴定为唇形科塔花属植物新塔花Juz.,标本保存于新疆维吾尔自治区药物研究所维吾尔药重点实验室标本室。
1.2 主要试剂
RNAprep Pure多糖多酚植物总RNA提取试剂盒(北京天根有限公司),反转录试剂盒PrimeScript™ RT-PCR Kit(TAKARA),实时荧光定量SYBR®Premix Ex TaqTMII(TAKARA)。Taq酶(2.5 U/μL)、dNTPs(2.5 mmol/L)、DL2000 DNA Mark、DH5α等均购自北京天根有限公司。pMD-19T、JM109、pET28a(+)、BL21(DE3)等均购自TAKARA公司。Tryptone、Agar、Yeast extract、琼脂糖(GENE Biowest),核酸染料(Geneview)等均购自北京鼎国有限公司。液氮、无水乙醇、NaCl等其他常规试剂均购自国产分析纯。本实验引物的合成及其基因测序由北京华大基因科技股份有限公司完成,引物相关信息见表1。

表1 实验中用到的引物及序列
2 方法
2.1 总RNA提取及cDNA的合成
取约100 mg组织样本在液氮中迅速研磨成粉末,总RNA的提取依据RNAprep Pure多糖多酚植物总RNA提取试剂盒操作说明书进行,总RNA经过DNase I处理,再经1%琼脂糖凝胶电泳检测其完整性后,储存于−80 ℃冰箱中备用。取约1 µg总RNA,以Random为引物进行1st cDNA的合成,具体方法依据PrimeScript™ RT-PCR Kit操作说明书进行,其反转录产物存放于−20 ℃,备用。
2.2 zbCHS基因克隆与测序
根据本课题组前期获得的新塔花转录组数据相关信息,采用Premier Primer 6.0设计一对特异性引物chs-F和chs-R。反应体系为25 μL,体系包含Taq酶0.25 μL、10×Buffer 2.5 μL、dNTP 2.0 μL、正反向引物各0.5 μL、总DNA 3μL、ddH2O 16.25 μL。PCR反应体系条件为:94 ℃、3 min;94 ℃、30 s,58 ℃、30 s,72 ℃、1.5 min,34个循环;72 ℃、7 min;12 ℃持续。取5 μL PCR扩增产物,经1%琼脂糖凝胶电泳,染色,紫外凝胶成像系统进行观察,成像。用普通琼脂糖凝胶DNA回收试剂盒回收PCR产物后,连接至pMD-19T载体,转化至大肠杆菌DH5α感受态细胞,涂布于LB(含Amp)固体培养基平板上,37 ℃培养过夜。挑取单菌落为模板,用菌落PCR法筛选出阳性结果并送北京华大基因科技股份有限公司测序验证。
2.3 zbCHS基因生物信息学分析
基于基因的测序结果,应用NCBI的ORF finder工具进行开放阅读框(open reading frame,ORF)的查找以及推导编码氨基酸序列。采用ProtParam(http://web.expasy.org/protparam)分析zbCHS蛋白的理化性质;应用ProtScale(http://web.expasy.org/prots-cale)对zbCHS蛋白的亲水性进行预测;利用TMHMM Server2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0)分析zbCHS蛋白序列跨膜结构域;使用SignalP 5.0 server (http://www.cbs.dtu.dk/services/SignalP)分析zbCHS蛋白信号肽;PSORT(http://psort.hgc.jp)预测蛋白亚细胞定位;使用NetNGlyc server (http://www.cbs.dtu.dk/services/NetNGlyc)分析zbCHS蛋白糖基化位点;使用NetPhos server (http://www.cbs.dtu.dk/ services/NetPhos)分析zbCHS蛋白磷酸化位点;使用SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_ automat.pl?page=/NPSA/np-sa_sopma.html)和SWISS MODEL (https://swissmodel.expasy.org)预测zbCHS蛋白二级与三级结构。在NCBI数据库中通过BlastP进行检索,搜索出与zbCHS蛋白氨基酸同源的其他植物氨基酸序列,采用MEGA6.0软件的邻接法(neighobor-joining)构建系统进化树。
2.4 RT-PCR
以反转录得到新塔花不同组织的根、茎、叶、花1st cDNA为模板,依据前期新塔花转录组数据(ID:c143126_g2)筛选得到的18S rRNA作为内参基因,设计合成内参引物为18S-F和18S-R。依据软件Primer6.0设计一对实时荧光定量PCR引物realtime-F和realtime-R,检测其在根、茎、叶、花组织中zbCHS基因相对表达量。Real-Time PCR依据SYBR®Premix Ex TaqTMII试剂盒说明书进行,25 μL反应体系如下:SYBR Premix 12.5 μL,上下游引物各1 μL,cDNA模板2 μL,ddH2O 8.5 μL。反应程序:95 ℃、30 s;95 ℃、5 s,60 ℃、30 s,40个循环。每个样品3次生物学重复,利用2−ΔΔCt相对定量的方法来检测基因在不同组织根、茎、叶、花中的相对表达水平。
2.5 原核表达载体的构建
根据新塔花基因序列在原核表达体系中大肠杆菌密码子偏好性及其使用频率,对zbCHS基因编码序列进行密码子优化,并在首尾分别加上Bam HI/Hind III酶切位点,密码子优化及其基因合成由大连宝生物工程有限公司完成。在微量离心管中配制12 μL反应体系(包含Insert DNA 1 μL;pET28a(+) 2 μL;5×In Fusion HD Enzyme Premix 2 μL和ddH2O 6 μL),于50 ℃保温15 min。取2.5 μL产物,42 ℃热激法转化至感受态细胞JM109,涂布于含卡那霉素的LB固体培养基上,挑取单菌落用T7通用引物PCR扩增筛选阳性克隆,提取质粒测序,将构建正确的表达载体命名为pET28a-chs。
2.6 IPTG诱导表达
将质粒pET28a-chs和pET28a各取l μL转入BL21(DE3)感受态细胞中;使用LB/抗生素Kan(50 μg/mL)平板,50 μL转化液涂布,37 ℃过夜培养。挑取单菌落至2 mL LB/抗生素Kan液体培养基中,37 ℃过夜培养。取100 μL培养菌液加到5 mL LB/抗生素Kan液体培养基中,37 ℃培养至吸光度(600)值约为0.6。添加150 mmol/L IPTG 34 μL(终浓度为1 mmol/L IPTG)进行诱导,37 ℃培养4 h后集菌。加入320 μL PBS悬浊后进行超声波破碎,对菌体破碎液12 000 r/min离心5 min,进行蛋白质抽提。分别取全蛋白、上清、沉淀抽提液各8 μL,加入2 μL 4×SDS Loading Buffer,置沸水加热10 min,进行SDS-PAGE(5%浓缩胶,12%分离胶)电泳检测重组蛋白是否表达。
3 结果
3.1 zbCHS基因克隆及序列分析
RT-PCR扩增产物经1%琼脂糖凝胶电泳后,成功扩增出一条明显的单一特异性核苷酸片段,其长度大小约为1.2 kb(图1),经华大基因科技股份有限公司测序得到基因的核苷酸序列,经过进一步分析,其基因大小为1226 bp,含有1个由1176 bp组成的ORF,共计编码391个氨基酸(图2)。测序结果已提交至NCBI,登录号为MN599471。
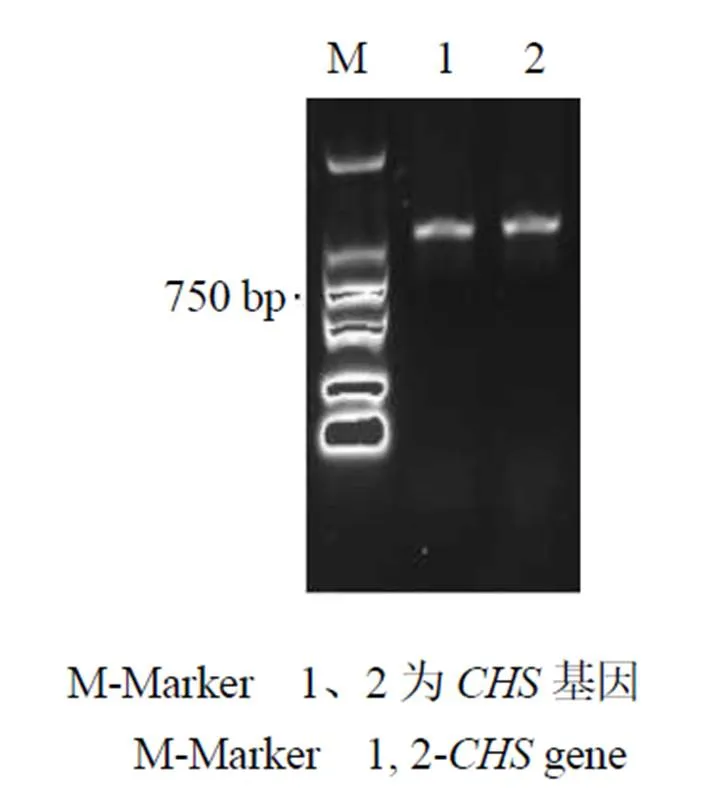
图1 新塔花CHS基因PCR扩增
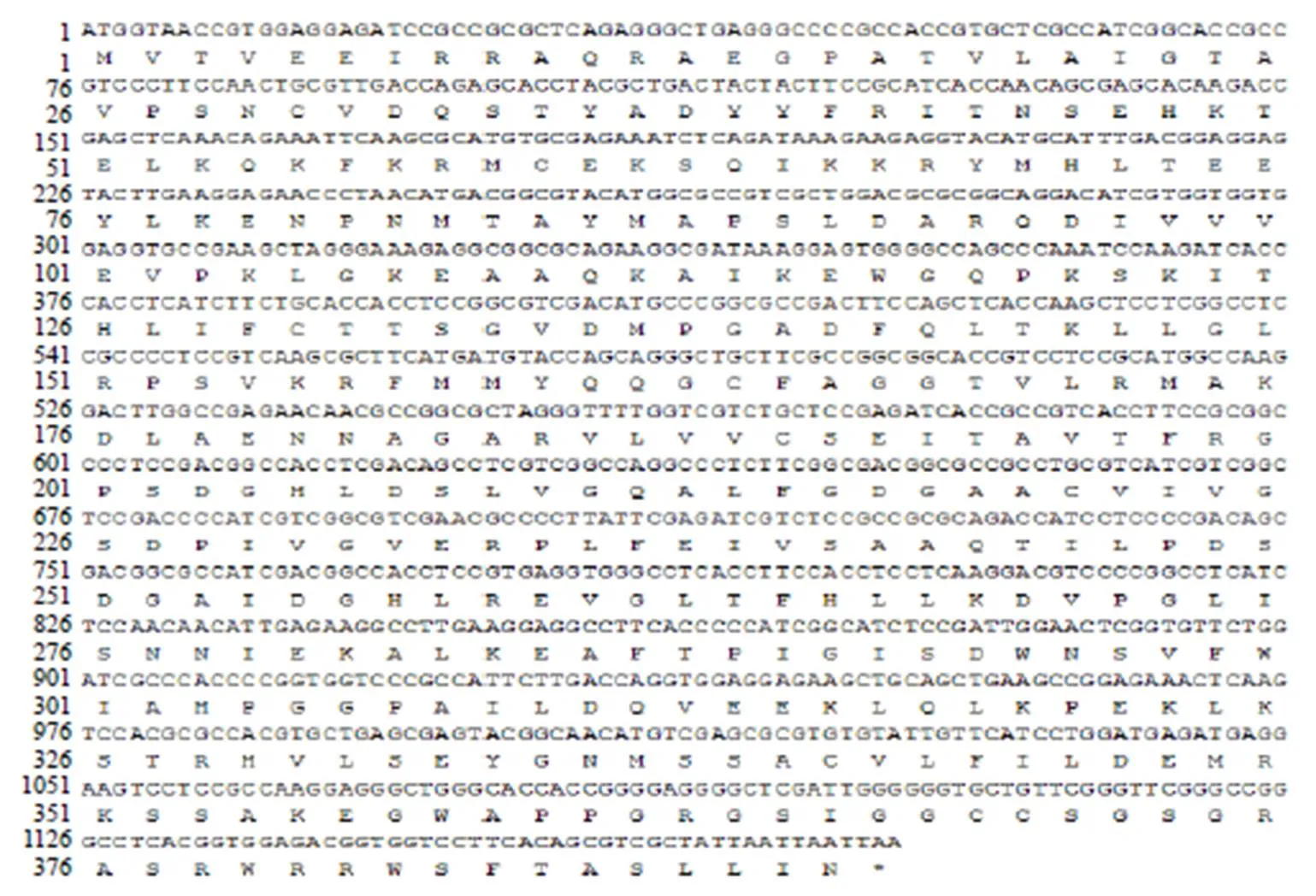
图2 zbCHS基因ORF序列及相应氨基酸序列
3.2 zbCHS基因编码蛋白理化性质分析
ProtParam分析预测基因编码蛋白相对分子质量42 848.37,酸性氨基酸残基(Asp+Glu)总数为43,碱性氨基酸残基(Arg+Lys)总数为47,理论等电点8.48,化学式C1899H3033N527O560S20,脂肪指数86.32,不稳定指数46.42,亲水性指数(GRAVY)平均值为−0.159。ProtScale分析显示该蛋白中氨基酸均匀分布于肽链中,其亲水性氨基酸多于疏水性氨基酸,由此可推断出该蛋白属于不稳定性亲水蛋白。SignalP 5.0在线预测显示该蛋白不存在明显的信号肽,是一种非分泌蛋白。TMHMM 2.0在线预测该蛋白无明显跨膜结构域。亚细胞定位结果显示,该蛋白定位于细胞质中。NetNGlyc 1.0 Server在线预测该蛋白在82与336位置上各有1个糖基化位点。NetPhos 3.1 Server预测该蛋白具有31个磷酸化位点,其中丝氨酸为18个,苏氨酸为10个,酪氨酸为3个,并存在着CKII、PKC、unsp、cdc2、EGFR、PKG、PKA、PKC等多种特异性蛋白激酶结合位点,见图3。
3.3 zbCHS基因编码蛋白的结构预测
结果(图4)显示,多肽链中α-螺旋(蓝色部分)共计出现175个,占其总二级结构的含量为44.76%;无规则卷曲(紫色部分)共计出现125个,占其总二级结构的含量为31.97%;延伸链(红色部分)共计出现65个,占其总二级结构的含量为16.62%;β-转角(绿色部分)共计出现26个,占其总二级结构的含量为6.65%;α-螺旋是该蛋白多肽链中大量的结构元件,散布于整个肽链之中。以1d6f.1.B(chalcone synthase)为模板同源建模zbCHS三维结构,该编码蛋白与模板相似性为77.49%,模型的GMQE值和QMEAN值分别为0.88和−0.88,建模可靠(图5)。
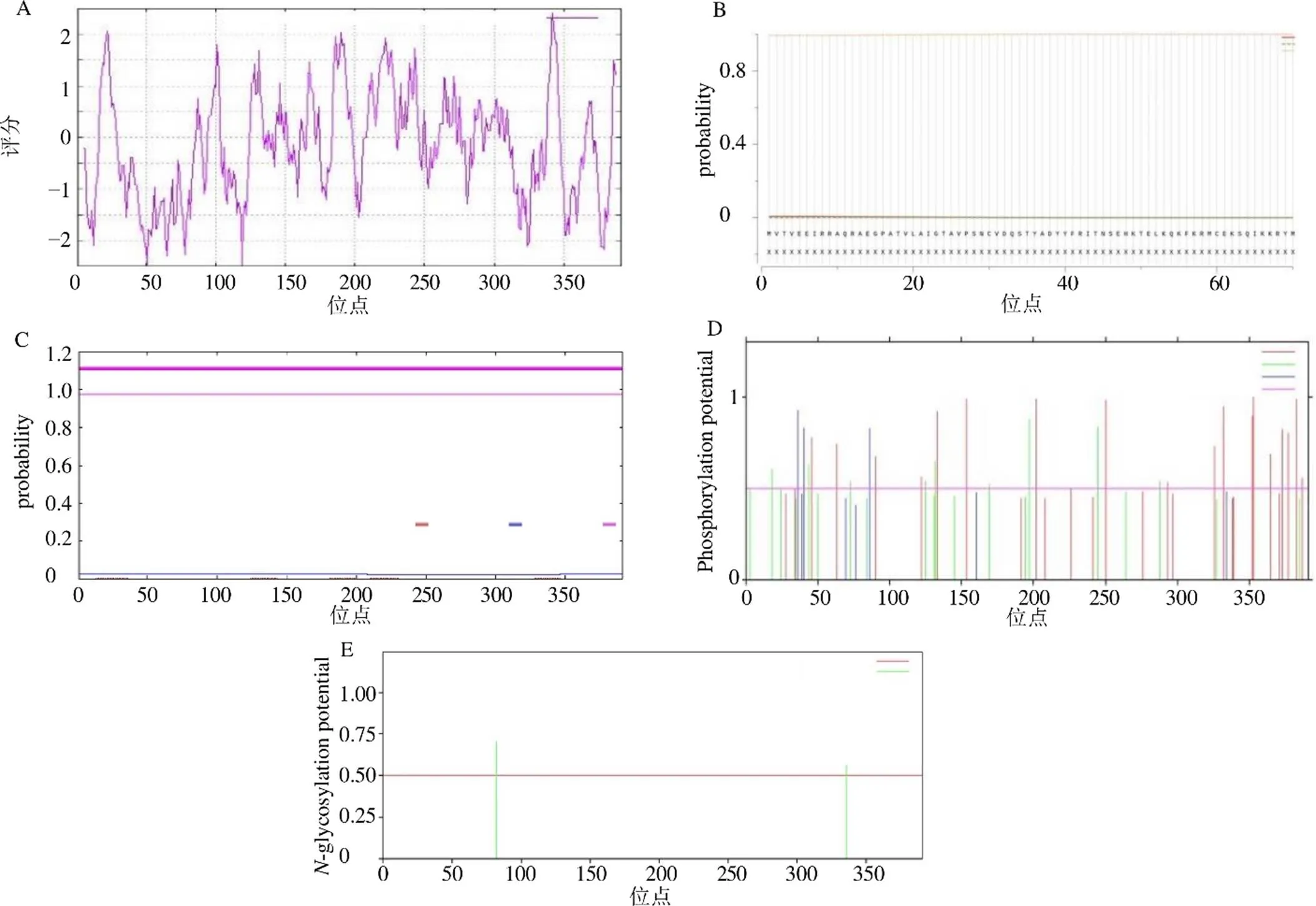
图3 zbCHS蛋白亲水性/疏水性(A)、蛋白信号肽(B)、蛋白跨膜结构域(C)、蛋白磷酸化位点(D)、蛋白糖基化位点(E)预测
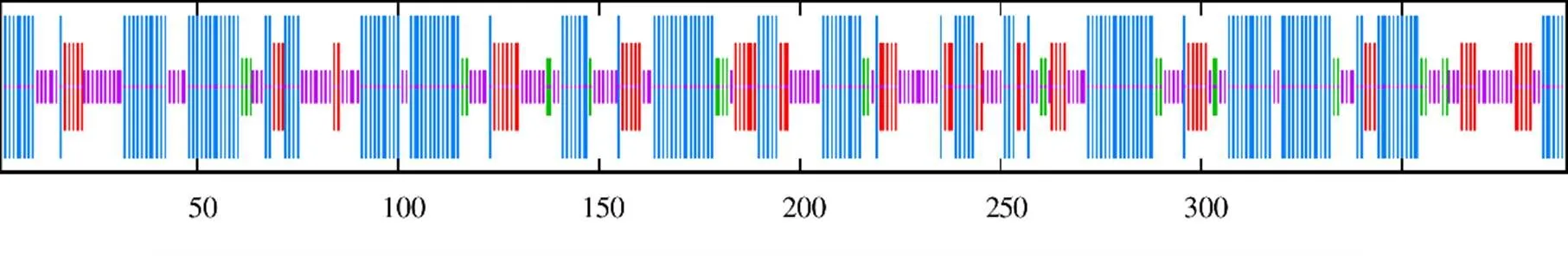
图4 zbCHS编码氨基酸序列二级结构预测
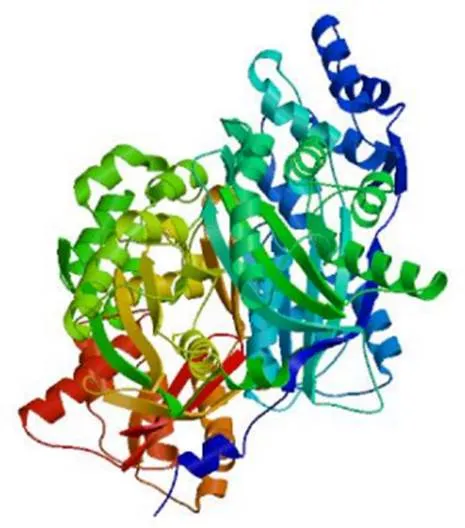
图5 zbCHS基因编码蛋白的三维结构预测
3.4 zbCHS编码蛋白系统进化分析
利用NCBI的blastp功能将基因编码蛋白序列与其他物种进行同源性比较,选取CHS序列一致性在80%~91%的彩叶草、紫苏、藿香等13个植物,用MEGA6.0的邻接法(neighbour- joining,N-J)对CHS编码蛋白氨基酸序列构建系统进化树(图6),结果表明整个进化树CHS蛋白进化为I、II、III 3大分枝,而新塔花基因则在第II支上,其与丹参、藿香、紫苏等亲缘关系最为接近。

图6 不同植物CHS氨基酸序列分子进化分析
3.5 zbCHS mRNA在不同组织中相对表达分析
RT-PCR结果显示(图7),基因具有组织表达特异性,在新塔花的根、茎、叶、花组织中均有所表达,其中在叶中相对表达量较高,约是花中相对表达量的3倍。花相对表达量次之,根与茎中表达量相对较低。
3.6 zbCHS编码蛋白诱导表达
根据大肠杆菌密码子偏好性及其使用频率,对基因编码序列进行密码子优化后,通过人工合成基因序列(图8)将构建表达载体pET28a-chs转化至BL21(DE3)感受态细胞,挑取单克隆于37 ℃培养至600为0.6左右,加入终浓度为1 mmol/L IPTG进行诱导,37 ℃培养4 h,菌液超声波破碎后经过SDS-PAGE电泳检测,结果在42 800处菌液全细胞与沉淀都存在明显的特异蛋白质条带,而上清液中很弱或是无表达(图9),zbCHS生物信息学预测的分子质量约为42 800,据此判断其为诱导表达的zbCHS重组蛋白。以上结果表明,zbCHS重组蛋白主要是以包涵体的形式存在。
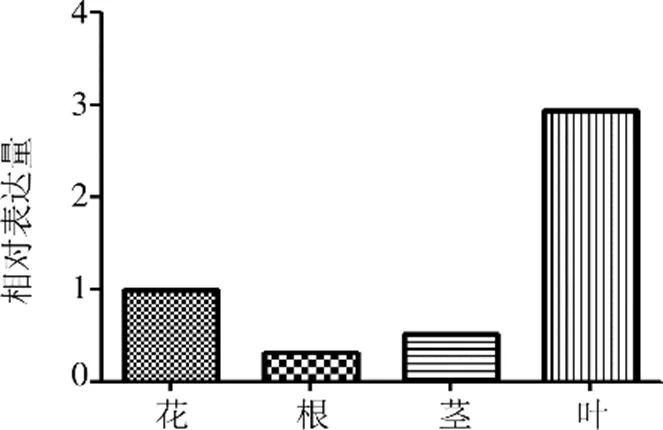
图7 不同组织zbCHS mRNA水平表达分析(n=3)
4 讨论
本研究成功克隆了基因,该基因具有1176 bp的开放阅读框,编码391个氨基酸。该蛋白属于不稳定性亲水蛋白,不存在明显的信号肽,是一种非分泌蛋白。无明显跨膜结构域,定位于细胞质中,在82与336位置上各有1个糖基化位点,具有31个磷酸化位点,并存在着多种特异性蛋白激酶结合位点。α-螺旋是该蛋白多肽链中大量的结构元件,散布于整个肽链之中。系统进化树分析表明,zbCHS与丹参、藿香、紫苏等亲缘关系最为接近。RT-PCR结果显示基因在根、茎、叶、花中均有所表达,其中叶中相对表达量最高,花相对表达量次之,根、茎中相对表达量较低。通过IPTG成功的进行了原核重组蛋白的诱导表达。

图8 zbCHS基因编码序列的优化
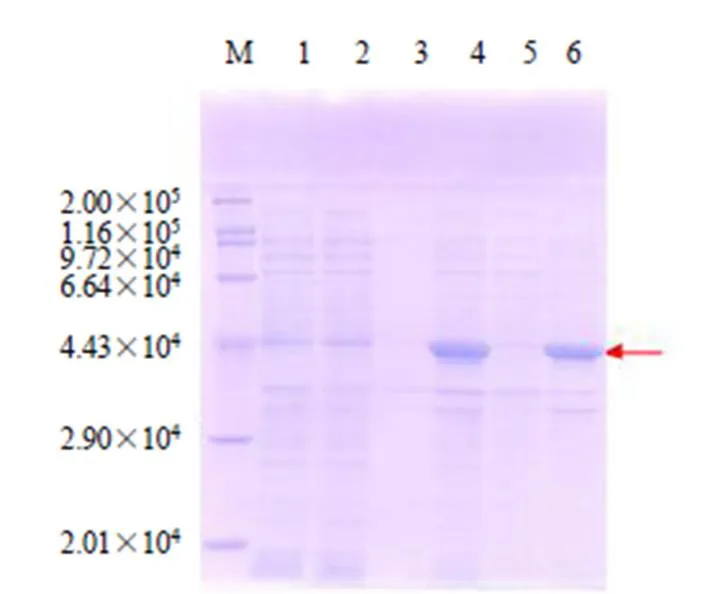
M-Marker 1-pET28a全细胞 2-pET28a上清 3-pET28a沉淀 4-pET28a-chs全细胞 5-pET28a-chs上清 6-pET28a-chs沉淀
植物CHS是黄酮类生物合成途径中的一个重要的关键酶,广泛存在于各类植物中,直接或间接影响植物代谢产物合成、抗性调节、花色形成等过程[11]。基因编码区十分保守,cDNA全长约1200 bp,编码390个左右氨基酸,基因家族成员间的氨基酸一致性达到80%[12]。这与本次研究结果相一致,说明其在相关结构及其功能方面具有一定的稳定性,推测基因在参与体内重要黄酮类化合物的生物合成过程中,与其他植物的基因可能行使相同或相似的生物学功能。
随着植物黄酮类生物合成途径中相关酶的分离鉴定,利用相关的酶表达来改变黄酮类生物活性物质组成,将成为改良作物及其中药品质的一种新手段。孟衡玲等[13]发现铁皮石斛基因在不同时期分别参与激素运输与器官形态建成和类黄酮物质合成。陈洁等[14]以百合为材料,采用农杆菌介导法获得了转正义基因的烟草植株,其黄酮含量升高14.0%~59.7%。柳忠玉等[15]成功构建了虎杖查耳酮合酶基因RNAi载体,获得了干涉基因表达下调的转化植株,抑制基因的表达,白藜芦醇苷量均得到显著提高,其中最高量是对照植株的3倍。Verhoeyen等[16]将基因和黄酮醇合酶基因共同转化至番茄后,增加了番茄中黄酮醇的含量,提高了其抗氧化水平。以上相关研究报道表明将基因进行克隆对于提高中药活性成分的量或品质具有十分重要作用。
RT-PCR分析结果显示,新塔花基因在根、茎、叶、花中均有所表达,其中在叶中相对表达量最高,约为花中相对表达量的3倍,花相对表达量次之,而根、茎中相对表达量较低。植物中基因在不同的发育时期表达位置有所差异,一些早期发育阶段的植物,基因出现在叶片组织中[17],而成熟植株中主要在花组织中表达[18]。而此次新塔花叶中表达较高,这可能是由于采摘时,正是新塔花初花期,花朵还没有正式开放,养分大部分输送给了叶,相关的代谢终产物积累在叶组织中,导致根与茎因养分供应相对不足,而出现表达量相对较低的现象。
利益冲突 所有作者均声明不存在利益冲突
[1] 李伟, 赵翡翠.民族药新塔花质量标准研究 [J].中国现代应用药学, 2011, 28(3): 236-241.
[2] 刘勇民.维吾尔药志-上册 [M].修订版.乌鲁木齐: 新疆科技卫生出版社(K), 1999: 263.
[3] 徐新, 巴哈尔古丽·黄尔汗.哈萨克药志(第一卷)[M].北京: 民族出版社, 2009: 126.
[4] 杨伟俊, 哈木拉提, 孙玉华, 等.芳香新塔花对大鼠急性心肌缺血和乳鼠心肌细胞的保护作用 [J].现代药物与临床, 2010, 25(3): 194-198.
[5] 陈秋红, 李钦, 杨伟俊, 等.芳香新塔花总黄酮对大鼠离体心脏缺血再灌注损伤的保护作用 [J].中国现代应用药学, 2015, 32(3): 264-268.
[6] Yang W J, Liu C, Gu Z Y,.Protective effects of acacetin isolated fromLam.(Xintahua) on neonatal rat cardiomyocytes [J]., 2014, 9(1): 28.
[7] Koes R E, Quattrocchio F, Mol J N M.The flavonoid biosynthetic pathway in plants: Function and evolution [J]., 1994, 16(2): 123-132.
[8] 张变玲, 黄雪梅, 刘心怡, 等.人参查耳酮合成酶基因PgCHS1的克隆与表达分析 [J].中国细胞生物学学报, 2018, 40(12): 2010-2017.
[9] 杨丽, 刘雅莉, 王跃进, 等.百合查耳酮合成酶(CHS)基因的克隆与分析 [J].西北植物学报, 2006, 26(5): 933-936.
[10] 康亚兰, 裴瑾, 刘薇, 等.红花查耳酮合成酶基因的克隆、生物信息学分析及表达 [J].中草药, 2014, 45(16): 2385-2389.
[11] 李苗, 李国旗.査尔酮合成酶基因及其分子进化研究进展 [J].中国农学通报, 2015, 31(18): 116-120.
[12] Han Y Y, Ming F, Wang W,.Molecular evolution and functional specialization ofsuperfamily fromorchid [J]., 2006, 128(1/2/3): 429-438.
[13] 孟衡玲, 张薇, 卢丙越, 等.铁皮石斛查耳酮合酶基因克隆与表达分析 [J].南方农业学报, 2016, 47(12): 2015-2019.
[14] 陈洁, 安利清, 王涛, 等.百合查耳酮合成酶基因克隆及其转化烟草的花色表达分析 [J].西北植物学报, 2012, 32(8): 1511-1517.
[15] 柳忠玉, 赵树进.虎杖查耳酮合酶基因RNAi载体的构建及其遗传转化 [J].中草药, 2015, 46(3): 412-417.
[16] Verhoeyen M E, Bovy A, Collins G,.Increasing antioxidant levels in tomatoes through modification of the flavonoid biosynthetic pathway [J]., 2002, 53(377): 2099-2106.
[17] Knogge W, Schmelzer E, Weissenböck G.The role ofin the regulation of flavonoid biosynthesis in developing oat primary leaves [J]., 1986, 250(2): 364-372.
[18] Koes R E, Spelt C E, Reif H J,.Floral tissue of(V30) expresses only one member of the chalcone synthase multigene family [J]., 1986, 14(13): 5229.
Cloning and expression analysis of chalcone synthase gene from
CHENGBo, MANERHABAHairula, HEJiang
Key Laboratory of Xinjiang Uighur Medicine, Xinjiang Institute of Materia Medica, Urumqi, 830004, China
To clone the key gene of chalcone synthase (zbCHS) in flavonoid biosynthesis pathway of, analyze tissue-specific expression of the chalcone synthase, construct the prokaryotic expression vector and induce the recombinant protein to express.Based on the transcriptome data of Zb in the previous study, the full-length cDNA of ZbCHS was cloned by RT-PCR and bioinformatics analysis was performed.The RT-PCR was used to analyze the tissue-specific expression of ZbCHS.The prokaryotic expression vector pET28a-CHS was constructed, transformed into BL21 (DE3) competent cells and the expression of recombinant protein was induced by IPTG.The size ofgene was 1226 bp, containing an open reading frame (ORF) of 1176 bp and encoding 319 amino acids.The theoretical molecular weight of ZbCHS protein was 42 848.37.The encoded protein was located in the cytoplasm without a transmembrane region and signal peptide.It was a non-secretory protein with one glycosylation site and 31 phosphorylation sites.The α-helix was a large number of structural elements in that polypeptide chain, which was scattered throughout the peptide chain.Phylogenetic analysis indicated that the sequence of the amino acids was most closely related to,, andof Real-Time PCR showed thatgene was expressed in all tissues, with a higher expression level and a relatively lower expression level in roots and stems.Prokaryotic expression vector pET28a-CHS was expressed in BL21(DE3) competent cell expression system after induction by IPTG, and its molecular weight was 42 800, which was consistent with the prediction.Through the full-length cDNA cloning ofgene, tissue-specific expression analysis and prokaryotic expression vector construction, we can provide the basis for further study on the biosynthesis and gene regulation of ZbCHS gene in, and finally lays the foundation for the improvement of the quality of this herb.
Juz.; CHS; gene clone; real-time PCR; prokaryotic expression
R282.12
A
0253 - 2670(2022)10 - 3134 - 08
10.7501/j.issn.0253-2670.2022.10.024
2021-09-06
国家自然科学基金资助项目(81860748);新疆维吾尔自治区自然科学基金资助项目(2017D01B45);国家中医局青年岐黄学者项目
程 波,硕士,研究方向为植物功能基因组学及生药学。E-mail: chengbo0417@163.com
通信作者:何 江,研究员,博士,研究方向为生药与药用植物资源。E-mail: hj_1211@163.com
[责任编辑 时圣明]
