秦岭太白山不同植被带土壤团聚体碳库变化及温度敏感性
2022-05-20王福慧周林燕郭垚鑫任成杰白红英孙昊田赵发珠
王福慧,周林燕,胡 汗,王 俊,郭垚鑫,任成杰,白红英,孙昊田,赵发珠,*
1 陕西省地表系统与环境承载力重点实验室,西安 710127 2 西北大学城市与环境学院,西安 710127 3 西北大学生命科学学院,西安 710127 4 西北农林科技大学,杨凌 712100
森林土壤作为陆地生态系统中最大的有机碳库(约800—1200 Pg C),占全球土壤碳库的40%,每年向大气中排放约40 Pg C,相当于大气CO2存量的5%[1]。因此,即使森林SOC矿化速率产生微小的变化也会对大气环境中CO2含量和全球的碳储量产生深远的影响[2]。在气候变暖的背景下,研究人员开始关注温度对土壤碳库分解速率产生的影响,这是因为升温可能会加速土壤SOC的矿化[3]。通常把SOC矿化速率对变暖的响应称为温度敏感性,定义为温度升高10℃时SOC矿化速率的相对之比[4],表示为Q10。近些年来,全球范围内开展了一些的探究Q10影响因素的研究,但是由于样地环境因素的差异导致了一些有争议的结论[5]。例如,周学雅的研究认为团聚体的物理保护对土壤微生物呼吸速率及Q10具有显著性影响[6];Ghosh等人的研究则认为Q10主要受到胞外酶活性的控制[7];而Haddix等人认为不同纬度或海拔梯度造成的环境差异也会显著影响Q10[8]。这些研究使我们提高了对Q10及其潜在影响因素的理解,但是结论的不确定性促使我们需要对Q10的影响因素进行全面综合的研究,以揭示土壤有机碳矿化受到温度控制的固有本质[9]。
海拔梯度的本质是在气候梯度的差异下形成的不同的植被带,并且在相似的海拔梯度上聚集了很多的微生物群落。全球变暖下,土壤碳库沿海拔梯度的分解具有很多的影响因素,其中包括土壤团聚、碳库组成差异等生物及非生物因素[10]。其中土壤团聚作用会造成团聚体粒径差异并限制氧气扩散、底物接触对有机碳提供的物理保护,根据土壤团聚体粒径的大小将其分为大团聚体、中团聚体、小团聚体[11]。土壤有机碳库根据其周转时间的长短将其分为活性碳库,缓效碳库和惰性碳库[4]。据C quality-temperature(CQT)假设,具有较高分解能的惰性碳库具有较高的Q10[4],这种假设的机制不仅受到土壤微生物群落和胞外酶活性的影响,还会受到海拔梯度造成的土壤团聚、土壤底物、植被类型和土壤特性等的影响,但其中的具体机制我们尚不清楚。并且,在对沿海拔梯度变化导致的升温引起不同粒径团聚体的Q10变化的综合性研究很少,这降低了CQT假设的适用范围和结论的准确性[4]。
因此,为了研究沿海拔梯度不同粒径团聚体各碳库的Q10的差异及其影响因素,本研究将选取太白山北坡的四个不同海拔植被带(锐齿栎林Quercus aliena var.acuteserrata、辽东栎林Quercus liaotungensis、红桦林Betula albo-sinensis、牛皮桦林Betula albo sinensisvar.septen-trionalis)的0—10 cm表层土壤[2]。在土壤处于原位温度条件下培养的同时,并且为了保证Q10计算的准确性及便捷性,本研究将土壤样品分别在5℃、15℃、25℃进行培养。本研究目的是:(1)确定各碳库组分和Q10在不同粒径团聚体之间和海拔梯度上的变化差异;(2)探讨各碳库Q10受到微生物特性的影响机制;(3)探究海拔梯度上环境因子对各碳库Q10的潜在影响。
1 材料与方法
1.1 研究区概况与样品采集
研究区处于陕西省秦岭山脉中段太白山(N 33°49′—34°10′,E 107°19′—107°58′),太白山是秦岭山脉的主山峰,也是中国西部的最高峰,年均气温为1.8—2.1℃,年均降雨量为800—900 mm,降雨主要集中在夏季。太白山具有极其丰富的生物多样性、巨大的植被固碳潜力、完整的垂直植被带梯度,可以典型代表国内森林生态系统,为展开森林碳库分解、土壤呼吸的一系列研究提供得天独厚的实验平台。本研究选取了四个沿海拔梯度分布完整、林带明显且样地皆以棕壤为主的不同典型垂直植被林带,分别是锐齿栎林(1100—1800 m)、辽东栎林(1800—2200 m)、红桦林(2200—2600 m)和牛皮桦林(2600—2800 m)[12]。
本研究于2018年7月进行植物样品采集,选择每一个采样点内典型代表植物为调查对象,于上述样地内分别设置乔木层样方(10 m×10 m)、灌木层样方(2 m×2 m,灌木层样方设置于每一个乔木层样方的中心和四角,灌木层样方数量是乔木层样方数量的5倍)、草本层样方(1 m×1 m,草本层样方设置于每一个灌木层样方的中心和四角,草本层样方数量是灌木层样方数量的5倍)。统计各个样方内的乔木层、灌木层、草本层中所有植物的种类数。以上方法均是由相同的2名观察者同时观察与鉴定(即如果存在误差,则所有海拔都存在相同的误差),并记录这些样方中每个物种的总数。
本研究于2019年7月进行土壤采样,在海拔1503,1915,2405,2600m处选取了地形、地貌、坡向基本相似的采样点(采样地的具体信息详见表1)进行土壤、凋落物、叶片、根系的样品采集。采样的具体步骤为:在每个海拔的采样地选择3个采样样方(25 m×25 m),然后在每个样方中以“S”型设立10个采样点(1 m×1 m),先去除采样点的弃土层,在表层土样上盖住厚铝盒,使用橡胶锤将铝盒打入土壤,接着用工兵铲清除周围土壤后,将厚铝盒取出得到原状土。运回实验室后依照纹理将土壤掰开,剔除石块以及其杂质等,然后过8 mm筛网,并混合同一样地的样品。
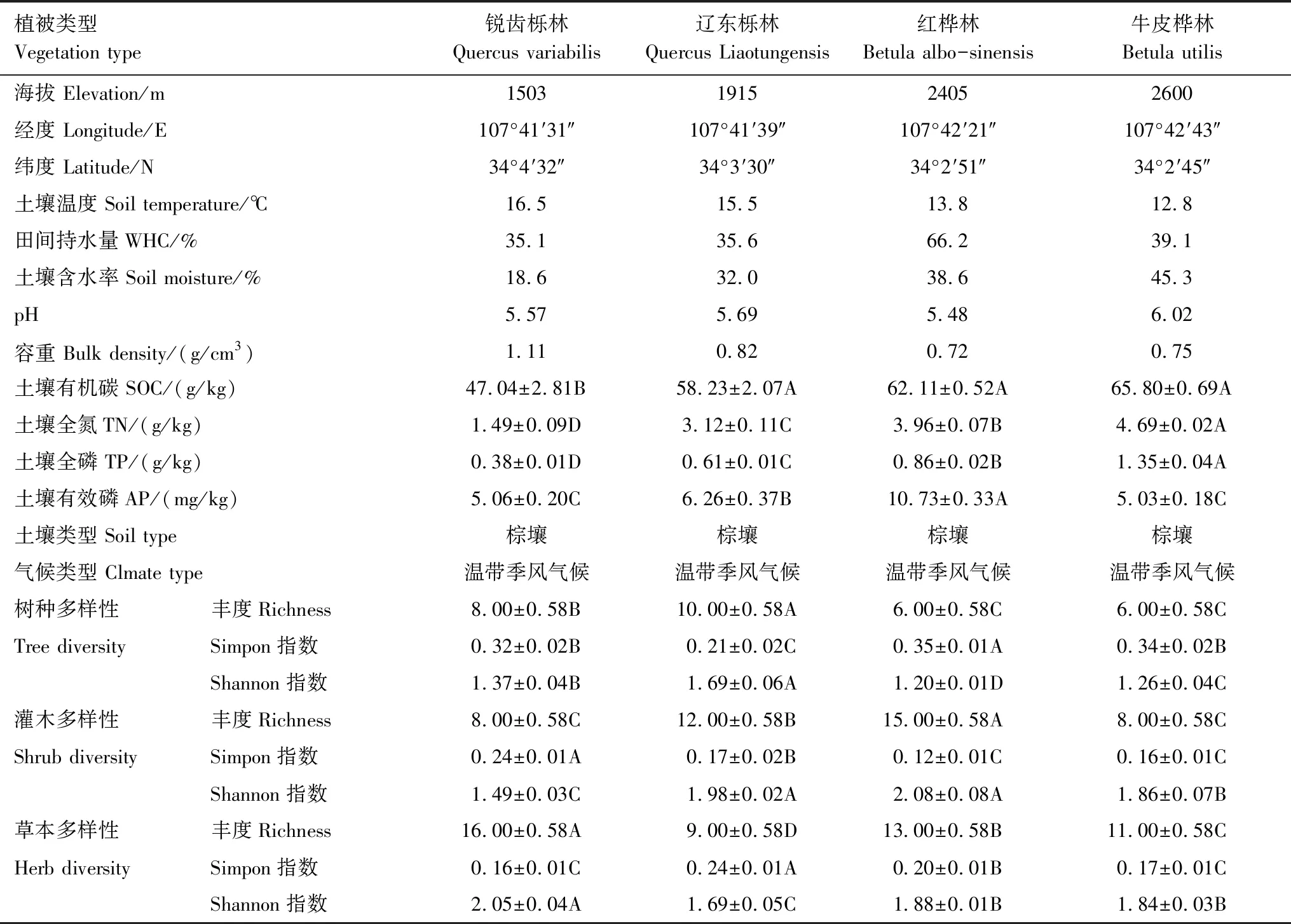
表1 采样地基本信息Table 1 Basic information of sampling point
土壤样品的分离采用干筛法[13]。在土壤半干状态下,将大块土壤捏碎,避免结成硬块,待土壤相当干燥时进行筛分,以保持团聚体的结构强度,避免破坏团聚体结构[14—15]。将风干的土样混匀,取500 g。用孔径分别为2 mm、0.25 mm筛子进行筛分(筛子附有底和盖)。筛完后得到大团聚体(>2 mm)、中团聚体(0.25—2 mm)和小团聚体(<0.25 mm)[11,16]。将筛分后的不同粒径的各团聚体的土壤分成三份相等的部分:第一部分储存于4℃下,测量土壤初始微生物量碳和土壤胞外酶活性;第二部分在室温下避光风干,接着测量其初始土壤理化性质;第三部分储存于厚铝盒中,进行培养实验(具体方法详见1.2)。
1.2 团聚体微生物呼吸及其相关环境因子测定
土壤预培养实验前1天测量土壤样品到达田间持水量时的土壤重量。预培养实验正式开始后,调节RXM-280A型培养箱保持恒湿,前20天每天进行测重并补充差量水分,从第20—60天每3天进行补水,第60天到实验结束每7天进行补水,从而保证持水量达到田间持水量的60%[17]。将预培养好的每个重复的土壤分为两个部分:第一部分为400 g,用于培养期间进行采样;第二部分为300 g,用于测定土壤呼吸。两个部分分别装在不同的500 mL玻璃培养瓶中,所有实验条件等同。将这些培养瓶在3个不同的恒定温度下进行培养(5℃,15℃,25℃),共计103天。期间使用LI-8100A碳通量自动测量仪(产自LI-COR,美国)测量其土壤呼吸,每个呼吸瓶测量3次。103天中,总计测量呼吸66次,于前1—39天每天测量,40—68天每两天测量,70—103天每三天测量。此外,在培养的第5,10,20,30,40,60,80,100天,分别在3个重复的取样瓶中每一个取出50 g土壤(共计150 g土壤×4个海拔×3个温度×3个粒径),测定培养期间的土壤理化性质、微生物量碳和胞外酶活性。
土壤水分(SM)通过在105℃下干燥24 h后称重进行测量。土壤容重采用环刀法测定。土壤有机碳(SOC)采用K2Cr2O7氧化法进行测定[18]。采用氯仿熏蒸-K2SO4提取和过硫酸钾消化法估算微生物量碳(MBC)[19—20]。采用96孔微孔板荧光法测定团聚体中3种碳获取水解酶活性(β-葡萄糖苷酶,β-1,4-glucosidaseBG;β-木糖苷酶,β-1,4-xylosidase,BX;纤维二糖水解酶,cellobiohydrolase,CBH);采用吸光光度法测定2种碳获取氧化酶活性分别是过氧化物酶(Peroxidase,PER)和多酚氧化酶(Polyphenol oxidase,PPO)。
1.3 数据处理与分析
1.3.1植物群落多样性
通过计算不同物种的重要值(Importance value,IV,单位为%),以用于反映该物种在采样样方中的优势程度。具体而言,分别将菊科、豆科和禾本植物的物种重要值相加,以计算3种植物科在不同海拔上的植物群落的占比。物种重要值的计算公式如下:
(1)物种重要值:

式中,相对盖度、相对高度、相对密度计算公式如下:

(2)物种丰富度:
物种丰富度(richness)=出现在样地内的物种数
(3)植物α多样性:
本研究用Simpson index(D)和Shannon-Wiener diversity index(H)来描述物种多样性。这两个值用以下公式计算:
式中,S、Pi和Ni分别是物种i的总数、i物种的密度比例和个体总数。
1.3.2土壤呼吸与三库模型
根据驻留时间的不同,本研究将SOC分为3个独立的碳库:活性碳库、缓效碳库、惰性碳库。三库的具体计算方式如下[10,21]:
Ri=Ci×e-ki×t
式中,Rcum表示土壤呼吸的累积量,其值为3个库的土壤呼吸之和;Ci表示3个碳库的碳库分解速率(i=1、2、3代表活性碳库、缓效碳库、惰性碳库);Ch和Cl分别是高温(Th)和低温(Tl)时的土壤呼吸速率;Q10表示温度升高10℃时SOC分解速率的相对比例变化[4],fi表示3个碳库的碳库分解速率占总分解速率的比例,且fi的总和为1;ki表示3个池的分解率。fi和ki是根据Bayes′ theorem来计算的[21]。
P(θ|z)∝P(z|θ)P(θ)
该模型的参数(θ)(包括f和k)和后验概率密度函数PDFP(θ|z),其来源于prior knowledge of parameters-PDFP(θ)以及本研究在336天内测量的土壤呼吸的似然函数P(z|θ)。其中,该似然函数P(z|θ)的计算是基于模型拟合值和观测值之间的误差彼此独立,并且服从均值为0的多元高斯分布(multivariate Gaussian distribution):
式中,Xi(t)和Zi(t)是模型拟合和测量出的累积呼吸的值,而σi(t)是测量值的标准偏差。使用Metropolis-Hastings(M-H)算法构造posterio-rPDFs参数[22]。具体步骤如下:
(1)依照以下公式得出θnew:
θnew=θold+d(θmax-θmin)/D
式中,θmax和θmin分别是给定参数范围内的最大值和最小值;d是一个随机变量(-0.5 (2)本研究检验该θnew是否服从上述多元高斯分布,如果是,则接受该参数,如果否,则舍弃该参数。 将上述过程多次重复(本研究中重复了100万次,其中接受参数优化大约在15万次),可以使参数得到有效的优化,使得本实验中的土壤呼吸值与三库模型累积值的拟合度r2均达到99以上。 1.3.3胞外酶活性 为了达成实验目的,本研究将木质素酶的活性由PER和PPO的活性平均值代表,纤维素酶的活性由BG、BX、CBH的活性平均值代表,通过以下公式来表示并计算生态化学计量比(木质素酶:纤维素酶(Ligninase:Cellulase))[23]: 式中,BG表示β-葡萄糖苷酶的活性,BX表示β-木糖苷酶的活性,CBH表示纤维二糖水解酶的活性,PER表示过氧化物酶的活性,PPO表示多酚氧化酶的活性。 1.3.4Mantel 分析 以上公式通过归一化如下: 式中,r即为距离矩阵的相关性,取值范围为(-1,1);x是四个植被带、三种培养温度、三种粒径团聚体下的Q10、MBC、胞外酶活性组成的12×10矩阵;y是植被类型、土壤环境、土壤特性、土壤底物四类因子各数据按x矩阵i排列顺序相对应组成的12×17矩阵;i、j代表元素在矩阵中的位置;¯x、¯y代表矩阵元素的均值;n是距离矩阵中的元素数;s是矩阵的标准差[24]。 1.3.5数据分析 使用基于邓肯检验(Duncan′s multiple range test)的单因素方差分析(one-way analysis of variance,ANOVA)以用于分析土壤、凋落物、根系、叶片的理化性质的差异性。使用斯皮尔曼相关性(Spearman′s correlation)探究碳库温度敏感性和微生物量、胞外酶以及其计量比之间的相关性。以上分析均在SPSS 22.0中完成(SPSS 22.0 for Windows,Chicago,IL,US)。使用MATLAB(MATLAB 2017b,MathWorks,US)计算三库模型中的参数,包括Pi,Ri,fi,ki以及三库的驻留时间。使用Origin 9.4绘制图1、图2、图3,使用Rstudio(Rstudio for Windows,version 1.2.5033)绘制图4。 由表2可知,各粒径团聚体占全土比例随团聚体粒径增大而增大,四个海拔上小团聚体、中团聚体、大团聚体平均占全土比例分别为10.0%、39.0%、51.3%。四个海拔上团聚体平均质量直径(MWD)以及几何平均直径(GMD)出现最大值的均是锐齿栎林,分别为2.17、1.67 mm,出现最小值的均是红桦林,分别为1.83、1.32 mm。本研究发现,各粒径团聚体间土壤有机碳含量的变化规律与团聚体分布规律相反,呈随粒径增大而减小的规律,其中锐齿栎林上有机碳含量减小最多为66.7%,辽东栎林上减小最少为12.2%。对于相同粒径的团聚体,土壤有机碳含量会随着海拔的升高而升高,具体地说以牛皮桦林各团聚体有机碳含量最多,大团聚体、中团聚体、小团聚体有机碳含量分别为60、73、80 g/kg;锐齿栎林上各团聚体有机碳含量最小,大团聚体、中团聚体、小团聚体有机碳含量分别为36、50、60 g/kg。 表2 不同植被带团聚体颗粒组成Table 2 Aggregate particle composition of different vegetation belts 在100天的培养过程中,本研究发现在温度相同的条件下,团聚体SOC累计矿化量均随海拔梯度升高而增加,具体地说随着海拔升高,大、中、小团聚体矿化量在5℃下增加了7.33%、5.08%、2.81%;在15℃下增加了10.35%、9.53%、3.80%;在25℃下增加了14.64%、17.45%、3.63%(图1)。值得注意的是,本研究发现在四个海拔、3个培养温度下均以小团聚体的SOC矿化率最低,在四个海拔上小团聚体矿化率在5℃、15℃、25℃分别为14.08%—15.56%、21.71%—23.79%、33.56%—37.62%(图1)。在各团聚体之间,以小团聚体中惰性碳库比例最大,各海拔平均为66.08%;活性碳库比例最小,各海拔平均为14.20%,有趣的是,本研究观察到随着海拔的升高,大团聚体、中团聚体、小团聚体的惰性碳库比例分别升高5.89%、17.41%、23.94%,大团聚体、中团聚体、小团聚体的活性碳库比例降低7.15%、7.05%、16.31%,(图1)。本研究还发现在三种培养温度下各碳库的SOC矿化速率均随培养时间下降,以活性碳库表现的最明显,具体地说活性碳库矿化速率在最初达到最大值,短期内迅速下降,随后稳定下来处于缓慢下降状态,在5℃、15℃、25℃培养20天后矿化速率平均下降了58.25%、80.92%、93.08%(图1)。 图1 四个植被带上各粒径团聚体土壤有机碳矿化动态Fig.1 Soil organic carbon decomposition dynamics of aggregates with different particle sizes on four vegetation zones 由图2可知,团聚体的Q10值介于1.47—5.26,团聚体的Q10随着海拔的升高而增加,并且相同粒径团聚体中各碳库的Q10均随海拔升高而变大,具体地说惰性碳库T1Q10、T2Q10值分别平均增加了0.51、0.32;缓效碳库T1Q10、T2Q10值分别平均增加了0.22、0.27;活性碳库T1Q10、T2Q10值分别平均增加了0.34、0.19。在不同碳库之间Q10存在显著性差异(P<0.05),表现出惰性碳库>缓效碳库>活性碳库,惰性碳库的T1Q10、T2Q10分别平均为5.24、4.52;缓效碳库的T1Q10、T2Q10分别平均为4.25、3.59;活性碳库的T1Q10、T2Q10分别平均为2.93、1.92(图2)。在相同海拔、同一粒径团聚体中,T1Q10与T2Q10存在显著性差异(P<0.05),表现出随温度升高而降低的现象即T1Q10>T2Q10(图2)。此外,在相同海拔、同一温度梯度中,不同粒径团聚体的Q10之间无显著性差异(P>0.05)(图2)。 图2 四个植被带上各粒径团聚体土壤有机碳矿化温度敏感性(Q10)Fig.2 Temperature sensitivity of soil organic carbon decomposition(Q10)of aggregates of various sizes on four vegetation zones QVA:锐齿栎林Quercus aliena var.acuteserrata;QW:辽东栎林Quercus liaotungensis;BA:红桦林Betula albo-sinensis;BAV:牛皮桦林Betula albo-sinensisvar.septen-trionalis;T1指5℃与15℃的温差,T2指15℃与25℃的温差;不同字母表示不同植被带上,相同碳库Q10差异显著,P<0.05 团聚体的MBC随着培养时间,各海拔、各温度下均呈现先升高后下降的趋势,且在不同粒径团聚体之间MBC无显著性差异(P>0.05)(图3)。本研究观察到MBC在开始的20—30天内达到最大值,在培养的第20天,5℃、15℃、25℃培养温度下的MBC相对于第1天升高了16.81%、36.98%、40.33%;在培养的第40天,5℃、15℃、25℃培养温度下的MBC相对于第1天升高了14.04%、6.74%、9.83%;在整个培养期末期各团聚体的MBC达到最低值,5℃、15℃、25℃培养温度下的MBC相对于第1天降低了50.76%、49.56%、59.30%(图3)。此外,本研究发现ln(Ligninase):ln(Cellulase)随培养时间呈现缓慢升高的趋势,在培养的第10天其相对于第1天平均升高了2.21%,在培养的第40天其相对于第10天平均升高了2.79%,在培养的第100天其相对于第40天平均升高了2.71%(图3)。 图3 四个植被带上各粒径团聚体微生物量碳及ln(Ligninase):ln(Cellulase)变化动态Fig.3 MBC and ln(Ligninase):ln(Cellulase)change dynamics of aggregates of various sizes on four vegetation zonesMBC:微生物量碳Microbial biomass carbon;Ligninase:木质素酶;Cellulase:纤维素酶 本研究发现在4个海拔上活性碳库的Q10与MBC、BG呈极显著性相关(P<0.01),与CBH、PPO、ln(Ligninase):ln(Cellulase)呈显著性相关(P<0.05),然而与BX、PER无显著性相关(P>0.05)(图4)。缓效碳库在四个海拔上与PPO呈显著性相关(P<0.05),与MBC、PER、BX、ln(Ligninase):ln(Cellulase)呈极显著性相关(P<0.01),与CBH、BG无显著性相关(P>0.05)(图4)。惰性碳库在四个海拔上与PPO、BX、ln(Ligninase):ln(Cellulase)呈显著性相关(P<0.05),与MBC、PER呈极显著性相关(P<0.01),与CBH、BG无显著性相关(P>0.05)(图4)。本研究在Mantel分析中还发现植被类型、土壤特性、土壤环境、土壤底物与活性碳库Q10、MBC、BG呈显著性相关(P<0.05),与缓效碳库和惰性碳库均无显著性相关(P>0.05),其中植被类型、土壤特性与BX、ln(Ligninase):ln(Cellulase)呈显著性相关(P<0.05)(图4)。 图4 各碳库Q10与胞外酶的相关性分析及环境因子Mantel分析Fig.4 Correlation analysis of each carbon bank Q10 and extracellular enzyme and environmental factor mantel analysis P1:活性碳库;P2:缓效碳库;P3:惰性碳库;BX:β-木糖苷酶 β-1,4-xylosidase;BG:β-葡萄糖苷酶 β-1,4-glucosidase;CBH:纤维二糖水解酶 cellobiohydrolase;PER:过氧化物酶 Peroxidase;PPO:多酚氧化酶 Polyphenol oxidase;Lig.Cell:ln(木质素酶):ln(纤维素酶)ln(Ligninase):ln(Cellulase);植被类型:植被多样性;土壤特性:BD、pH;土壤环境:ST、SM;土壤底物:及Mantel相关性R2;P:Mantel相关性P值;*、**、***分别代表Spearman相关性P<0.05、P<0.01、P<0.001 本研究的结果表明,惰性碳库相较活性碳库和缓效碳库具有较高的Q10。这符合C quality-temperature(CQT)假设[4,9],即具有较高分解能的顽固性SOC具有较高的Q10[25],大部分已经发表的培养实验均支持这种猜想,例如Knorr和Conant等的研究[26—27]。然而也有研究得出相反的结论,例如Cusack和Liski等认为活性碳库的Q10更高或者不同碳库的Q10相等的结论[28—29],Wang等的meta分析认为造成这种差异的原因是Q10可能还会受到土壤团聚和胞外酶的影响[4],但本研究的实验结果表明Q10值在不同粒径的团聚体之间无显著性差异。以上证据说明惰性碳库可能是变暖导致改变全球CO2升高的主要因素[30—31],其Q10值对SOC循环与全球气候变化之间的反馈具有重要意义[4]。相反,活性碳库主要由不完全分解的植物残渣和微生物生物量组成[28],其Q10较小、具有较短的驻留时间,不会显著地促进上述积极反馈,这与Lin和Wang等人的研究结果一致[25,32]。然而,也有Giardina和Liski等人研究认为是由活性碳库引起变暖造成SOC矿化加速从而诱导的CO2排放升高[29,33],这表明碳库的温度敏感性还可能会受到多种环境因素的影响[34],例如矿物质的吸附和微生物的生理特性等[35]。此外,本研究还发现团聚体的Q10和SOC累计矿化量随海拔的升高而增加,可能的原因是惰性碳库随海拔升高而增加[36]。 本研究发现团聚体Q10值随着培养温度的升高而降低,即T1Q10>T2Q10[1],该结果与Wang和Qi等人的实验结果相一致[4,37],这是因为温度升高有利于SOC与腐殖酸盐复合物的解吸并降低物理保护以加速SOC矿化[11,22],从而增加了不稳定SOC库的大小[38]。然而Mikan等人的研究认为Q10值随着温度的升高而升高[39],可能的原因是这些研究地区大部分位于高纬度地区[4],另外Bekku等研究表明Q10值与温度的变化无明显相关[40],造成差异的原因可能是研究区域土壤类型、凋落物的输入或者微生物群落之间存在差异[1]。有趣的是,本研究发现小粒级团聚体的SOC矿化率最低[10],与王菁的结论相同[41],可能的原因是小粒级团聚体中有机碳多为微生物来源的腐殖质[11],如胡敏酸和腐殖酸[4],有机质腐解程度较高,更难被微生物分解利用[4]。 相关性研究的结果表明,团聚体的Q10受到MBC和胞外酶的影响[42—43],但不同碳库Q10对MBC和胞外酶的变化表现出不同的响应[9,44],本研究的实验结果验证了Wang等人的猜想[4]。具体地说,活性碳库的Q10与MBC、CBH、BG之间存在相关关系,惰性碳库和缓效碳库的Q10与PER、PPO、ln(Ligninase):ln(Cellulase)之间存在相关关系[18,45]。可能的原因是一方面活性碳库的矿化强烈依赖于MBC[46—47],而升温会导致MBC的减少从而降低活性碳库的矿化速率[26,48];另一方面基于米氏方程,酶的活性主要取决于底物可利用性[26,49],在培养初期升温会导致微生物群落提升降解不稳定C的酶(CBH、BG)产量[50],这会加速不稳定C的矿化[51],随着底物的可利用性降低CBH的产量也会降低,这会进一步降低活性碳库的矿化速率[26,45],最终两个方向的作用相互叠加会导致活性碳库对温度的不敏感[31,52],这样的响应都表现在本研究的实验结果中。值得注意的是,升温导致土壤活性碳库的消耗殆尽[53—54],微生物群落会增加BX、PER、PPO的产量[6],这些酶主要参与难分解C的矿化[45],适应土壤活性碳库和惰性碳库比例的变化并利用缓效碳库和惰性碳库中的难分解C[31],这会导致惰性碳库对温度的敏感性升高;另一方面Meng、Chen等研究结果认为升温引起的可利用性碳的增加会导致微生物对氮的需求增加[31,48],在这种情况下微生物群落会倾向于矿化含氮的来自惰性碳库的木质素[55],这些酚蛋白复合物的分解主要通过木质素酶的解聚[56],这导致了PPO、PER的产量增加[56],并且,Sinsabaugh等研究发现由于低温和低氧含量通常会抑制木质素酶的的活性[49],因此升温导致的土壤温度升高和土壤水分减少可能会刺激酶的活性并提高氧气利用率[57],本研究的结果支持了这种假设,因为在40天后代表底物分解偏好的ln(Ligninase):ln(Cellulase)持续升高[26,45],这样的响应会加剧惰性碳库对温度的敏感性。重要的是,这证明了升温可能会通过直接影响胞外酶和MBC从而间接加速惰性碳库的矿化造成全球变暖[4]。 (1)对于Q10而言,各团聚体Q10表现出随海拔升高而增加,随温度升高而降低(T1Q10>T2Q10)的现象,并且符合惰性碳库Q10>缓效碳库Q10>活性碳库Q10的规律。 (2)中团聚体中含有较高的活性碳库和缓效碳库,而小团聚体中含有高的惰性碳库,大团聚体的三库比例均处于小团聚体和中团聚体之间。这表明小团聚体含较多稳定的碳组分,而中团聚体含有较多活跃的碳组分,大团聚体是中团聚体与小团聚体的混合物。 (3)微生物会通过改变胞外酶的活性影响各碳库的温度敏感性。具体而言,CBH、BG与活性碳库的温度敏感性相关,BX、PER、PPO与缓效碳库和惰性碳库的温度敏感性相关。植被类型、土壤特性、土壤环境、土壤底物会通过影响微生物特性控制活性碳库的Q10。
2 结果分析
2.1 团聚体分布及有机碳含量
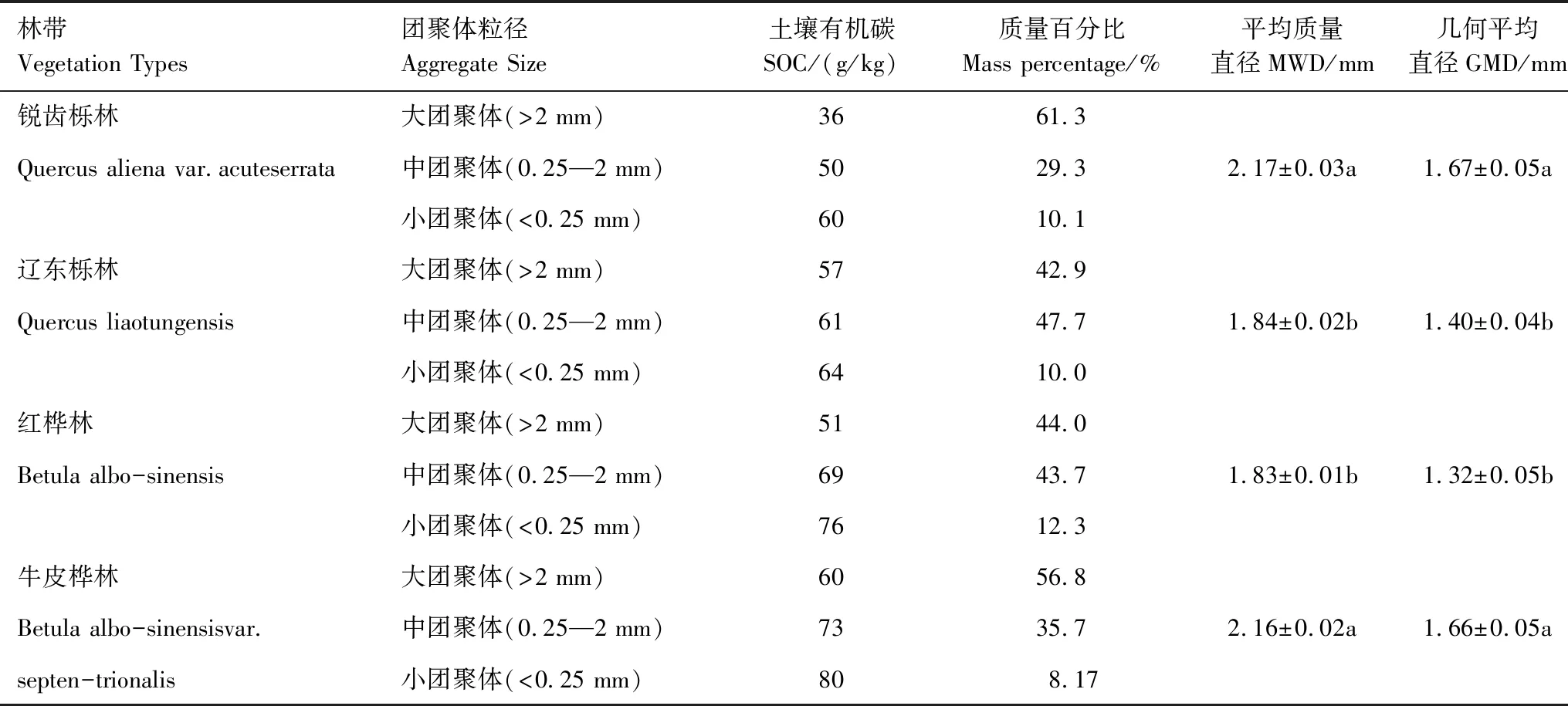
2.2 三库模型下团聚体有机碳矿化
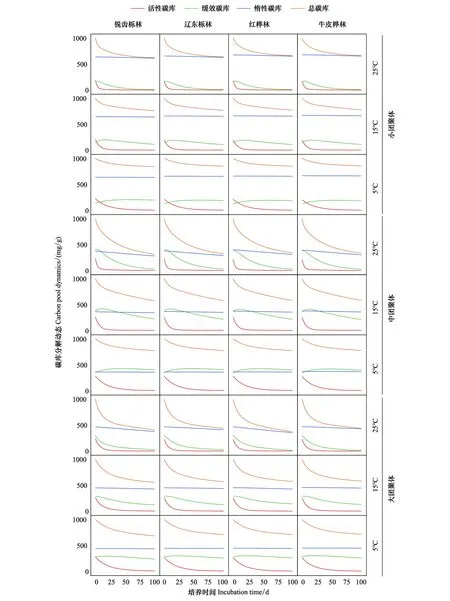
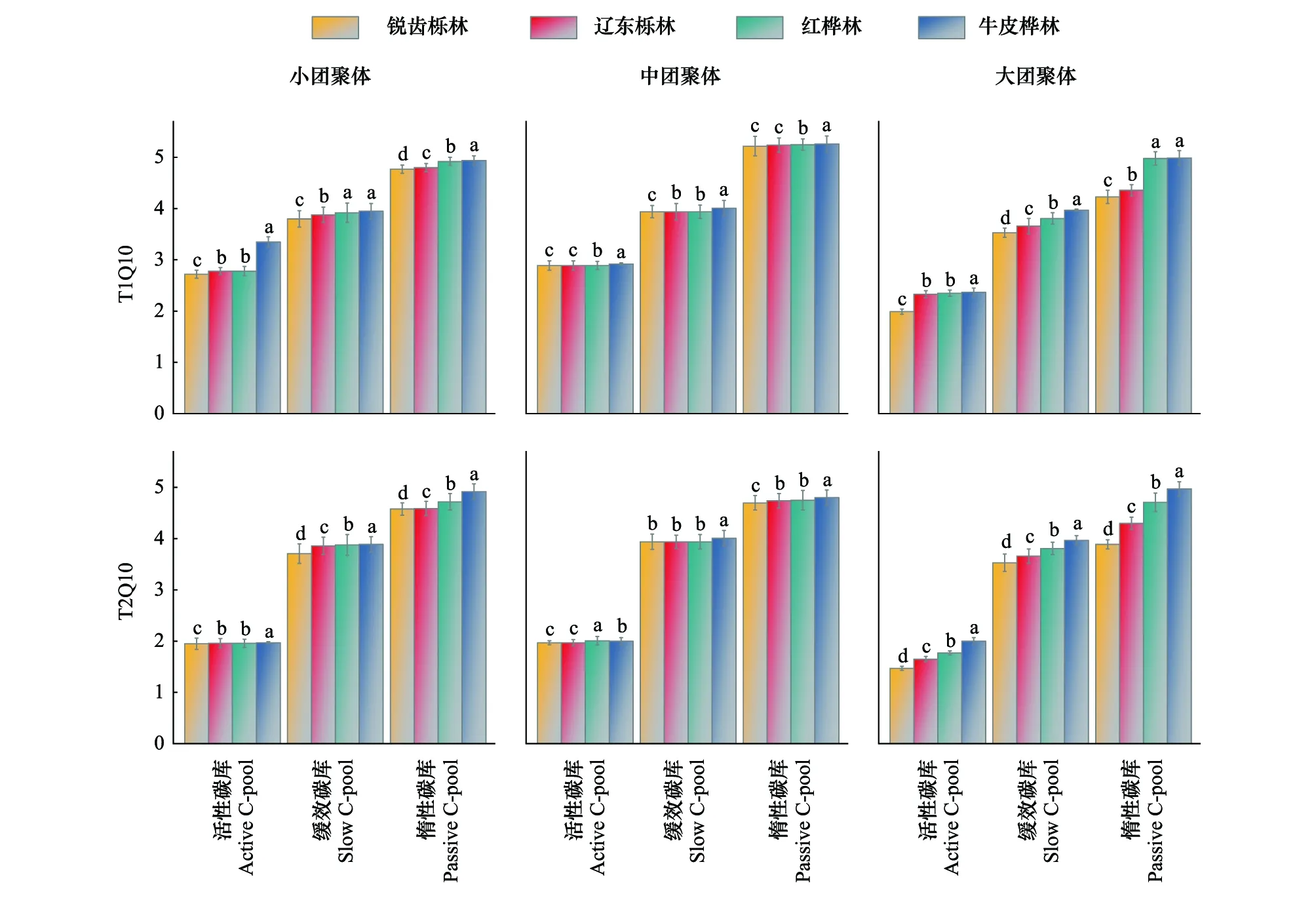
2.3 团聚体有机碳矿化温度敏感性
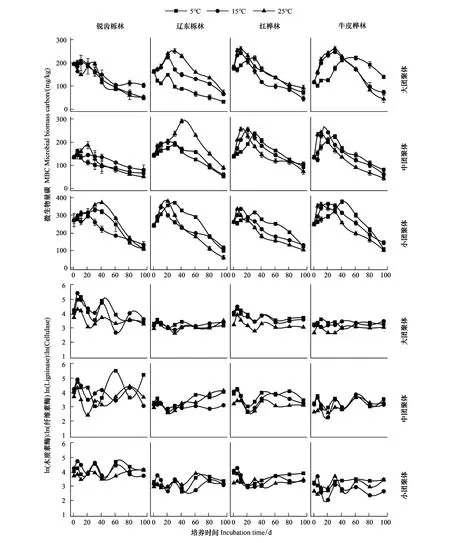
2.4 团聚体微生物量碳和胞外酶活性的变化
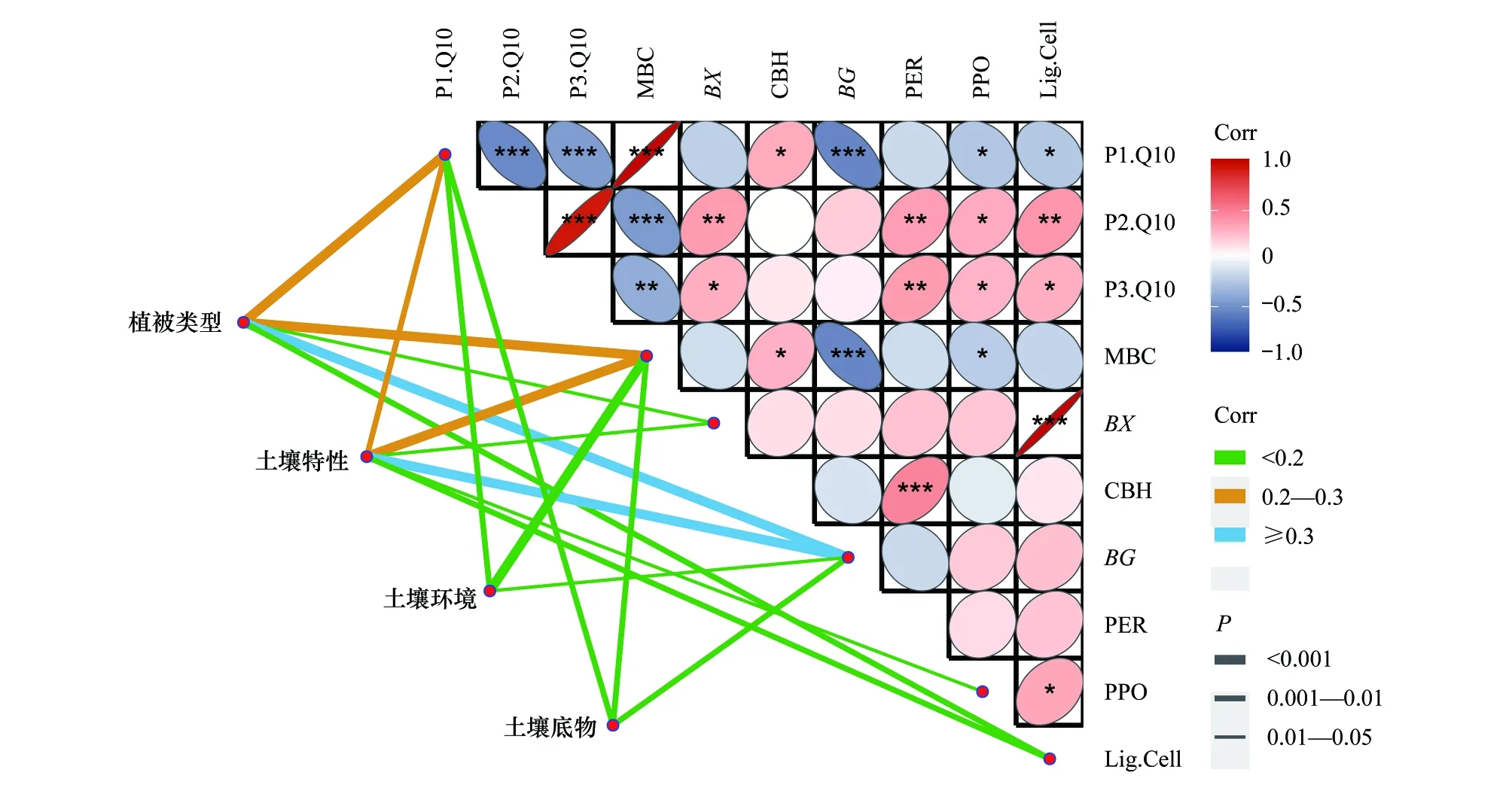
2.5 微生物量和胞外酶对Q10的影响
3 讨论
3.1 海拔梯度上各团聚体不同碳库的矿化及Q10差异
3.2 海拔梯度上微生物活性及环境因子对Q10的影响
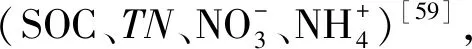
4 结论
