水产养殖不同物种对水体和沉积物中细菌群落的影响
2022-05-20张弘杰徐慧敏过梓栩赵大勇
张弘杰,徐慧敏,过梓栩,何 斐,曾 巾,赵大勇
1 河海大学水文水资源与水利工程科学国家重点实验室,南京 210098 2 生态环境部南京环境科学研究所,南京 210042 3 湖泊与环境国家重点实验室,中国科学院南京地理与湖泊研究所,南京 210008
水产养殖业是农业的重要组成部分,也是全球最大的食品产业之一[1]。近年来,克氏原螯虾(Procambarusclarkii)、中华鳖(Pelodiscussinensis)等重要淡水物种的人工养殖发展迅速[2]。克氏原螯虾隶属于十足目(Decapoda)、螯虾科(Astacidae)[3],是我国养殖最广的淡水螯虾品种[4]。中华鳖属龟鳖目(Testudinata)、鳖科(Trionychidae)[5],在我国分布广泛,药用价值极高,是我国重要的淡水养殖物种之一[6]。
细菌是生态系统中的重要组成部分[7]。在水产养殖系统中,细菌既能作为分解者降解养殖动物无法利用的有机质,又可以作为养殖动物的直接或间接饵料[8]。此外,细菌群落对环境的变化十分敏感,其与周围的环境因子相互作用、往复调控[9]。在水产养殖的水体中,细菌群落的结构、多样性等均随水环境的变化而改变,水体细菌群落的变化又会对水环境造成影响[10],因此,对养殖环境中的水体细菌群落进行深入研究具有重要意义[11]。除养殖水体外,沉积物也是细菌附着的主要介质[12]。大量的细菌富集于沉积物中,通过同化、异化等代谢过程来影响沉积物中营养盐的分布、转化和利用等[13]。因此,沉积物中的细菌群落可以作为水环境变化和演替的重要标志[14],探究水产养殖对沉积物中细菌群落的影响也具有重要意义。
近年来,快速发展的高通量测序技术由于其具有通量大、测试结果准确等优点成为准确、便捷和全面地研究养殖系统中的细菌群落结构和组成的研究手段之一[15]。胡常巨等人[16]利用高通量测序技术探究网箱养殖对水环境细菌群落的影响,表明养殖活动显著改变了养殖水环境中浮游细菌群落结构。陶玲[11]利用高通量测序技术研究发现,稻田—池塘复合循环水养殖系统与常规池塘养殖系统中的细菌群落结构存在差异。但目前的研究大多是对比水产养殖(或某种特殊的养殖系统,如循环水养殖系统)和天然水体细菌群落的差异[17—18],鲜有研究利用高通量测序技术,对养殖不同物种的水环境细菌群落进行深入探究。而水产养殖不同物种对水环境中的细菌群落可能产生完全不同的影响[19]。不同物种的生活习性和管理方式等可能会对细菌群落产生不同的影响,而不同的细菌群落又可能会对养殖水环境或作物产生不同的影响[20]。因此,利用高通量测序技术对养殖不同物种的水体和沉积物中细菌群落进行深入研究,对探究水产养殖对水环境中细菌群落的影响有着重要意义。克氏原螯虾和中华鳖是两种在生理特性、生活习性及管理方式等方面具有明显差异的淡水养殖物种。克氏原螯虾是杂食性动物,生长发育较快,挖洞能力强,抗逆力很强,能生活在一些轻度污废水中[21]。中华鳖以肉食为主,生长发育相对缓慢,繁殖力低,具有上岸晒背的习性[5,22]。因此,我们预期养殖这两种作物会对水体和沉积物产生不同的影响。综上,本研究以养殖不同物种(克氏原螯虾和中华鳖)的水体和沉积物细菌群落为研究对象,以基于16S rRNA基因的高通量测序技术为研究方法,揭示了养殖不同物种的水体和沉积物间细菌群落α多样性、群落组成和优势细菌的异同,以期为养殖环境的维护和改善提供参考。
1 材料与方法
1.1 样品采集
本次研究的水体和沉积物样品均采集于江苏省省级精品渔业园(119°01′48″E,32°13′51″N)的多年轮作稻田(Oryzasativa:亚洲栽培稻)湿地。在实验开始前,利用不锈钢板将该湿地划分为两个区域,分别投放克氏原螯虾(Procambarusclarkii)和中华鳖(Pelodiscussinensis),并根据养殖物种分别命名为PC和PS区。该湿地首次尝试稻-虾/鳖共作的模式。PC和PS区均于2019年5月上旬进行水稻播种;6月底水稻插秧;7月上旬水稻进入返青分蘖期,此时投放幼虾(20—30 kg/hm2)和幼鳖(1500只/hm2);11月底收割水稻(共产出水稻360 kg);12月底—2020年1月初打捞克氏原螯虾和中华鳖。为保证PC和PS区中的本底微生物多样性和结构相似,两块稻田湿地的面积(5328 m2)、种植密度(46%)、管理方式和灌溉用水等均保持一致。为探究养殖不同作物对水体和沉积物细菌群落的影响,于养殖周期结束后(2020年1月)在上述2个区域中,各选择6个采样点,分别利用不锈钢采水器(HAD-WB-SS)和抓斗式采泥器(CN-100)采集水体(水面以下30—50 cm)和表层沉积物(0—3 cm)样品。为避免水稻根系微生物对沉积物样品的影响,在采集沉积物样品时,我们尽量避开水稻生长的地方,并确保所采集的样品中无水稻根系。收集到样品后,利用保温箱(4 ℃)冷藏,快速运回实验室。利用YSI 6600(YSI 6600,Yellow Springs,美国)对水体的温度(T)、pH和溶解氧浓度(DO)分别进行原位测定。
1.2 样品预处理
样品运回实验室后,利用真空冷冻干燥机(LABCONCO,美国)冻干沉积物样品,并在样品冻干后进行研磨和过筛(35目土壤筛)。取部分水体样品,用0.22 μm的硅胶微孔滤膜进行过滤,分别冷冻保存滤膜和滤液于超低温冰箱中(-70 ℃)。
1.3 样品理化指标测定

沉积物的总氮(TN)和总磷(TP)浓度也采用碱性过硫酸钾消解紫外分光光度法(HJ 636—2012)进行测定[23]。使用重铬酸钾氧化-分光光度法(HJ 615—2011)[26]测定沉积物的有机碳浓度(OC)。
各区域水体和沉积物的理化指标测定结果如表1所示。
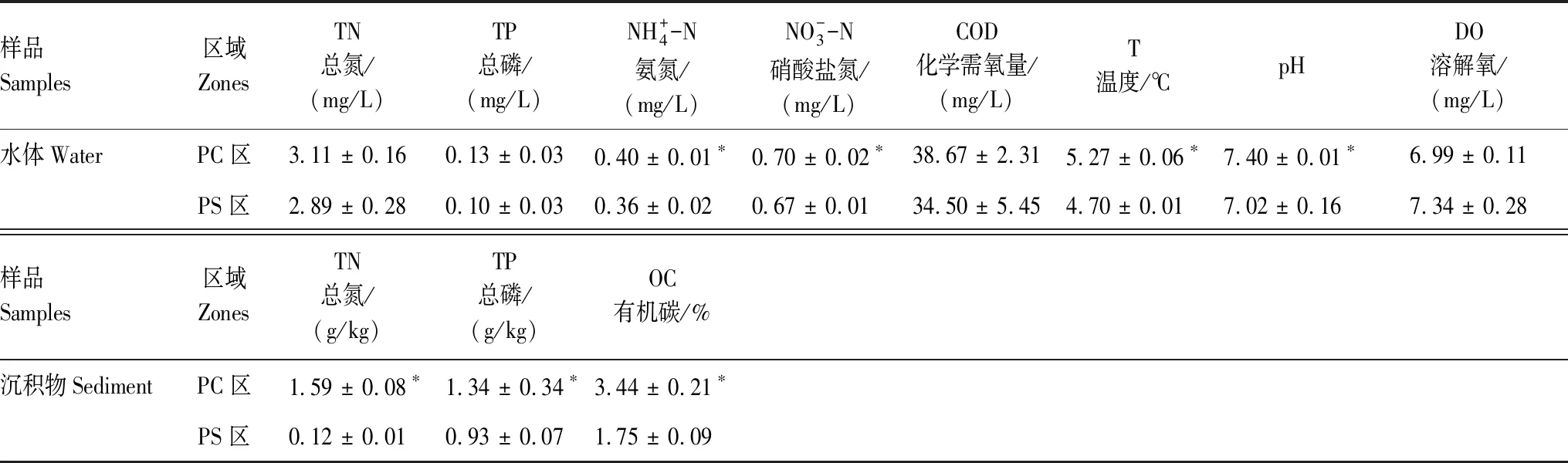
表1 2个养殖区域水体和沉积物的环境变量Table 1 Environmental variables of water and sediment samples in the two aquacultural zones
1.4 DNA提取及高通量测序
水体滤膜和沉积物样品分别采用E.Z.N.A.®水体DNA提取试剂盒(Omega Biotek,Doraville,GA,美国)和PowerSoil® DNA提取试剂盒(MoBio Laboratories,Inc.,Carlsbad,CA,美国)进行水体和沉积物总DNA的提取[27]。使用PowerCleanTMDNA纯化试剂盒(MoBio Laboratories,Carlsbad,CA,美国)对DNA样品进行纯化[28]。采用1%的琼脂糖凝胶电泳验证所提取的DNA样品。
使用引物对515F(5′-GTGCCAGCMGCCGCGG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对16S rRNA基因的高可变区V4区进行扩增[29]。PCR扩增体系为20 μL(0.8 μL上下游引物、10 ng DNA模板、2 μL dNTP、0.4 μL FastPfu酶,及无菌蒸馏水),PCR扩增程序为95 °C预变性2 min,25次的扩增循环(95 °C变性30 s,55 °C退火30 s,72 °C延伸30 s),并最终在72 °C下延伸5 min[30]。PCR产物合并后通过2%的琼脂糖凝胶电泳检验。PCR产物经纯化和定量后,由诺禾致源生物科技有限公司(北京)利用Illumina Miseq测序平台进行测定。本研究所获得的所有细菌基因序列均已上传到National Center for Biotechnology Information(NCBI)数据库中,序列登记号为PRJNA698288。
测序结果使用QIIME (v 1.9.1)进行处理[31],使用“trim”功能筛选出截断读数超过10 bp且配对成功的序列[32]。然后使用FLASH (v 1.0.0)拼接序列[33],再使用QIIME (v 1.9.1)中的“vsearch”功能查找并去除嵌合体[34],使用“pick_de_novo_otus.py”命令,根据3%的差异原则划分操作分类单元(Operational Taxonomic Units,OTU)[35]。对照 SILVA 16S rRNA 基因数据库(SILVA123_QIIME_release,2016)[36],匹配分类学信息。使用“filter_taxa_from_otu_table.py”命令去除非细菌序列和序列数不高于总序列数0.0005%的稀有OTU[37],使用“parallel_align_seqs_pynast.py”命令计算进化树,最后使用“multiple_rarefactions_even_depth.py”命令对最终完善的文件进行重采样,并导出最终的OTU表。
基于OTU表,在QIIME (v 1.9.1)中使用“alpha_diversity.py”计算Observed OTUs和Shannon指数来反映细菌群落的α多样性。再利用QIIME (v 1.9.1)中的“beta_diversity.py”计算Weighted Unifrac距离矩阵来反应细菌群落的β多样性。
1.5 多元统计分析
本研究利用软件GraphPad Prism (v 8)绘制箱型图来反映细菌群落α多样性的高低。基于OTU表,利用R(v 3.5.3)中的程序包“Vennerable”进行Venn图的绘制。根据β多样性矩阵,使用R(v 3.5.3)中的“vegan”程序包进行非度量多维尺度分析(Nonmetric multidimensional scaling,NMDS),来可视化不同样品间群落结构的差异和相似性。为探究细菌群落与环境因子的相关性关系,利用R(v 3.5.3)中的“vegan”程序包进行冗余分析(redundancy analysis,RDA)。将平均相对丰度大于0.5%的细菌门作为优势菌门,并利用软件GraphPad Prism (v 8)绘制堆叠图。筛选平均相对丰度大于1%的OTUs作为优势OTUs,使用软件IBM SPSS Statistics (v 22.0)分析优势OTUs与环境因子的相关关系(Pearson相关),并利用R(v 3.5.3)中的“Heatmap”程序包分别绘制热图。采用独立样本T检验对水体样品和沉积物样品指标进行差异显著性检验。
2 结果与分析2.1 2个养殖区域的水体和沉积物环境变量

2.2 水产养殖不同物种的水体和沉积物中细菌群落的α多样性特征
2个区域细菌群落的α多样性如图1所示,对于水体和沉积物样品,PS区的Observed OTUs和Shannon指数均显著(P<0.05)高于PC区。即PS区中水体和沉积物细菌群落的α多样性均显著高于PC区。

图1 2个养殖区域中水体和沉积物的α多样性Fig.1 α-diversity of bacterial communities within water and sediment samples between the two zonesObserved OTUs:OTU数,Shannon:Shannon指数;PC:克氏原螯虾,PS:中华鳖;图中*表示显著性差异(独立样本T检验),*:P<0.05,***:P<0.001
对于养殖水体,2个区域共有2639个相同的OTUs,PS区的特有OTU数为2588远大于PC区的195(图2)。对于沉积物,PC和PS区的OTU数基本一致,绝大多数OTUs为两区域共有,但PS区的特有OTU数(408)仍明显高于PC区(143)。由此可见,沉积物中的共有OTU数占总OTU数的比重大于水体。并且,PS区中水体和沉积物的特有OTU数均高于PC区。
对于水体,PC区的特有OTUs共分类为15个细菌门,PS区的特有OTUs共分类为16个细菌门。两个区域的特有OTUs均是属于拟杆菌门(Bacteroidetes)的最多(PC:33个,PS:280个),并且SR1仅在PS区中观测到(图2)。对于沉积物,PC区的特有OTUs共分类为13个细菌门,其中属于拟杆菌门(Bacteroidetes)和β-变形菌纲(Betaproteobacteria)的特有OTUs均为19个明显高于其他门(图2)。PS区的特有OTUs共分类为14个细菌门,其中属于拟杆菌门(Bacteroidetes)的特有OTUs最多(70个)。
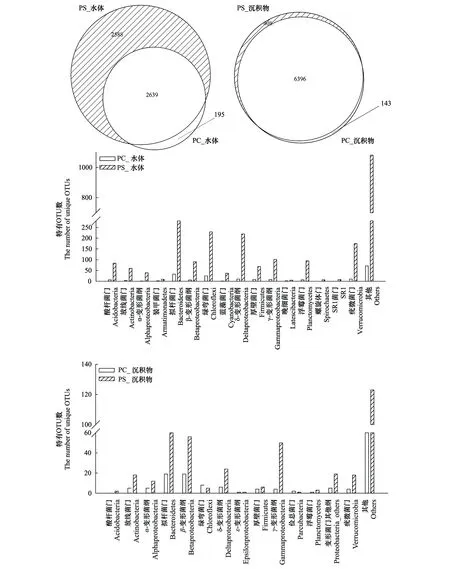
图2 2个养殖区域中水体和沉积物细菌群落共有和特有OTU数的Venn图及2个养殖区域中水体和沉积物细菌群落特有OTUs分类学信息(门/亚门水平)Fig.2 Venn plots showing of the number of OTUs of bacterial communities shared and specialized between the two zones within water and sediment samples.Taxonomy information of OTUs (phyla/subphyla)of bacterial communities specialized between the two zones within water and sediment samplesPC:克氏原螯虾,PS:中华鳖
2.3 水产养殖不同物种的水体和沉积物中细菌群落结构


图3 基于Weighted Unifrac距离矩阵的非度量尺度分析(NMDS)及细菌群落结构与环境因子间的冗余分析(RDA)Fig.3 Nonmetric multidimensional scaling analysis (NMDS)based on Weighted Unifrac dissimilarity and redundancy analysis (RDA)between bacterial community structure and environmental variablesPC:克氏原螯虾,PS:中华鳖;图中*表示显著相关,*:P<0.05,**:P<0.01,***:P<0.001
2.4 水产养殖不同物种的水体和沉积物中细菌群落组成
本研究共获得1487129条序列、7247个OTUs,它们属于细菌的34门、114纲、258目、504科和955属。2个区域的优势(相对丰度>0.5%)细菌门/亚门如图4所示。水体样品中共有11个优势菌门,这11个门的相对丰度和占到所有细菌的91.46%—98.54%。沉积物样品中共有13个优势菌门,其相对丰度和占到总细菌的77.52%—84.98%。

图4 2个养殖区域中水体和沉积物细菌群落的优势菌门/亚门(相对丰度>0.5%)相对丰度Fig.4 Relative abundance of dominant phyla/subphyla (relative abundance>0.5%)of bacterial communities within water and sediment samples between the two zonesPC:克氏原螯虾,PS:中华鳖
将相对丰度>1%作为筛选优势OTUs的阈值,水体细菌群落中共筛选出15个优势OTUs,而沉积物细菌群落中仅筛选出7个优势OTUs(图5)。水体细菌群落优势OTUs中,6个属于β-变形菌纲(Betaproteobacteria)、5个属于拟杆菌门(Bacteroidetes)、3个属于放线菌门(Actinobacteria)和1个属于α-变形菌纲(Alphaproteobacteria)。PS区中OTU3394(丛毛单胞菌科,Comamonadaceae)、OTU12347(腐螺旋菌科,Saprospiraceae)、OTU12385(丛毛单胞菌科,Comamonadaceae)、OTU15668(嗜甲基菌属,Methylophilus)、OTU16336(丛毛单胞菌科,Comamonadaceae)、OTU20544(丛毛单胞菌科,Comamonadaceae)、OTU38268(黄杆菌属,Flavobacterium)、OTU41298(放线菌目,Actinomycetales)、OTU42336(沉积杆菌属,Sediminibacterium)、OTU52126(多核杆菌属,Polynucleobacter)和OTU61118(黄杆菌属,Flavobacterium)的相对丰度显著低于PC区(P<0.01),OTU94966(腐螺旋菌科,Saprospiraceae)的相对丰度显著高于PC区(P<0.001)。

图5 2个养殖区域中水体和沉积物的优势OTUs(相对丰度>1%)相对丰度热图Fig.5 Heatmap showing the relative abundance of dominant OTUs (relative abundance>1%)of bacterial communities within water and sediment samples between the two zonesPC:克氏原螯虾,PS:中华鳖;图中*表示组间存在显著性差异(独立样本T检验),**:P<0.01,***:P<0.001;最低分类学等级中,不同小写字母表示不同分类水平,p:门,c:纲,o:目,f:科,g:属
沉积物优势OTUs中,5个属于拟杆菌门(Bacteroidetes)、1个属于β-变形菌纲(Betaproteobacteria)、1个属于绿弯菌门(Chloroflexi)。这7个优势OTUs的相对丰度在两个区域之间均存在显著差异(P<0.001)。PS区中OTU11213(Dechloromonas属)和OTU59770(Prolixibacteraceae科)的相对丰度均显著高于PC区(P<0.001)。而OTU1482(拟杆菌门,Bacteroidetes)、OTU89828(拟杆菌门,Bacteroidetes)、OTU97626(拟杆菌门,Bacteroidetes)、OTU103576(拟杆菌门,Bacteroidetes)和OTU103578(厌氧绳菌科,Anaerolineaceae)的相对丰度则是PC区显著更高(P<0.001)。


图6 2个养殖区域中水体和沉积物的优势OTU(相对丰度>1%)与环境因子的相关性热图Fig.6 Heatmap showing correlation between the relative abundance of the dominant OTUs (relative abundance>1%)and environmental factors in water and sediment samples between the two zones*表示显著相关,*:P<0.05,**:P<0.01
对于沉积物,TN、TP和OC浓度均与优势OTUs有较强的相关性。整体上,TP与优势OTUs的相关性较TN和OC弱。OTU11213和OTU59770与TN和OC均显著负相关(P<0.05),OTU1482、OTU89828、OTU97626、OTU103576和OTU103578与TN和OC均显著正相关(P<0.01)。
3 讨论
3.1 水产养殖不同物种对水体和沉积物中细菌群落多样性及结构的影响
本研究中,PS区的水体和沉积物细菌群落α多样性均显著高于PC区(P<0.05,图1)。细菌群落多样性受宿主影响较大[38],如张琼琼等人研究发现,微生物多样性与宿主呈现专一性,即宿主会在周围环境中形成独特的微环境并对细菌具有趋化和富集的作用,进而使得不同宿主对应了不同大小的细菌群落多样性[39]。因此,养殖克氏原螯虾(PC)和中华鳖(PS)的水体和沉积物中极有可能分别形成了独特的微环境,如2种不同物种的排泄物、皮肤分泌物等对细菌分别具有独特的趋化和富集作用,导致PC和PS区的水体和沉积物间细菌群落种类和数量发生变化,进而使细菌群落多样性与宿主呈现专一性,最终导致了PC和PS区细菌群落的α多样性呈现显著差异。Venn图的结果显示,细菌群落α多样性更高的PS区中拥有更多的特有OTUs(图2),这些OTUs可能就是在养殖中华鳖形成的特定微环境下定植并富集的。中华鳖还具有上岸晒背的习性,这一习性也可能将陆地中的细菌带入到养殖水环境中,使特有OTUs数量增加,进而导致细菌群落多样性升高[5,22]。本研究统计了PC和PS区中特有OTUs的分类学信息(图2),但由于目前认知所限,这些特有OTUs大多只能获得较为粗糙的分类学信息,因此这些OTUs的特性大部分还不清楚,需要在后续的研究中进一步探究,以探明养殖作物的哪些生理特征或生活习性会导致哪些特有OTUs的定殖和富集。此外,环境中的营养浓度对细菌群落多样性也有着较大影响[40]。研究表明,在营养浓度较高的养殖环境中,更低的营养负荷反而可能会造成更高的多样性[41]。而本研究中细菌群落α多样性更高的PS区中,水体TN、TP和COD均略低于PC区,沉积物TN、TP和OC均显著低于PC区(P<0.05,表1)。这可能是克氏原螯虾和中华鳖的生理特征、生活习性及管理方式的不同造成的。由于克氏原螯虾的杂食性,在养殖过程中存在饵料的过量投放和产生大量排泄物等问题[42]。另一方面,中华鳖生长发育缓慢,饵料投放较少,并且其代谢缓慢[43]。克氏原螯虾挖洞刨沙的习性会导致沉积物中的营养物质更容易释放到水体中[21]。因此,养殖中华鳖的水环境更容易保持较低的营养负荷,使细菌群落α多样性更高。综上,由于PC和PS区宿主不同分别形成了独特的微环境(排泄物、皮肤分泌物等对细菌独特的趋化和富集作用),及生理特征、生活习性和管理方式不同导致的水环境营养盐负荷的差异,二者共同作用导致了PS区的细菌群落α多样性显著高于PC区。

3.2 养殖不同物种的水体和沉积物中的优势OTUs


本研究筛选出的7个沉积物优势OTUs中,OTU11213、OTU59770和103578均与去除沉积物营养浓度有关。在本研究中,OTU11213是沉积物中平均相对丰度最高的(图5),其属于Dechloromonas属,Dechloromonas广泛存在于水产养殖系统中并参与氮循环[56]。OTU59770属于Prolixibacteraceae科,Prolixibacteraceae主要参与氮循环,能在缺氧的条件下,将硝酸盐还原为亚硝酸盐[57]。OTU103578属于厌氧绳菌科(Anaerolineaceae),是沉积物和湿地土壤中常见的优势类群,主要参与沉积物中氮素的去除[58]。
4 结论
(1)由于宿主的不同和营养浓度的差异,使得PC和PS区的水体和沉积物中细菌群落的α多样性呈现显著(P<0.05)差异。并且在水体和沉积物中,细菌群落α多样性均为PS区显著高于的PC区。


