三亚蜈支洲岛海洋牧场区域夏季食物网研究
2022-05-20尹洪洋朱文涛马文刚夏景全李建龙何法庆李秀保
尹洪洋,朱文涛,马文刚,章 翔,夏景全,许 强,李建龙,何法庆,李秀保,*
1 海南大学海洋学院,海口 570228 2 海南大学生态与环境学院,海口 570228 3 海南大学南海海洋资源利用国家重点实验室,海口 570228
随着热力学理论的研究及Nier型质谱仪的不断改进,稳定同位素技术(Stable Isotope Analysis,SIA)不断发展,其主要用于食物网中营养结构和营养级的分析、确定食物来源及食物贡献、生态位空间及水生生物洄游分布的研究等[1—5]。不同的碳源、碳氮比在珊瑚礁生态系统的结构和功能中所起的作用不同,可系统分析不同生物的营养关系、确定食物网以及食物网的相互作用关系等[6—8],如Graham等[9]利用250个珊瑚礁的经验数据,分析了人为介导下的珊瑚礁鱼类生物量的数量级梯度。海洋牧场生态系统功能复杂、渔业资源丰富,具有复杂的食物网结构[10]。目前,基于稳定同位素技术构建生态系统食物网分析不同生物的营养关系及生态系统的结构和功能已成为重要的研究手段之一[3]。有关食物网结构与功能的研究,国内外多采用稳定同位素方法来评估生态系统的营养关系,McMahon等[6]采用贝叶斯混合模型对稳定碳同位素比值(13C)进行分析,定量研究了红海初级生产者对珊瑚礁鱼类在不同摄食阶段和营养位置的碳流量。郭卫东等[11]利用稳定碳同位素分析技术研究了南沙渚碧礁生态系食物网主要生物类群之间的营养关系。朱文涛等[12]以碳、氮同位素分析了大亚湾底栖群落营养结构的季节性变化。相较传统胃含物技术的瞬时分析及样本量大的局限性,SIA能反映一定时间的生物摄食和消化吸收情况,能更准确的量化评估生物的营养级[1—2,13]。Dromard等[14]运用稳定同位素技术及胃含物方法分析了加勒比海珊瑚礁草食性鱼类的营养位置,发现SIA的结果较为准确。杨国欢等[15]根据δ13C、δ15N值分析珊瑚礁鱼类营养层次并与传统胃含物技术比较得出,SIA与传统的胃含物分析法所得的结果有很好的一致性。
三亚蜈支洲岛海域资源丰富,共记录造礁石珊瑚13科40属90种,珊瑚礁鱼类33科52属75种,大型无脊椎动物种类多样性也非常丰富[16]。目前在该海域的研究主要集中于珊瑚礁修复技术[17]、环境胁迫对珊瑚生理状态的影响[18—19]、人为因素对珊瑚群落的扰动[20]等,但关于三亚蜈支洲岛牧场区域生态系统食物网结构的研究尚未见报道。本研究基于碳氮稳定同位素技术初步建立了三亚蜈支洲岛牧场区域生态系统食物网,研究主要消费者稳定同位素特征,分析营养级层次并构建牧场区域食物网的连续营养谱。通过比较邻近海域的营养结构特征,揭示食物网内不同层次消费者的主要食源,旨在为了解该生态系统营养结构提供基础资料和参考数据。
1 材料及方法
1.1 样品采集和处理
2020年7月对海南省蜈支洲岛牧场区域共布设10个站点进行了生物样品的采样工作(图1)。其中,核心区(珊瑚礁区域D1、D2、D3、D4)四个站位进行浮游生物、底栖生物及游泳生物调查;外围区进行游泳生物样品采集(以拖网作业为主),平均拖速为2.1节,每站拖网40 min左右。在核心区站位分别选用浅水Ш型和浅水Ⅱ型浮游生物网采集浮游植物和浮游动物;并以垂钓等方式采集核心区鱼类;大型底栖生物由潜水及采样带法相结合的方法收集,采集生物样品进行物种鉴定与同位素样品处理。大型海藻经蒸馏水清洗干净,烘干后使用锡箔纸包裹备用。取5 L表层海水经浮游植物网过滤后抽滤至灼烧后的GF/F滤膜上,经浓盐酸酸熏5 h后烘干,所得样品即悬浮颗粒有机物(POM);沉积有机物(SOM)及底栖微藻样品采集制备方法参考徐军[21],取适量沉积物研磨后,加入1 mol/L稀盐酸进行酸化,充分反应至无气泡产生,再用去离子水洗涤3次后烘干。在各个站点取适量礁石,刮取分离底栖藻类后,将样品抽滤至灼烧后的GF/F滤膜直接烘干以测定底栖微藻同位素。浮游植物样品用160 μm的筛绢进行过滤,过滤后的样品抽滤到预先经马弗炉450℃灼烧5 h的Whatman GF/F膜上,浮游动物挑选出杂质后过滤到同样处理后的滤膜上。鱼类取其背部肌肉,头足类取胴体部位,虾类取适量肌肉,蟹类取螯肢或腹部肌肉,海参取体壁肌肉,海胆取亚氏提灯附属肌肉及性腺,海星取其性腺。

图1 三亚蜈支洲岛牧场区域采样站位图 Fig.1 Sampling stations in the marine ranch ecosystem of Wuzhizhou Island,SanyaC1—C4:核心区调查站位 Core area survey station;O1—O6:外围区调查站位 Outer area survey station
经处理的上述样品置于-50℃真空冷冻干燥机中冷冻干燥48 h至恒重,装入研磨器中研磨60 s至粉末状,存于5 mL棕色瓶中装入自封袋后,冷冻保存以待后续的同位素样品分析。
1.2 稳定同位素分析
所有样品碳、氮稳定同位素比值通过元素分析仪(PYRO Cube,德国Elementar 公司)和稳定同位素质谱仪(Isoprime 100,英国 Isoprime公司)测定,碳氮同位素比值以 δ 值的形式表达。为保持实验结果的准确性,每测试 10 个样品后加测 1—2 个标准样,个别样品进行3次重复测定,δ13C 值和 δ15N 值的分析精度均为±0.2‰。碳、氮稳定同位素值计算公式如下:
δ=[(Rsample/Rstandard)-1]×103
式中,δ代表碳、氮同位素 (δ13C和δ15N);Rsample表示所测样品的同位素比值 (13C/12C或15N/14N);Rstandard是国际上通用的标准物的同位素丰度之比,碳、氮稳定同位素标准物分别为咖啡因 (IAEA-600)和大气氮。
1.3 不同食源对主要消费者贡献率的计算
利用IsoSource模型计算三亚蜈支洲岛牧场区域珊瑚礁食物网中主要食源对消费者的贡献率,计算原理如下:
δjE=fAδjA+fBδjB+fCδjC+fDδjD
δkE=1×fAδkA+fBδkB+fCδkC+fDδkD
1=fA+fB+fC+fD
式中,jE、kE表示生物消费者E的2种同位素j、k的比值;A、B、C、D为食物源;f为食物对消费者的贡献率。本研究利用Phillips[22]等利用质量守恒原理反复叠代编写的IsoSource程序来计算各食源对珊瑚礁海域主要消费者的贡献率。
1.4 数据处理及分析
以珊瑚礁生态系统中消费者的 δ15N 平均值来计算平均营养级,营养级的计算公式如下:
TL=(δ15Nsample-δ15Nbaseline)/△15N+λ

基于标准化欧氏距离(Standardised Euclidean distance)对三亚蜈支洲岛牧场区域主要消费者的营养类群层次进行聚类分析,聚类分析(Hierarchical Cluster Analysis)方法采用瓦尔德法;基于IsoSource模型分析主要食源对消费者的贡献率。单因素方差分析(ANOVA)检验三亚蜈支洲岛珊瑚礁海域食物网各成分之间的稳定同位素差异。用 R 语言(R CoreTeam,2018)的 SIBER 模型计算食物网中的6个群落营养结构指标[26],利用Excel 2019、ArcGIS 10.2、SPSS 25.0、Origin 75、Adobe Illustrator 2020等软件进行数据处理及绘图。
2 结果分析
2.1 种类鉴定
2020年7月海洋生物调查共采集鱼类24科24属31种,头足类3科3属3种,虾蟹类7科9属10种,腹足类2科2属2种,海参2科2属3种、海胆2科2属2种、海星1科1属1种,大型海藻4科4属4种(表1)。
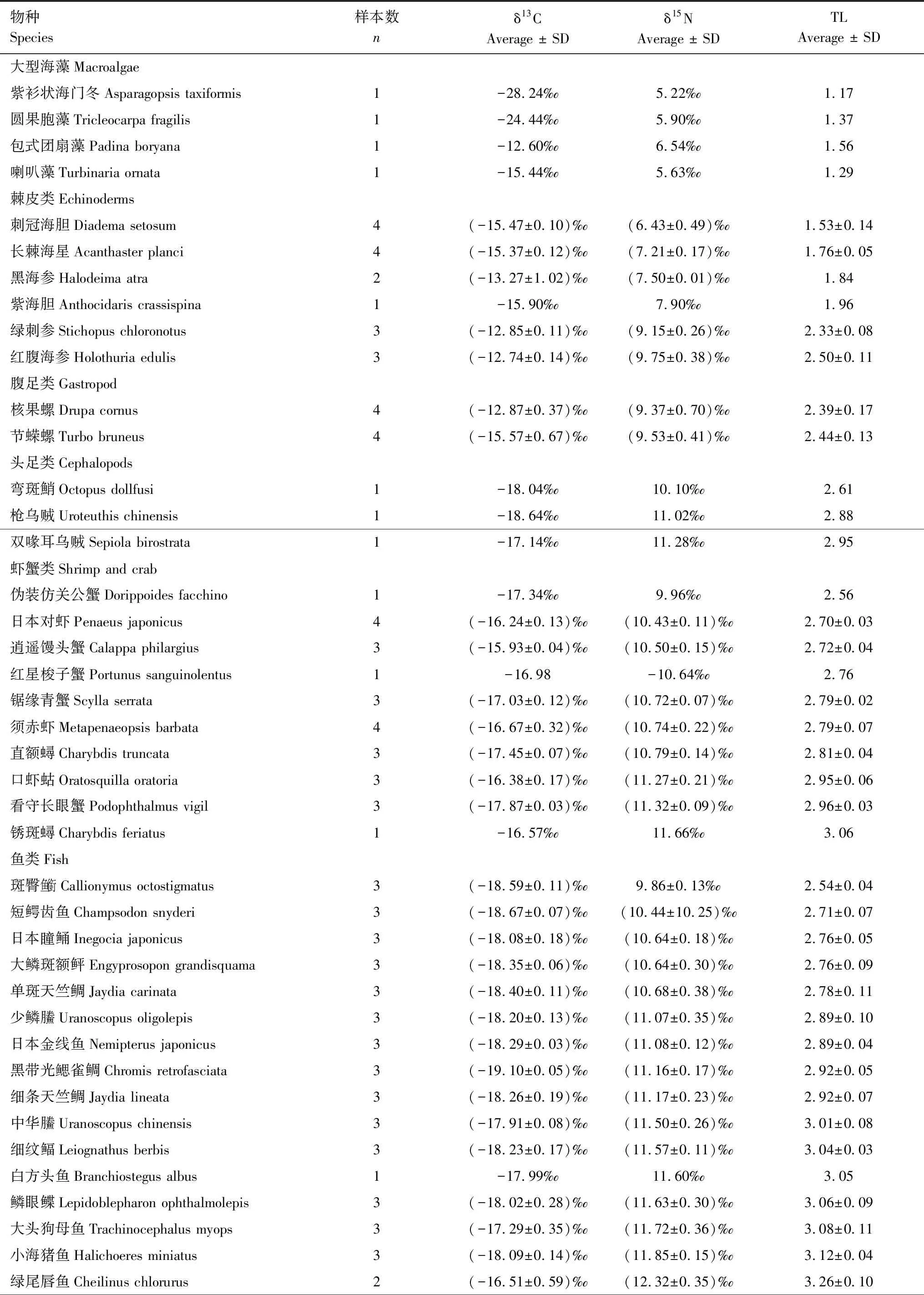
表1 三亚蜈支洲岛牧场区域生态系统主要消费者δ13C、δ15N值及营养级(TL)Table 1 The δ13C,δ15N values and trophic level (TL) of major consumers in the regional ecosystem of Wuzhizhou Island Ranch in Sanya

续表物种Species样本数nδ13CAverage ± SDδ15NAverage ± SDTLAverage ± SD中线天竺鲷Apogon kiensis3(-17.47±0.32)‰(-12.499±0.28)‰3.31±0.08蠕纹裸胸鳝Gymnothorax kidako1-18.14‰13.15‰3.35 东方豹鲂鮄Dactyloptena orientalis1-17.23‰12.68‰3.36 须拟鲉Scorpaenopsis cirrosa1-15.56‰12.75‰3.39 克里裸胸鳝Gymnothorax cribroris1-18.37‰12.81‰3.40 线纹叉鼻鲀Arothron immaculatus1-18.384‰-12.86‰3.42 花斑蛇鲻Saurida undosquamis3-18.14‰13.15‰3.50 日本绯鲤Upeneus japonicus1-18.48‰13.22‰3.52 伯恩斯裸胸鯙Gymnothorax buroensis1-16.24‰13.23‰3.53 黄纹拟鲈Parapercis xanthozona3(-16.31±0.09)‰(13.55±0.12)‰3.62±0.03斑柄鹦天竺鲷Ostorhinchus fleurieu1-17.49‰13.60‰3.64 齿颌眶棘鲈Scolopsis ciliatus1-15.77‰13.64‰3.65 密花裸胸鯙Gymnothorax thyrsoideus1-16.91‰13.70‰3.66 带纹躄鱼Antennarius striatus117.28‰13.73‰3.67 横带九棘鲈 Cephalopholis boenak 1-16.90‰14.03‰3.76
2.2 稳定同位素特征

图2 牧场区域生态系统主要消费者的 δ13C和 δ15N值的双位图Fig.2 The stable isotope biplots of the δ13C and δ15N values of the main consumers in the marine ranch ecosystem
2020年7月海洋生物调查除浮游生物、大型海藻外共采集52种主要消费者,以主要消费者的δ13C、δ15N值为横纵坐标绘制珊瑚礁生态系统食物网的稳定同位素双位图(图2)。
三亚蜈支洲岛牧场区域珊瑚礁生态系统食物网δ13C值范围为-19.10‰—-12.74‰,平均值(-16.99±1.52)‰;δ15N值范围为6.43‰—14.03‰,平均值(11.24±1.70)‰(表1)。稳定同位素结果显示,棘皮类δ13C、δ15N值范围分别为-15.90‰(紫海胆Anthocidariscrassispina)—-12.74‰(红腹海参Holothuriaedulis)和6.43‰(刺冠海胆Diademasetosum)—9.75‰(红腹海参Holothuriaedulis),均值分别为(-14.27±1.33)‰、(7.99±1.14)‰;鱼类δ13C、δ15N值范围分别为-19.10‰(黑带光鳃雀鲷Chromisretrofasciata)—-15.56‰(须拟鲉Scorpaenopsiscirrosa)和9.86‰(斑臀鱼銜Callionymusoctostigmatus)—14.03‰(横带九棘鲈Cephalopholisboenak),均值分别为(-17.65±0.90)‰、(12.16±1.15)‰,δ13C、δ15N值跨度较大。虾蟹类δ13C、δ15N值范围分别是-17.87‰(看守长眼蟹Podophthalmusvigil)—-15.93‰(逍遥馒头蟹Calappaphilargius)和9.96‰(伪装仿关公蟹Dorippefacchino)—11.66‰(锈斑蟳Charybdisferiatus),均值分别为(-16.85±0.57)‰、(10.80±0.39)‰;腹足类δ13C、δ15N值范围分别在-15.06‰—-13.33‰、9.37‰—9.53‰之间;头足类δ13C、δ15N值范围分别为-18.64‰—-17.14‰和10.10‰—11.28‰,均值分别为(-17.94±0.62)‰、(10.80±0.51)‰。单因素方差分析显示,棘皮类、虾蟹类、腹足类、鱼类等不同类群δ13C、δ15N值差异极显著(P<0.01)。
2.3 营养级及连续营养谱
本研究以浮游动物为基线生物,计算牧场区域珊瑚礁生态系统主要消费者的营养级并绘制连续营养谱。主要消费者的营养级范围为1.53—3.76,均值为2.94±0.50,跨度为2.23,属于3个营养级(图3)。其中,横带九棘鲈Cephalopholisboenak营养级最高为3.76,刺冠海胆Diademasetosum营养级最低为1.53±0.14。各类群营养级之间差异较大,棘皮类、虾蟹类、腹足类、头足类和鱼类的营养级范围分别为1.53—2.50、2.56—3.06、2.39—2.44、2.61—2.95和2.54—3.76。珊瑚礁鱼类的碳氮值跨度最大,而其他种群生物碳氮值相对跨度较小。

图3 三亚蜈支洲岛牧场区域生态系统主要消费者连续营养谱Fig.3 Continuous nutritional profile of major consumers in the regional ecosystem of Wuzhizhou Island Ranch in Sanya
2.4 牧场区域生物群落营养结构指标特征
进一步应用SIBER模型分析三亚蜈支洲岛牧场区域稳定同位素数据的6个营养结构指标,通过与邻近海域的研究结果比较,发现主要消费者的摄食来源多样性水平(CR)、营养级长度(NR)分别为6.36和7.60,表明牧场区域珊瑚礁生态系统的食源多样性水平较高,但食物链长度较短;生态位空间(TA)和平均营养级多样性(CD)分别为29.52和1.96,说明该食物网营养级多样性的总程度和平均程度相对较高;平均最近相邻距离(MNND)及最近相邻距离的标准偏差(SDNND)分别为0.37和0.30(表2)。
2.5 牧场区域的聚类分析及潜在碳源对不同消费者的贡献率
通过系统聚类分析(Hierarchical Cluster Analysis)及IsoSource模型分析发现,大型海藻和底栖微藻对主要消费者的贡献率最大为41.50%,沉积有机物(SOM)和浮游植物也是消费者的重要碳源(贡献率分别为20.05%、19.97%),悬浮颗粒有机物(POM)对消费者的碳源贡献率最低,为18.48%(表3)。
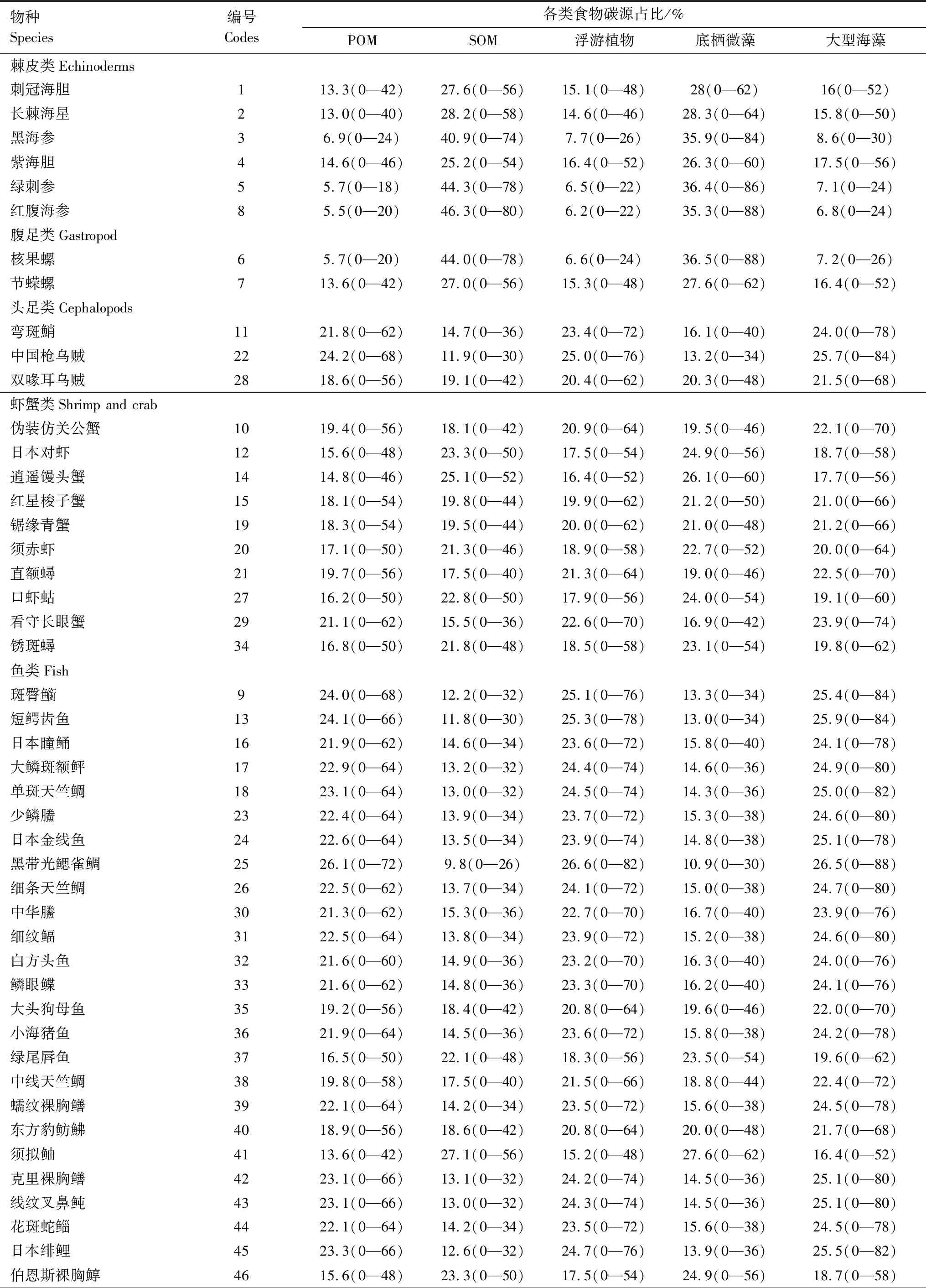
表3 三亚蜈支洲岛牧场区域生态系统不同食物碳源的贡献率Table 3 The contribution rate of different food carbon sources in the regional ecosystem of Wuzhizhou Island Ranch in Sanya

续表物种Species编号Codes各类食物碳源占比/%POMSOM浮游植物底栖微藻大型海藻黄纹拟鲈4716.0(0—46)23.2(0—50)17.7(0—56)24.3(0—56)18.9(0—60)斑柄鹦天竺鲷4819.9(0—58)17.3(0—40)21.4(0—66)18.8(0—44)22.7(0—72)齿颌眶棘鲈4914.2(0—42)25.8(0—54)15.9(0—50)26.9(0—60)17.1(0—54)密花裸胸鯙5017.9(0—54)20.3(0—44)19.6(0—60)21.4(0—50)20.8(0—64)带纹躄鱼5119.1(0—56)18.5(0—42)21.0(0—64)19.6(0—46)21.8(0—68)横带九棘鲈 5217.8(0—54)20.2(0—44)19.6(0—60)21.6(0—50)20.8(0—66)
3 讨论3.1 三亚蜈支洲岛牧场区域生态系统营养结构特征
CR 值表示食物网中的食源多样性特征,CR值越大初始食源越多。本研究碳值跨度为6.36‰(即CR值),高于南海中西部渔场[27](3.49‰)、华南典型海湾[28](海陵湾2.44‰、陵水湾4.45‰)和浙江南部近海[30](5.70‰)。三亚蜈支洲岛海洋牧场生态系统属于典型南方热带海洋牧场生态系统,与邻近海域相比,三亚蜈支洲岛牧场区域生态系统中的食物来源除浮游植物、POM及有机碎屑外,还有自养细菌、珊瑚共生藻、大型海藻等多类初级生产者[10]提供碳源,这会导致生态系统内主要消费者在摄食饵料范围上更广,其碳源更为复杂。此外,三亚蜈支洲岛海域临近琼东上升流区域[31],底层营养物质上涌使其更具高生产力,摄食来源多样性水平(CR)的值可能会受其影响。但研究海域的CR值要低于胶州湾(8.47‰)[32]、珠江口(12.58‰)[24]的研究,这可能与南北方水质环境差异有关,南方地区有较高的日照水平,初级生产者稳定同位素组成可能出现明显的碳富集[33—34],而且珠江口位于咸淡水交汇区域,水体、底质中有机质来源多样化,水域环境的生物种类食源更为复杂[24]。三亚蜈支洲岛牧场区域生态系统内主要消费者的NR值为 7.60,也明显高于邻近海域(表2),这可能与研究区域资源量有关,蜈支洲岛牧场区物种多样性高。牧场区中棘皮类、虾蟹类等底栖动物,头足类、腹足类等软体动物以及游泳动物的存在可能使食物链长度更长。TA与CD表示食物网营养级多样性的总程度和平均程度,MNND 和 SDNND 用来描述群落营养冗余的大小[35]。本研究中,生态系统的TA与CD值分别为29.52、1.92,MNND 和 SDNND值为0.37、0.30,与黄佳兴[27]、张文博[28]、宁加佳[29]等人分别在南海中西部、南海西南部、陵水湾、海陵湾的研究结果比较,三亚蜈支洲岛牧场区域生态系统的营养多样性水平及平均程度较高。三亚蜈支洲岛牧场区域食物网中具有相似营养特征的物种占多数,且营养生态位分布广[36],因此冗杂程度也比邻近海域高。

表2 不同区域主要消费者的群落结构指标Table 2 Community structure indicators of major consumers in different regions
三亚蜈支洲岛牧场区域珊瑚礁生态系统的主要消费者可以分为4种营养类群:第一类主要以大型海藻、浮游植物、POM为主的混合有机碳源包括日本瞳鲬(Inegociajaponicus)、细纹鲾(Leiognathusberbis)、鳞眼鲽(Lepidoblepharonophthalmolepis)等近海中下层、底栖性鱼类以及头足类构成,占采样总数的34.62%;第二类群食源以底栖微藻为主,SOM为辅,由红星梭子蟹(Portunussanguinolentus)、日本对虾(Penaeusjaponicus)等杂食性的虾蟹类构成,占采样总数的21.15%;第三类群主要包括横带九棘鲈(Cephalopholisboenak)、黄纹拟鲈(Parapercisxanthozona)、花斑蛇鲻(Sauridaundosquamis)、密花裸胸鳝(Gymnothoraxthyrsoideus)等肉食性鱼类,主要食源以大型海藻为主,底栖微藻为辅,占采样总数的30.77%;第四类群由红腹海参(Holothuriaedulis)、紫海胆(Anthocidariscrassispina)等营底栖生活的棘皮类和腹足类组成,主要食源为SOM和底栖微藻;占采样总数的13.46%(图4),经单因素方差分析,各组群间具有显著差异(P<0.01)

图4 三亚蜈支洲岛牧场区域主要消费者碳氮稳定同位素比值的聚类分析Fig.4 Cluster analysis of stable carbon and nitrogen isotope ratios of major consumers in Wuzhizhou Island Ranch area,Sanya
3.2 牧场区域食物网主要消费者的营养级
三亚蜈支洲岛牧场区域食物网中主要消费者的营养级范围为1.53—3.76,总体上三亚蜈支洲岛鱼类的平均营养级最高,其次为头足类和虾蟹类(平均营养级均为2.81),腹足类平均营养级为2.41,棘皮类平均营养级最低为1.99。根据国内学者营养层次的划分标准[37]计算得出,刺冠海胆Diademasetosum、长棘海星Acanthasterplanci等4种杂食性动物和横带九棘鲈Cephalopholisboenak、花斑蛇鲻Sauridaundosquamis、齿颌眶棘鲈Scolopsisciliatus、密花裸胸鳝Gymnothoraxthyrsoideus等10种高级肉食性动物分别占总数的7.69%、19.23%;由红星梭子蟹Portunussanguinolentus、大鳞短额鲆Engyprosopongrandisquama、弯斑鮹Octopusdollgusi以及日本瞳鲬Inegociajaponicus、大头狗母鱼Trachinocephalusmyops、锈斑蟳Charybdisferiatus等为代表的低级肉食性与中级肉食性动物分别占总数的32.69%、40.38%。牧场区域食物网的主要消费者分布在两端(杂食性动物与高级肉食性动物)的只占少数,绝大多数居于中间的层次,为低级肉食性动物与中级肉食性动物(表1),与大亚湾珊瑚礁生态系统营养层次分布特征相似[12]。
本次调查采集31种鱼类以中小型为主,营养级范围为2.54—3.76,跨度1.22。三亚蜈支洲岛鱼类营养级主要集中于2.92—3.40之间,营养级别较高,约占鱼类总数的49.21%。基准生物和采样方式会对鱼类营养级产生影响[38],本研究中基准生物取浮游动物,其δ15N值较低(8.04‰),采样方式可能是导致鱼类营养级较高的原因。三亚蜈支洲岛珊瑚礁区域无法进行拖网采样,本研究中鱼类主要使用动物饵料垂钓获得,具有一定的选择偏向性,后续研究应考虑流刺网或地笼网等更全面的采样方法。基于稳定同位素分析大部分鱼类的营养级结果和Fishbase资料中数据相差不大,表明稳定同位素技术是研究海洋生物营养级别、分析其营养层次的可靠手段。但其中花斑蛇鲻Sauridaundosquamis和大头狗母鱼Trachinocephalusmyop营养级偏低,花斑蛇鲻营养级为3.50,高于杨国欢[15]在徐闻珊瑚礁关于长蛇鲻的胃含物分析(3.20),花斑蛇鲻与长蛇鲻属于同科同属,且食性相似,应具有相近的营养级别[39],而低于Fishbase资料中的4.50±0.4;而大头狗母鱼的营养级水平(3.08)也略低于杨国欢[15]的研究(3.20)和Fishbase资料中的数据4.40±0.4。多项研究表明体长的差异会影响鱼类营养级[40—42]。Nakazawa[41]等研究发现掠食性鱼类体长与δ15N值有呈现正相关的趋势,张波等[42]研究幼鱼阶段赤鼻棱鲦营养级随叉长增加而增加。本研究中采样鱼类平均体长为(8.0±5.52)cm,体型较小,鱼类可能无法消耗高营养水平的较大猎物导致其食物种类范围在低营养级群落中。而且本次调查采集的鱼类主要为中小型鱼类,一些鲨类、鳐类等大型肉食性鱼类[11,27,29]可能未被采集到,这也可能是导致营养级偏低的原因。另外,本研究中基准生物选择为浮游动物,运用整体的浮游动物的δ15N值为基准估算鱼类营养级是有局限性的,浮游动物不同大小、不同种类、营养物质来源以及季节性变化等都会对营养级估算产生影响[38]。
本次采样调查中头足类的平均体长为(4.7±2.17)cm。头足类会摄食虾蟹类及鱼类,应位于营养层次较高的位置,但头足类胴长会显著影响其δ13C和δ15N值,在稚鱼阶段头足类常以端足类、糠虾等小型甲壳类为食[43—44]。聚类分析中,第二类群除虾蟹类外,双喙耳乌贼也被聚类,说明具有相似食性。此次采样双喙耳乌贼体长范围在3.0—4.2 cm之间,体重在8.78—24.21 g之间,体型较小。在南海中西部研究中也发现,头足类平均营养级随着体长(胴长)增大其营养级有相应增大的趋势[27],因此,两类平均营养级相同可能与采集样品中头足类的生长阶段及个体大小有关。另外,虾蟹类中锈斑蟳营养级最高,锈斑蟳食性比较复杂,会摄食甲壳类、藻类、鱼类等[45],张文博[28]、高春霞[30]、莫宝霖[46]等人研究中锈斑蟳也具有较高的δ15N值或营养级。棘皮类中营养级最高的生物是红腹海参,与其他棘皮动物相比,红腹海参除摄食沉积物、浮游生物外,还会摄食海草、藻类等[47]。食性差异可能是导致锈斑蟳与红腹海参营养级相对较高的原因。
3.3 牧场区域珊瑚礁食物网主要消费者食源分析
浮游植物、底栖微藻、大型海藻在海洋牧场生态系统中是重要的潜在食源,对确定食物网中的主要碳源具有重要意义[6,48—49]。稳定同位素分析在海洋牧场区域主要消费者食性来源方面的研究已有诸多报道。本研究中,底栖微藻贡献率为20.59%,大型海藻占比20.91%。其中,底栖微藻在虾蟹类、腹足类和棘皮类为主的第二、四类群生物中摄食最高,平均贡献率分别为21.84%、32.05%和32.44%,Briand[7]等也发现基于底栖藻类的底栖食物网为大多数中间消费者、杂食性鱼类提供了重要的食物来源。δ13C值富集程度可用于示踪及分析生态系统食物链[50—51],碳同位素高的生物基本与底栖食物网有关[30]。经过单因素方差分析,鱼类与虾蟹类、腹足类、棘皮类的稳定碳同位素之间呈现极显著性差异(P<0.01),鱼类与棘皮类差值最大(6.36%),δ13C值富集程度较低,研究区域可能存在以底栖微藻为食源基础的底栖食物链。本研究中,第三类群鱼类的主要食源是大型海藻,在海洋牧场生态系统中,大型海藻与珊瑚会有一定的竞争机制,但在营养物质的吸收与释放、生物饵料、空间庇护等方面也有重要作用[52—53]。如大型海藻在黑带光鳃雀鲷与细条天竺鲷中的碳源占26.5%、24.7%,蒋日进等[54]发现在枸杞岛食物网中鱼类的主要碳源也是大型海藻,McMahon[6]等利用贝叶斯模型研究表明大型海藻是红海珊瑚礁区域食物网的重要基础。SOM也是该海域生物食源的组成部分,是重要碳源。基于IsoSource模型分析,本研究中海参(黑海参、绿刺身、红腹海参)、海胆(刺冠海胆、紫海胆)等棘皮类的SOM贡献率最高,平均贡献率分别占43.83%、26.4%。SOM是棘皮类的基础食源,这与魏虎进[55]在象山港海洋牧场区研究发现SOM是食物网的营养基础和莫宝霖[46]基于稳定同位素技术分析大亚湾紫海胆食性的结果相似。
4 结论
本研究构建了三亚蜈支洲岛海洋牧场生态系统食物网,分析牧场区域内主要消费者的营养级特征,应用SIBER模型对比牧场区域与邻近海域的营养结构差异,进一步利用聚类分析与IsoSource模型揭示主要消费者的食源,为海洋牧场生态系统食物网的构建及实现基于生态系统的渔业管理提供科学的理论依据。在后续研究中,应针对牧场内珊瑚礁生态系统的规模、稳定性和成熟度研究其内部的物质循环和能量流动,分析海洋牧场关键捕食者或关键生境改造者在珊瑚礁区域的重要性。
