外泌体对鼻咽癌细胞耐药的作用研究
2022-05-19刘梦雅唐薇胡玉琳向澎路雪妍刘津
刘梦雅, 唐薇, 胡玉琳, 向澎, 路雪妍, 刘津
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院耳鼻咽喉头颈外科,广西 百色 533000)
鼻咽癌(nasopharyngeal carcinoma,NPC)是头颈部最常见的恶性肿瘤,在中国南方地区,尤其是广西、广东、福建等地发病率较高,目前以放疗结合化疗的治疗方案为首选治疗方案,在肿瘤早期亦可选择单纯手术联合化疗的方式,以减少放疗所产生的副作用:如咽干、咽鼓管功能不全等[1]。而肿瘤化疗耐药的产生常常导致治疗肿瘤的复发和治疗失败。外泌体是由细胞或组织分泌的具有双层膜结构的小囊泡,直径约40~150 nm,内含多种脂质、核酸、蛋白质等[2],在肿瘤的复发、转移、化疗耐药中发挥着重要作用。鼻咽癌细胞来源的外泌体也受到越来越多的关注,但鼻咽癌耐药细胞来源的外泌体对肿瘤细胞耐药的影响目前研究较少。本文通过超速离心的方法,观察肿瘤细胞来源的外泌体对肿瘤细胞的影响,探究鼻咽癌来源的外泌体在肿瘤耐药中的作用和可能机制。
1 材料与方法
1.1 细胞、主要试剂和仪器 鼻咽癌细胞CNE-1来自实验中心保存。RPMI 1640基础培养基、胎牛血清、胰蛋白酶(美国Gibco公司),抗人CD81、CD9抗体(Affinity公司),抗人TSG 101、MVP、P-gp(武汉三鹰),PKH67(美国sigma公司),Transwell小室、细胞培养瓶、培养板(美国Corning公司),激光共聚焦显微镜(日本OLYMPUS)、透射电子显微镜(型号 LVEM5)、超速离心机(美国Thermofisher)。
1.2 细胞培养及耐药细胞系的建立 用含10%胎牛血清和90%的RPMI 1640培养基的完全培养基培养细胞,待细胞生长稳定后从0.01 mg/ml的浓度起加入顺铂注射液,细胞稳定生长传代3次后加入更高的药物浓度, 如0.01 mg/ml、0.03 mg/ml、0.05 mg/ml、0.07 mg/ml、0.10 mg/ml、0.15 mg/ml、0.20 mg/ml、0.3 mg/ml、0.4 mg/ml,直至药物浓度达到2 mg/ml ,利用CCK-8法检测其耐药指数,利用免疫印迹法检测耐药蛋白MVP、P-gp的表达变化。
1.3 CCK-8检测细胞耐药性 将呈对数生长的细胞用胰蛋白酶消化后重悬于完全培养基中,按照2 000个/孔的的浓度接种于96孔板中,待细胞完全贴壁后(8~10 h)将培养液换为含药物浓度分别为1 μg/μl、2 μg/μl、5 μg/μl、8 μg/μl、10 μg/μl、15 μg/μl、20 μg/μl的培养基,48 h 后加入CCK-8检测其OD值,分别计算耐药细胞与敏感细胞的半数致死率IC50,两者比值即为耐药指数。
1.4 Transwell小室验证耐药的传递性 将细胞消化后接种于小室中,上层为耐药细胞,下层为敏感细胞,培养72 h,下层浓度为70%~80%,胰蛋白酶消化,收集细胞,按步骤1.3接种于96孔板,通过CCK-8法检测其耐药性变化。
1.5 无外泌体血清的制备 将胎牛血清配平后置于超速离心机,以4 ℃、100 000 g离心18 h ,取上层80%液体为去除外泌体的血清。
1.6 外泌体的提取 收集细胞上清液,分别以4 ℃ 300 g、4 ℃ 2 000 g离心15 min去除死细胞及细胞碎片后置于-80°冰箱保存,需用时提前解冻上清液,以4 ℃ 10 000 g离心30 min,进一步去除细胞碎片,4 ℃ 120 000 g离心75 min获得外泌体沉淀,用PBS吹打沉淀,收集所有管的外泌体于1支管中,再次以4 ℃ 120 000 g离心75 min,所得黄褐色沉淀即为外泌体,最后用100 μl培养基(根据后续实验情况,或用裂解液、无酶水)吹打重悬。
1.7 外泌体的鉴定 ①形态学观察:透射电子显微镜(TEM)观察外泌体形态:重悬exosome到50~100 μl 2%多聚甲醛中,取5 μl外泌体悬液加到载样铜网上,将铜网放在50 μl 1%戊二醛液滴上5 min,双蒸水清洗8次每次2 min,50 μl醋酸双氧铀液染色5 min,甲基纤维素液包被10 min(冰上操作),吸去多余液体,空气中干燥5~10 min,80 kV下观察并拍摄电镜照片。②外泌体表征蛋白检测Western blot:将上述步骤1.6所得外泌体用裂解液重悬后,用BCA试剂盒检测蛋白含量,加入1/4体积的上样缓冲液,水浴加热10 min进行蛋白质变性,然后进行电泳、转膜、蛋白孵育,检测抗体CD9、CD81、TSG101表达情况。③NTA纳米追踪技术(粒径分析):将离心所得的外泌体重悬于1 ml PBS,密封冰上保存,使用洁净的一次性样品池,对光擦拭外管壁,确保无颗粒附着,不影响检测光线,适度倾斜样品池,延管壁缓慢注入外泌体溶液,避免气泡产生,使用薄盖盖好样品池,将样品池放入仪器,按照标准操作规程操作上机检测。
1.8 外泌体细胞摄取实验 将步骤1.6所得的沉淀用培养基吹打重悬后加入1 μl的PKH 67预混染料(1 μl PKH 67+1 ml Diluent C),混匀后避光孵育20 min,再以4 ℃ 120 000 g离心75 min,得到染色后的外泌体沉淀,将其用PBS重悬后加入细胞浓度为50%的共聚焦显微镜专用培养皿中与细胞共同培养24 h,PBS清洗,多聚甲醛固定细胞20 min,用DAPI进行细胞核染色,将无外泌体组命名为对照组,外泌体组命名为实验组,共聚焦显微镜下观察外泌体被细胞摄取的情况。
1.9 统计学方法 采用SPSS 26.0进行统计分析,两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 检测耐药指数 耐药细胞药物半数抑制浓度IC50为(12.54±1),耐药指数为5.15,与敏感细胞相比耐药蛋白MVP、P-gp表达明显升高,如图1。细胞形态学观察发现敏感细胞呈规则圆形结构,排列整齐,耐药细胞呈梭形条索状,不规则排列。

图1 耐药细胞形态学变化及耐药蛋白表达情况
2.2 Transwell共培养 IC50明显升高(4.83±0.32),耐药指数为1.98,如图2。与耐药细胞相比有统计学意义(F=6.22,P<0.05)。

图2 外泌体共培养对细胞增值的影响
2.3 外泌体的鉴定 ①形态学观察:将稀释后的外泌体在透射电子显微镜下观察,可以看到外泌体呈经典茶托样形态,大小不一,直径约40~150 nm,如图3A。②CD9、CD81、TSG101蛋白在外泌体中的表型鉴定:Western Blot检测结果显示,外泌体中富含 CD9、CD81、TSG101蛋白,如图3B;③NTA粒径分析:外泌体浓度为2.2×1011个/毫升,直径大部分分布于50~150 nm之间,如图3C。三者共同验证所提取的物质为由细胞所分泌的外泌体,证明实验方法正确有效。

图3 外泌体鉴定结果(形态、标志蛋白、粒径)
2.4 外泌体摄取情况 外泌体采用PKH67绿色荧光蛋白标记,CNE-1细胞采用DAPI荧光进行核染色,于共聚焦显微镜专用培养皿中培养24 h,共聚焦显微镜下我们观察到细胞核被DAPI染色为蓝色,外泌体被染为绿色,对照组无外泌体附着,实验组细胞表面有外泌体附着,如图4。
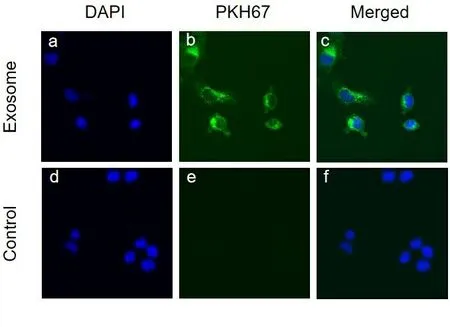
注:a.外泌体共孵育的细胞核,b.外泌体,c.外泌体与细胞共孵育,d.无外泌体的细胞核,e.无外泌体,f.无外泌体的细胞。
3 讨论
外泌体是由细胞或组织分泌的直径约40~150 nm的双磷脂层微囊泡,我们体内几乎所有细胞都可以分泌外泌体,内含蛋白质、核酸、脂质等生物活性物质[2],在肿瘤的发生发展、侵袭、转移、耐药等过程中发生重要作用,如在鼻咽癌中,外泌体来源的miR-24-3p通过抑制FGF11的表达来形成新的免疫逃逸[3],可通过介导cicRNA促进非小细胞肺癌细胞的增值、迁移和侵袭[4],亦可通过介导miRNA促进肺癌间充质从而促进肺癌的侵袭,巨噬细胞来源的外泌体可以促进结肠癌的细胞迁移和侵袭[5],肿瘤细胞来源的外泌体可促进胃癌细胞增殖、侵袭、迁移和上皮-间充质转变[6],癌症相关成纤维细胞(CAFs)分泌的外泌体可促进结直肠癌的转移和化疗耐药性[7]。本研究采用经典超高速离心的方法获取鼻咽癌耐药细胞源性的外泌体,并发现鼻咽癌耐药细胞源性的外泌体可促进鼻咽癌敏感细胞产生耐药性,表明鼻咽癌耐药细胞源性的外泌体内富含耐药相关基因或蛋白,从而介导两种或多种细胞间的信息传递。
鼻咽癌是头颈部恶性肿瘤的常见肿瘤,其化疗耐药的产生常常导致肿瘤的转移和治疗失败。为了探讨鼻咽癌细胞的耐药机制,我们将耐药细胞与敏感细胞置于一个只能容纳外泌体通过的小室中共培养,发现外泌体可以介导该耐药株的耐药传递性,外泌体被细胞摄取的实验也进一步验证了我们的观点。由此我们认为来源于耐药细胞的外泌体中含有耐药细胞信息,且能够将此信息传递给其他(敏感)细胞,导致其他细胞耐药,进而使全部细胞携带耐药性,但这种传递性是有限度的,如在我们共培养之后的细胞耐药性也只能提高1.98倍,我们认为敏感细胞只能接受一部分的耐药信息,而保留大部分的自身信息,从而只能有限度地提高耐药性,当然这可能也和共培养的时间以及次数有关。有研究证明[8],在小鼠黑色素瘤细胞中,随着时间的增加,外泌体的摄取率也逐渐增加,相关蛋白表达也随之增高。
外泌体在心血管疾病[9]、骨关节炎[10]、抑郁症[11]、肝癌[12]等多种疾病中发挥着至关重要的作用。鼻咽癌外泌体参与了肿瘤与受体细胞之间的通讯,通过改变邻近肿瘤和间质细胞的基因表达来控制病毒感染、免疫逃逸和肿瘤微环境[13]。崔兆磊等[14]等检测了鼻咽癌患者治疗前和转移后以及健康人的血浆外泌体miR-BART的表达差异,结果发现 miR-BART3转移前后有较大的差别,且和肿瘤分期相关,即miR-BART3表达量越高,分期越晚。Lu J等[15]建立了过表达miR-9的稳转株,通过一系列细胞功能实验发现,鼻咽癌外泌体miR-9在血管内皮细胞内通过作用于MDK,抑制下游PI3K/AKT信号通路,进而抑制血管生成,与鼻咽癌患者的生存期呈正相关。罗轶等[16]通过射线照射建立放疗抵抗鼻咽癌细胞模型,并检测放疗抵抗的鼻咽癌细胞外泌体中miR-21表达含量明显增高,通过外泌体共培养、转染等方法进一步验证了鼻咽癌放疗抵抗细胞(R-CNE2)来源的外泌体miR-21在CNE2细胞放疗抵抗中发挥重要作用。Li JX等[17]发现化疗耐药和末期患者血清中外泌体miR-106a-5p水平高于非耐药和首期患者,并通过进一步的实验验证了肿瘤的耐药和外泌体源性miR-106a-5p相关,提出了外泌体miR-106a-5p是鼻咽癌患者潜在的诊断生物标志物和药物靶点。这些使我们对鼻咽癌化疗耐药发生机制有了更深入的了解,为后续治疗鼻咽癌化疗耐药提供了思路。作为肿瘤微环境、液体活检的重要研究对象,外泌体在鼻咽癌早期筛查、靶向治疗、预后评估等方面具有重要的应用前景[18-19]。 在本研究中,我们通过对外泌体共培养后的敏感细胞进行检测,发现共培养后的敏感细胞对顺铂的耐药性显著提高,提示耐药细胞来源的外泌体内含有耐药相关蛋白或基因,参与调控肿瘤细胞间信息的传递,但本研究存在局限性,具体何种耐药基因参与表达调控机制,目前还有待于进一步探索。
综上所述,本研究证实,鼻咽癌耐药细胞来源的外泌体可诱导敏感细胞对顺铂产生耐药,其作用机制可能和其携带的非编码RNA及相关的信号转导通路有关,这为我们今后研究由外泌体介导的鼻咽癌耐药机制提供了基础。
