高茶氨酸茶树新品系‘福黄1号’黄化变异机理
2022-05-17林馨颖王鹏杰杨如兴郑玉成陈潇敏张磊邵淑贤叶乃兴
林馨颖,王鹏杰,杨如兴,郑玉成,陈潇敏,张磊,邵淑贤,叶乃兴
高茶氨酸茶树新品系‘福黄1号’黄化变异机理
林馨颖1,王鹏杰1,杨如兴2,郑玉成1,陈潇敏1,张磊2,邵淑贤1,叶乃兴1
1福建农林大学园艺学院/茶学福建省高校重点实验室,福州 350002;2福建省农业科学院茶叶研究所,福州 350013
【】分析茶树黄化变异相关的代谢和转录机制,探究高茶氨酸茶树新品系‘福黄1号’的黄化变异和高茶氨酸形成机理。以茶树‘福安大白茶’及其黄化突变种质‘福黄1号’为试验材料,利用超微电镜、广泛靶向代谢组学、靶向代谢组学及转录组学联合分析,确定茶树黄化变异相关的色素、代谢物及转录组数据。超微结构显示,‘福黄1号’的叶绿体类囊体呈现丝状,基粒片层排列散乱不规则,片层间疏松,存在许多异常的囊泡。色素含量测定表明,叶绿素a和叶绿素b含量显著下降,叶绿素a/b比率下降,相关基因表达显著下调,黄化叶片中光捕获叶绿素a/b蛋白(LHC)表达显著下调。类胡萝卜素总含量虽然差异不大,但各组分含量显著变化,玉米黄质为唯一显著增加的组分,其调控基因表达显著上调,其余组分含量均下降。与‘福安大白茶’相比,‘福黄1号’中共鉴定到680个差异表达基因(DEGs)和57个显著变化的代谢物(SCMs)。KEGG富集分析表明,SCMs和DEGs显著富集到氨基酸生物合成、谷胱甘肽代谢以及TCA循环等途径。此外,与碳和氮代谢相关的通路也被激活。通过靶向测定,共鉴定到19种游离氨基酸,新品系‘福黄1号’游离氨基酸含量显著高于‘福安大白茶’,达到97.13 mg∙g-1,其中茶氨酸为66.90 mg∙g-1,占氨基酸含量的68.89%,而精氨酸含量达到8.46 mg∙g-1,是‘福安大白茶’的56.4倍。调控氨基酸合成的和的表达量上调1.17倍和3.17倍。‘福黄1号’的芽叶色泽主要受叶绿素、类胡萝卜素和类黄酮等色素代谢的影响,和4种的共同作用也可能影响叶绿体的生物合成来调节叶片色泽。‘福黄1号’茶氨酸含量显著高于‘福安大白茶’的原因主要是泛素化相关的蛋白质水解酶表达上调蛋白降解能力加强,叶绿素和其他含氮分子生物合成的减少,以及黄化叶中碳骨架的缺乏,氨基和氮资源被更有效地储存,使得与氨基酸合成相关的氮代谢激活,茶氨酸合成前体物质之一的谷氨酸积累,这可能促使茶氨酸成为黄化叶中显著积累的含氮化合物。
茶树;福黄1号;黄化;代谢;转录;组学技术
0 引言
【研究意义】茶树()是一种在世界范围内广泛种植的叶用经济作物[1]。茶叶中富含次级代谢产物,例如儿茶素、茶氨酸、咖啡碱,不同茶树品种的生化成分差异很大,对茶叶品质和价值具有较大影响[2]。近年来,具有特定叶色的茶树突变体,其独特的外形和品质受到越来越多的关注[3]。与绿叶品种相比,茶树黄化突变种一般具有较高的游离氨基酸(包括茶氨酸)[4],对茶树新品种选育具有重要意义。【前人研究进展】植物叶片黄化现象的形成受到色素沉着、细胞结构变异、代谢等多种生理生化过程的改变和环境因素影响[5]。黄化植物叶片的早期发育一般经历3个阶段:黄化前期、黄化期和返青期,大多数茶树叶片在黄化期,其叶绿体和类囊体膜异常发育,叶片颜色呈现白色到黄色不等,而这取决于叶绿素和类胡萝卜素的缺乏程度[6-7]。光照敏感型黄化茶树品种‘黄金芽’的叶片着色主要由类黄酮和类胡萝卜素生物合成综合作用决定[8]。而在‘白叶1号’中,参与固碳、苯丙素和类黄酮生物合成的代谢物的显著变化是导致其叶色变异主要原因,同时,碳水化合物和能量代谢、叶绿体生物发生也在‘白叶1号’中有差异变化[9]。此外,黄化现象还伴随着有助于茶叶风味的代谢物积累,例如,高氨基酸会带来“鲜味”;低水平含量的咖啡碱和儿茶素减少了涩味和苦味[5]。有研究认为,茶树黄化品种中的游离氨基酸含量增加,提高了成品茶的质量,相对于绿叶品种而言,茶树黄化品种具有更高的经济价值[10]。茶叶中含量较高的游离氨基酸是茶氨酸、谷氨酰胺、谷氨酸和精氨酸,而作为茶叶中一种独特的氨基酸,茶氨酸是一种天然成分,是茶叶鲜爽味的主要来源[11]。茶氨酸自被发现以来,其在食品和医药领域有着广泛应用,对人体具有镇静、安神等多种生理保健功能[12]。茶树黄化品种因其高茶氨酸备受关注,因此,研究茶树黄化品种茶氨酸的累积机理具有极其重要的意义。目前选育高茶氨酸茶树品种,是茶树育种研究的一个重要方向,也是茶树功能性育种的重要内容之一。【本研究切入点】福建省是中国茶树栽培的主要省份之一,而在福建省内发现的黄化变异种,如‘白鸡冠’‘黄叶肉桂’‘黄金水仙’均不具有高茶氨酸。‘福黄1号’是茶树优良品种‘福安大白茶’的黄化突变种,是笔者课题组前期挖掘出的高茶氨酸茶树新品系,其黄化代谢及高茶氨酸累积机制不明,利用多组学技术分析黄化叶片相关通路尚待研究。【拟解决的关键问题】本研究以‘福安大白茶’和‘福黄1号’为试验材料,利用透射电镜、广泛靶向代谢组学、靶向代谢组学和转录组学整合分析,阐明茶树黄化变异形成的机制,为高茶氨酸茶树资源选育提供新的理论依据。
1 材料与方法
1.1 材料处理
2021年3月在福建省宁德市蕉城区八都镇茶树品种示范茶园采集的‘福安大白茶’及其黄化种‘福黄1号’的春梢一芽二叶,立即用液氮进行冷冻固定并在-80℃下保存,用于后续色素、代谢及转录试验,均设置3个生物学重复。再取表面完整无缺口或虫口的第二片叶片,用2.5%戊二醛固定,用于后续超微结构的鉴定。
1.2 叶绿体超微结构观察
透射电镜样品的制备参考Hao等[13]的方法,对‘福安大白茶’和‘福黄1号’的成熟二叶进行处理,漂洗(磷酸缓冲液)并固定2 h,重复3次,再经渗透剂渗透8—12 h后加入包埋剂(环氧树脂),聚合48 h。超薄切片机(EM UC7,Leica(德国))切出厚度为80—100 nm的切片,并用铀铅双染色,室温干燥过夜,使用TEM Hitachi HT7700(日本)电镜进行观察。
1.3 叶绿素和类胡萝卜素含量测定
叶绿素和类胡萝卜素总含量的测定方法参考Wang等[3],称取0.1 g样品于15 mL离心管中,加入2 mL乙醇,涡旋混匀。12 000 r/min离心10 min。重复上述步骤直至残渣呈无色,合并上清。使用UV-3200分光光度计(Mapada,中国)在665 nm(Chl a)、649 nm(Chl b)和470 nm(总类胡萝卜素)分析,以乙醇为空白对照。
类胡萝卜素各组分含量的测定样品前处理参考林馨颖等[14]的方法。数据采集仪器系统主要包括超高效液相色谱(UPLC)(ExionLC™ AD,https://sciex.com. cn/)和串联质谱(MS/MS)(QTRAP® 6500+,https://sciex.com.cn/)。液相条件主要包括:色谱柱:YMC C30(100 mm×2.0 mm,3 μm);流动相:A相,甲醇/乙腈(1﹕3,v/v)加入0.01% BHT和0.1%甲酸;B相,甲基叔丁基醚加入0.01% BHT;梯度洗脱程序:0 min A/B为100﹕0(V/V),3 min为100﹕0(V/V),5 min为30:70(V/V),9 min为5﹕95(V/V),10 min为100﹕0(V/V),11 min为100﹕0(V/V);流速0.8 mL∙min-1;柱温28℃;进样量2 μL。质谱条件主要包括:大气压化学离子源(atmospheric pressure chemical ionization source,APCI)温度350℃,气帘气(curtain gas,CUR)25 psi。在Q-Trap 6500+中,每个离子对是根据优化的去簇电压(declustering potential,DP)和碰撞能(collision energy,CE)进行扫描检测。
1.4 游离氨基酸含量的测定
游离氨基酸含量的测定是利用三重四极杆液质联用仪分析数据,液质联用仪:Sciex 4500 QTrap质谱仪(美国Sciex公司)配Nexera X2LC-30A高效液相色谱仪(日本Shimadzu公司)。样品提取及AQC衍生、色谱条件及质谱条件的具体方法参考陈思肜[15]等。
1.5 LC-ESI-MS/MS代谢物分析
代谢物的提取参考ZHENG等[16]的方法。利用超高效液相色谱(SHIMADZU Nexera X2,https://www. shimadzu.com.cn/)和串联质谱(Applied Biosystems 4500 QTRAP,http://www.appliedbiosystems.com.cn/)分析代谢物。液相条件主要包括:色谱柱:Agilent SB-C18(2.1 mm×100 mm,1.8 µm)。流动相:A相为超纯水(加入0.1%的甲酸),B相为乙腈(加入0.1%的甲酸)。洗脱梯度:0 min,B相比例为5%;9.00 min内,B相比例线性增加到95%,并维持在95% 1 min;10.00—11.10 min,B相比例降为5%,并以5%平衡至14 min。流速0.35 mL∙min-1;柱温40℃;进样量4 μL。质谱条件主要包括:电喷雾离子源(electrospray ionization,ESI)温度550℃,离子喷雾电压(IS)5 500 V(正离子模式)/-4 500 V(负离子模式);离子源气体I(GSI)、气体II(GSII)和帘气(CUR)分别设置为50、60和25.0 psi,碰撞诱导电离参数设置为高,具体条件参考Lin等[17]。利用多元统计分析VIP值、值及差异倍数来筛选差异代谢物(SCMs),通过R包(v3.3.2)中pheatmap程序对筛选出的‘福安大白茶’和‘福黄1号’差异代谢成分进行聚类分析并绘制热图。对各组样本差异代谢物进行层次聚类,同时将得到的相应差异代谢物进行KEGG富集分析。
1.6 转录组测序及分析
总RNA提取和质量控制参考文献[18]。通过迈特维尔生物科技有限公司在Illumina HiSeq测序平台上对文库片段进行测序。经过原始数据过滤、测序错误率检查、GC含量分布检查,获得后续分析使用过滤序列(clean reads)。利用HISAT2将clean reads与参考基因组(茶树‘黄棪’基因组)[1]进行序列比对,获取在参考基因组或基因上的位置信息,以及测序样品特有的序列特征信息。基因的reads计数使用featureCounts[19],并计算FPKM(Fragments Per Kilobase of transcript per Million fragments mapped)。采用DESeq2来确定差异表达基因(DEGs),差异分析之后,还需要用Benjamini-Hochberg方法对假设检验概率(-value)进行多重假设检验校正,得到错误发现率(false discovery rate,FDR)。差异基因的筛选条件为|log2fold change|≥1,且FDR<0.05。使用clusterProfiler软件[20]进一步对DEGs进行KEGG富集分析。
1.7 转录组数据验证
为验证转录组数据的准确性,挑取11个差异基因进行表达水平验证,通过Primer3Plus(http://www. bioinformatics.nl/cgi-bin/)设计荧光定量引物(附表1)。参照林馨颖等[21]的方法,根据已提取的总RNA,使用全式金Easyscript One-step gDNA Removal and cDNA synthesis superMix试剂盒合成cDNA作为实时荧光定量PCR模板。以(登录号:GE651107)作为内参基因[22],使用Bio-Rad的CFX96 Touch荧光定量PCR仪进行qRT-PCR反应,反应体系参照Transstart® Tip Green qPCR superMix试剂盒的方法,反应程序:94℃,30 s;94℃,5 s;60℃,30 s,40个循环。所有样品均设置3个生物学重复,使用2-△△CT方法计算表达水平。
2 结果
2.1 芽叶表型特征和超微结构分析
正常性状(图1-a1)‘福安大白茶’芽到成熟叶均为正常绿色,黄化种‘福黄1号’(图1-b1)顶芽到芽下三或四叶呈现黄色。超微结构观察表明(图1-a2、a3、a4),‘福安大白茶’叶绿体紧贴细胞壁,多呈梭形或长椭圆形,基粒片层结构排列紧密有序且清晰,有少量的嗜锇颗粒和淀粉粒,叶绿体被膜完整;‘福黄1号’叶绿体结构显示(图1-b2、b3、b4),细胞和叶绿体的形态和结构具有显著地变化,叶绿体的被膜完整,但是叶绿体内部结构发育不良,只有少许的丝状类囊体存在,基粒片层排列散乱不规则,片层间疏松,层次不清晰,甚至断裂不成形,嗜锇颗粒体积较小。
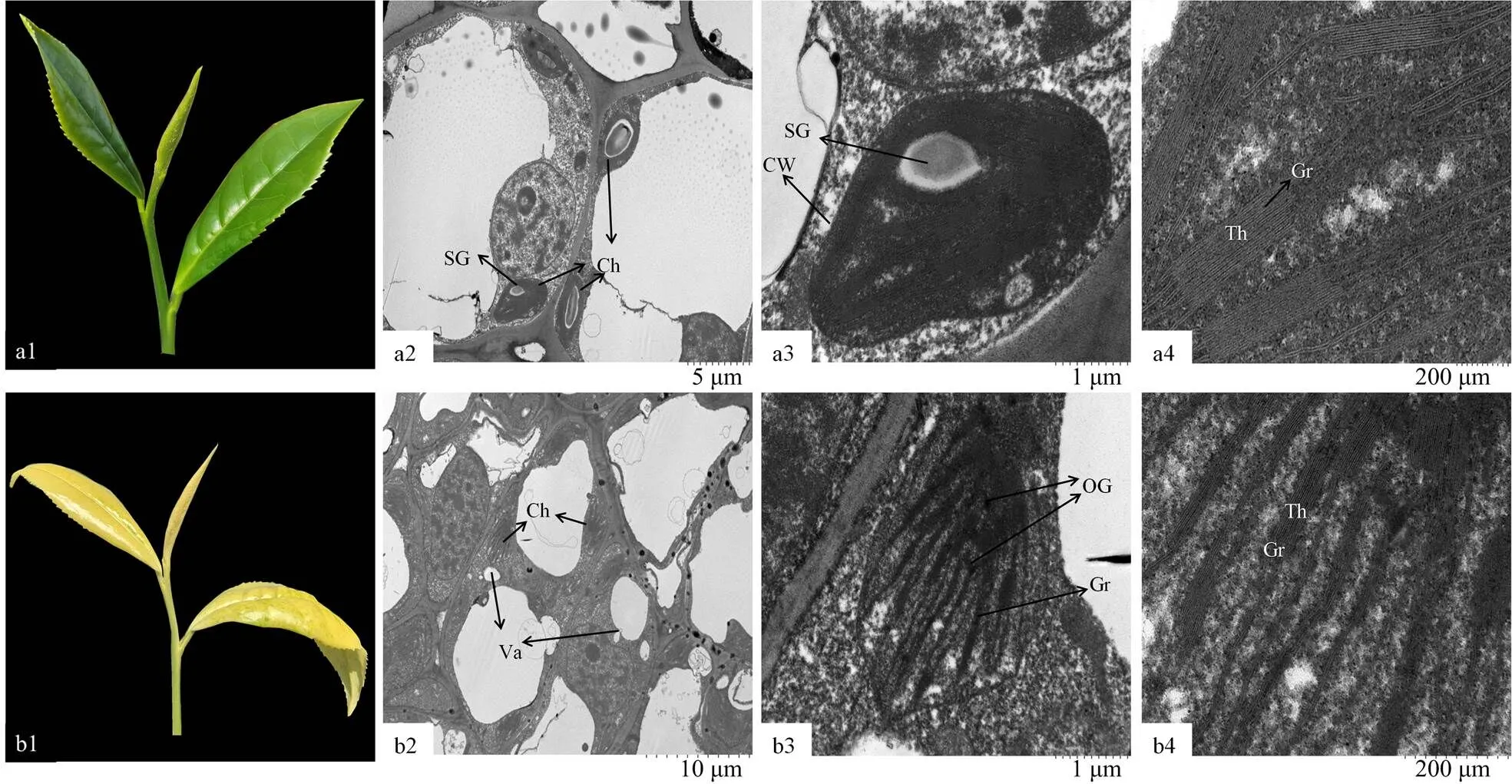
a1—a4:‘福安大白茶’表型和超微结构;b1—b4:‘福黄1号’表型和超微结构;SG:淀粉粒;Ch:叶绿体;CW:细胞壁;Th:类囊体;Gr:基粒;Va:液泡;OG:嗜锇颗粒
2.2 广泛靶向代谢组差异分析
2.2.1 广泛靶向代谢物分析及差异代谢物筛选 通过广泛靶向代谢组学在‘福安大白茶’(GF)和‘福黄1号’(YF)中共鉴定到1 158种代谢物,PCA和OPLS-DA分析结果表明,‘福安大白茶’与‘福黄1号’的代谢物分布明显分离(附图1-a和1-b)。根据代谢物VIP≥1、log2fold change≥2和log2fold change≤0.5筛选差异代谢物(SCMs),火山图(图2-A)显示,含量显著上升的代谢物26种,显著下降的代谢物31种。与‘福安大白茶’相比,在‘福黄1号’中共鉴定出57种(4.92%)差异代谢物(附表2)。这些差异代谢物可分为11类,包括氨基酸及其衍生物、酚酸类、核苷酸及其衍生物、黄酮、木脂素和香豆素、鞣质、萜类、有机酸、脂质、生物碱和其他类(图2-B);而在黄化种中,脂质、氨基酸及其衍生物、黄酮等上调,鞣质、木脂素和香豆素、萜类无显著变化。
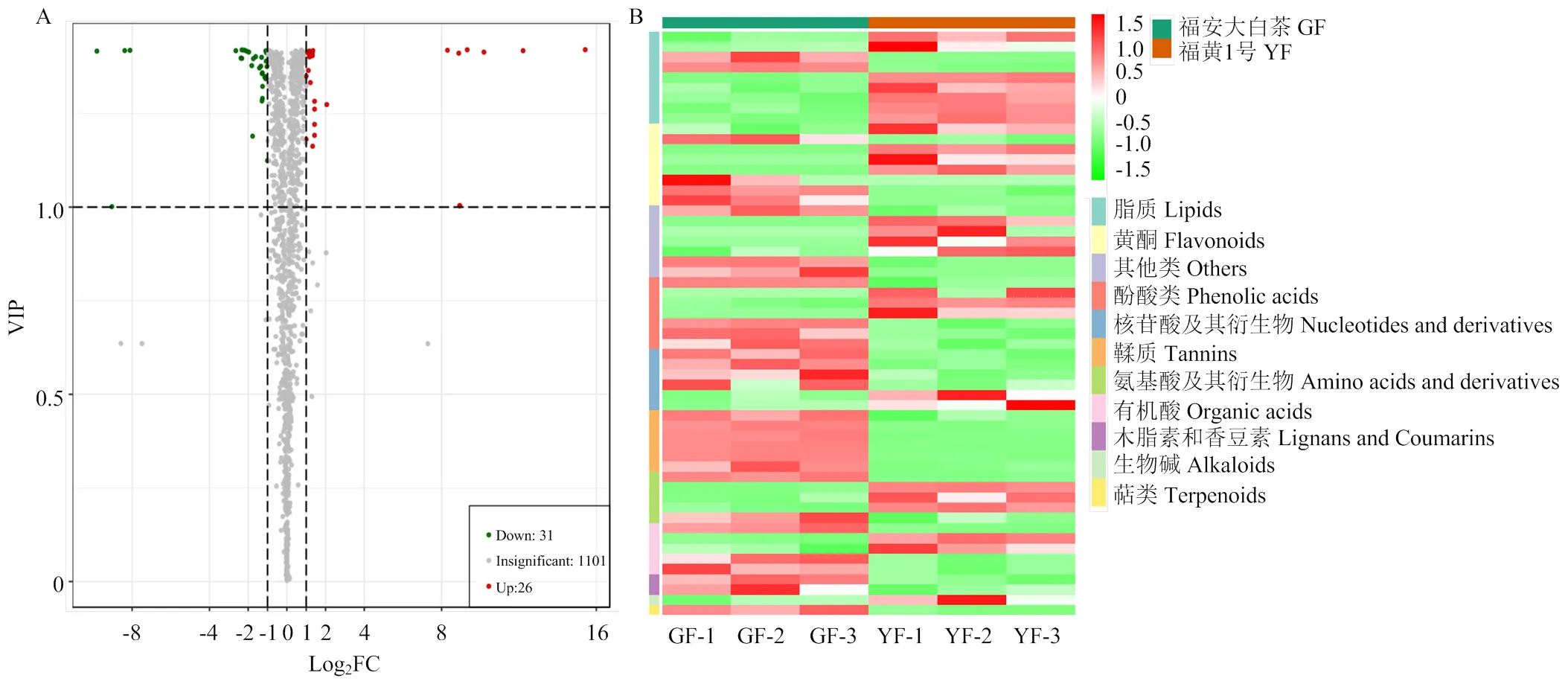
A:正交偏最小二乘法判别分析;B:差异代谢物聚类热图 A: OPLS-DA; B: SCMs heatmap
2.2.2 差异代谢物KEGG功能富集分析 差异代谢物富集到氨基酸生物合成途径,碳代谢,丙氨酸、天冬氨酸和谷氨酸代谢,半胱氨酸和蛋氨酸代谢,光合代谢等途径(图3)。表明在黄化茶中可能发生大规模代谢重编程事件,以适应环境。
2.3 转录组分析
2.3.1 测序数据质量分析及差异表达基因筛选 为了鉴定‘福安大白茶’(GF)和‘福黄1号’(YF)中的差异表达基因(DEGs),进行转录组学比较。如表1所示,总共获得了290 925 592个原始序列(raw reads),在去除测序接头污染和低质量的序列后,共获得高质量的283 954 518个过滤序列(clean reads),共产生42.6 G的过滤碱基(clean bases),并且过滤序列Q20在95.62%以上,Q30在88.54%以上,整体测序错误率在0.03%,表明测序数据质量好,可用于后续分析。差异基因的筛选条件为|log2fold change|≥1,且FDR<0.05。共筛选出680个DEGs,包括460上调基因和220下调基因。
2.3.2 差异表达基因KEGG功能富集分析 将‘福安大白茶’(GF)和‘福黄1号’(YF)的DEGs进行KEGG功能富集,共富集到102个代谢途径。前20条途径的富集分析表明,大多数DEGs都作用于多个代谢过程,与氨基酸代谢、核苷酸代谢、脂质代谢、碳水化合物代谢和次级代谢有关(图4)。这些DEGs注释的途径与SCMs的分类密切相关,表明差异基因调控两者之间代谢产物的变化。且DEGs富集到氨基酸生物合成、色氨酸代谢、谷胱甘肽代谢、类黄酮生物合成、光合作用-天线蛋白、TCA循环以及角质、次分泌物和蜡生物合成等途径。
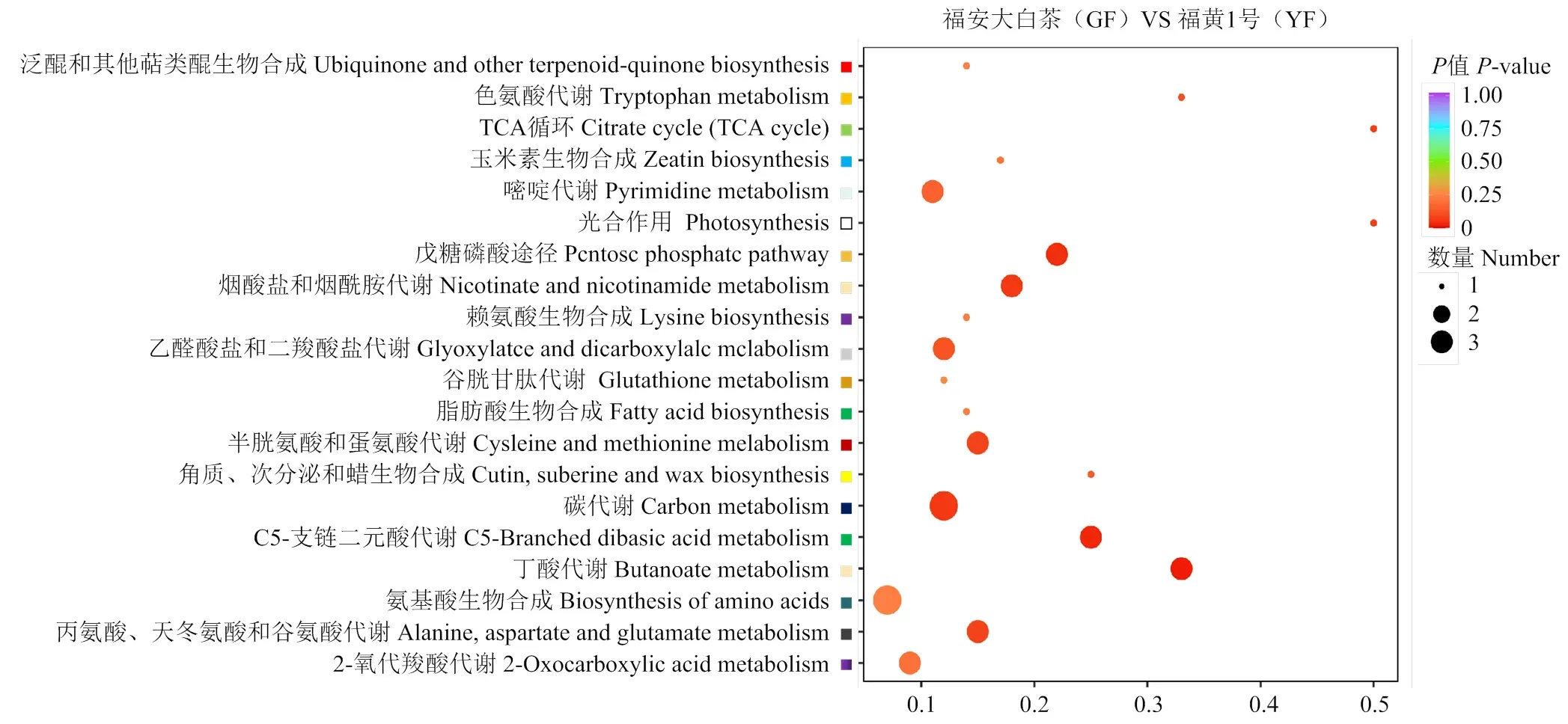
图3 ‘福安大白茶’和‘福黄1号’差异代谢物KEGG富集分析
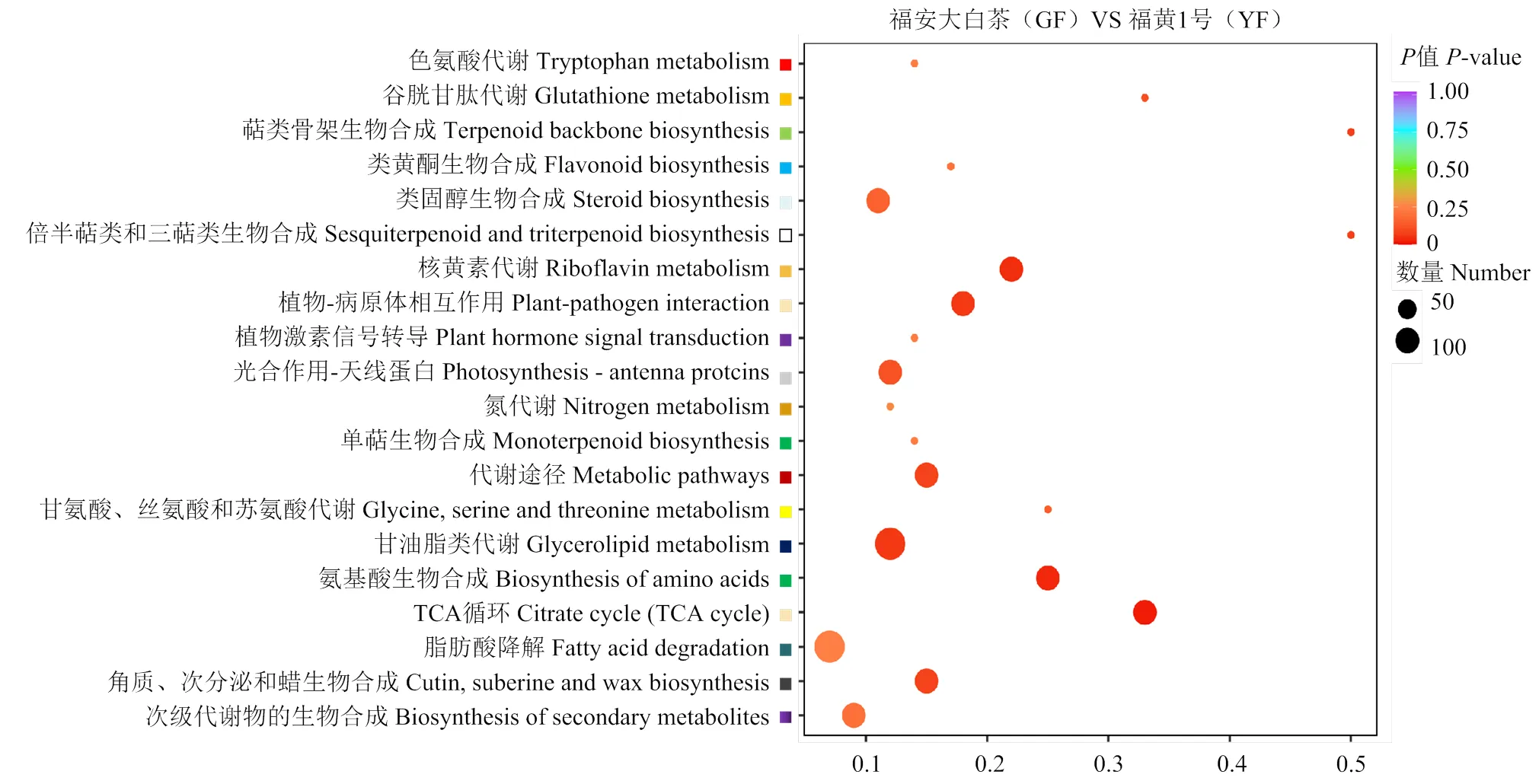
图4 差异表达基因KEGG富集分析
2.3.3 差异表达基因RT-qPCR分析 为了进一步验证转录组数据的准确性,从转录组数据中选取了各通路中较为重要的11个差异表达基因()、()、()、()、()、()、()、()、()、()和()进行RT-qPCR验证。结果表明,挑选的11个差异基因的荧光定量表达水平的变化与转录组基因丰度变化趋势基本一致,进一步验证了转录组测序数据的可靠性(图5)。
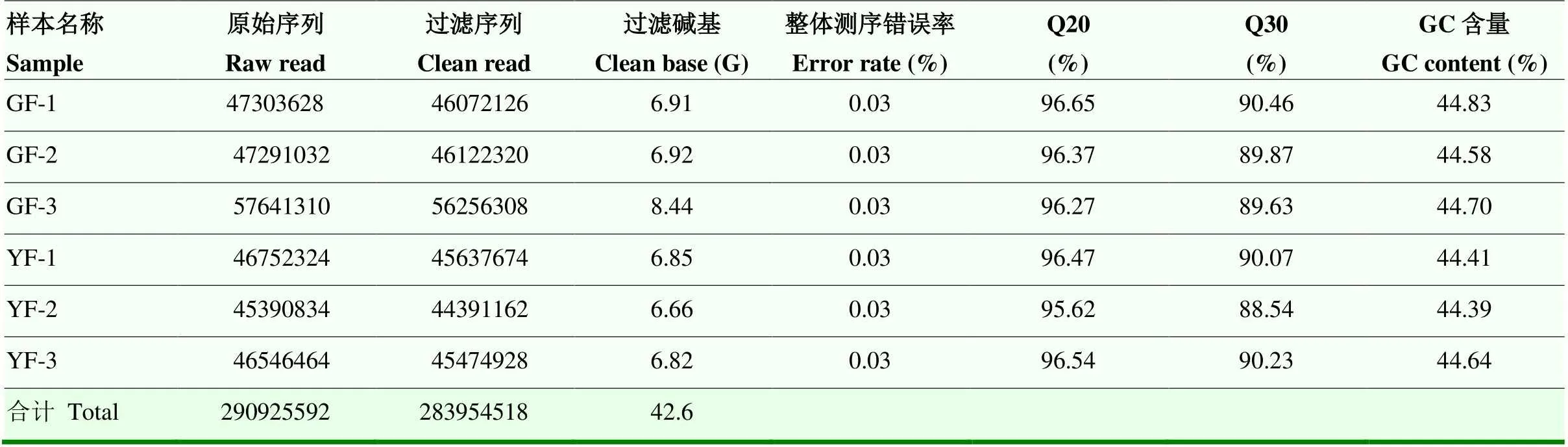
表1 ‘福安大白茶’和‘福黄1号’转录组数据的质量
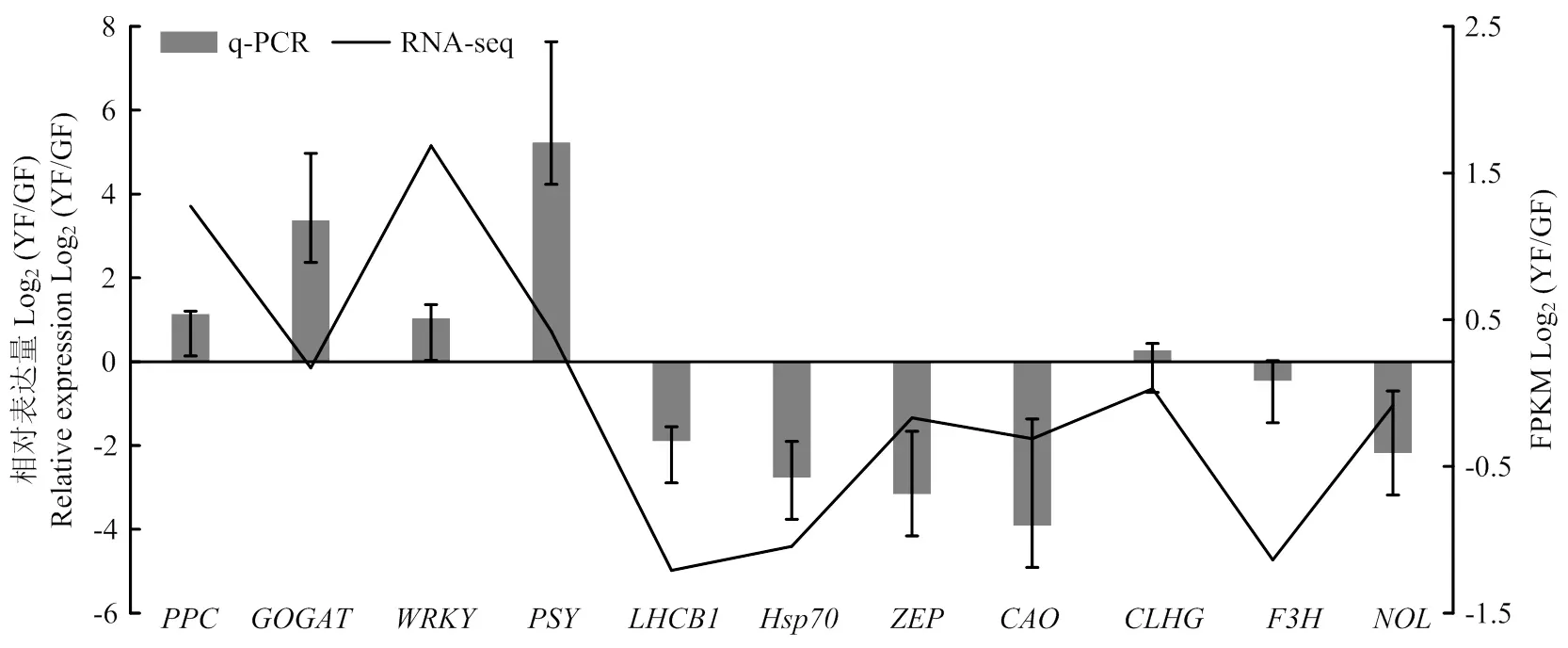
图5 11个差异表达基因的表达水平验证
2.4 色素代谢相关的DEGs和SCMs联合分析
植物叶片着色受许多色素的影响,包括叶绿素、类胡萝卜素和类黄酮。对‘福安大白茶’和‘福黄1号’叶绿素a、b和总叶绿素含量进行测定,结果发现在黄化叶片中叶绿素a、b和总叶绿素含量较绿叶显著下降(图6),叶绿素含量降低与黄化表型相关。在叶绿素合成途径中叶绿素a镁脱氢酶()表达水平显著下调,下调2.46倍(图7-A)。对叶绿素a的合成和降解有重要作用,其表达降低可能会影响叶绿素代谢。对叶绿素合成途径中的其他相关基因转录数据进行鉴定分析,在黄化叶片中未见显著区别于‘福安大白茶’(附表3)。
类胡萝卜素是植物中另一种重要的捕光色素,也可以显著防止光损伤。‘福黄1号’类胡萝卜素总含量低于‘福安大白茶’,并未达到显著水平;而‘福黄1号’中的-胡萝卜素、叶黄素、-胡萝卜素、花药黄质、紫黄质和新黄质的含量显著降低(图6),但玉米黄质的含量显著增加。此外,叶黄素含量在两者中均高于其他类胡萝卜素成分,其次是玉米黄质和-胡萝卜素。类胡萝卜素生物合成途径中(图7-B),黄化种玉米黄质环氧酶()和9-顺式-环氧类胡萝卜素双加氧酶()的表达显著下调,八氢番茄红素合成酶()和紫黄质脱环氧酶()表达上调,这些DEGs不同程度的表达,调节类胡萝卜素含量的变化。是类胡萝卜素合成途径的第一个限速酶基因,其表达上调可能加速‘福黄1号’中类胡萝卜素的代谢。表达下调、上调可能是玉米黄质含量在黄化种中上升的重要原因。
在类黄酮生物合成途径中,其代谢物存在一定区别,与‘福安大白茶’相比,‘福黄1号’中代谢物含量略微下降,包括肉桂酸、查尔酮、二氢山奈素、二氢槲皮素和二氢杨梅素(附表3)。转录数据显示(图7-C),类黄酮生物合成途径相关的DEGs显著下调。类黄酮3-羟化酶(F3H)、类黄酮3′, 5′-羟化酶(F3′5′H)、二氢黄烷醇4-还原酶(DFR)和花青素还原酶(ANS)表达显著下降,F3H和F3′5′H是类黄酮合成途径的关键酶,分别下调2.20和2.61倍。
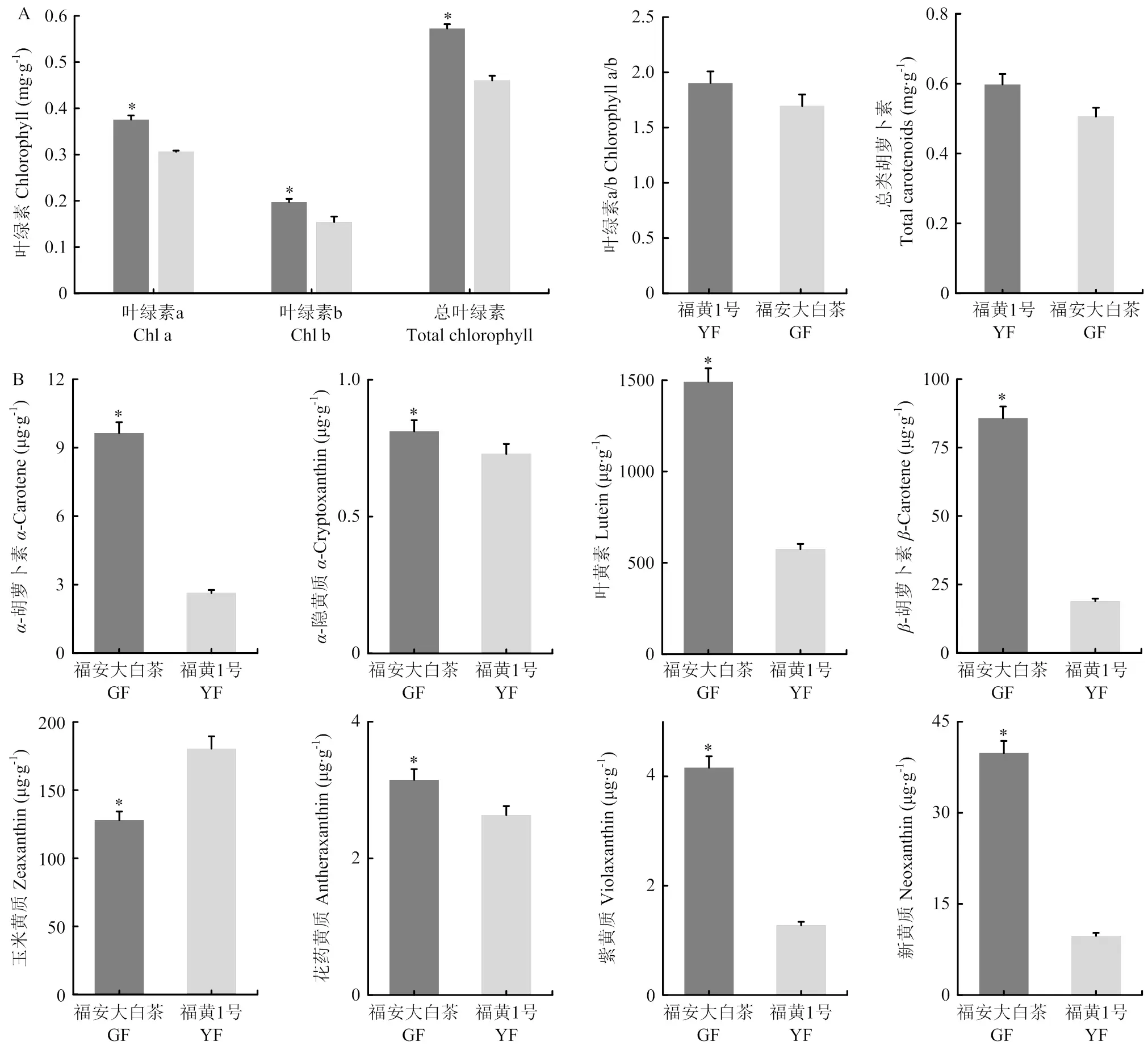
A:叶绿素a、叶绿素b、叶绿素总含量、叶绿素a/b以及类胡萝卜素总含量;B:类胡萝卜素各组分含量。*表示在P<0.05水平上差异显著
2.5 ‘福黄1号’转录组与代谢组联合分析
2.5.1 光合蛋白相关的DEGs基因分析 差异表达基因KEGG功能富集分析显示,DEGs富集到与光合蛋白相关的途径,包括‘光合作用-天线蛋白’途径和‘内质网中的蛋白质加工’途径(图8)。和是植物光合系统中重要的控制酶,‘福黄1号’中、、、均显著下调,这与叶绿体发育不完全密切相关。外部压力和植物体内相关结构产生变化会干扰蛋白质的合成和变性过程,黄化种中内质网中的蛋白质加工途径中相关的多种DEGs发生显著变化,其中,热休克蛋白作为应激水平的指标,在‘福黄1号’中显著下调,包括热休克蛋白(、、)和热休克转录因子()。在黄化品种中,与蛋白加工相关的DEGs变化显著,、、和显著下调,和显著上调,与泛素化相关的蛋白水解酶基因、、显著上调,显著下调,表明黄化种中的蛋白质合成和降解更加剧烈,这可能导致黄化过程中其他物质的积累或降解。
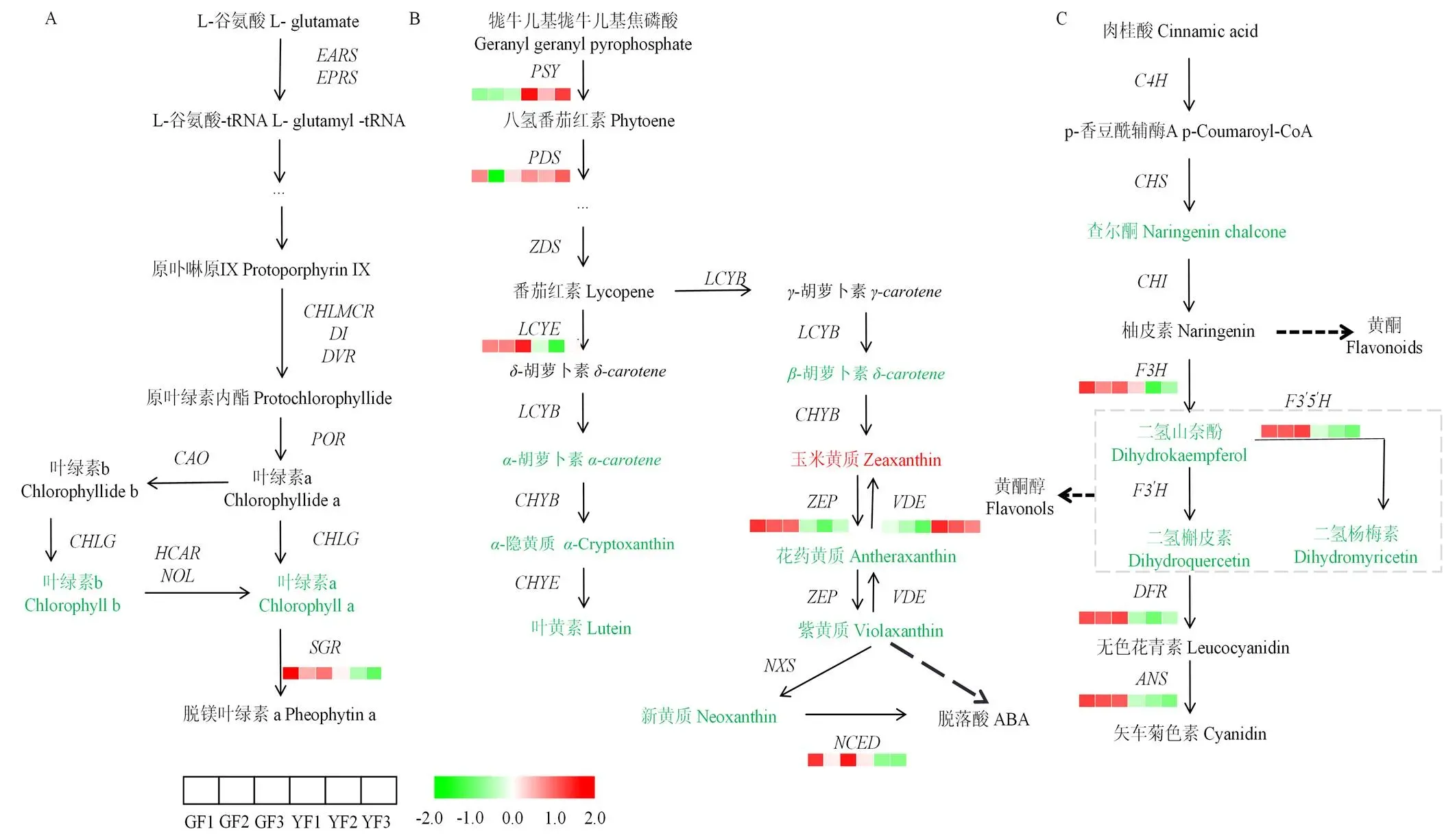
A:叶绿素生物合成通路;B:类胡萝卜素生物合成通路;C:类黄酮生物合成通路。红色代表上调代谢物,绿色代表下调代谢物。热图表示所有与通路相关DEGs的表达水平,由3个重复样本计算得出的平均值进行log2转换生成。CHLG:叶绿素a合酶。NOL:叶绿素b还原酶;HCAR:7-羟甲基叶绿素a还原酶;DVR:二乙烯基叶绿素a 8-乙烯基还原酶;POR:原叶绿素还原酶;EARS:谷氨酰tRNA合成酶;SGR:镁脱氢酶;PSY:八氢番茄红素合成酶;PDS:八氢番茄红素脱氢酶;LCYE:ε-番茄红素环化酶;ZEP:玉米黄质环氧酶;VDE:紫黄质脱环氧酶;NCED:9-顺式-环氧类胡萝卜素双加氧酶;CHS:查耳酮合成酶;CHI:查耳酮异构酶;F3H:类黄酮3β-羟化酶;F3′5′H:类黄酮3′, 5′-羟化酶;DFR:二氢黄烷醇4-还原酶;ANS:花青素还原酶。下同
2.5.2 碳、氮代谢相关的DEGs和SCMs联合分析 对游离氨基酸进行靶向测定,共鉴定到19种游离氨基酸,其中‘福黄1号’茶氨酸、精氨酸、脯氨酸、赖氨酸、天冬氨酸、缬氨酸、异亮氨酸、谷氨酰胺和天冬酰胺均显著高于‘福安大白茶’,茶氨酸含量达到66.90 mg∙g-1,占68.69%,而精氨酸含量达到8.46 mg∙g-1,是‘福安大白茶’的56.4倍(表2)。相反,在黄化叶片中,叶绿素、核酸和其他几种含氮化合物被抑制,氮的利用率降低。关于无机氮同化为氮转运氨基酸,观察到编码铁氧还蛋白-亚硝酸盐还原酶()、二氧化碳可逆作用酶()表达水平较低,但编码谷氨酸合成酶()、谷氨酰胺合成酶()、谷氨酸脱羧酶()表达水平与‘福安大白茶’相比较高(图9)。参与丝氨酸羟甲基转移酶()的表达在‘福黄1号’中受到抑制,而在芳香族氨基酸生物合成途径中,观察到编码醇脱氢酶()在黄化叶片中上调。在‘福黄1号’中、和的表达水平分别是‘福安大白茶’的1.17倍、3.17倍和2.31倍。谷胱甘肽代谢途径中(图9),磷脂酰胆碱二酰基甘油胆碱磷酸转移酶()表达受到抑制,而与编码6-磷酸葡萄糖酸脱氢酶()相关的基因表达上调,且烟酰胺腺嘌呤二核苷酸磷酸()含量也在黄叶中显著上调(附表3)。
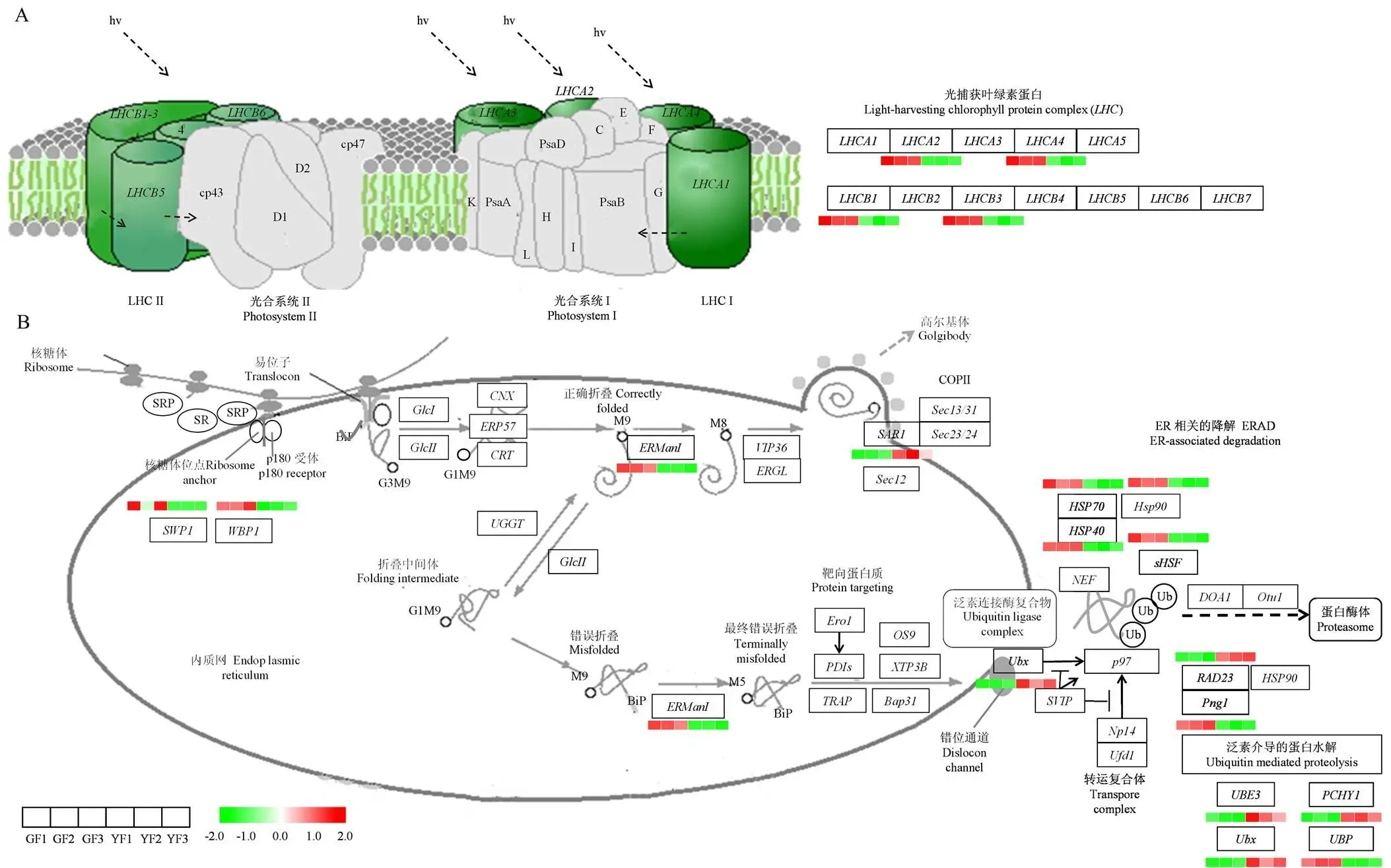
A:光合作用-天线蛋白途径;B:内质网中的蛋白质加工途径。GlcI:甘露糖基寡糖葡糖苷酶;GlcII:甘露糖基寡糖α-1, 3-葡萄糖苷酶;Climp63:细胞骨架相关蛋白4;CNX:钙连接蛋白;ERP57:蛋白质二硫键异构酶A3;CRT:钙网蛋白;UGGT:UDP-葡萄糖∶糖蛋白葡萄糖基转移酶;VIP36:凝集素, 甘露糖结合2;ERGL:凝集素, 甘露糖结合1;Sec:调节元件结合蛋白;Ero1:ERO1 α蛋白;PDIs:蛋白质二硫键异构酶;OS9:OS-9蛋白;XTP3B:蛋白质二硫键异构酶A1;TRAP:转位子相关蛋白亚基α;Bap31:B细胞受体相关蛋白31;NEF:热休克蛋白110;DOA1:磷脂酶A-2激活蛋白;Otu1:泛素硫酯酶;LHCA、LHCB:叶绿素a/b结合蛋白;Hsp20、Hsp40、Hsp70、Hsp90:热休克蛋白;sHSF:热休克转录因子;Png1:肽-N4-(N-乙酰基-β-氨基葡萄糖基)天冬酰胺酰胺酶;ERManI:甘露糖基寡糖α-1, 2-甘露糖苷酶;SAR1:GTP结合蛋白;RAD23:紫外线切除修复蛋白;SWP1、WBP1:寡聚糖基转移酶;Ubx、APC3、PCHY1:泛素化介导的蛋白水解酶;UBE3:RING型E3泛素化转移酶;UBP:泛素化特异性蛋白酶
叶绿体和膜结构的异常发育抑制了光合作用,从而损害了糖代谢和碳同化作用。SCMs和DEGs联合分析发现,在‘福黄1号’中,糖酵解途径中相关DEGs表达显著下调,包括葡萄糖-6-磷酸异构酶()、果糖二磷酸醛缩酶()、2, 3-二磷酸甘油酸依赖性磷酸甘油酸变位酶()。基于广泛靶向代谢组数据,发现与‘福安大白茶’相比,‘福黄1号’中大多数碳水化合物及其结合物的含量较低,如D-果糖(D-Fructose)、D-葡萄糖*(D-Glucose*)、D-半乳糖*(D-Galactose*)、麦芽糖(Maltotriose)、木糖醇(Xylitol)、蔗糖-6-磷酸(Sucrose-6-phosphate)。相比之下,在‘福黄1号’中D-木糖(D-Xylose)、D-蔗糖*(D-Sucrose*)的含量都明显增加(附表3)。关于TCA循环(图9),黄化叶片中的酮戊二酸和柠檬酸含量增加,但苹果酸含量减少。磷酸烯醇式丙酮酸羧激酶()、三磷酸腺苷柠檬酸合酶()表达量显著上调,而琥珀酸脱氢酶()表达量显著下调。
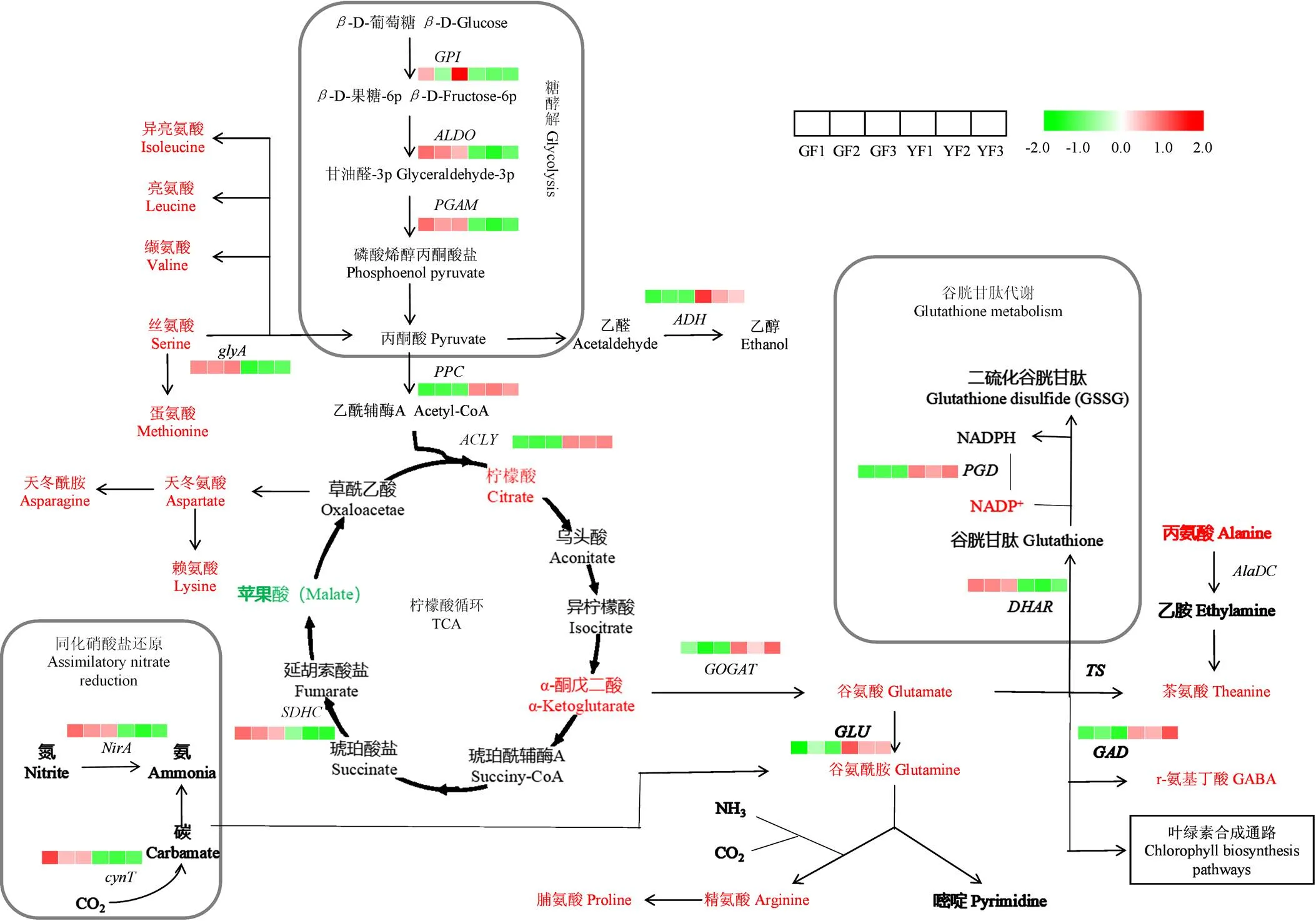
糖酵解途径、三羧酸循环途径、同化硝酸盐还原途径、谷胱甘肽代谢途径及氨基酸合成途径。GPI:葡萄糖-6-磷酸异构酶;ALDO:果糖二磷酸醛缩酶;PGAM:2,3-二磷酸甘油酸依赖性磷酸甘油酸变位酶;PPC:磷酸烯醇式丙酮酸羧激酶;ACLY:三磷酸腺苷柠檬酸合酶;ADH:醇脱氢酶;SDHC:琥珀酸脱氢酶;glyA:丝氨酸羟甲基转移酶;GOGAT:谷氨酸合成酶;GLU:谷氨酰胺合成酶;GAD:谷氨酸脱羧酶;DHAR:磷脂酰胆碱二酰基甘油胆碱磷酸转移酶;PGD:6-磷酸葡萄糖酸脱氢酶;NirA:铁氧还蛋白-亚硝酸盐还原酶;cynT:二氧化碳可逆作用酶
3 讨论
3.1 ‘福黄1号’的叶色变异
植物叶片颜色由其所含色素共同作用决定,叶绿素a和叶绿素b代谢异常产生的黄化、浅绿等表型居多,而类胡萝卜素代谢异常,通常会产生白化致死表型[23]。在‘福黄1号’中,发现叶绿素a和叶绿素b的含量显著低于‘福安大白茶’,叶绿素a/b通常与光合能力有关[24],也呈现下降。叶绿素合成途径中,‘福黄1号’中镁脱氢酶基因()表达量显著降低,该基因是叶绿素a和叶绿素b合成相关的重要酶,在茶树‘黄金水仙’发现表达量下调会影响叶绿素的合成,而叶绿素生物合成相关基因和也可能在‘华白1号’的颜色变化中起一定作用[10,16]。在茶树黄化品种中,叶片叶绿体结构遭到破坏,叶绿素a/b下降和叶绿素含量降低,相关基因表达下调,黄化叶片中光吸收和转换光能效率降低,最终影响叶片着色。类胡萝卜素合成通路中,和表达显著上调,是类胡萝卜素合成通路的第一个限速酶,对类胡萝卜素的合成具有调控作用。催化玉米黄质裂解而调控玉米黄质积累[25];在‘福黄1号’中,这些差异基因不同程度的上调与下降有助于类胡萝卜素组分的改变。尤其是玉米黄质的显著增加,玉米黄质具有氧化作用,保护类囊体膜免受光抑制和光破坏,推测黄化品种茶树的叶片中玉米黄质含量的升高是植物在过剩光和低温下为了维持正常的光合能力和效率而做出的调整,也可能是茶树黄化产生的原因之一[14,26]。有研究发现类黄酮合成基因在黄化叶片中表达量下降[27]。在‘福黄1号’类黄酮合成途径中,SCMs与DEGs均下调,和是类黄酮合成途径的关键酶,这表明‘福黄1号’黄叶表型产生由不同的分子机制决定。
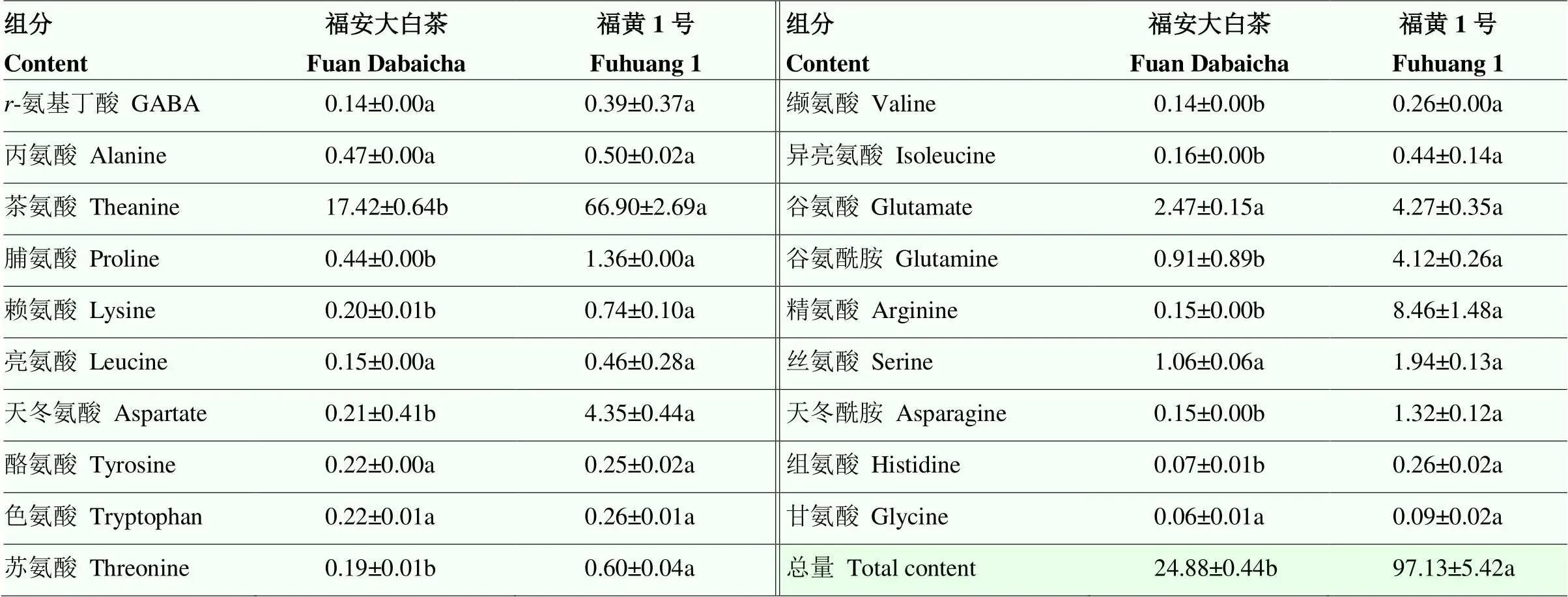
表2 ‘福安大白茶’和‘福黄1号’游离氨基酸含量
不同小写字母表示差异显著(<0.05) a, b: Indicate significant difference (<0.05)
前人研究发现,大多数叶色突变体在类囊体膜的结构上会发生变化,如在银杏叶中,黄叶的类囊体膜被转化成许多异常的囊泡[28]。在‘福安大白茶’和‘福黄1号’的研究中,发现突变体的叶绿体结构与正常绿叶的叶绿体结构有显著差异,叶绿体类囊体呈丝状,基粒片层排列疏松散乱,片层间缝隙大,存在许多异常的囊泡。因此,突变体叶片颜色的变化可能反映了突变体叶片中质体发育和功能的异常。植物光合系统与叶绿体密切相关,‘福黄1号’叶绿体的发育不完全,使得与光合作用相关的差异基因显著下调,是植物光合系统中重要的光捕获叶绿素a/b结合蛋白,与‘福安大白茶’相比,其黄叶中、、、均显著下调,表明光合作用活性下降。而外界压力会干扰蛋白质的合成和变性过程,热休克蛋白(HSPs)可以作为保护性蛋白质来维持植物体内的细胞稳态[29]。在许多植物中已经观察到通过介导叶绿体发育而参与叶片的着色。拟南芥中HSP100家族成员的失活通过影响叶绿体功能而导致叶片变黄和生长迟缓[30]。抑制两个的转基因拟南芥表现为白色且发育不良,并且叶绿体类囊体膜很少或完全没有[31]。在‘黄叶肉桂’中也发现这种特定的转录模式[3]。这暗示在‘福黄1号’中,和表达受到抑制进而影响叶绿体的生物合成来调节叶片着色。
3.2 ‘福黄1号’高茶氨酸代谢
前人研究发现,植物在应对生物或非生物胁迫反应中,通过降解异常、错误折叠或受损的蛋白质,以避免这些冗余蛋白造成的损害。蛋白质降解是一种非常重要的翻译后修饰,而泛素(Ub)-蛋白酶系统(UPS)是真核细胞中主要的蛋白降解途径[32]。在‘安吉白茶’中共鉴定到9个显著上调的泛素化相关蛋白,低温耐受性的蛋白质泛素化可能是‘安吉白茶’白化期蛋白质减少和氨基酸积累的关键原因[33]。本研究中,‘福黄1号’中与泛素化相关的DEGs共4个,包括泛素化介导的蛋白水解酶(、)和RING型E3泛素化转移酶()表达显著上调,泛素化特异性蛋白酶()表达显著下调,这表明在黄化种中处理变性蛋白的需求增加,黄化叶片中蛋白质的降解更加剧烈,这可能与导致黄化过程中氨基酸的积累相关,在‘黄金菊’中也有类似的发现[5]。
在茶树黄化突变体中,氮代谢的激活和氨基酸的积累通常归因于广泛的蛋白质降解和低氮消耗[34]。在目前的研究中,观察到‘福黄1号’中叶绿素、核酸和其他几种含氮化合物被抑制,氮的利用率降低,蛋白质加工和氨基酸代谢相关的转录水平增加,这种现象可能是由膜结构受损和大分子分解引起的[27],从而增加了黄化叶中的氨基酸含量。事实上,通过转录和非靶向测定,发现‘福黄1号’中游离氨基酸含量显著高于‘福安大白茶’,包括茶氨酸、谷氨酰胺、精氨酸等,尤其是茶氨酸(表2),且在‘福黄1号’中调节谷氨酸和谷氨酰胺合成的、的表达水平分别是‘福安大白茶’的1.17倍、3.17倍。谷氨酸一直被用作含氮化合物生物合成的氮源[35]。叶绿素和其他含氮分子生物合成的减少导致谷氨酸的前体代谢物的消耗减少,从而推动谷氨酸的积累。随着氮资源的积累,以及黄化叶片中碳骨架的缺乏,氨基和氮资源被更有效地储存,这可能促使谷氨酰胺、茶氨酸和精氨酸成为黄化叶片中显著积累的含氮化合物[27]。此外,L-茶氨酸只能在根系中生物合成,可能由于从根系中的连续运输和在黄化叶中消耗的减少而积累。在茶叶中,谷氨酸作为茶氨酸生物合成的前体,谷氨酸向茶氨酸的转化经常发生,高谷氨酸水平加速茶氨酸的生物合成[36]。在‘福黄1号’中,碳水化合物减少,糖代谢减少,类黄酮含量减少以及氨基酸含量显著积累,这表明与碳代谢相关的途径都被抑制,进一步破坏了黄化突变种中碳氮之间的平衡,前人在拟南芥变异种中也有类似发现,光合速率和碳代谢降低,而氮代谢增强[34]。转录和代谢联合分析结果显示,黄化叶片参与糖酵解相关的DEGs表达显著下调(、、),大多数碳水化合物及其结合物的含量较低,如果糖、葡萄糖,叶片处于缺碳状态,没有足够的碳骨架促进生物合成氨基酸。有趣的是,黄化叶中柠檬酸、酮戊二酸含量显著增加但苹果酸含量减少。磷酸烯醇式丙酮酸羧激酶()、三磷酸腺苷柠檬酸合酶()表达量在‘福黄1号’中显著上调,而琥珀酸脱氢酶()表达量显著下调,这暗示了即使碳架的有效性降低,TCA循环却被激活。这一结果可能是氮积累和碳供应短缺的共同作用,该结果与以往研究相似[5,17,27]。
4 结论
‘福黄1号’叶绿素a/b值下降、叶绿素含量降低、叶绿体结构受到破坏,叶绿素合成以及光捕获相关的基因表达下调,这可能是叶色呈现黄色的重要原因。此外,在黄化叶片中,泛素化相关的蛋白质水解酶表达上调,蛋白降解能力加强,叶绿素和其他含氮分子生物合成的减少,以及碳骨架的缺乏,氨基和氮资源被更有效地储存,使得与氨基酸合成相关的氮代谢激活,与茶氨酸合成有关的前体物质之一的谷氨酸积累,这可能促使茶氨酸在‘福黄1号’中显著积累。高茶氨酸茶树资源具有重要的应用价值,具有高茶氨酸的‘福黄1号’可排除遗传背景、生长条件等部分因素的影响,是较优的叶色变异和高茶氨酸茶树新品系选育材料。
致谢:本研究得到福建省蕉城区茶产业发展中心连光付、吴洪新、冯昌强,福建省蕉城区茶业协会郑康麟、宋岸伟、吴妙金的大力帮助,特此致谢。
[1] WANG P J, YU J X, JIN S, CHEN S, YUE C, WANG W L, GAO S L, CAO H L, ZHENG Y C, GU M Y, CHEN X J, SUN Y, GUO Y Q, YANG J F, ZHANG X T, YE N X. Genetic basis of high aroma and stress tolerance in the Oolong tea cultivar genome. Horticulture Research, 2021, 8(1): 107. doi: 10.1038/s41438-021-00542-x.
[2] PANG D D, LIU Y F, SUN Y N, TIAN Y P, CHEN L B. Menghai Huangye, a novel albino tea germplasm with high theanine content and a high catechin index. Plant Science, 2021, 311(prepublish): 110997. doi: 10.1016/J.PLANTSCI.2021.110997.
[3] WANG P J, ZHENG Y C, GUO Y C, LIU B S, JIN S, LIU S Z, ZHAO F, CHEN X J, SUN Y, YANG J F, YE N X. Widely targeted metabolomic and transcriptomic analyses of a novel albino tea mutant of ‘Rougui’. Forests, 2020, 11(2): 229. doi: 10.3390/f11020229.
[4] FENG L, GAO M J, HOU R Y, HU X Y, ZHANG L, WAN X C, WEI S. Determination of quality constituents in the young leaves of albino tea cultivars. Food Chemistry, 2014, 155: 98-104. doi:10.1016/j. foodchem.2014.01.044.
[5] JIANG X F, ZHAO H, GUO F, SHI X P, YE C, YANG P X, LIU B Y, NI D J. Transcriptomic analysis reveals mechanism of light-sensitive albinism in tea plant‘Huangjinju’. BMC Plant Biology, 2020, 20(1): 216. doi: 10.1186/s12870-020-02425-0.
[6] LI Q, HUANG J N, LIU S Q, LI J, YANG X H, LIU Y S, LIU Z H. Proteomic analysis of young leaves at three developmental stages in an albino tea cultivar. Proteome Science, 2011, 9(1): 44. doi: 10.1186/ 1477-5956-9-44.
[7] LI N N, YANG Y P, YE J H, LU J L, ZHENG X Q, LIANG Y R. Effects of sunlight on gene expression and chemical composition of light-sensitive albino tea plant. Plant Growth Regulation, 2016, 78(2): 253-262. doi: 10.1007/s10725-015-0090-6.
[8] SONG L B, MA Q P, ZOU Z W, SUN K, YAO Y T, TAO J H, KALERI N A, LI X H. Molecular link between leaf coloration and gene expression of flavonoid and carotenoid biosynthesis incultivar ‘Huangjinya’. Frontiers in Plant Science, 2017, 8: 803. doi: 10.3389/fpls.2017.00803.
[9] LI C F, YAO M Z, MA C L, MA J Q, JIN J Q, CHEN L. Differential metabolic profiles during the albescent stages of ‘Anji baicha’ (). PLoS ONE, 2017, 10(10): e0139996. doi: 10.1371/journal.pone.0139996.
[10] MA Q P, LI H, ZOU Z W, ARKORFUL E, LV Q R, ZHOU Q Q, CHEN X, SUN K, LI X H. Transcriptomic analyses identify albino-associated genes of a novel albino tea germplasm ‘Huabai 1’. Horticulture Research, 2018, 5: 54. doi: 10.1038/s41438-018-0053-y.
[11] 疏再发, 王琳琳, 娄艳华, 吉庆勇, 邵静娜, 刘瑜, 何卫中. 白化茶树L-茶氨酸累积机理的研究进展. 食品研究与开发, 2020, 41(17): 217-224. doi: 10.12161/j.issn.1005-6521.2020.17.035.
SHU Z F, WANG L L, LOU Y H, JI Q Y, SHAO J N, LIU Y, HE W Z. Research progress on accumulation mechanism of L-theanine in albino tea plant. Food Research and Development, 2020, 41(17): 217-224. doi: 10.12161/j.issn.1005-6521.2020.17.035. (in Chinese)
[12] 方开星, 姜晓辉, 吴华玲. 茶树茶氨酸的代谢及其育种研究进展. 园艺学报, 2016, 43(9): 1791-1802. doi: 10.16420/j.issn.0513-353x. 2016-0162.
FANG K X, JIANG X H, WU H L. Research progress on theanine metabolism and its content breeding in tea. Acta Horticulturae Sinica, 2016, 43(9): 1791-1802. doi: 10.16420/j.issn.0513-353x.2016-0162. (in Chinese)
[13] HAO X Y, ZHANG W F, LIU Y, ZHANG H J, REN H Z, CHEN Y, WANG L, ZENG J M, YANG Y J, WANG X C. Pale green mutant analyses reveal the importance of CsGLKs in chloroplast developmental regulation and their effects on flavonoid biosynthesis in tea plant. Plant Physiology and Biochemistry, 2020, 146(C): 392-402. doi: 10.1016/j.plaphy.2019.11.036.
[14] 林馨颖, 王鹏杰, 刘仕章, 郑玉成, 刘宝顺, 陈雪津, 叶乃兴. 茶树黄化种: 黄叶肉桂的类胡萝卜素组分分析. 茶叶学报, 2020, 61(3): 120-126. doi: 10.3969/j.issn.1007-4872.2020.03.004.
LIN X Y, WANG P J, LIU S Z, ZHENG Y C, LIU B S, CHEN X J, YE N X. Carotenoids in Huangye Rougui tea plant. Tea Science and Technology, 2020, 61(3): 120-126. doi: 10.3969/j.issn.1007-4872. 2020.03.004. (in Chinese)
[15] 陈思肜, 赵峰, 王淑燕, 金珊, 周鹏, 危赛明, 叶乃兴. 基于AQC衍生和液质联用的茶叶游离氨基酸分析. 南方农业学报, 2019, 50(10): 2278-2285. doi: 10.3969/j.issn.2095-1191.2019.10.18.
CHEN S R, ZHAO F, WANG S Y, JIN S, ZHOU P, WEI S M, YE N X. Analysis of free amino acids in tea based on AQC derivation with liquid chromatography-mass spectrometry. Journal of Southern Agriculture, 2019, 50(10): 2278-2285. doi: 10.3969/j.issn.2095-1191. 2019.10.18. (in Chinese)
[16] ZHENG Y C, WANG P J, CHEN X J, YUE C, GUO Y C, YANG J F, SUN Y, YE N X. Integrated transcriptomics and metabolomics provide novel insight into changes in specialized metabolites in an albino tea cultivar ((L.) O. Kuntz). Plant Physiology and Biochemistry, 2021, 160: 27-36. doi: 10.1016/j.plaphy.2020.12. 029.
[17] LIN X Y, CHEN X J, WANG P J, ZHENG Y C, GUO Y C, HONG Y P, YANG R X, YE N X. Metabolite profiling in albino tea mutant‘Fuyun 6’ using LC-ESI-MS/MS. Trees, 2022, 36(1): 261-272. doi: 10.1007/s00468-021-02203-x.
[18] ZHENG Y C, WANG P J, CHEN X J, SUN Y, YUE C, YE N X. Transcriptome and metabolite profiling reveal novel insights into volatile heterosis in the tea plant (). Molecules, 2019, 24(18): 3380. doi: 10.3390/molecules24183380.
[19] LOVE M I, WOLFGANG H, SIMON A. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology, 2014, 15(12): 550. doi: 10.1186/s13059-014-0550-8.
[20] YU G C, WANG L G, HAN Y Y, HE Q Y. clusterProfiler: An R package for comparing biological themes among gene clusters. Omics: a Journal of Integrative Biology, 2012, 16(5): 284-287. doi: 10.1089/ omi.2011.0118.
[21] 林馨颖, 王鹏杰, 陈雪津, 郭永春, 谷梦雅, 郑玉成, 叶乃兴. 茶树LOX基因家族的鉴定及其在白茶萎凋过程的表达分析. 茶叶科学, 2021, 41(4): 482-496. doi: 10.13305/j.cnki.jts.2021.04.004.
LIN X Y, WANG P J, CHEN X J, GUO Y C, GU M Y, ZHENG Y C, YE N X. Identification of LOX gene family inand expression analysis in the process of white tea withering. Journal of Tea Science, 2021, 41(4): 482-496. doi: 10.13305/j.cnki.jts.2021.04. 004. (in Chinese)
[22] 谷梦雅, 王鹏杰, 金珊, 陈思肜, 郑知临, 赵峰, 叶乃兴. 基于转录组分析不同强度红光对茶树苯丙烷类代谢的影响. 应用与环境生物学报, 2020, 27(6): 1636-1644. doi: 10.19675/j.cnki.1006-687x. 2020.06047.
GU M Y, WANG P J, JIN S, CHEN S R, ZHENG Z L, ZHAO F, YE N X. Effects of different red LED light intensities on phenylpropanoid metabolism of tea plants based on transcriptomics. Chinese Journal of Applied and Environmental Biology, 2020, 27(6): 1636-1644. doi: 10.19675/j.cnki.1006-687x. 2020.06047. (in Chinese)
[23] 郭效琼, 罗迪, 朱骞, 李伟, 陈丽娟, 李东宣. 水稻白化突变体遗传机理与发掘利用研究进展. 分子植物育种, 2021: 1-19.
GUO X Q, LUO D, ZHU Q, LI W, CHEN L J, LI D X. Research progresses on genetic mechanism and uilization of rice albino mutants. Molecular Plant Breeding, 2021: 1-19. (in Chinese)
[24] NOVER L, SCHARF K D. Heat stress proteins and transcription factors. Cellular and Molecular Life Sciences CMLS, 1997, 53(1): 80-103. doi: 10.1007/PL00000583.
[25] 张向娜, 熊立瑰, 温贝贝, 王坤波, 刘仲华, 黄建安, 李娟. 茶树叶色变异研究进展. 植物生理学报, 2020, 56(4): 643-653. doi: 10.13592/j.cnki.ppj.2019.0378.
ZHANG X N, XIONG L G, WEN B B, WANG K B, LIU Z H, HUANG J N, LI J. Advances in leaf color variation of tea plant (). Plant Physiology Journal, 2020, 56(4): 643-653. doi: 10.13592/j.cnki.ppj.2019.0378. (in Chinese)
[26] LI C F, MA J Q, HUANG D J, MA C L, JIN J Q, YAO M Z, CHEN L. Comprehensive dissection of metabolic changes in albino and green tea cultivars. Journal of Agricultural and Food Chemistry, 2018, 66(8): 2040-2048. doi: 10.1021/acs.jafc.7b05623.
[27] WU Z M, ZHANG X, WANG J L, WAN J M. Leaf chloroplast ultrastructure and photosynthetic properties of a chlorophyll-deficient mutant of rice. Photosynthetica, 2014, 52(2): 217-222. doi: 10.1007/ s11099-014-0025-x.
[28] LI W X, YANG S B, LU Z G, HE Z C, YE Y L, ZHAO B B, WANG L, JIN B. Cytological, physiological, and transcriptomic analyses of golden leaf coloration inL. Horticulture Research, 2018, 5(1): 12. doi: 10.1038/s41438-018-0015-4.
[29] PINCUS D. Regulation ofand the heat shock response. Advances in Experimental Medicine and Biology, 2020, 1243: 41-50. doi: 10.1007/978-3-030-40204-4_3.
[30] TOONG L J, YI J S, MIN T W, JIH M S. Comparisons of flavonoids and anti-oxidative activities in seed coat, embryonic axis and cotyledon of black soybeans. Elsevier, 2010, 123(4): 1112-1114. doi: 10.1016/j. foodchem.2010.05.070.
[31] IKARASHI N, TODA T, HATAKEYAMA Y, KUSUNOKI Y, KON R, MIZUKAMI N, KANEKO M, OGAWA S, SUGIYAMA K. Anti-hypertensive effects ofpolyphenol in spontaneously hypertensive rats. International Journal of Molecular Sciences, 2018, 19(3): 700. doi: 10.3390/ijms19030700.
[32] GLICKMAN M H, AARON C. The ubiquitin-proteasome proteolytic pathway: Destruction for the sake of construction. Physiological Reviews, 2002, 82(2): 373-428. doi: 10.1152/physrev.00027.2001.
[33] YUAN L, XIONG L G, DENG T T, WU Y, LI J, LIU S Q, HUANG J A, LIU Z H. Comparative profiling of gene expression inL. cultivar AnJiBaiCha leaves during periodic albinism. Gene, 2015, 561(1): 23-29. doi: 10.1016/j.gene.2015.01.007.
[34] SATOU M, ENOKI H, OIKAWA A, OHTA D, SAITO K, HACHIYA T, SAKAKIBARA H, KUSANO M, FUKUSHIMA A, SAITO K, KOBAYASHI M, NAGATA N, MYOUGA F, SHINOZAKI K, MOTOHASHI R. Integrated analysis of transcriptome and metabolome ofalbino or pale green mutants with disrupted nuclear-encoded chloroplast proteins. Plant Molecular Biology, 2014, 85(4/5): 411-428. doi: 10.1007/s11103-014-0194-9.
[35] SAHINER N, SUNER S S, SAHINER M, SILAN C. Nitrogen and sulfur doped carbon dots from amino acids for potential biomedical applications. Journal of Fluorescence, 2019, 29(5): 1191-1200. doi: 10.1007/s10895-019-02431-y.
[36] RUAN J, HAERDTER, GERENDAS J. Impact of nitrogen supply on carbon/nitrogen allocation: a case study on amino acids and catechins in green tea[(L.) O. Kuntze] plants. Plant Biology, 2010, 12(5): 724-734. doi: 10.1111/j.1438-8677.2009.00288.x.
The Albino Mechanism of a New High Theanine Tea Cultivar Fuhuang 1
LIN XinYing1, WANG PengJie1, YANG RuXing2, ZHENG YuCheng1, CHEN XiaoMin1, ZHANG Lei2, SHAO ShuXian1, YE NaiXing
1College of Horticulture, Fujian Agriculture and Forestry University/Key Laboratory of Tea Science at Universities in Fujian, Fuzhou 350002;2Tea Research Institute, Fujian Academy of Agricultural Sciences, Fuzhou 350013
【】 The aim of this study was to analyze metabolic and transcriptional mechanism of etiolated variation in tea plant, and to explore the albino mutation of a new homotheanine tea cultivar Fuhuang 1 and its formation mechanism of homotheanine. 【】 The experimental materials were Fuan Dabaicha and Fuhuang 1. The combined analysis of ultramicroelectron microscopy, widely targeted metabolism, targeted metabolomics and transcriptomics was used to clarify the pigments, metabolism and transcriptome data related to the albino tea.【】The results of ultrastructure showed that the chloroplast thylakoids of Fuhuang 1 was filamentous, with irregular arrangement of basal granule lamellae and many abnormal vesicles. Chlorophyll a and chlorophyll b content, chlorophyll a/b ratio,gene expression and light-harvesting chlorophyll a/b protein (LHC) expression were significantly reduced in yellow leaves. Although the total content of carotenoids did not change significantly, the content of each component changed significantly. Zeaxanthin was the only component with significant increase, and the expression of its regulatory genewas significantly up-regulated, and the content of other components decreased. Compared with Fuan Dabaicha, 680 differentially expressed genes (DEGs) and 57 significantly changed metabolites (SCMs) were identified in Fuhuang 1. KEGG enrichment analysis showed that SCMs and DEGs were significantly enriched in pathways related to amino acid biosynthesis, glutathione metabolism and TCA cycle. In addition, the pathways related to carbon and nitrogen metabolism were also activated. A total of 19 free amino acids were identified by targeted determination. The free amino acid content of Fuhuang 1 was 97.13 mg∙g-1, which was significantly higher than that of Fuan Dabaicha. Theanine content was 66.90 mg∙g-1, accounting for 68.89% of amino acids, while the content of arginine was 8.46 mg∙g-1, which was 56.4 times as more as that of Fuan Dabaicha. The expression levels ofand, which regulated amino acid synthesis, were up-regulated in Fuhuang 1 by 1.17 and 3.17 times higher than that in Fuan Dabaicha. 【】The leaf color of Fuhuang 1 was mainly influenced by chlorophyll, carotenoids and flavonoids. The combined action ofand the fourmight also affect chloroplast biogenesis to regulate leaf color. The content of theanine in Fuhuang 1 was significantly higher than that in Fuan Dabaicha. The main reason was that the up-regulation of ubiquitination-related protein hydrolase activity and the enhanced protein degradation ability. The biosynthesis of chlorophyll and other nitrogen-containing molecules was reduced, the carbon skeleton in yellow leaves was lacking, amino and nitrogen resources were stored more effectively. The activation of nitrogen metabolism associated with amino acid synthesis led to the accumulation of glutamate, one of the precursors of theanine synthesis. Theanine accumulated significantly in yellow leaves.
teaplant; Fuhuang 1(); albino; metabolomics; transcriptomics; omics technology

10.3864/j.issn.0578-1752.2022.09.012
2021-09-02;
2021-11-01
福建省“2011协同创新中心”中国乌龙茶产业协同创新中心专项(闽教科〔2015〕75号)、福建省属公益类科研院所基本科研专项(2021R1029001)、茶学福建省高校重点实验室开放项目(KLTS2018001)、福建张天福茶叶发展基金会科技创新基金(FJZTF01)
林馨颖,E-mail:12565769@qq.com。通信作者叶乃兴,E-mail:ynxtea@126.com。通信作者杨如兴,E-mail:649745878@qq.com
(责任编辑 赵伶俐)
