抗心律失常药品说明书中孕妇及哺乳期妇女用药信息标注情况统计分析
2022-05-17李云娇黄汉辉严鹏科
李云娇 黄汉辉 严鹏科


中圖分类号 R972+.2 文献标志码 A 文章编号 1001-0408(2022)09-1126-06
DOI 10.6039/j.issn.1001-0408.2022.09.17
摘 要 目的 为规范抗心律失常药品说明书中孕妇及哺乳期妇女用药信息标注提供参考。方法 收集医脉通科技有限公司官方网站“用药参考”项下收录的所有抗心律失常药品说明书,参照国家食品药品监督管理局发布的《化学药品和治疗用生物制品说明书规范细则》的规定,对孕妇及哺乳期妇女用药信息标注情况进行整理、统计、分析。结果 本研究共收集到的111份抗心律失常药品说明书中,102份药品说明书有“孕妇用药”项标注(占91.89%),其中有用药指导意见、无用药指导意见的比例分别为75.68%、16.22%;88份药品说明书有“哺乳期妇女用药”项标注(占79.28%),其中有用药指导意见、无用药指导意见的比例分别为70.27%、9.01%。不同分类抗心律失常药中,“孕妇用药”项标注情况最佳为Ⅰ类抗心律失常药(占100%),而Ⅲ类标注(占25.00%)缺失最多;“哺乳期妇女用药”项标注情况最佳为Ⅳ类抗心律失常药(占94.44%),而Ⅰ类标注(占26.47%)缺失最多。部分同品种不同生产厂家药品说明书的“孕妇用药”及“哺乳期妇女用药”项标注内容存在差异。99份国内药企药品说明书中,92份(92.93%)单独列出“孕妇用药”及“哺乳期妇女用药”项,有用药指导意见的比例分别为74.75%、69.70%;12份国外药企药品说明书中,10份(83.33%)单独列出“孕妇用药”及“哺乳期妇女用药”项,有用药指导意见的比例分别为83.33%、75.00%。结论 国内抗心律失常药品说明书标注内容存在“孕妇用药”及“哺乳期妇女用药”相关信息缺失、指导意见表述混乱、同品种不同生产厂家药品说明书标注内容不一致、修改更新滞后、说明书规范性欠佳等问题,应引起药品监督管理部门、药品生产企业的重视,并不断加强对说明书的管理和规范。
关键词 孕妇;哺乳期妇女;抗心律失常药;药品说明书;特殊人群用药
Statistical analysis of medication information labeling of pregnant women and lactating women in the instructions of antiarrhythmic drugs
LI Yunjiao1,2,HUANG Hanhui1,2,YAN Pengke1,2(1. Dept. of Pharmacy, the Third Affiliated Hospital of Guangzhou Medical University, Guangzhou 510150, China; 2. Key Laboratory for Major Obstetric Diseases of Guangdong Province, Guangzhou 510150, China)
ABSTRACT OBJECTIVE To provide reference for standardizing the labeling of medication information for pregnant women and lactating women in the instructions of antiarrhythmic drugs. METHODS The instructions of antiarrhythmic drugs were collected from the terms of “medication reference” on official website of Yimaitong Technology Co., Ltd. The labeling of medication information of pregnant women and lactating women were sorted out, counted and analyzed with reference to the Detailed Rules for Specifications of Instructions of Chemical Drugs and Therapeutic Biological Products issued by the State Food and Drug Administration. RESULTS A total of 111 instructions of antiarrhythmic drugs were collected in this study, of which 102 instructions were marked with “medication for pregnant women” (91.89%), of which the proportion of those with medication guidance and without medication guidance were 75.68% and 16.22% respectively. Eighty-eight drug instructions were marked with the item “medication for lactating women” (79.28%), of which the proportion of those with medication guidance and without medication guidance were 70.27% and 9.01% respectively. Among different categories of antiarrhythmic drugs, the best labeling of “medication for pregnant women” was class Ⅰ antiarrhythmic drugs (100%), while class Ⅲ drugs (25.00%) were most missing; class Ⅳ antiarrhythmic drugs (94.44%) were the best labeled for “medication for lactating women”, while class Ⅰ(26.47%) were the most missing. There were differences in the labeling contents of “medication for pregnant women” and “medication for lactating women” in some drug instructions of the same variety from different manufacturers. Among the 99 drug instructions of domestic pharmaceutical enterprises, 92 (92.93%) listed the items of “medication for pregnant women” and “medication for lactating women”, and the proportions of them with medication guidance were 74.75% and 69.70% respectively; among the 12 drug instructions of foreign pharmaceutical enterprises, 10 (83.33%) listed the items of “medication for pregnant women” and “medication for lactating women”, and the proportion with medication guidance was 83.33% and 75.00% respectively. CONCLUSIONS There are some problems in the labeling content of domestic antiarrhythmic drug instructions, such as the lack of information related to “medication for pregnant women” and “medication for lactating women”, the confusion of guidance expression, the inconsistent content of drug instructions of the same variety from different manufacturers, the lag of modification and update, and the poor standardization of drug instructions. Drug supervision and administration departments and drug manufacturers should pay attention to them and constantly strengthen the management and standardization of instructions.
KEYWORDS pregnant women; lactating women; antiarrhythmic drugs; drug instructions; medication for special population
孕妇及哺乳期妇女均为特殊人群,其用药安全问题一直备受关注。妊娠期心律失常在我国妊娠期心血管疾病中较为常见,其中室性期前收缩发生率最高(33/10万),心房颤动和阵发性室上性心动过速发生率次之,室性心动过速和心室颤动发生率较低[1]。孕期特有的生理变化使有心律失常病史患者的复发率增加,尤其是器质性心脏病孕妇。“二孩政策”实施以来,我国高龄孕妇越来越多,妊娠期心律失常的发病率也逐渐上升。该疾病引起的血流动力学变化严重危害孕妇及胎儿的健康与生命[2]。目前,药物在心律失常的治疗中仍占有重要地位,但由于抗心律失常药可能会导致孕妇及胎儿发生不良反应,部分药物通过授乳也会对乳儿产生不良影响[3],因此,孕期和哺乳期临床用药决策的制定尤为重要。药品说明书具有法律效力,是指导医师开具处方和患者用药的重要依据,应当包含与药品安全性和有效性相关的重要科学数据、信息等[4]。本研究对抗心律失常药品说明书中涉及孕妇及哺乳期妇女用药信息的标注情况进行整理、统计、分析,以期为规范抗心律失常药品说明书中孕妇及哺乳期妇女用药信息的标注提供参考。
1 资料与方法
1.1 资料来源
登录医脉通科技有限公司官方网站(https://www.medlive.cn/),按照“药品分类→循环系统药物→抗心律失常药”的操作流程,收集在“用药参考”项下收录的所有抗心律失常药品说明书(网页版),对每一种抗心律失常药的药品名称、生产厂家、“孕妇用药”及“哺乳期妇女用药”项下的用药标注情况进行提取和整理,收集时间为2021年3月。对辅助用药及外用制剂的药品说明书未进行收集,如三磷酸腺苷二钠肠溶胶囊、利多卡因凝胶贴膏、硫酸阿托品眼膏等。
1.2 方法
参照国家食品药品监督管理局发布的《化学药品和治疗用生物制品说明书规范细则》[5],对“1.1”项下收集的抗心律失常药品说明书中涉及孕妇及哺乳期妇女用药信息的内容进行整理、统计、分析。内容主要包括以下4个部分:(1)“孕妇用药”及“哺乳期妇女用药”项标注情况——根据改良的Vaughan Williams分类法中药物对心肌细胞动作电位的影响及其与心律失常相关的作用机制[6-7],将抗心律失常药分为Ⅰ、Ⅱ、Ⅲ、Ⅳ类及其他类,对不同分类抗心律失常药品说明书中“孕妇用药”及“哺乳期妇女用药”项标注情况进行统计,分为有用药标注和无用药标注2类。(2)用药指导意见标注情况——对(1)项下获得的“孕妇用药”及“哺乳期妇女用药”项有用药标注的药品说明书,进一步收集药品说明书的具体指导意见,然后参考文献[8],将指导意见分为无用药指导意见(包括意见尚不明确、意见缺失、临床资料无或有限)和有用药指导意见(包括禁用、忌用、避免使用、不宜使用、不得使用、不应使用、慎用、权衡利弊、需调整剂量)2类。(3)对同品种不同生产厂家药品说明书中“孕妇用药”及“哺乳期妇女用药”项标注内容进行比较。(4)对国内外药企药品说明书中“孕妇用药”及“哺乳期妇女用药”项标注情况、是否有用药指导意见的情况进行对比分析。
2 结果
2.1 “孕妇用药”及“哺乳期妇女用药”项标注情况
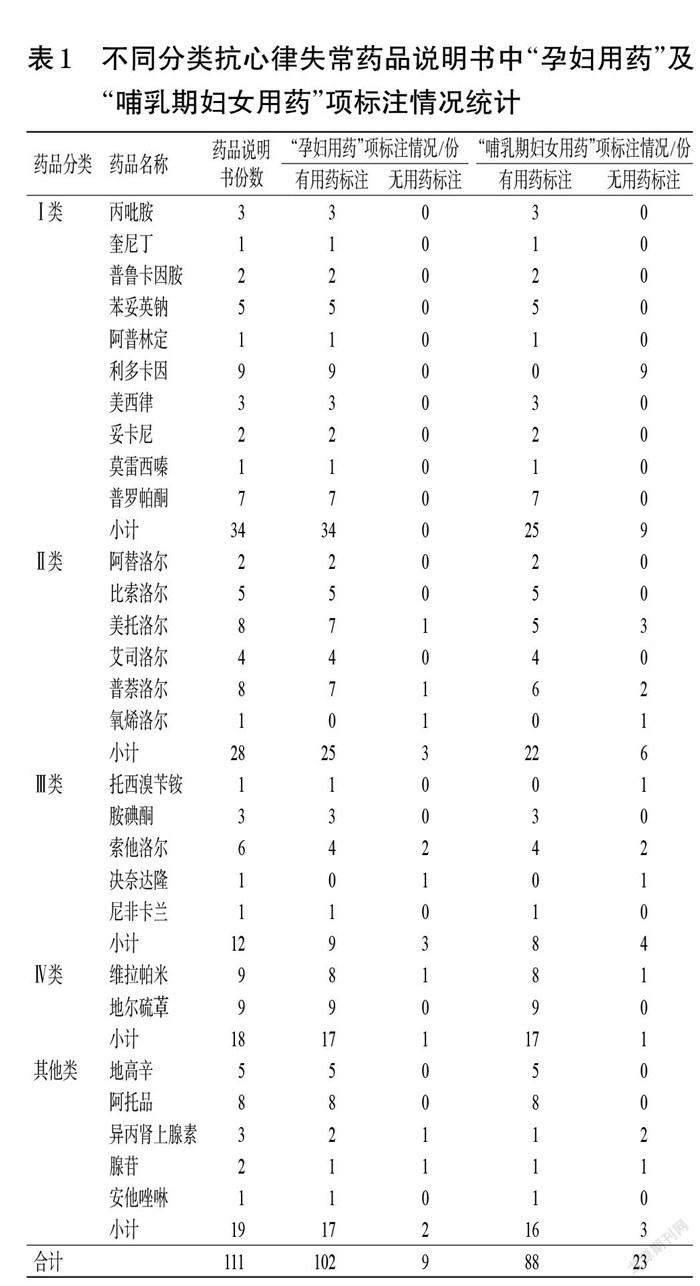
本研究共收集到111份抗心律失常药品说明书。对药品说明书中“孕妇用药”及“哺乳期妇女用药”项标注情况进行统计,结果显示,102份药品说明书有“孕妇用药”项标注(占91.89%),9份药品说明书无“孕妇用药”项标注(占8.11%);88份药品说明书有“哺乳期妇女用药”项标注(占79.28%),23份药品说明书无“哺乳期妇女用药”项标注(占20.72%)。
不同分类抗心律失常药品说明书中,“孕妇用药”项标注情况最佳为Ⅰ类抗心律失常藥(占100%),其次为Ⅳ类(占94.44%),而Ⅲ类标注(占25.00%)缺失最多;“哺乳期妇女用药”项标注情况最佳为Ⅳ类抗心律失常药(占94.44%),而Ⅰ类标注(占26.47%)缺失最多。结果见表1。
2.2 有“孕妇用药”及“哺乳期妇女用药”项标注的药品说明书中用药指导意见标注情况
102份有“孕妇用药”项标注的药品说明书经整理分析,结果显示,18份无用药指导意见(占全部药品说明书的16.22%);84份有用药指导意见,其中标注“慎用、权衡利弊”的药品说明书最多(占全部药品说明书的57.66%),其次为“忌用、避免使用、不宜使用、不得使用、不应使用”(占全部药品说明书的11.71%)。88份有“哺乳期妇女用药”项标注的药品说明书经整理分析,结果显示,10份无用药指导意见(占全部药品说明书的9.01%);78份有用药指导意见,其中标注“忌用、避免使用、不宜使用、不得使用、不应使用”的药品说明书最多(占全部药品说明书的34.23%),其次为“慎用、权衡利弊”(占全部药品说明书的31.53%),无标注“需调整剂量”的药品说明书。结果见表2。
2.3 同品种不同生产厂家药品说明书中“孕妇用药”及“哺乳期妇女用药”项标注内容比较
对同品种不同生产厂家药品说明书内容进行整理分析,结果显示,部分同品种不同生产厂家药品说明书中“孕妇用药”及“哺乳期妇女用药”项标注内容存在差异。结果见表3。
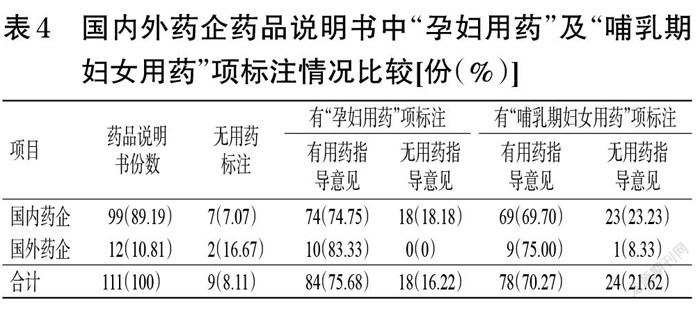
2.4 国内外药企药品说明书中“孕妇用药”及“哺乳期妇女用药”项标注情况比较
111份抗心律失常药品说明书中99份为国内药企药品说明书,12份为国外药企药品说明书。99份国内药企药品说明书中有92份(占92.93%)有“孕妇用药”及“哺乳期妇女用药”项标注;12份国外药企药品说明书中有10份(占83.33%)有该项标注。值得注意的是,国外企业生产的决奈达隆片(法国赛诺菲-安万特集团)说明书中无“孕妇用药”及“哺乳期妇女用药”项标注,而是在“禁忌”项里提到“妊娠、哺乳母亲禁用”,虽然在该说明书中可获取孕妇及哺乳期妇女用药信息,但严格来说仍属不规范书写,故本文将该药品归入“无用药标注”。国外药企药品说明书中“孕妇用药”及“哺乳期妇女用药”项下有用药指导意见的比例(83.33%、75.00%)均大于国内药企(74.75%、69.70%)。笔者仔细阅读药品说明书发现,国外药企药品说明书中用药指导意见的描述均较为详尽细致,如数据包括来自动物实验或临床观察病例、对不同妊娠分期的影响等,而部分国内药企药品说明书该项下仅用“尚不明确”或“权衡利弊”来描述。结果见表4。
3 讨论
3.1 抗心律失常药品说明书中“孕妇用药”及“哺乳期妇女用药”项标注情况欠佳
国家食品药品监督管理局颁布的《化学药品和治疗用生物制品说明书规范细则》明确要求:药品说明书应包括“孕妇用药”及“哺乳期妇女用药”项,着重说明该药品对妊娠、分娩及哺乳期母婴的影响,并写明可否应用本品及用药注意事项;未进行该项试验且无可靠参考文献的,应当在该项下予以说明[5]。但从表1可知,111份抗心律失常药品说明书中“孕妇用药”及“哺乳期妇女用药”项仍存在标注缺失的问题,其中9份药品说明书无“孕妇用药”项标注,23份药品说明书无“哺乳期妇女用药”项标注,分别占8.11%和20.72%。且不同分类抗心律失常药品说明书标注缺失情况不一致,其中Ⅲ类的“孕妇用药”项标注缺失率为25.00%,Ⅰ类的“哺乳期妇女用药”项标注缺失率为26.47%。造成标注缺失率高的原因可能是由于孕妇及哺乳期妇女这一特殊群体对药物的敏感性,以及受到医学伦理的约束,往往不愿或不能成为受试者。有研究表明,只有1%的药物临床研究专门为孕妇设计,而95%的研究排除孕妇参与到Ⅳ期临床试验中,针对孕妇的药物临床试验严重缺失[9]。很多药物缺乏试验数据或仅有上市前动物安全性评价,存在很大的局限性,导致至今仍有许多药物对胎儿及乳儿的影响尚不完全清楚。对此,有学者提出可通过有效招募和保留孕妇受试者、防控风险、提高受益及完善保护孕妇受试者的相关体系等对策,解决孕妇药物临床试验缺失的问题[10]。此外,药品监督管理部门应该出台相应的规范细则,落实奖惩措施,提倡药品研发和生产企业广泛开展此类人群的药物临床试验,对于药品说明书标注不完整的生产企业提出警告,督促其在一定时间内尽快完善相关信息;加强对药品的评审,要求药品生产企业制定说明书前应收集当前孕妇及哺乳期妇女尽可能完整的数据(如动物实验、临床试验、上市后的真实世界研究等数据),把药物暴露对该类人群的风险与获益进行充分科学评估,形成有数据支持的药品说明书标注内容,确保特殊人群用药信息详尽、可靠。
3.2 同品种不同生产厂家药品说明书内容不一致
从表3可知,同品种不同生产厂家药品说明书的“孕妇用药”及“哺乳期妇女用药”项标注内容存在较大差异。如美托洛尔,不同生产厂家药品说明书的该项存在“孕妇禁用”“不宜使用”等不一致的表述,不利于指导临床合理用药。造成以上情况的原因分析如下:(1)与药物剂型不同有关,如口服制剂和注射制剂的剂型属性决定了其在安全性方面会有所差异;(2)不同生产厂家的药品上市时间不同,参考了不同来源的文献及资料,如《中国药典》、美国FDA颁布的药物妊娠危险性等级表、其他厂家相同成分的药品说明书、发表于不同时间的文献专著、药品临床前或临床试验的生殖毒性结果报告等,造成说明书中妊娠期人群用药信息不一致[11];(3)标注“孕妇禁用”,则可能是由于一些厂家为了规避风险。但相同剂型的同品种药品,不同生产厂家对该项的表述应尽量接近、准确。针对此种差异性,有学者提出可通过设计国产药品说明书信息差异分析程序,帮助监管人员及时有效地识别药品说明书的信息差异,以督促企业尽快完善药品说明书[12]。
3.3 药品说明书修改更新滞后
目前国内外已有大量关于妊娠期心律失常方面的研究,并取得了一定进展,为妊娠期心律失常的诊治提供了可靠依据。欧洲心脏病学会发布的《2018 ESC妊娠期心血管疾病管理指南》详细阐述了妊娠合并心律失常患者的药物使用推荐[13]。针对不同类型的心律失常,该指南推荐的药物主要包括β受体阻滞剂、维拉帕米、氟卡尼、普罗帕酮、地高辛等。指南中该类药物的证据等级均为C级,表明证据来源于病例系列研究、低质量队列研究、低质量病例对照研究等;但推荐等级多为Ⅰ级,即有指征情况下建议使用。可见,目前妊娠期使用抗心律失常药仍缺乏高级别的循证医学证据,应权衡利弊,在充分告知可能存在胎儿心律失常风险或胎儿毒性的情况下谨慎使用,使患者获益最大化。本文表1、表3结果显示,指南提及的上述抗心律失常药,如β受体阻滞剂美托洛尔有部分厂家说明书的该项无用药标注或标注为“孕妇禁用”,又如地高辛说明书则标注为“未进行该项试验且无可靠参考文献”。说明书的滞后易给临床医师实施治疗带来很大困扰,给患者用药带来一定顾虑,延误病情。建议药品生产厂家提高主体责任意识,及时关注相关指南和追踪最新循证医学证据,积极研究说明书修订方案;此外,还需关注药品上市后的不良反应报告,及时修改和补充,确保药品能够有效、安全使用。
3.4 国內药企药品说明书规范性欠佳
由表3可知,国外药企药品说明书中“孕妇用药”及“哺乳期妇女用药”项下有用药指导意见的比例均大于国内药企,且药品说明书中有用药指导意见的描述均较为详尽,数据来源比较清晰,而部分国内药企药品说明书该项下仅标注为“尚不明确”或“权衡利弊”。可见,国内药企药品说明书规范性欠佳,这与文献[14-16]的报道类似。各国药品监督管理部门为保证药品说明书规范、准确,纷纷进行规范化管理。在美国,规范药品说明书的相关法律法规包括《联邦食品药品化妆品法》《食品药品管理法修正案》《联邦法规汇编》等;也有相关行业指南对人用处方药和生物制品说明书的不良反应、临床药理及用法用量进行形式和内容的规范;对药品说明书的修订管理主要为《食品药品管理法修正案》,其规定药品生产商作为说明书修订的第一责任人,以提升生产商监测上市后药品不良事件的主动性[17]。欧洲药品管理局于2013年9月起实施更新药品说明书模板,具体规定了药品说明书各个项目的内容[18]。虽然我国也相继出台了药品说明书的相关法律法规,但未能对各个项目内容进行具体的指导和规范,且缺乏清晰的处罚条款。相比之下,美国法律对违规企业实施递增式处罚条款,能有效约束未及时修改药品说明书的企业行为[19]。建议国内药企参考欧美国家对药品说明书进行书写,使药品说明书的信息更规范;建议修订《药品管理法》等法律法规,出台详细的药品说明书修订程序及处罚条款,规定药品生产企业为说明书修订的第一责任人,引导其根据药品上市后风险信息主动、及时、持续地修订药品说明书。值得关注的是,美国FDA于2015年6月30日实施了《妊娠与哺乳标注规则》(the Pregnancy and Lactation Labeling Rule,PLLR),要求所有制药公司在说明书中删除妊娠期“ABCDX”分类[20]。美国FDA认为这种分类过于简单,无法准确传递胎儿风险程度的差异,可能导致不明智的临床决策。PLLR要求在说明书中描述妊娠期的药物风险摘要和支持这些摘要的讨论;创建女性和男性生殖潜能小项,便于医护人员查找妊娠、避孕和不孕信息;并根据更新信息及时修订说明书。PLLR实施的新标签格式是为了解决处方药和生物制品标签中怀孕和哺乳信息不足的问题,更好地帮助提供者向孕妇或哺乳期妇女传达有关服用特定药物风险和益处的重要信息[21]。美国FDA为贯彻实施PLLR,于2014年12月发布了供企业用的“人用处方药和生物制品说明书妊娠、哺乳期和生殖潜能的内容和形式”指导原则,该指导原则介绍了对说明书中“特殊人群用药”项下妊娠、哺乳期、女性和男性生殖潜能小项的组织结构,以及撰写内容和形式的最新要求[22]。PLLR细化了证据数据的描述信息,增加了对临床因素的考虑,同时增加了对有生育可能人群的考虑,从用药角度更多地转向了患者角度考虑其综合获益,有助于临床作出更有利于患者的正确决策。而在我国目前尚无相应指导原则、法规和实施细则的情况下,美国FDA的这一指导原则对药品说明书撰写者和监管者均有重要的参考价值。
4 结语
国内抗心律失常药品说明书标注内容存在“孕妇用药”及“哺乳期妇女用药”相关信息缺失、指导意见表述混乱、同品种不同生产厂家药品说明书标注内容不一致、修改更新滞后、说明书规范性欠佳等问题,应引起药品监督管理部门、药品生产企业的重视。药品说明书中孕妇及哺乳期妇女信息标注内容的规范化对该类特殊人群临床实践的指导意义重大,希望通过不断加强对说明书的管理和规范,提高其在临床应用方面的实用性和指导性。
参考文献
[ 1 ] VAIDYA V R,ARORA S,PATEL N,et al. Burden of arrhythmia in pregnancy[J]. Circulation,2017,135(6):619-621.
[ 2 ] 刘诗文.妊娠期心律失常的研究进展[D].南昌:南昌大学,2017.
[ 3 ] KORNACEWICZ-JACH Z,PEREGUD-POGORZELSKA M. Maternal arrhythmias during pregnancy. Practical review[J]. Przegl Lek,2014,71(3):177-181.
[ 4 ] 国家食品药品监督管理局.药品说明书和标签管理规定[EB/OL]. (2006-03-15)[2021-10-10]. https://www.nmpa.gov.cn/xxgk/fgwj/bmgzh/20060315010101975.html.
[ 5 ] 国家食品药品监督管理局.关于印发化学药品和治疗用生物制品说明书规范细则的通知:国食藥监注〔2006〕202号[EB/OL].(2006-05-10)[2021-10-10]. https://www.nmpa.gov.cn/directory/web/nmpa/xxgk/fgwj/gzwj/gzwjyp/20060510010101566.html.
[ 6 ] VAUGHAN WILLIAMS E M. Classification of antidy- srhythmic drugs[J]. Pharmacol Ther B,1975,1(1):115- 138.
[ 7 ] HARRISON D C. Antiarrhythmic drug classification:new science and practical applications[J]. Am J Cardiol,1985,56(1):185-187.
[ 8 ] 苏洽玉,陈海坤.药品说明书中标注孕妇及哺乳期妇女用药警示语浅议[J].中国药房,2008,19(14):1110-1112.
[ 9 ] SHIELDS K E,LYERLY A D. Exclusion of pregnant women from industry-sponsored clinical trials[J]. Obstet Gynecol,2013,122(5):1077-1081.
[10] 江泽宇,魏璧,许倩,等.孕妇药物临床试验中的伦理问题及其解决方案综述[J].中国医学伦理学,2019,32(6):719-723.
[11] 黄珈雯. 259份抗高血压药品说明书中妊娠妇女用药信息的调查分析[J].中国医院药学杂志,2014,34(12):1027-1029.
[12] 傅书勇,杨悦,邓剑雄,等.国产药品说明书信息差异分析程序设计的探讨[J].药物评价研究,2018,41(2):177- 181.
[13] REGITZ-ZAGROSEK V,ROOS-HESSELINK J W,BAUERSACHS J,et al. 2018 ESC Guidelines for the management of cardiovascular diseases during pregnancy
[J]. Eur Heart J,2018,39(34):3165-3241.
[14] 王萌萌,庞艳玉,王先利,等.复旦大学附属妇产科医院609份药品说明书中有关妊娠期及哺乳期妇女用药标注调查[J].中国医院用药评价与分析,2014,14(9):831-834.
[15] 王凤炜. 42份抗菌药物说明书对孕妇及哺乳期妇女用药分析[J].北方药学,2017,14(7):151-153.
[16] 冯娜. 166份抗糖尿病药品说明书中妊娠妇女用药信息标注情况调查分析[J].中国药房,2017,28(16):2301- 2304.
[17] 李名石,任瑜,杨悦.美国药品说明书管理研究[J].中国药物警戒,2014,11(12):739-742,745.
[18] EMA. European Medicines Agency updates product-information template to label medicines subject to additional monitoring and encourage adverse-reaction reporting[EB/OL].(2013-03-15)[2021-10-10]. http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2013/ 03/news_detail_001740.jsp&mid=WC0b01ac058004d5c1.
[19] 傅书勇,杨悦,于金冉.中美药品说明书管理的法律法规比较[J].医药导报,2018,37(10):1291-1294.
[20] FDA. Pregnancy and lactation labeling final rule[EB/OL]. (2021-03-15)[2021-10-10]. https://www.fda.gov/vaccines- blood-biologics/biologics-rules/pregnancy-and-lactation- labeling-final-rule.
[21] DINATALE M,SAHIN L,JOHNSON T,et al. Medication use during pregnancy and lactation:introducing the pregnancy and lactation labeling rule[J]. Pediatr Allergy Immunol Pulmonol,2017,30(2):132-134.
[22] 萧惠来. FDA对处方药说明书妊娠、哺乳期和生殖潜能的新要求[J].药物评价研究,2015,38(2):128-134.
(收稿日期:2021-10-21 修回日期:2022-01-10)
(编辑:舒安琴)
