锰酸锂的制备、表征及甲醛降解性能研究
2022-05-16俞天寿柳宛彤金红晓葛洪良王新庆金顶峰
俞天寿,韩 哲,柳宛彤,张 明,金红晓,葛洪良,王新庆,金顶峰
(1.中国计量大学 材料与化学学院,浙江 杭州 310018;2.中国计量大学 质量与安全工程学院,浙江 杭州 310018)
随着居民生活水平和健康意识的不断提高,加上近年来疫情所带来的的冲击,人们对于居住环境对自身健康的影响也日益重视[1-2]。甲醛广泛应用于纺织品、木质家具、建筑材料,是造成室内空气污染的主要来源。其为一级致癌物,毒性大,刺激性强。当代人们生活与工作大部分时间都位于室内,患上病态建筑综合症(SBS)[3-4]的人日益增加。因此,21世纪以来降解环境中的甲醛逐渐成为了一个热门的课题。
目前,去除甲醛的主要方法有活性炭吸附法[5-9]、臭氧氧化法[10-13]、光催化氧化法[14-16]等,但均存在一些限制应用的缺点,如:活性炭吸附法存在吸附极限,存在二次释放的可能。臭氧氧化法中臭氧本身也是一种空气污染物,降解甲醛的同时引入新的污染物。光催化氧化法中,光催化剂的效率低于10%,且降解时会产生一氧化碳等有害中间产物。因此研究者们致力寻求常温常压下无需额外能量的甲醛降解催化剂。
研究者们发现部分过渡金属氧化物拥有优秀的甲醛降解性能。Sekine等[17]比较了不同金属氧化物(Ag2O、PdO、MnO2、CoO、TiO2、CeO2、Mn3O4等)对甲醛的催化活性,发现其中MnO2的表现最为优异。MnO2是一种非化学计量化合物,存在多种不同的结构与晶型;其表面氧物种丰富,降解时无二次污染。
不同晶型的二氧化锰对于甲醛的催化降解性能有所不同[18]。原子掺杂可以调节MnO2的形态、比表面积、晶体结构、电子结构、锰氧键强度和表面种类等特性。Zhu[19]等在δ-MnO2中掺杂不同浓度Ce3+,发现随着掺杂的Ce3+浓度提高δ-MnO2晶粒尺寸逐渐减小,结晶度逐渐变差。掺杂后的δ-MnO2对甲醛的降解效率得到了明显的提升,在100 ℃下可完全降解190×10-6甲醛;而同等条件下未经掺杂的δ-MnO2需要在130 ℃下才能完全降解。
Wei等[20]发现利用Li+、Na+、K+、Rb+等碱性金属离子对MnO2进行掺杂之后,MnO2表面的氧空位得到了显著增加,氧迁移率及电子迁移率也明显增加,因此提升了甲醛的催化性能[21]。当掺杂的MnO2为层状δ-MnO2时,外层电子结构稳定的掺杂离子会作为助剂插入δ-MnO2层间,使其层间距发生改变,从而改善其甲醛降解性能[22]。在各种碱性离子中,Li+由于其较小的体积可以更好的改善MnO2的表面性能,从而提高其对甲醛的降解性能。
因此,本文考虑通过改变水热温度制备锰酸锂材料,并测试其对于甲醛的催化活性。采用水热法在不同温度下制备锰酸锂材料,制得了可用于降解低浓度甲醛的催化剂;以XRD,N2吸脱附,XPS和TEM等方法对催化剂进行了表征;详细研究了水热温度对于锰酸锂的表面结构与形貌、元素价态等影响,并对催化剂的甲醛催化性能进行了探讨。
1 实验部分
1.1 样品的制备
氢氧化锂(LiOH)、抗坏血酸、高锰酸钾(KMnO4)等试剂均为分析纯,购买自阿拉丁试剂(上海)有限公司。
锰酸锂的制备:称取0.200 g抗坏血酸、0.335 g氢氧化锂、0.974 g高锰酸钾。将氢氧化锂溶于80 mL去离子水,充分搅拌直至完全溶解,加入高锰酸钾,持续搅拌至完全溶解后再将抗坏血酸加入混合溶液中,继续搅拌将所有反应物溶解混合均匀;将混合溶液倒入容积为100 mL的水热反应釜中,在150 ℃下反应4 h,反应结束后待水热釜冷却完毕,倒出产物进行减压过滤,并利用去离子水反复洗涤直至洗涤液呈中性,将所得滤饼转移到真空干燥箱在80 ℃下烘干24 h,制备得锰酸锂样品,记为LiMn2O4-150。
以同样的实验方法,分别在170 ℃、190 ℃、210 ℃、230 ℃的水热温度下制得LiMn2O4-170、LiMn2O4-190、LiMn2O4-210和LiMn2O4-230。催化测试前将不同的二氧化锰压片,磨碎,取80~100目筛,在100 ℃下老化6 h后装样测试。
1.2 材料测试
催化剂的XRD数据由X射线衍射仪(Smartlab,日立(中国)有限公司,日本)测得,参数设置为2θ扫描角度范围10°至90°,扫描步长0.02°,扫描速度10°/min。;N2吸附-脱附测试由全自动快速比表面积分析仪(ASAP 2020,麦克默瑞提克(上海)仪器有限公司,美国)测得;X射线光电子能谱采用光电子能谱仪(ESCALAB 250Xi,赛默飞世尔科技公司,美国)进行测试,以Al Kα射线(hv=1 486.6 eV)作为激发源,分析室真空度低于5.0×10-7mBar,全谱扫描通能100 eV,步长1 eV,以C1s=284.80 eV结合能为能量标准进行荷电矫正;样品的TEM图像通过透射电子显微镜(JEM-2100,日本电子株式会社,日本)获得。
1.3 催化活性分析
实验流程图如图1。首先,取0.5 g样品放入石英玻璃管,两端利用石英棉固定,并安装于恒温烘箱D中。烘箱温度设置为恒温30 ℃。开启氮气与氧气瓶与气体流量计A连接,设置氧气的流量为60 mL/min,氮气140 mL/min,混合气体通过装置B,在低温冷却液循环泵中0 ℃下水浴的0.1%甲醛溶液,利用鼓泡法使混合气体中携带一定质量浓度(3~4×10-6)的甲醛,经过恒温烘箱内的玻璃管D与催化剂进行反应,装置末尾将气体通入盛有500 m去离子水的烧杯F中,进行尾气的收集。
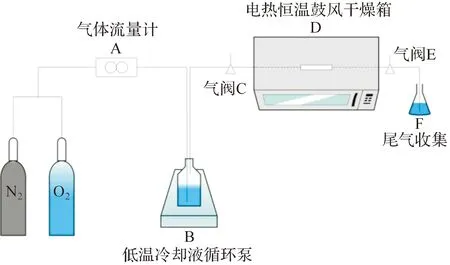
A—气体流量计;B—低温冷却液循环泵;C—气阀;D—电热恒温鼓风干燥箱:E—气阀;F—烧杯图1 实验流程Figure 1 Experimental process
测试时分别利用甲醛测试仪在气阀C与E处测出反应器前端甲醛质量浓度C1×10-6和后端降解后的甲醛质量浓度C2×10-6,根据式(1):
(1)
即可计算出该时刻下催化剂对甲醛的催化效率。
2 结果与讨论
2.1 XRD分析
不同水热温度下制备锰酸锂的XRD如图2所示。LiMn2O4-150与LiMn2O4-170由于反应温度较低,产物结晶性较差,表面存在大量缺陷,表现为无定型锰酸锂。LiMn2O4-190的XRD曲线分别在2θ=18.8°、36.5°、44.4°、58.1°及64.6°处出现了5个衍射峰,分别对应了(111)、(311)、(400)、(511)、(440)晶面,锰氧化物主晶相为Li1.27Mn1.73O4,峰型较为宽化,说明其结晶性不是很好。LiMn2O4-210与LiMn2O4-230的XRD曲线在2θ=18.6°、36.1°、43.9°、58.1°、63.8°及67.1°处出现了6个较强的衍射峰,分别对应(111)、(311)、(400)、(511)、(440)、(531)晶面,峰型尖锐且晶面无偏移,结晶性良好,主晶相为LiMn2O4(PDF#35-0782)。
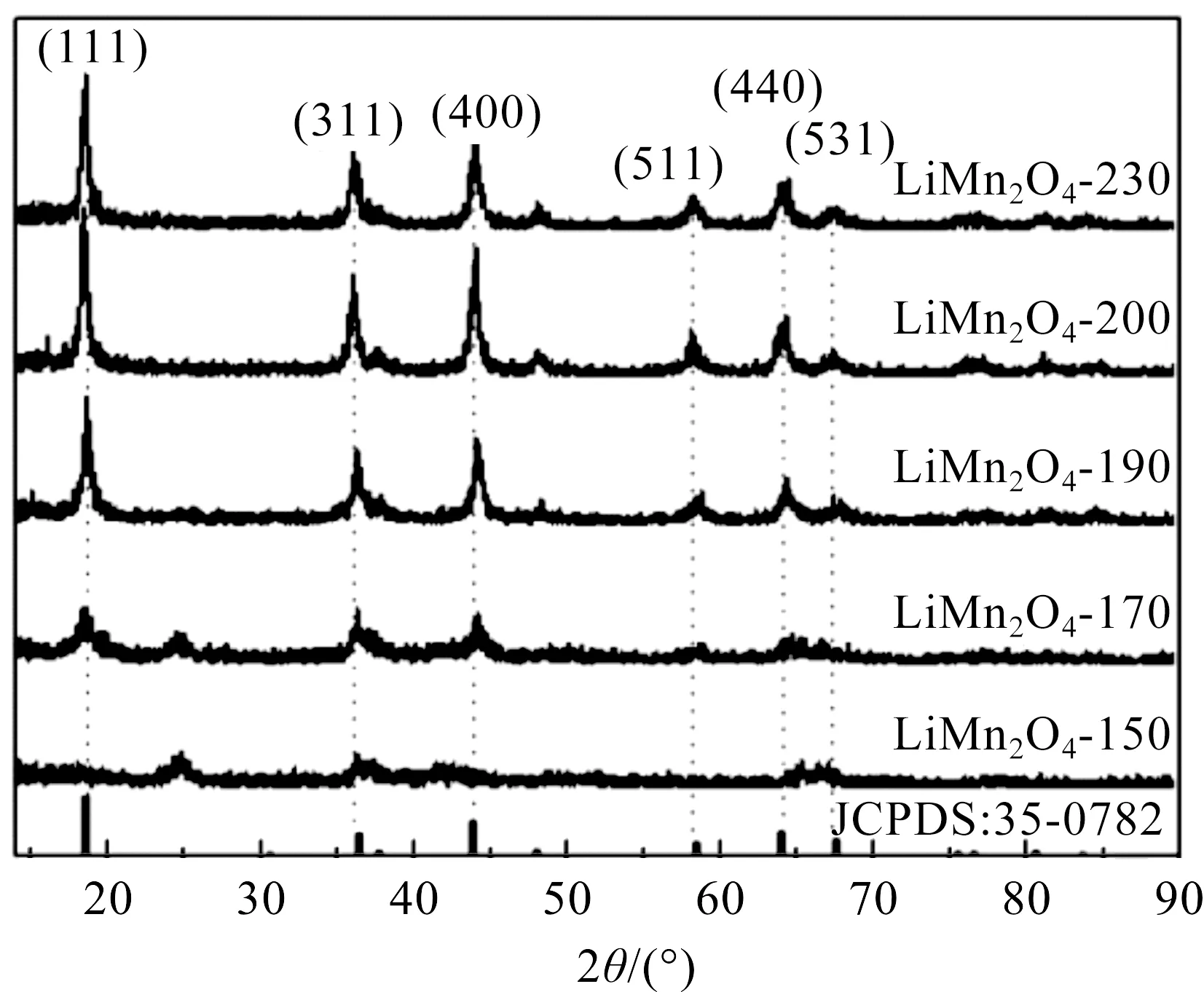
图2 不同水热温度下所得样品的XRD图谱Figure 2 XRD patterns of samples obtained at different hydrothermaltemperature
2.2 N2吸附-脱附分析
不同水热温度制得的锰酸锂N2吸脱附曲线如图3。可观察到,样品吸附曲线在低压区(P/P0=0~0.1)发生可逆的单层吸附,而在相对压力较高的区域等温线迅速上升,表现为IV型等温线,滞后环类型为H3型;LiMn2O4-150、170、190、210吸附曲线的滞后环出现在P/P0=0.6~1.0区域,230 ℃吸附曲线的滞后环出现在相对压力P/P0=0.5~0.9区域,较宽的滞后环表明其孔径相比其他材料略大,趋向于介孔材料,具有多孔、比表面积大的特点,可以在表面吸附更多的甲醛、氧气与水等反应物,在催化降解甲醛的过程中提供更多的活性位点,有利于甲醛的降解。
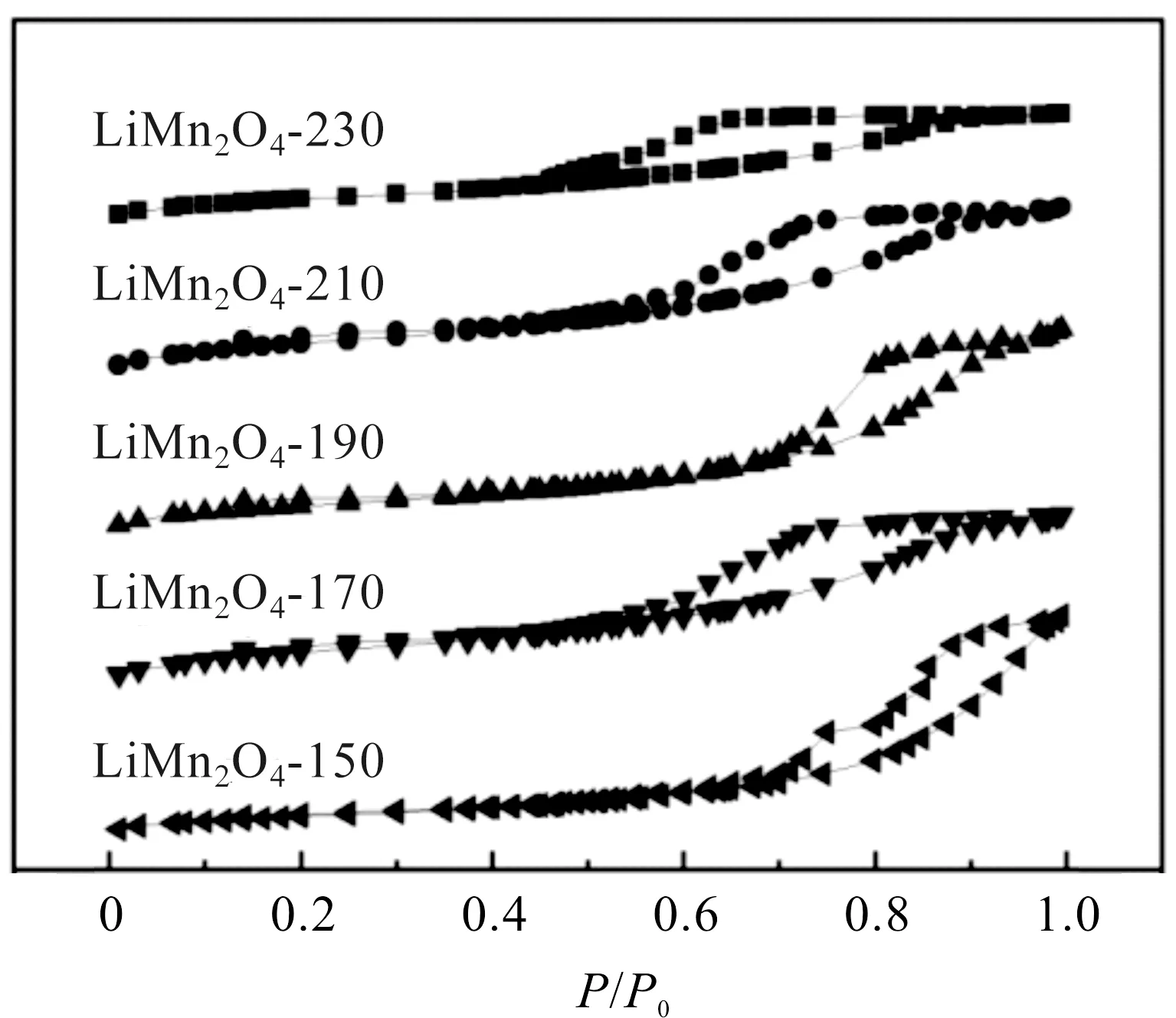
图3 不同水热温度下所得样品的吸脱附等温曲线Figure 3 N2 adsorption-desorption isotherms of samples obtained at differenthydrothermal temperatures
各样品比表面积、孔容、平均孔径等数据汇总于表1,可以观察到水热温度在150 ℃到210 ℃之间时,随着样品熟化更为充分,比表面积随着温度的升高而增大。将反应温度提高到230 ℃时,LiMn2O4-230比表面积略有降低,而孔径和孔容增大。

表1 不同水热温度下所得样品的的BET参数
2.3 XPS结果分析
不同水热温度下制得的锰酸锂XPS结果如图4所示。利用XPS对不同水热温度下制备的锰酸锂的元素组成(Li1s,Mn2p,Mn3s和O1s)、金属氧化状态和吸附物种类进行研究。由图4(a)可观察到位于54.2 eV的Li1s特征峰,在不同的水热温度下,Li+出峰位置基本无变化,其含量随水热温度升高而增加,在210 ℃时达到最高。图4(b)中Mn2p轨道出现了Mn3/2和Mn1/2两个峰,其自旋能分离为11.4~11.6 eV。其中Mn2p3/2在不同水热温度下峰面积出现了明显变化,表明不同水热温度会对产物中的锰含量产生明显影响[23],随着水热温度提高样品表层锰含量逐渐增加。Mn3s峰分裂源自Mn3s和Mn3d轨道电子之间的平行自旋耦合,当Mn3d轨道电子减少时,Mn3s两峰分裂差值减小,其氧化态随之提高[24]。根据图4(c)测得多峰分裂差值(ΔE Mn3s),再根据式(2)进一步计算得到Mn的平均氧化度(AOS):
AOS=8.95-1.13×ΔEs(eV)。
(2)
计算得LiMn2O4-150、170、190、210、230的AOS分别为3.42、3.19、3.40、4.07和3.80,其中LiMn2O4-210具有最高的平均氧化度。
图4(d)各样品的O1s轨道图像。其特征峰主要由529 eV左右的Olatt(晶格氧)和531 eV左右的Osurf(表面氧)组成。随着反应温度的升高,表面氧的含量逐步提高。氧气是催化剂降解甲醛的主要反应物之一,能被表面的三价Mn还原为活性氧物质,从而进一步氧化甲醛降解产生的中间产物,对甲醛催化氧化起到关键作用。表面氧的变化趋势与N2脱吸附数据中比表面积变化趋势较为一致,LiMn2O4-210拥有最大的比表面积,可以更好地捕获并吸附空气中的氧气。在催化剂的表面提供更多的活性位点,有利于对甲醛的催化降解活性。

图4 不同水热温度下所得样品的的XPS谱图Figure 4 XPS of samples obtained at different hydrothermal temperatures
2.4 TEM结果分析
不同水热温度下制备锰酸锂的TEM结果如图5所示。由图5(a)可知LiMn2O4-150为无定型结构,且有团聚现象,表明LiMn2O4在150 ℃下熟化不充分,从氮气吸脱附结果发现团聚现象的发生导致其比表面积、孔容、孔径相比于其他样品较小,表面缺陷与活性位点相对也会减少,不利于对甲醛的降解。LiMn2O4-170与LiMn2O4-190结晶度较差,且结构较为松散,松散的结构有利于对空气中甲醛气体分子的捕获与吸附,对于提高催化剂的甲醛降解性能有所帮助。LiMn2O4-210为八面体结构,产物结晶度较好,与理想的尖晶石型锰酸锂晶体结构一致,其粒径大小约为50~100 nm,比表面积进一步提高。而LiMn2O4-230经过熟化后,其结构发生了变化并产生了团聚现象,同时相比LiMn2O4-210比表面积减小。


图5 不同温度下所得样品的TEM图像Figure 5 TEM images of samples obtained at different hydrothermal temperatures
2.5 催化活性分析
不同水热温度下制备锰酸锂的甲醛降解活性如图6。在10 h内LiMn2O4-210的催化效率明显高于其余样品,甲醛降解效率可达到97%,LiMn2O4-230在10 h内对甲醛的降解效率也达到了96%。总的来说各个样品的甲醛降解活性从大到小排序为LiMn2O4-210>LiMn2O4-230>LiMn2O4-190>LiMn2O4-170>LiMn2O4-150。对比样品的各个参数发现,该排序与催化剂的比表面积、AOS与表面氧含量变化趋势排序较为一致,表明LiMn2O4的比表面积与AOS可能是影响LiMn2O4甲醛催化活性主要因素。各样品中LiMn2O4-150的比表面积较小、Mn的平均价态较低,结晶性较差在甲醛催化反应中催化活性较弱。观察甲醛催化曲线发现,各样品的催化效率在前2 h内随着时间提高明显,存在一段时间的诱导期,这可能是由于随降解时间增加,样品表面吸附的水分子与氧气逐渐增加,从而甲醛降解活性缓慢升高,当吸附量达到极限后,降解曲线出现一个平台。
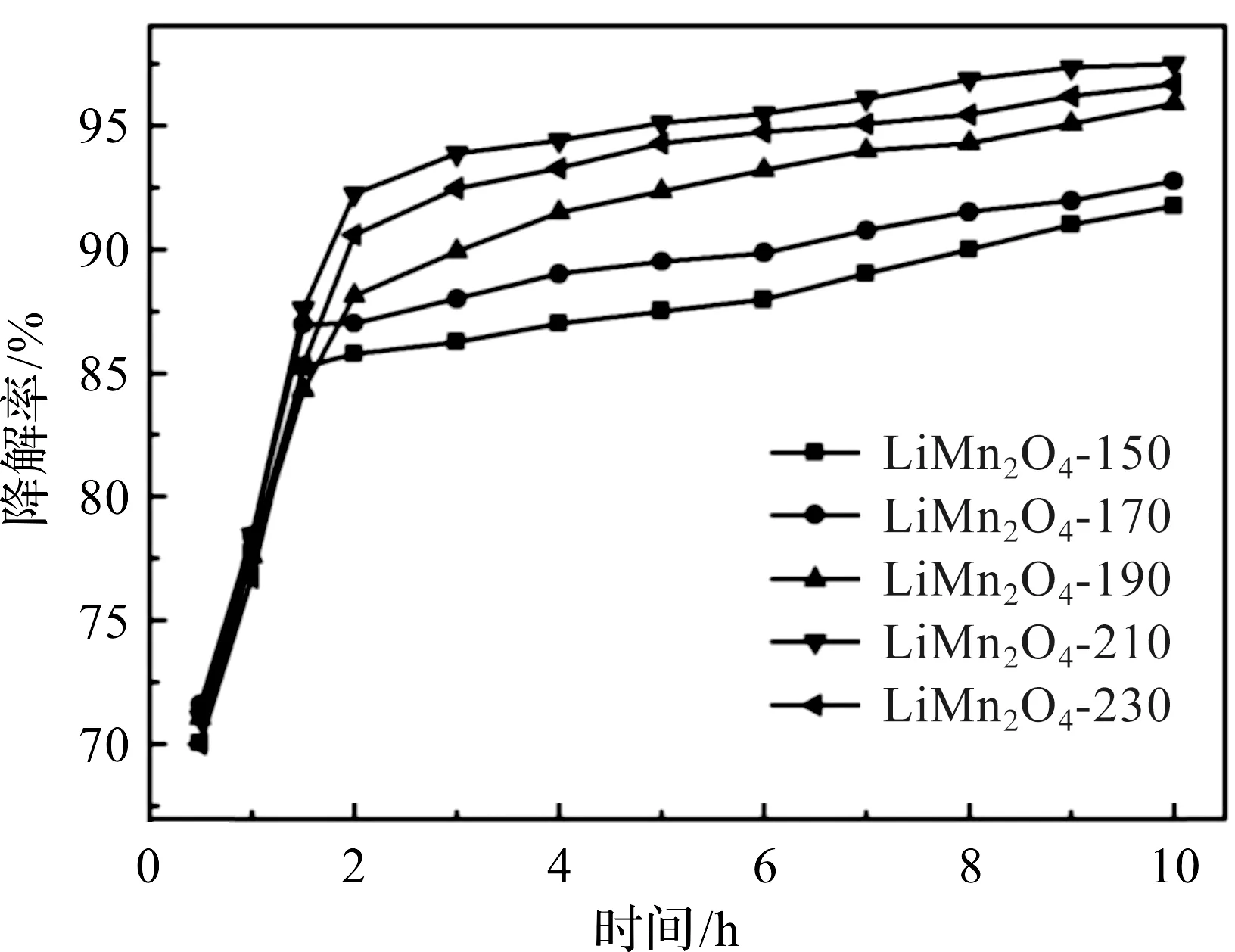
图6 不同水热温度催化剂降解甲醛的效率对比曲线Figure 6 Removing rate for formaldehyde of samples obtained at different hydrothermal temperatures
3 结 论
以抗坏血酸、高锰酸钾与氢氧化锂为原料,利用水热法在不同水热温度下制备了锰酸锂,在恒温30 ℃下对低浓度甲醛进行了降解,探究了水热温度对所得锰酸锂结构、晶型及甲醛降解效率的影响。锰酸锂的比表面积、AOS与表面氧含量可能是影响其甲醛降解活性的关键因素。五种水热温度下制备的催化剂在10 h内对低浓度甲醛保持90%以上的催化效率,其中LiMn2O4-210对低浓度甲醛降解效率10 h内可达到97%以上。所制备的锰酸锂表面性能优异,可以吸附更多的水与氧气参与反应,在常温条件下,对空气中的甲醛具有良好的催化氧化活性。
