重组人胰岛素注射液中异天冬氨酸含量检测*
2022-05-16晏菊姣范晓磊宋德芳吴健鸿周朝晖
李 恒,晏菊姣,范晓磊,宋德芳,吴健鸿△,周朝晖
(1. 武汉药品医疗器械检验所,湖北 武汉 430075; 2. 东北大学化学与生物化学系·巴奈特化学与生物分析研究所,美国 波士顿 02115)
脱酰胺化是常见的蛋白翻译后修饰形式,普遍存在于蛋白、多肽类药物中。药物蛋白在生产、存储过程中天冬酰胺(Asn)残基发生非酶催化脱酰胺反应[1],产生特异性降解产物异天冬氨酸(isoAsp),可改变蛋白质的结构和功能[2-3],并可能导致蛋白活性下降[4-5]。重组人胰岛素由51 个氨基酸组成,含有3 个天冬酰胺残基,Asn21位点易发生脱酰胺反应[6],2020年版《中国药典(三部)》中对A21脱氨人胰岛素进行了杂质控制[7]。目前,胰岛素注射液质量标准的逐步提升使其制剂工艺不断改进,其质量显著提高。蛋白的脱酰胺化研究已列入生物技术药物质量控制的相关内容[1]。本研究中应用IsoQuant®定量试剂盒,建立了测定重组人胰岛素注射液中脱酰胺产物isoAsp 含量的高效液相色谱(HPLC)法。现报道如下。
1 仪器与试药
1.1 仪器
Agilent 1260 Infinity Ⅱ型高效液相色谱仪(安捷伦科技有限公司);XS205BU型电子天平(精度为0.01 mg),Mettler SevenEasy 型pH 计,均购于梅特勒- 托利多仪器公司;Classic型超纯水机(Elga 公司);Vortex-Kylin-Bell 5 型涡旋仪(海门市其林贝尔仪器制造有限公司);DK - S26 型电热恒温水浴锅(上海精宏实验设备有限公司);SK250LHC 型超声波清洗仪(上海科导超声仪器有限公司,功率为250 W,频率为50 kHz);R1750R 型高速离心机(湖南湘仪实验室仪器开发有限公司);AP -9928-3型真空泵(天津奥特赛恩斯仪器有限公司)。
1.2 试药
重组人胰岛素注射液[诺和诺德(中国)制药有限公司,商品名诺和灵®,批号分别为2020010192 和2020061612,规格为300 IU/ 3 mL(笔芯),质量浓度为3.5 mg/ mL];重组人胰岛素标准品(中国食品药品检定研究院,批号为140633-201907,含量为27.2 IU/mg);IsoQuant®定量试剂盒[美国Promega 公司,货号为MA1010,批号为0000387327,S- 腺苷-L- 高半胱氨酸(SAH)含量为14.97 μmol/ L,IsoAsp - DSIP 含量为96.1 μmol/ L,S- 腺苷-L- 甲硫氨酸(SAM)含量为1 mmol/L,异天冬氨酸甲基转移酶(PIMT),5 倍反应缓冲液,0.3 mol/ L 磷酸];磷酸二氢钾(批号为20190509)、磷酸氢二钾(批号为20180109)、无水硫酸钠(批号为20181023)、磷酸(批号为20160425)、乙醇胺(批号为20200807),均为分析纯,盐酸(优级纯,批号为20190118),均购自国药集团化学试剂有限公司;甲醇(色谱纯,Scharlau公司,批号为20277613)。
2 方法与结果
2.1 HPLC 法测定isoAsp 含量
2.1.1 色谱条件
色谱柱:Welch Ultimate®XB - C18柱(100 mm ×4.6 mm,5 μm);流速:1.0 mL/min;采用二极管阵列检测器(DAD);检测波长:260 nm;进样量:40 μL;柱温:25 ℃;流动相:10%甲醇溶液(含7.9 mmol/L 磷酸二氢钾和1.1 mmol/L磷酸氢二钾,用磷酸调pH至6.2,A)-甲醇(B),梯度洗脱(程序见表1)。

表1 梯度洗脱程序(%)Tab.1 Gradient elution procedure(%)
2.1.2 溶液制备
SAH 对照品溶液:取IsoQuant®定量试剂盒,于室温放置30 min 解冻,取试剂盒中SAH 对照品(浓度为14.97 μmol/L),分别精密吸取0.5,1.0,2.0,3.0,5.0,10.0 μL,置200 μL进样瓶中,加水稀释至60 μL,制备含量分别为0.125,0.250,0.500,0.750,1.250,2.500 μmol/L的系列SAH对照品溶液。
isoAsp - DSIP 质控对照溶液:取IsoQuant®定量试剂盒,于室温放置30 min 解冻,取试剂盒中的IsoAsp -DSIP质控对照品浓度为96.1 μmol/L),精密吸取2 μL,置200 μL 离心管中,加水稀释至50 μL,得浓度为3.84 μmol/L的isoASP-DSIP质控对照溶液。
酶反应溶液:取重组人胰岛素注射液(批号为2020010192),取上述isoAsp - DSIP 质控对照溶液(浓度为3.84 μmol/L)和水(空白)各10 μL,分别置200 μL离心管中,平行2 份,各加入主反应混合物(MM)溶液[水-5倍反应缓冲液-SAM-PIMT(1∶1∶1∶1,V/V/V/V)]40 μL,轻轻涡旋并离心(转速为12000 r/min),以确保液体均在管底。将离心管放置在30 ℃的水浴中30 min,取出,置冰上,加终止液(0.3 mol/ L 磷酸)10 μL,放置5~10 min 至反应完全,轻轻涡旋并离心(4 ℃,转速为12000 r/ min),取上清液,置200 μL 进样瓶中,4 ℃避光保存。
2.1.3 测定法
取SAH 对照品溶液(浓度为1.25 μmol/ L),以及参与酶反应的供试品溶液、isoAsp - DSIP 质控对照溶液、水(空白)各40 μL,分别注入液相色谱仪,记录色谱图。用标准曲线计算样品中SAH 的含量,酶反应溶液中测得1 mol SAH 相当于样品中蛋白含有1 mol isoAsp,以此计算重组人胰岛素注射液和IsoAsp-DSIP 质控对照溶液中蛋白的isoAsp含量。色谱图见图1。
2.1.4 方法学考察
线性关系考察:分别取2.1.2项下系列SAH对照品溶液各40 μL,按2.1.1项下色谱条件进样测定,以SAH进样量(X,pmol)为横坐标、峰面积(Y)为纵坐标进行线性回归,得回归方程Y=0.8667X+0.3613(R2=0.9997)。结果表明,SAH 进样量在5~100 pmol 范围内与峰面积线性关系良好。
精密度及稳定性试验:取2.1.2 项下浓度为1.25 μmol/L的SAH对照品溶液40 μL,分别于开始(0 h)、中间(5 h)和结束(10 h)时按2.1.1 项下色谱条件进样测定2次。结果SAH峰保留时间和峰面积平均值分别为3.96 min和43.57,RSD分别为0.11%和0.33%(n=6)。
重复性试验:取样品(批号为2020010192)适量,按2.1.2项下酶反应溶液制备方法平行制备6份供试品溶液,按2.1.1 项下色谱条件进样测定,用标准曲线计算含量。结果isoAsp 含量的平均值为3.46 nmol/mL,RSD为5.10%(n=6),表明方法重复性良好。
加样回收试验:取2.1.2项下酶反应溶液与SAH对照品溶液各30 μL,混匀,即得添加SAH 对照品浓度分别为0.25,0.75,1.25 μmol/L 的低、中、高水平加样回收溶液,平行3 份,按2.1.1 项下色谱条件进样测定SAH的含量,并计算回收率。结果见表2。
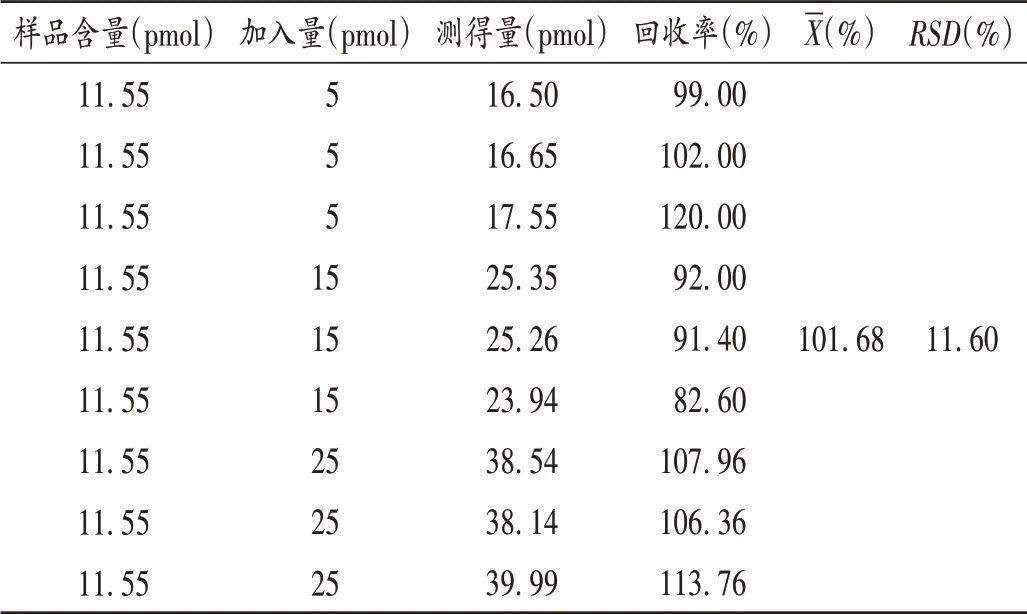
表2 加样回收试验结果(n=9)Tab.2 Results of the recovery test(n=9)
灵敏度考察:取2.1.2 项下SAH 对照品溶液(浓度为0.125 μmol/ L),按2.1.1 项下色谱条件进样测定。结果色谱峰的信噪比(S/N)为15.9,符合定量要求。
2.2 法定标准A21 脱氨人胰岛素测定
2.2.1 色谱条件
色谱柱:Welch Ultimate®XB - C18柱(100 mm ×4.6 mm,5 μm);流动相:以0.2 mol/ L 硫酸盐缓冲液(取无水硫酸钠28.4 g,加水溶解,加磷酸2.7 mL、水800 mL,用乙醇胺调pH 至2.3,加水至1000 mL)- 乙腈(82∶18,V/V)为流动相A,以乙腈-水(50∶50,V/V)为流动相B,梯度洗脱(程序见表3);流速:1.0 mL/min;柱温:40 ℃;检测波长:214 nm;进样量:20 μL。
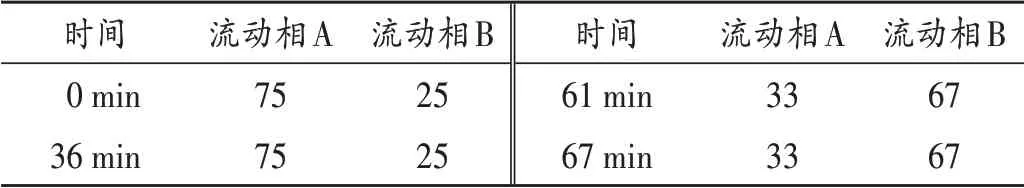
表3 梯度洗脱程序(%)Tab.3 Gradient elution procedure(%)
2.2.2 溶液制备
系统适用性试验溶液:取重组人胰岛素标准品,加0.01 mol/L 盐酸溶液溶解,稀释成每1 mL 含1 mg 的溶液,室温放置至少24 h。
供试品溶液:取重组人胰岛素注射液,每1 mL中加9.6 mol/L盐酸溶液3 μL,即得(相当于人胰岛素70 μg)。
2.2.3 系统适用性试验
取2.2.2 项下系统适用性试验溶液,按2.2.1 项下色谱条件进样测定,调节流动相比例使重组人胰岛素主峰的保留时间约为25 min,重组人胰岛素峰和A21脱氨人胰岛素峰(与重组人胰岛素峰的相对保留时间约为1.3)的分离度不小于1.8,拖尾因子不大于1.8。另取2.2.2 项下供试品溶液,按2.2.1 项下色谱条件进样测定,记录色谱图,除去苯酚峰或间甲基苯酚峰,按峰面积归一化法计算A21脱氨人胰岛素含量。色谱图见图2。
2.3 样品含量测定
对不同批次的样品蛋白进行isoAsp与A21脱氨人胰岛素含量测定,结果见表4。

表4 isoAsp和A21脱氨人胰岛素含量测定结果Tab.4 Results of content determination of isoAsp and A21 desamido human insulin
3 讨论
随着生物技术药物在我国的发展,蛋白药物的质量控制越来越严格,脱酰胺化越来越受到关注[1],关于蛋白药物中isoAsp的研究越来越多[8-10]。isoAsp的产生是动态变化的过程[11-14],建立准确、定量的检测方法非常必要。
本研究中应用IsoQuant®定量试剂盒中的PIMT 催化SAM 上的甲基移至样品蛋白中isoAsp 的羧基上,而SAM 转变为SAH[1],反应中SAM,SAH,isoAsp 的摩尔比为1∶1∶1,即可通过测定SAH 而测定蛋白中isoAsp。为保证结果的准确性,需特别注意溶液配制、酶反应操作过程的精确度。重组人胰岛素注射液和isoAsp -DSIP 质控对照溶液中SAH 含量均在5~100 pmol 线性范围内;加入isoAsp - DSIP 质控对照溶液(浓度为3.84 μmol/ L,理 论 值 为25.63 pmol),其 平 均 值 为27.80 pmo(l+8.5%),符合要求(±10%)。本研究中所建立的方法操作简便、测定快速、检测有效、结果准确。
曾对重组人胰岛素对照品中的isoAsp进行测定,结果未检测到。可能原因是对照品为粉末,在-18 ℃温度下于棕色瓶中保存,脱酰胺化不易发生;重组人胰岛素注射液中检测到isoAsp,样品为液体,且保存条件通常为2~8 ℃,易发生脱酰胺化。由表4 可知,2 批重组人胰岛素注射液蛋白中isoAsp 含量测定结果高于药典方法测得A21脱氨人胰岛素含量,表明重组人胰岛素注射液中发生脱酰胺的位点除Asn21 外,还存在其他位点[15],该结果是对制剂中蛋白脱酰胺化程度的整体评价。isoAsp不同于脱氨人胰岛素,现行法定检验方法有关物质A21脱氨人胰岛素不能真实反映重组人胰岛素注射液中蛋白的脱酰胺化程度,更不能表达isoAsp的情况。
综上所述,所建立的方法能较全面地反映重组人胰岛素注射液中胰岛素蛋白脱酰胺化后产生isoAsp 的含量,可作为法定标准中杂质A21脱氨人胰岛素检验的补充,以更好地控制其质量。
