苦参碱与氧化苦参碱的常压与减压提取工艺对比研究
2022-05-16张冰玉李金金
韩 飞,张冰玉,李 贤,李金金
(1.杨凌职业技术学院,陕西杨凌 712100;2.西北农林科技大学,陕西杨凌 712100)
苦参类生物碱广泛存在于苦参、苦豆子及广豆根等豆科植物中[1-2]。这类生物碱表现出广泛而优良的生物活性如抗病毒[3]、抗肿瘤[4]、抗炎[5]、镇痛等[6]。此外,还对心、肝、肺、肾、脑、血管等具有一定的保护作用。因此上述富含苦参碱的植物多为我国长期使用的中药资源。
近年来,随着对农产品中农药残留量限制的加压以及对抗生素使用的管控加强,人们对于新型、高效环保的农药的需求日益增加[7]。中药以其广泛的生物活性和相对较低的毒性,逐渐引起人们的重视。近些年出现了很多关于中药活性成分作为农药的研究[8-9]。苦参碱对植物和动物害虫均表现出显著的毒杀作用[10-11],还能抑制多种影响作物生长的真菌或细菌[12-13]。此外,苦参类生物碱也显现出植物的生长调节活性[14-15]。因此,含有苦参的中药具有直接开发为农药或兽药的价值。
在苦参类生物碱中,具有显著药理活性的分子是苦参碱和氧化苦参碱。这两种物质的作用与功效大致相同。但是,相比氧化苦参碱,苦参碱具有毒性,使得苦参直接作为药物使用会存在一定的安全隐患,从而限制苦参类药物的推广应用。苦参碱和氧化苦参碱存在着可以相互转化的化学反应[16],因此通过适当控制条件,使高毒性的苦参碱转变为毒性更低的氧化苦参碱。
综上所述,本研究以中药苦参饮片作为原材料,在常压和减压两种方式下,通过改变提取条件来对比两种不同方法的提取效果,以期发现合适的提取工艺,使得苦参碱与氧化苦参碱的提取率高,而且使其保持一定的比例,降低毒性,从而提高苦参类药物的临床使用价值。
1 材料与方法
1.1 材料
1.1.1 提取材料 苦参饮片(来自豆科植物苦参的干燥根[17],批号:20210101),宝鸡向源中药饮片有限责任公司产品。
1.1.2 主要试剂 苦参碱标准品(编号MUST-13021904),氧化苦参碱标准品(编号MUST-13021902),成都曼斯特生物有限公司产品;无水乙醇、乙腈均为色谱纯,氯仿、磷酸均为分析纯,购自杨凌天成化玻仪器有限公司;实验用纯水由实验室自制[18]。
1.1.3 主要仪器 高效液相色谱仪(LC-10AT),日本岛津公司产品;pH计(pHS-3C),上海日岛科学仪器有限公司产品;1/10万电子分析天平(AE24),瑞士梅特勒-托利多公司产品。
1.2 方法
1.2.1 对照品溶液的配制 准确称量0.528 mg的苦参碱和1.523 mg的氧化苦参碱,分别转移入10 mL棕色容量瓶中,并加入乙腈-无水乙醇进行溶解稀释、定容、摇匀,配制成苦参碱和氧化苦参碱对照品溶液。
1.2.2 供试品溶液的配制 精确量取10 mL提取液并转移入锥形瓶中,加入适量氨水调节其pH 9~10。用6×20 mL的氯仿对上述溶液进行萃取。合并氯仿相,减压蒸除溶剂,残余物加入适量无水乙醇进行溶解,并转移入 25 mL容量瓶中定容、摇匀,得到供试品溶液。
1.2.3 色谱条件 采用高效液相色谱法测定提取液中苦参碱和氧化苦参碱的含量。色谱柱:Kromasil NH2柱(4.6 mm×250 mm,5 μm);流动相:乙腈-无水乙醇-3%磷酸80∶10∶10;检测波长:220 nm;流动速度:1 mL/min;柱温:30℃;进样量:10 μL。
2 结果
2.1 色谱方法性试验结果
2.1.1 苦参碱与氧化苦参碱标准品谱图 图1和图2是苦参碱与氧化苦参碱标准品的色谱图。从图中可以看出,苦参碱和氧化苦参碱的的保留时间分别为5.875 min和8.848 min。因此,在一定的色谱条件下,确定了苦参碱和氧化苦参碱的在液相色谱仪上的出峰位置,从而能够进一步对提取的苦参碱和氧化苦参碱进行定性或定量分析。

5.875:苦参碱的保留时间5.875:Retention time of matrine
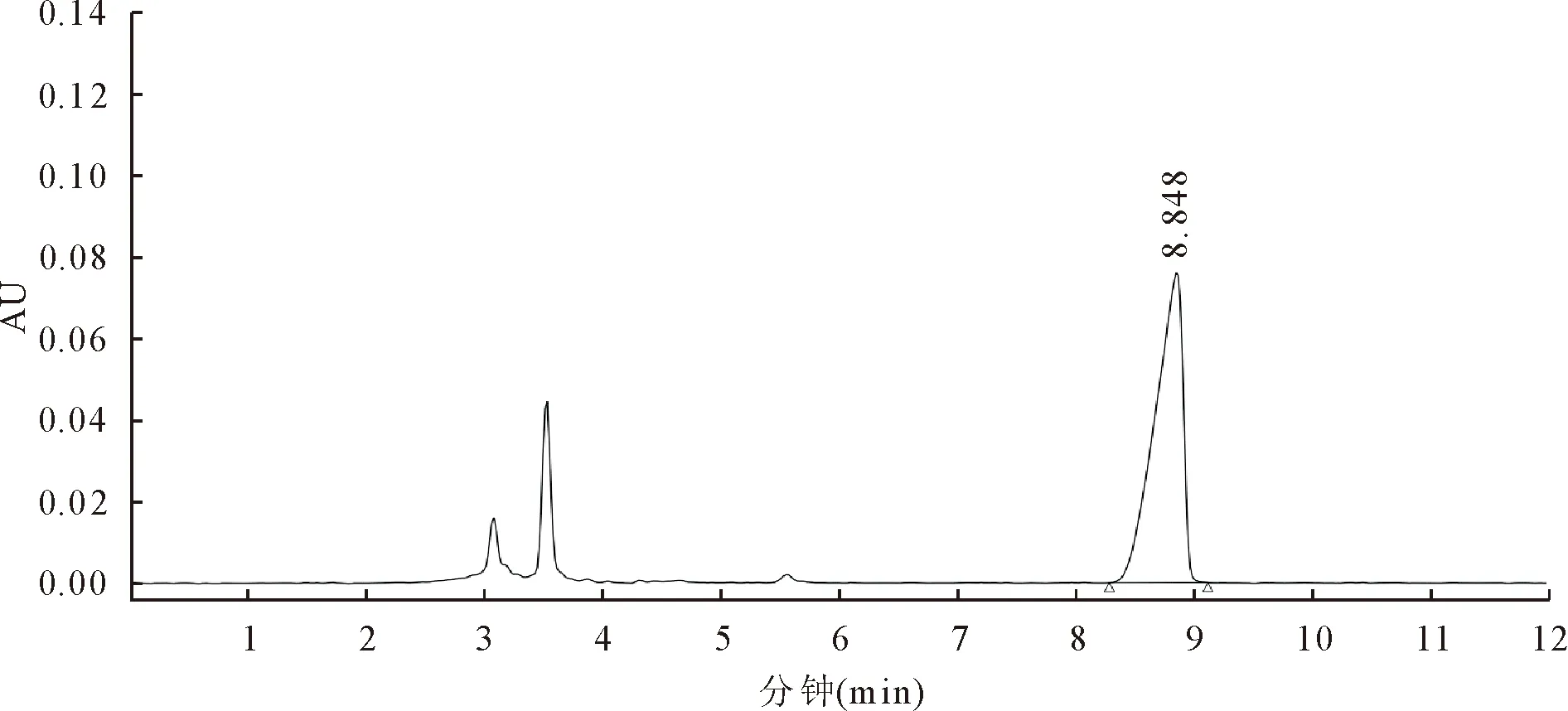
8.848:氧化苦参碱的保留时间8.848:Retention time of and Oxymatrine
2.1.2 线性关系 准确量取对照品溶液,并分别倒入容量为2 L、4 L、6 L、8 L、16 L、20 L的量杯中,随后按照色谱条件进行测定。以横坐标为进样量,纵坐标为峰面积,建立了两个对照品的回归方程,分别为y=6.976 105x-3 028.1(R2=0.999 8),y=7.353 105x-7 315.3(R2=0.999 8),线性范围分别为0.105 6 μg~1.056 μg与0.304 6 μg~3.046 μg之间。
2.1.3 精密度试验 选用对照品溶液,继续在色谱条件下进行6次连续测定,得出两种对照品溶液的计算峰值面积分别为1.1%和2.6%,说明测量仪器精密度非常优良。
2.1.4 稳定性试验 选择同样等量的供试品分别记录不同时间段的测量结果,记录的时间为0 h、2 h、4 h、6 h、8 h、10 h,然后计算在这些时间下苦参碱和氧化苦参碱的峰面积分别为2.1%和2.4%,得出最佳的时间为12 h。
2.1.5 重复性试验 量取6份同一提取条件的提取液,参照2.1.2的方法制备供试品提取液,按2.1.3的条件进行测定。最终测得供试品溶液中的苦参碱与氧化苦参碱的峰值面积分别为2.5%和2.7%,表明这种试验方式的重复性良好。
2.1.6 加样回收试验 量取6份5.0 mL的已知含量的提取液,并依次加入11.76 mL的苦参碱和9.06 mL的氧化苦参碱,继续按2.1.2的制备方式制备供试品溶液,并在色谱条件下计算出苦参碱平均回收率为97.63%、面积为2.2%,氧化苦参碱的平均回收率为98.12%、面积为2.4%,说明这种方法具有科学性。
2.2 常压提取工艺的分析与优化
称取34份10 g苦参饮片,在常压和减压条件下,设置不同的时间、温度、次数、溶剂用量对其进行提取,并结合液相色谱对不同提取液中苦参碱与氧化苦参碱的含量进行分析,以考察上述因素对提取效果的影响。提取效果的指标通过提取液中苦参总碱含量(苦参碱与氧化苦参碱的总量),各自的含量以及综合评分来体现,权重系数为0.5。根据前期的研究结果发现,最佳提取溶剂为水。
2.2.1 单因素考察
(1)提取时间:将提取温度设置成恒温60℃,水料比10∶1,共提取两次,然后将提取时间分别设置成0.5 h、1 h、1.5 h、2 h。试验结果如下:苦参总碱质量分数分别为0.81% (0.5 h)、0.99% (1 h)、1.09% (1.5 h)、1.06% (2 h);苦参碱与氧化苦参碱各自的含量分别为0.72%和0.09%(0.5 h)、0.9%和0.09% (1 h)、0.97%和0.12%(1.5 h)、0.93%和0.13%(2 h)。综合上述两组数据,得出各个温度下的综合评分为0.76 (0.5 h)、0.95 (1 h)、0.92 (1.5 h)、0.84 (2 h)。因此最终确定最佳提取时间为1 h。
(2)提取温度:将提取时间固定为1 h,水料比与提取次数不变。然后将提取温度分别设置成50℃、60℃、70℃、80℃、90℃、100℃进行提取试验与含量的测定。得出的结果分别为:50℃时苦参总碱含量0.89%,各自含量为0.79%和0.1%,综合评分0.89;60℃时苦参碱与氧化苦参碱总质量分数为0.99%,各自含量为0.88%和0.11%,综合评分为0.94;70℃时总质量分数为1.04%、苦参碱和氧化苦参碱含量分别为0.93%和0.11%,综合评分为1.00;80℃的苦参总碱质量分数为0.91%,各自含量为0.78%和0.13%,综合评分为0.79;90℃苦参总碱总质量分数为0.87%,各自含量为0.73%和0.14%,综合评分0.73;100℃总质量分数为0.74%,苦参碱与氧化苦参碱的含量为0.52%和0.22%,综合评分为0.5。综合比较,发现70℃比60℃的评分略高,但是综合实际工艺成本考虑,选择60℃作为最佳提取温度。
(3)提取次数:将提取温度、提取时间、料液比分别固定为60℃、1 h、10∶1,以考察提取次数对提取效果的影响。结果显示,提取1次的总碱含量、苦参碱与氧化苦参碱的含量分别为0.74%、0.68%和0.06%,综合评分为0.85;提取2次的总碱含量、苦参碱和氧化苦参碱各自含量分别为1.01%、0.92%和0.09%,综合评分为0.93;提取3次的含量分别为1.05%、0.95%和0.1%,综合评分为0.87。以上结果表明,提取2次和3次效果差别不大。综合实际工艺成本考虑,发现提取2次为最佳条件。
(4)水料比:本试验所用提取溶剂为水,因此通过水与提取的苦参饮片原材料用量的比值体现溶剂的使用量。结果表明,当提取温度均为60℃、提取时间均为1 h、提取次数都是2次时,水料比为 8∶1的提取处理中,苦参碱与氧化苦参碱的总质量分数为0.97%,各自的含量分别为0.08%和0.89%,综合评分为0.97;水料比为10∶1处理的苦参总碱含量为1.03%、苦参碱和氧化苦参碱的含量分别为0.95%和0.08%,综合评分为0.99;12∶1 的苦参总碱质量分数为1.04%,各自的含量为0.93%和0.1%,综合评分为0.87;14∶1的苦参碱与氧化苦参碱的总质量分数为1.03%、各自含量为0.92%和0.11%,综合评分为0.87。综合各评分,以及实际工艺的可行性和合理性,发现水料比8∶1时就能达到最佳的提取效果。
2.2.2 正交试验优化 经过单因素试验,发现最佳提取温度为60℃。将提取时间、次数、水料比作为考察因素,对提取工艺进行正交试验优化。提取效果的指标为苦参碱与氧化苦参碱的总质量分数、比值以及综合评分。
称取18份10 g苦参饮片进行试验,得出结果如表1,方差分析见表2。从试验表格中可以发现最能影响常压工艺提取效果的是提取次数,其次为提取时间,最后为溶剂用量。最佳组合方案为A1B1C3,但C对试验结果有显著影响,其他因素不明显,因此,综合实际生产情况A2B1C3更符合现实,为常压提取工艺的最佳方案,即加8倍水提取3次,每次1 h,分别将3份约为10 g的苦参饮片进行验证,得出的苦参总碱质量分数分别为1.19%、1.17%、1.20%,苦参碱和氧化苦参碱的含量分别为0.84%和0.35%、0.81%和0.36%、0.84%和0.36%。
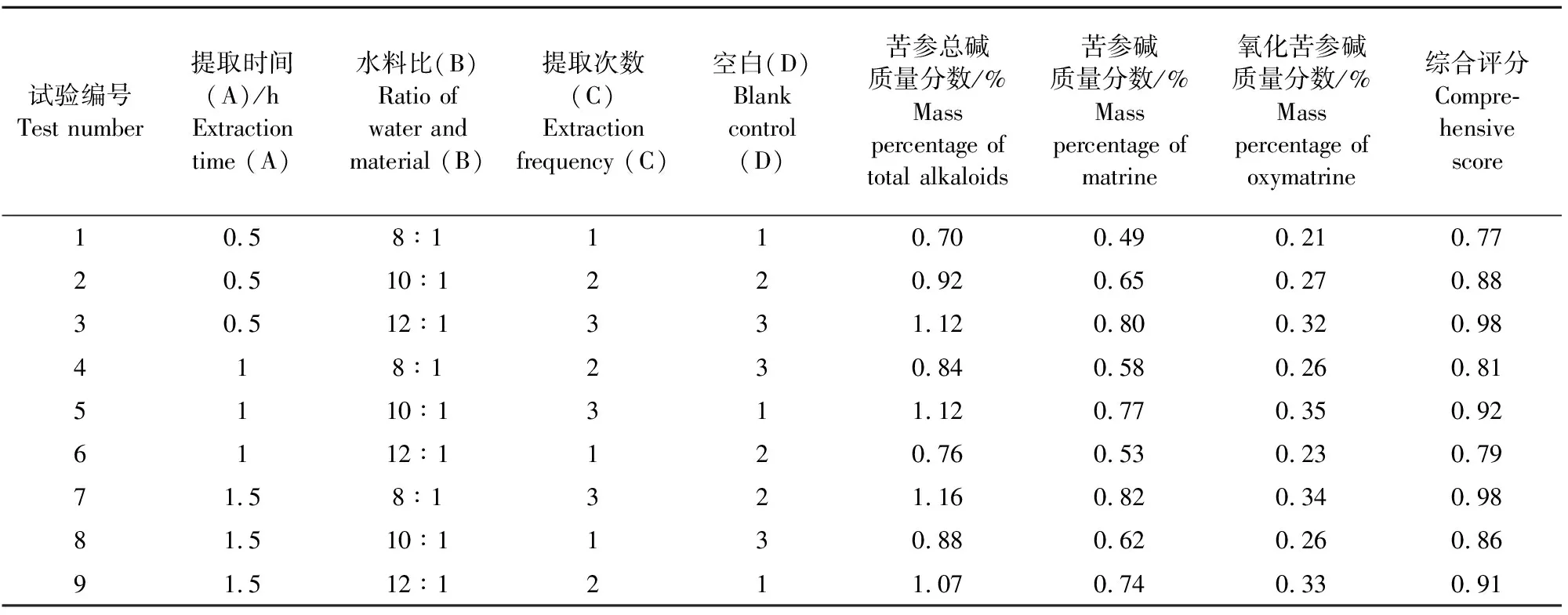
表1 苦参常压提取工艺正交试验安排及结果
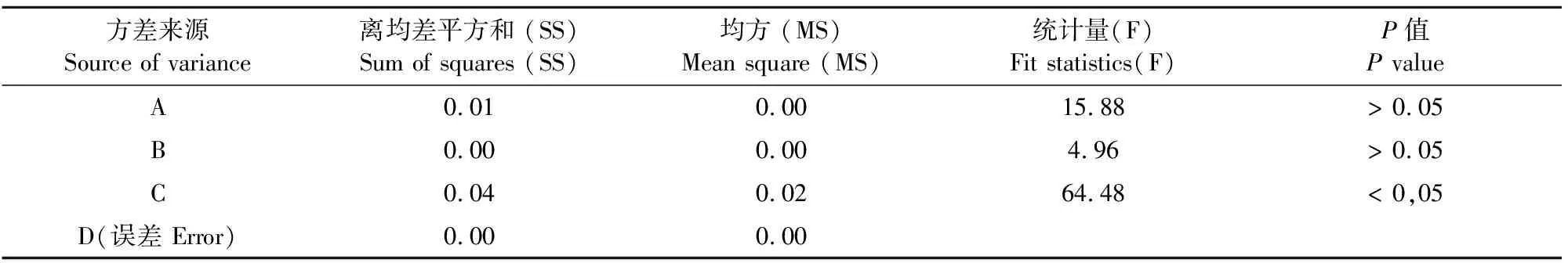
表2 常压提取工艺综合评分方差分析
2.2 减压提取工艺的分析与优化
取18份10 g的苦参饮片,按照上述同样的步骤进行单因素和正交提取试验。试验结果见表3,方差分析见表4。
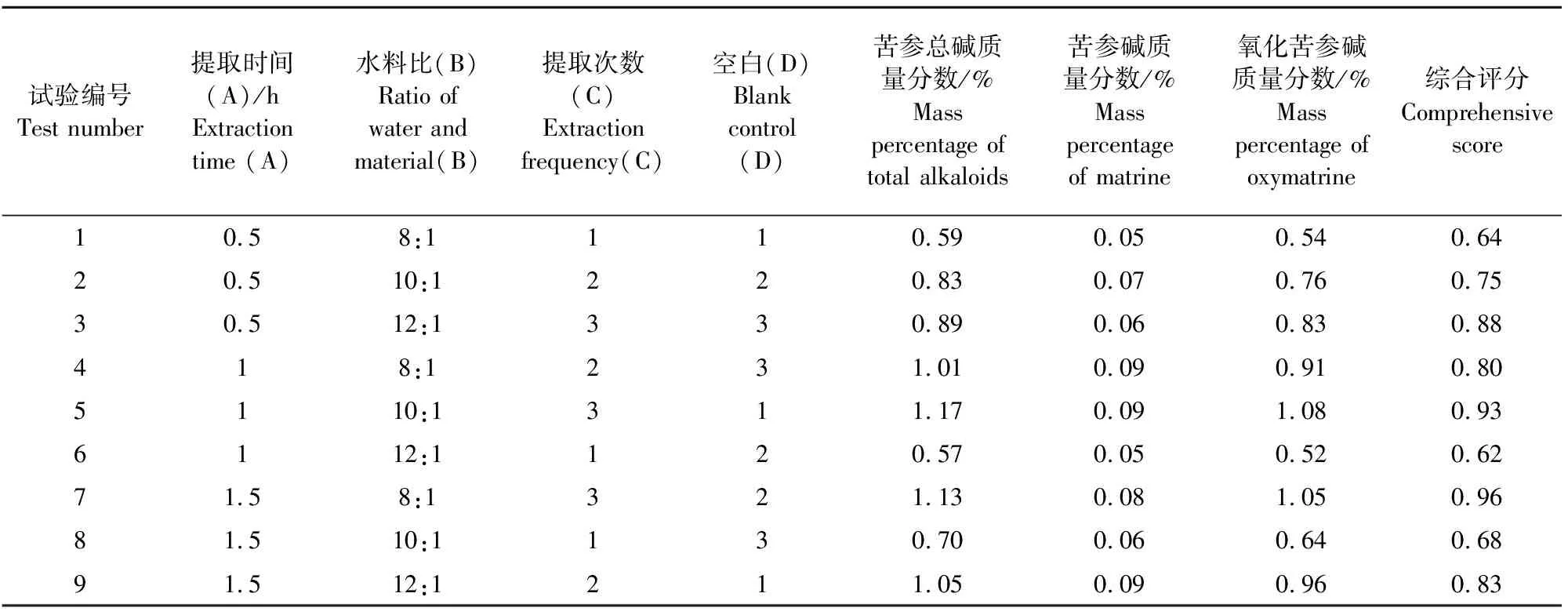
表3 苦参减压提取工艺正交试验安排及结果
从表中结果可以看出,影响因素排序与常压工艺一样,最佳组合也是A1B1C3,实际生产工艺最佳组合也是A2B1C3,即加8倍水于70℃减压提取3次,每次1 h。分别将3份约为10 g的苦参饮片按照以上工艺进行验证,得出的苦参碱与氧化苦参碱总质量分数分别为1.16%、1.20%、1.17%,苦参碱和氧化苦参碱的含量依次为0.09%和1.07%、0.08%和1.12%、0.09%和1.08%。
表4 减压提取工艺综合评分方差分析
3 讨论
经过对比后发现,常压法和减压法所得苦参碱的含量相近。这说明,常压法和减压法的提取能力是相同的。但是相比常压法,减压提取能够显著降低苦参碱的含量。张喻娟等[19]对苦豆子进行了常压与动态减压提取,也发现在减压条件下氧化苦参碱的含量明显高于苦参碱,并且认为减压-温度是提高氧化苦参碱含量的关键条件,即在减压存在下,高温限制了氧化苦参碱向苦参碱的转化。但是根据本研究的结果分析,也存在另一种可能,即减压和高温也会协同促进苦参碱向氧化苦参碱的转化。这也正是减压法苦参碱与氧化苦参碱的比值显著低于常压法的原因,以及确定减压提取工艺温度为70℃的必要性。总之,减压条件是提取工艺中控制活性成分的有效手段,值得围绕减压工艺进一步改进和优化,使其能够真正为获得目标药用成分提供理论指导和技术支撑。
苦参碱的提取工艺经历了水煎法[20]、乙醇提取法[21]、氯仿提取法[22]、酸水提取法[23]的演变。但是已有的研究表明,以上几种方法的提取能力和提取效果差别并不大[24]。综合考虑工艺的成本、可操作性、安全性以及提取效果等因素,最终选取水作为提取溶剂。此外,通过改变其他条件如提取温度、料液比、提取时间等,收到了较好的苦参类生物碱的提取效果,其含量达到甚至超过了已有的提取方法[25-26]。
4 结论
以水作为溶剂,通过对比试验,发现减压提取工艺能够显著提高弱毒性成分氧化苦参碱的含量。最佳提取工艺为:水料比8∶1,提取次数为3次,每次提取时间1 h,提取温度70℃。最佳苦参碱与氧化苦参碱的总质量分数及各自的含量为1.20%、0.08%和1.12%。以上提取工艺安全简便、结果稳定可靠、成本低,适合工业化生产,并且能够有效降低苦参类药物的毒性成分,增强其推广应用价值。
