低磷胁迫下黄瓜木质部与韧皮部汁液的代谢物变化
2022-05-16李青林张文涛徐慧孙京京
李青林,张文涛,徐慧,孙京京
低磷胁迫下黄瓜木质部与韧皮部汁液的代谢物变化
李青林*,张文涛,徐慧,孙京京
江苏大学农业工程学院,江苏镇江 212013
【背景】木质部汁液负责为地上部分运输水和营养物质,韧皮部汁液则主要负责光合产物的运输,在植株受到非生物胁迫时,它们会发生不同的变化。【目的】研究低磷胁迫下黄瓜木质部与韧皮部汁液内各种代谢物含量变化,探究黄瓜在低磷胁迫下的代谢变化规律,为黄瓜磷匮乏状态诊断提供新思路与依据。【方法】采集正常磷水平(1.25 mmol∙L-1)与低磷胁迫(0.3125 mmol∙L-1)下黄瓜植株的木质部与韧皮部汁液,经三甲基硅烷化衍生化处理后用气相色谱质谱联用技术(GC-MS)进行检测和定性定量分析。【结果】低磷胁迫下木质部汁液内糖类没有发生显著变化,多数氨基酸的含量与正常情况相比明显上升,有机酸中的苹果酸呈显著下降趋势,软脂酸、油酸等则显著高于正常水平;低磷胁迫下的韧皮部汁液中,糖类与氨基酸多数低于正常水平,草酸、琥珀酸等有机酸的含量也明显降低。此外,为筛选黄瓜木质部与韧皮部汁液内潜在的生物标志物,使用OPLS-DA与独立样本T检测方法对GC-MS试验数据进行进一步分析,结果表明,在黄瓜木质部汁液检出8种低磷胁迫下的潜在生物标志物(VIP>1,<0.05),分别为尸胺、苹果酸、四氨基丁酸、软脂酸、肌醇、纤维二糖、N, N-二甲基十二酰胺与单硬脂酸甘油酯;在黄瓜韧皮部汁液中检出7种低磷胁迫下的潜在生物标志物(VIP>1,<0.05),分别为丝氨酸、亚油酸、10, 13-环氧-11-甲基十八碳-10, 12-二烯酸、脱氢枞酸、N, N-二甲基十二酰胺、2, 2'-亚甲基双(6-叔丁基-4-甲基苯酚)、L-2-哌啶酸。【结论】低磷胁迫下,黄瓜的木质部与韧皮部汁液内的糖类、氨基酸和有机酸均发生了变化,但是变化趋势并不相同。分别在木质部和韧皮部汁液中筛选出8种和7种生物标志物,可为黄瓜磷匮乏状态诊断提供新思路与依据。生物标志物中,苹果酸、四氨基丁酸、软脂酸、丝氨酸与亚油酸的检测手段已经较为成熟,以其为检测对象的黄瓜磷匮乏状态诊断方法具有较好的实用性。
黄瓜;木质部;韧皮部;磷胁迫;代谢组学;生物标志物
0 引言
【研究意义】木质部与韧皮部汁液在植物养分和信号的传输与分配中起着关键作用[1],木质部汁液主要将根系吸收的水分和矿质养分从土壤输送到植物的地上部分,其中还含有许多其他有机化合物,包括羧酸盐、激素、氨基酸、肽和蛋白质[2];韧皮部汁液的主要作用是将光合产物从进行光合作用的源器官运输到库器官,其主要成分是糖,还有蛋白质、氨基酸、酰氨、维生素、无机盐和植物激素等[3]。研究低磷胁迫下植株木质部与韧皮部汁液内代谢物含量的变化规律,对加深植物在低磷胁迫下代谢变化规律的认识,探究新的植物磷匮乏检测手段具有重要意义。【前人研究进展】在受到非生物胁迫时,植株会调整代谢网络以保证植株正常生长发育[4],从而影响体内各种代谢物的含量。代谢组学可以通过对植株体内的各种小分子化合物进行定性定量分析,研究代谢物的变化规律[5],进而反映植物在非生物胁迫下的生理变化。同时,代谢组学分析能够发现在不同组间具有显著性差异的某种或若干种代谢物,即为生物标志物,其在生物体代谢过程和生理变化机制的研究中具有重要作用[6]。Sung等[7]通过对番茄叶片和根系在氮、磷或钾胁迫下的新陈代谢变化进行分析,发现这3种矿物质胁迫都会影响能量生产和氨基酸代谢。zhao等[8]通过高效液相色谱质谱分析低温下草菇的代谢变化,确定了216种潜在生物标志物,揭示了耐低温草菇菌株的耐低温机理。Zhang等[9]使用核磁共振波谱分析盐胁迫下烟草植株的代谢响应。对植株进行代谢组学研究,能探究植株在不同环境影响下的代谢变化规律。对生物标志物的含量进行测量,能在一定程度上反映植株的生理状态,为植株生长环境的调控提供指导。【本研究切入点】近年来传感器工艺不断发展,其在农业上也有所运用[10],借助微针传感器可以在低损伤的情况下对木质部或韧皮部汁液的某些生物特性参数进行测量,以黄瓜木质部或韧皮部汁液为检测对象的低损伤检测方法成为可能。但是现阶段针对黄瓜的代谢组学研究主要对象多为黄瓜的根部或叶片[11-13],针对黄瓜木质部与韧皮部汁液在非生物胁迫下的代谢变化规律和生物标志物的研究较少。【拟解决的关键问题】采用GC-MS技术对正常与低磷胁迫下黄瓜木质部和韧皮部汁液内的代谢物进行定性定量,分析低磷胁迫下汁液内糖类、氨基酸和有机酸含量的变化,并筛选出潜在生物标志物,旨在使用代谢组学技术加深对低磷胁迫下黄瓜木质部与韧皮部汁液内代谢物组分变化规律的认识,为通过木质部或韧皮部汁液进行黄瓜磷养分状态的诊断提供依据,为新的黄瓜磷匮乏状态检测方法提供方向,为黄瓜的精细化种植提供参考。
1 材料与方法
试验于2020年在江苏大学现代农业装备与技术教育部重点试验室玻璃温室进行。
1.1 试验材料与仪器
试验材料:黄瓜品种为‘津研四号’,种植期间温室温度范围为18—35℃,光照采用自然光照,种植期间标准光照下平均日照时间为5.13 h,平均日辐照量13.2 MJ∙m-2。
试验仪器与设备:GCMS-QP2010气相色谱质谱分析仪(日本岛津公司);HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm,美国安捷伦公司);超声洗浴仪(上海科导公司);台式高速冷冻离心机(Neofuge 18R,力康生物医疗科技控股有限公司);FreeZone12Plus冷冻干燥机(北京中科科尔仪器有限公司);DH-101-2BY电热鼓风干燥箱(天津中环电炉股份有限公司)。
1.2 样本培育
采用镇江培蕾基质科技发展有限公司的植物培养基进行育苗,待黄瓜苗生长到3片真叶时进行移栽工作,移栽后采用无土栽培方式进行样本培育,基质为2—4 mm珍珠岩,使用霍格兰配方营养液进行浇灌,营养液的组成成分:A溶液(Ca(NO3)2·4H2O 945 mg∙L-1、KNO379 mg∙L-1、NH4NO340 mg∙L-1、Fe-EDTA (13.1%) 7 mg∙L-1);B溶液(KNO3604 mg∙L-1、KH2PO4170 mg∙L-1、MgSO4·7H2O 339 mg∙L-1、MnSO4∙4H2O 1.7 mg∙L-1、ZnSO4·7H2O 1.45 mg∙L-1、Na2B4O7·10H2O 2.45 mg∙L-1、CuSO4·5H2O 0.19 mg∙L-1、Na2MoO4·2H2O 0.12 mg∙L-1),将A、B两溶液等量混合进行浇灌,营养液的补充时间为每天早上7:00—8:00。总黄瓜培育数为60株,当黄瓜生长到七叶一心时,选取长势基本一致的12株黄瓜幼苗(株高、茎粗上下偏差在20%以内),并将其分为试验组(6株)与对照组(6株)。对试验组进行低磷胁迫处理,缺磷处理下黄瓜试验组的营养液中磷含量为正常水平的25%,实施方式是将B溶液中的KH2PO4降低至42.5mg∙L-1,并使用63.75mg∙L-1的K2SO4保证K+浓度正常,对照组不做任何处理,按照原营养液配方进行培育。
1.3 黄瓜木质部与韧皮部汁液取样
每周对黄瓜植株的株高和离地3 cm处的茎粗进行测量,确定黄瓜植株每周的株高和茎粗增长量,测量结果见表1,可以看出在低磷胁迫的第一周,植株株高和茎粗的增长就已有所放缓,但是并没有显著性差异。在第二周内,植株的株高和茎粗增长量均与正常处理植株有显著区别,证实了两周的低磷胁迫会导致黄瓜植株的性状与正常状态产生差异[14],表明黄瓜的生理代谢已经产生了明显变化,此时的检测结果更为可靠,更能反映黄瓜木质部与韧皮部汁液内代谢物在低磷胁迫下的含量变化规律,因此,本研究在低磷胁迫的14 d后进行取样。取样时,将植株茎秆切断,从近地段切口取得汁液为木质部汁液[15];从另一端切口取得的为韧皮部汁液[16]。

表1 不同磷处理下黄瓜植株的表型参数每周变化量
同列不同小写字母表示差异显著(<0.05)Different lowercase letters in the same column indicate significant differences (<0.05)
使用消毒后的锋利刀片,在离地3—5 cm处切断黄瓜茎秆,使用去离子水清洗两端创伤面,再使用消毒后的脱脂棉吸干水分,弃去第一滴后开始分别从两端切口收集木质部与韧皮部汁液。收集到的汁液放于样本管中,置于液氮暂存。每株黄瓜取得木质部汁液样本与韧皮部汁液样本各1个,取样量为100—300 μL,共取得样本24个(表2)。
1.4 样本三甲基化衍生化处理
每例样本30 μL,加入170 μL去离子水,800 μL甲醇乙腈(1﹕1,v/v),53 KHz冰浴超声1 h, -20℃孵育1 h沉淀蛋白,14 000×4℃离心20 min,取上清液400 μL,加入60 μL核糖醇(0.2 mg∙mL-1)作为内参代谢物,涡旋10 s,然后进行真空冷冻干燥,得到干燥提取物;往干燥后的样本中加入80 μL的15 mg∙mL-1甲氧胺吡啶溶液复溶,涡旋振荡30 s。使用恒温箱37℃反应90 min然后快速加入80 μL的BSTFA试剂(含1% TMCS);使用恒温箱70℃反应60 min,取出后等待测定。
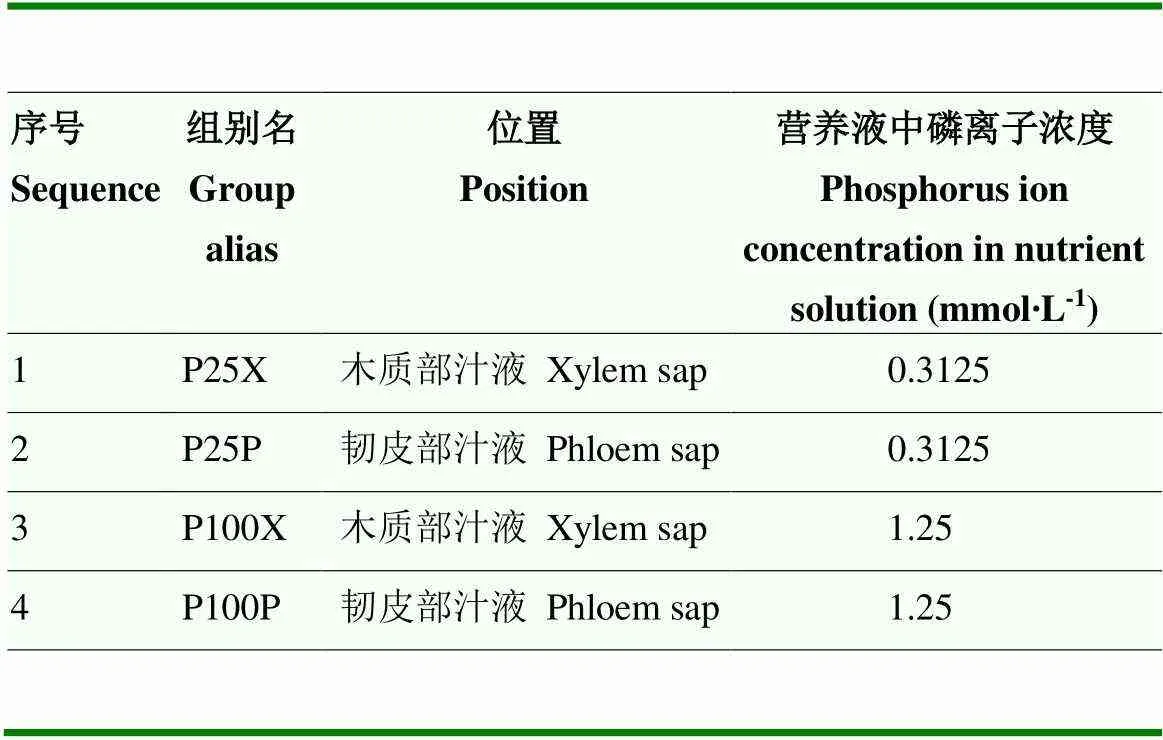
表2 黄瓜分组表
组别名中,第一个英文字母“P”代表试验方法为磷胁迫,中间的数字“25”“100”分别代表磷含量为25%与100%,最后的字母“X”与“P”分别为木质部和韧皮部的英文首字母(Xylem,Phloem)。下同
n the group aliases, the first English letter “P” represents that the test method is phosphorus stress, the numbers “25” and “100” in the middle represent the phosphorus content of 25% and 100%, respectively, and the last letters “X” and “P” are the English initials of xylem and phloem, respectively.The same as below
1.5 GC-MS分析
使用岛津GCMS-QP2010气相色谱质谱分析仪对前处理后的样本进行检测。
色谱条件:进样量:1 μL;载气:氦气;前进样口吹扫流速:3 mL·min-1;流速:1 mL·min-1;柱温:初始温度90℃保持15 s,以10℃·min-1升至180℃,再以5℃·min-1升至240℃,再以20℃·min-1继续升至285℃保持11.5 min。
质谱条件:前进样口温度:280℃;传输线温度:245℃;离子源温度:220℃;电离电压:-70 eV;扫描方式:20—600 m/z(全扫描);扫描速度:100 spectra/s;溶剂延迟:480 s。
1.6 数据处理与分析
1.6.1 代谢物的定性定量 使用岛津仪器的GCMS Real Time Analysis软件,结合NIST数据库确定检出代谢物名称,根据核糖醇内标物的浓度,使用内标标准化法确定每种代谢物的浓度。
1.6.2 代谢物的PCA分析 PCA是多元统计分析中最常见的无监督模式的数据分析方法,能将大量相关变量通过线性变换转化为一组最能代表数据特征的不相关的变量,展示数据组内的重复性和组间的差异性,评估数据的可重复性,发现异常值,提高数据精准度[17]。本研究使用PCA判断低磷胁迫下黄瓜木质部与韧皮部汁液内代谢物含量是否发生了明显变化。
1.6.3 糖、氨基酸和有机酸含量分析 糖、氨基酸和有机酸都是植物正常生长发育必不可缺的营养成分,糖为植物的生长发育储备和提供能量[18];氨基酸参与植物体内各种生理代谢活动,增强植株抗逆性[19];有机酸同样涉及到抗逆性等生理代谢反应[20]。为了解植株在磷匮乏时的生理反应,将黄瓜木质部与韧皮部汁液在正常与低磷胁迫下的糖、氨基酸和有机酸的含量进行对比,分析是否有显著性差异。
1.6.4 潜在生物标志物筛选 使用正交偏最小二乘法(OPLS-DA)和独立样本t检测对数据进行处理并筛选潜在生物标志物。OPLS-DA能选择区分各组的特征变量,确定样本间的关系,建立代谢物表达量与分组关系之间的模型,获取组间差异信息,预测样品分组[21]。独立样本t检测用于分析定性数据与定量数据之间的关系,可检验数据间的差异[22]。将OPLS-DA与独立样本T检测相结合,是常见的生物标志物筛选方式[23]。
2 结果
2.1 木质部与韧皮部汁液的主成分分析
图1分别为使用SIMCA-P软件(14.1版,瑞典)得到的低磷胁迫与正常处理黄瓜木质部汁液和韧皮部汁液内代谢物的PCA得分图,图1-A是木质部汁液的PCA分析,此时第一和第二主成分的解释率分别为33.0%和19.7%;图1-B是韧皮部汁液的PCA分析,第一和第二主成分的解释率分别为37.0%和17.2%。根据样本在PCA得分图上的分布来看,木质部和韧皮部汁液中的低磷组和正常磷组被明显区分,说明磷胁迫下,黄瓜木质部汁液和韧皮部汁液内各种代谢物的含量变化明显。
2.2 磷胁迫对黄瓜木质部与韧皮部汁液内糖、氨基酸和有机酸含量的影响
2.2.1 对糖组分含量的影响 图2为低磷胁迫下木质部与韧皮部汁液内糖分的变化。其中,木质部汁液内检出蔗糖、果糖、葡萄糖、山梨醇共4种糖类;韧皮部汁液中,除了同样能检出木质部中的4种糖类外,还检出海藻糖。在韧皮部汁液中,糖组分的含量普遍高于木质部汁液,这符合木质部与韧皮部汁液分别运输根系合成物与叶片合成物的功能特性。低磷胁迫下,木质部汁液内的各种糖类均高于正常磷供应情况,平均提升15%以上,但在统计学上,木质部汁液内的各种糖类含量均未发生显著变化。低磷胁迫下韧皮部汁液中不同糖组分的变化趋势则略有不同,其中蔗糖、海藻糖和山梨醇的含量显著降低(< 0.05),分别是正常水平的72.3%、52.1%和50.6%,葡萄糖和果糖的含量虽然有所升高,但未达到显著性差异水平。

图1 木质部(A)与韧皮部(B)汁液的PCA得分图

不同小写字母表示差异显著(P<0.05)。下同Different lowercase letters mean significant difference (P<0.05).The same as below
2.2.2 对氨基酸含量的影响 木质部汁液中主要检出谷氨酸、甘氨酸等9种氨基酸,韧皮部共检出14种氨基酸,比木质部汁液多检出鸟氨酸、脯氨酸等(图3)。低磷胁迫的木质部汁液中,缬氨酸的含量显著低于正常水平(<0.05),仅为正常状态的43.5%;而半胱氨酸、谷氨酸、苏氨酸、天冬氨酸、赖氨酸则显著高于正常状态(<0.05),分别是正常水平的165.3%、146.4%、200.5%、122.6%和137.4%。低磷处理下韧皮部汁液检出的氨基酸中,仅鸟氨酸的含量显著高于正常水平(<0.05),而苏氨酸、甘氨酸、丝氨酸、丙氨酸、脯氨酸、缬氨酸、谷氨酸和瓜氨酸均显著低于正常状态(<0.05),分别是正常水平的83.0%、80.7%、59.3%、61.8%、83.1%、79.0%、59.0%和73.9%。

图3 低磷胁迫下木质部与韧皮部汁液内氨基酸含量的变化
2.2.3 对常见有机酸含量的影响 木质部与韧皮部汁液内的有机酸种类有一定差别(图4)。低磷胁迫下的木质部汁液中,苹果酸的含量显著低于正常水平(<0.05),仅为正常状态的38.2%,而乳酸、软脂酸、油酸、肉豆蔻酸、四氨基丁酸、苏糖酸的含量则显著高于正常水平(<0.05),分别为正常水平的128.8%、108.0%、143.5%、111.8%、159.3%和172.5%。低磷胁迫的韧皮部汁液中,草酸、琥珀酸、亚油酸、肉豆蔻酸、四氨基丁酸、苏糖酸和丙二酸的含量与正常水平相比有显著降低(<0.05),分别为正常水平的79.4%、72.1%、55.2%、87.3%、64.3%、67.3%和57.8%,未发现显著高于正常水平的有机酸。
2.3 木质部与韧皮部汁液内代谢物的潜在生物标志物筛选
2.3.1 汁液内代谢物的OPLS-DA分析 对木质部与韧皮部汁液内代谢物进行OPLS-DA分析,得到OPLS- DA得分图(图5-A、B)。在OPLS-DA中,R2Y和Q2为模型的评价指标,R2Y和Q2均大于0.5,说明模型效果较好。对于木质部汁液,R2Y=0.992,Q2= 83.2%;对于韧皮部汁液,R2Y=1,Q2=97.8%,说明OPLS-DA得到的模型良好。

图4 低磷胁迫下木质部与韧皮部汁液内有机酸含量的变化
使用OPLS-DA模型生成木质部与韧皮部汁液代谢物的S-plot图(图5-C、D)。S-plot图能同时体现每个变量与模型某一成分之间的协变性和相关性,它们分别代表变量对模型的贡献大小和变量的权重系数,可以用于筛选有意义的变量。S-plot图中S型曲线上的每一个点代表一个代谢物,点与原点的距离越大,对分类的贡献就越大,越靠近左下角和右上角的代谢物对样品的分类贡献越大,可以用变量权重重要性排序值(VIP)评价变量的贡献大小,VIP>1即认为此代谢物有较大贡献。
为了防止模型过度拟合,使用200次置换检验验证模型(图5-E、F),置换检验要求Q2的回归截距小于0.05,图中木质部汁液中Q2的回归截距为-0.77,韧皮部汁液中为-1.16,均低于0.05,说明两个模型均可靠,不存在过拟合情况。
2.3.2 木质部与韧皮部汁液的独立样本t检测和潜在生物标志物筛选 结合OPLS-DA的VIP值与独立样本t检测的值,按照VIP>1且<0.05的要求筛选磷胁迫下木质部与韧皮部汁液的代谢物,最终分别筛选出8种和7种代谢物。木质部汁液筛选出的8种代谢物(VIP>1,<0.05)分别为尸胺、苹果酸、四氨基丁酸、软脂酸、肌醇、纤维二糖、N, N-二甲基十二酰胺与单硬脂酸甘油酯(图6)。韧皮部汁液筛选出的7种代谢物(VIP>1,<0.05)分别为丝氨酸、亚油酸、10, 13-环氧-11-甲基十八碳-10, 12-二烯酸、脱氢枞酸、N, N-二甲基十二酰胺、2, 2'-亚甲基双(6-叔丁基-4-甲基苯酚)、L-2-哌啶酸(图7)。这些符合条件的代谢物均在低磷与正常处理两组样本的分离中发挥了重要作用,被认为是低磷胁迫下黄瓜木质部与韧皮部汁液内的潜在生物标志物。
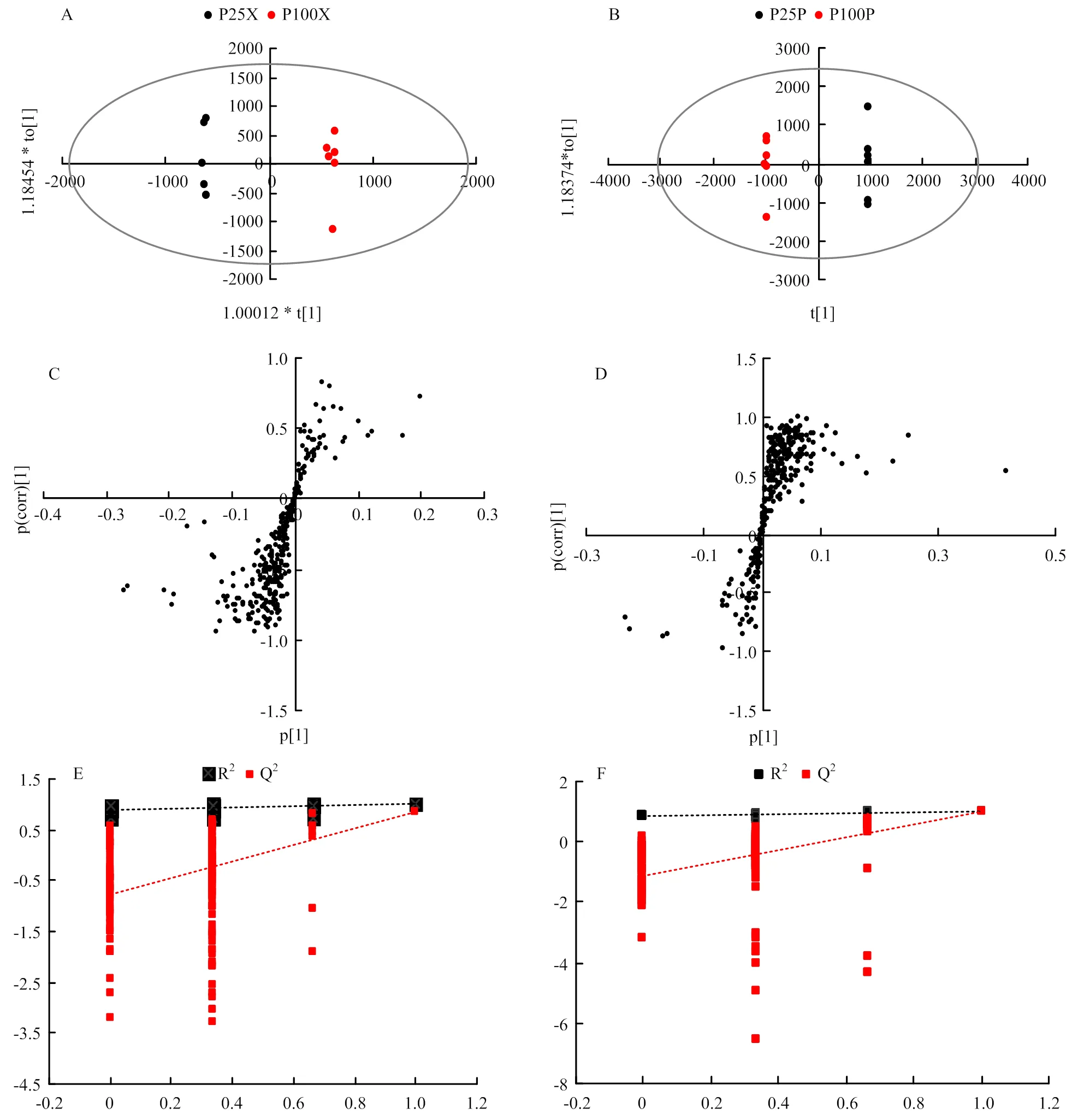
图5 木质部与韧皮部汁液的OPLS-DA得分图(木质部A、韧皮部B),S-plot图(木质部C、韧皮部D),200次置换检验结果(木质部E、韧皮部F)
3 讨论
3.1 磷胁迫影响黄瓜中糖、氨基酸和有机酸代谢
黄瓜在低磷情况下会对代谢进行适当调整,以保证黄瓜正常生长。根据低磷胁迫下黄瓜木质部与韧皮部汁液内糖分变化,可以看出低磷胁迫阻碍了植株地上组织内蔗糖、海藻糖和山梨醇的合成,导致向根部供应的养分大量减少。根据低磷胁迫下黄瓜木质部与韧皮部汁液内氨基酸的变化,可以看出黄瓜韧皮部汁液中多种氨基酸的含量均减小,说明低磷胁迫同样抑制植株地上组织的氨基酸合成。与此同时,植株根系增加了多种氨基酸的合成以抵抗外界胁迫对正常生长代谢的干扰,并对地上部分氨基酸合成量的减少进行补偿,比如大量生产谷氨酸以增加对磷的吸收效率,大量生产苏氨酸增加对不利条件的耐受性。根据低磷胁迫下黄瓜木质部与韧皮部汁液内有机酸的变化,可以看出低磷胁迫影响各种有机酸的合成,特别是四氨基丁酸、苏糖酸、肉豆蔻酸,它们在低磷胁迫下的木质部和韧皮部汁液中的含量均与正常水平有显著性差异,但是变化趋势并不相同,这可能与植株不同部位应对磷胁迫时的反应机理不同有关。
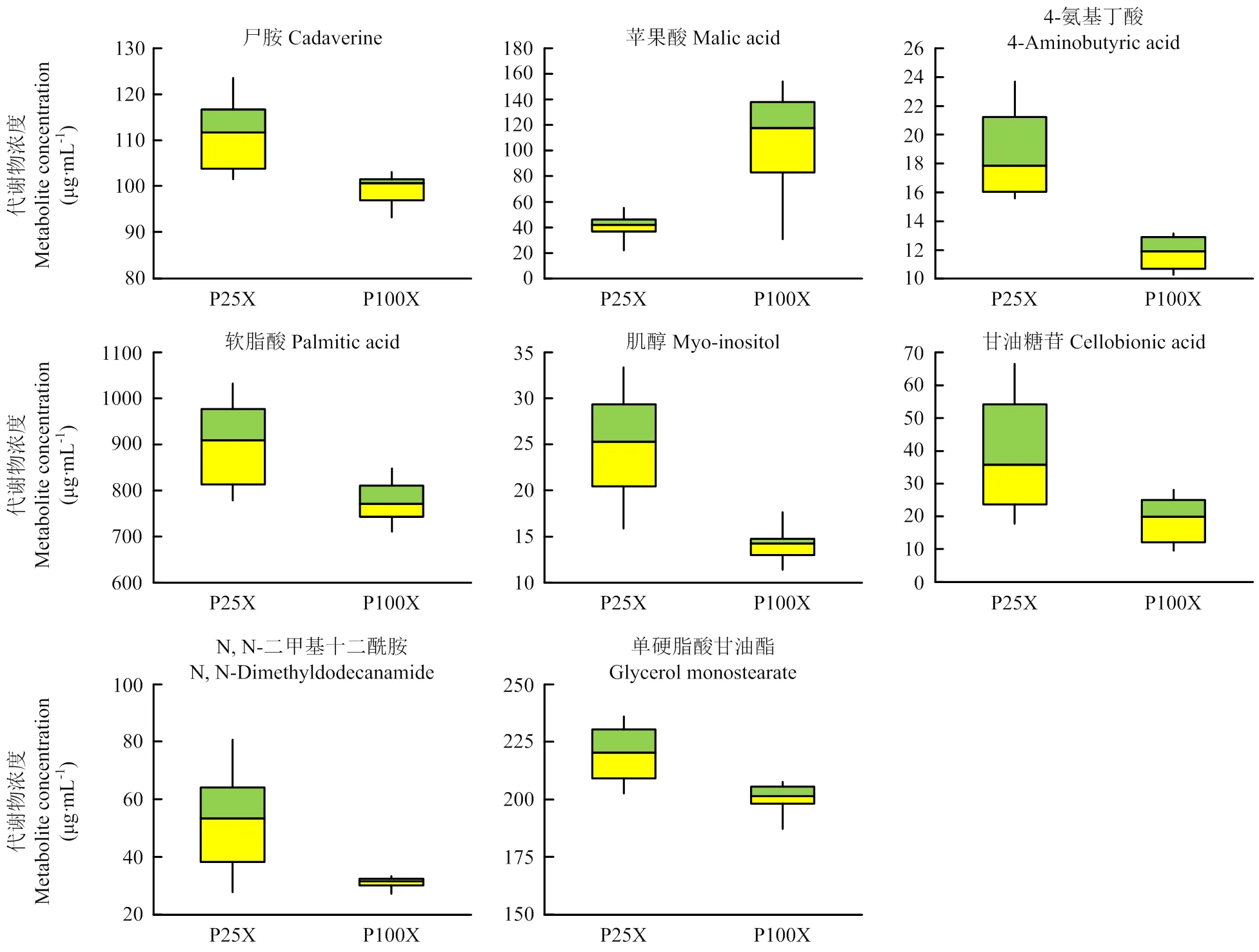
图6 木质部汁液潜在生物标志物的箱型图
Fig.6 Boxplots of potential biomarkers of xylem sap
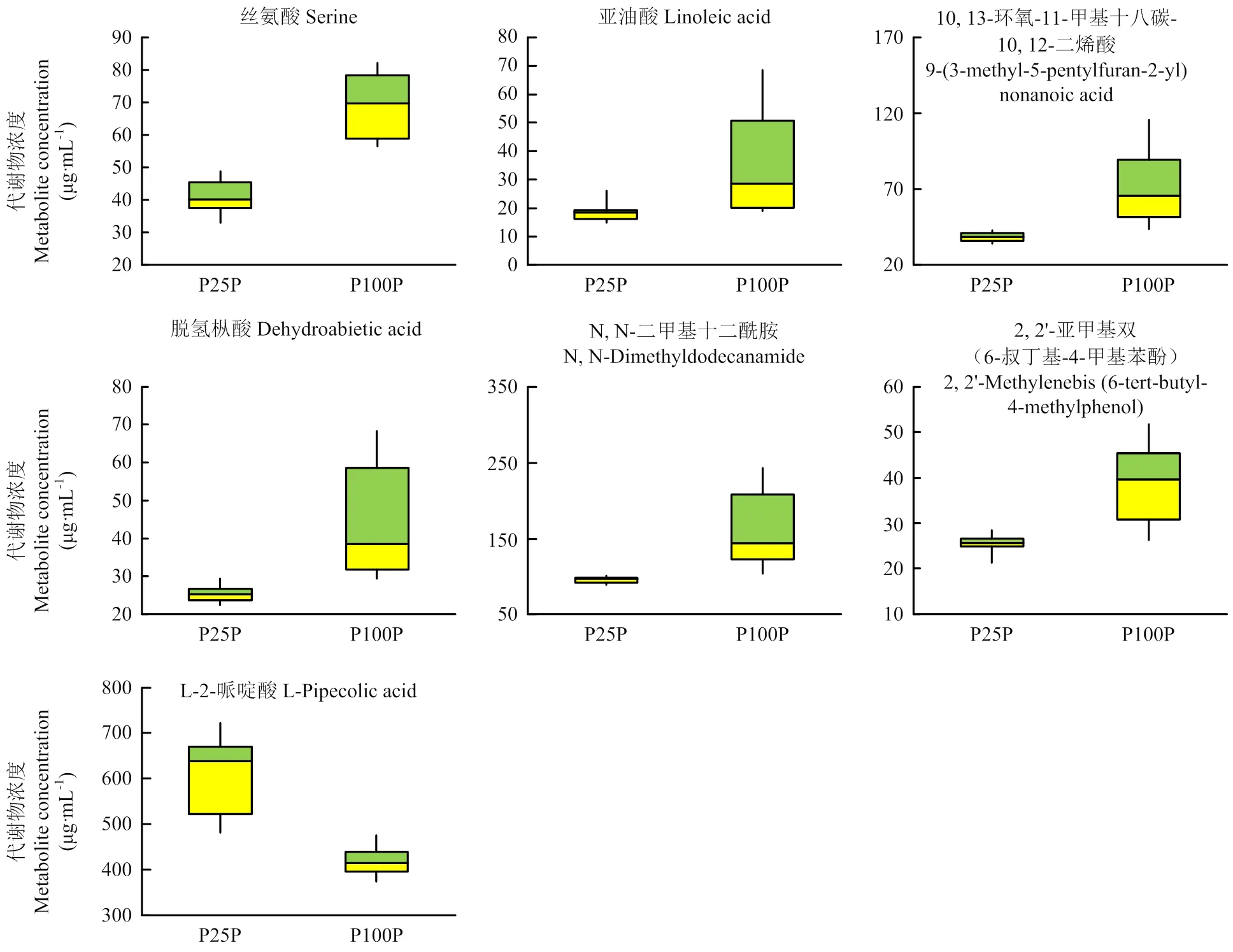
图7 韧皮部汁液潜在生物标志物的箱型图
Fig.7 Boxplots of potential biomarkers of phloem sap
3.2 生物标志物可用于估测黄瓜磷营养供应
低磷胁迫下,植株会调节糖、氨基酸和有机酸的代谢,以减小磷供应不足造成的不利影响,维持植株的正常生理代谢[24-25]。且这种变化会先于植株外部特征的变化,因此检测植株的代谢物变化能够较早反映植株的养分状态。但相较于对所有代谢物进行检测,仅检测生物标志物即可反映植株的磷养分状态,且检测流程更短,检测效率更高。如Gao等[26]通过比较低氮、低磷胁迫下莴苣叶片各种代谢产物的含量变化并筛选出代谢物标志物,为莴苣早期营养胁迫的诊断提供依据。但针对植物木质部或韧皮部汁液进行代谢组学分析的案例较少。
本研究在低磷胁迫下的木质部汁液中发现了8种具有明显差异的代谢物,在韧皮部汁液中发现了7种具有明显差异的代谢物,这些潜在生物标志物能在一定程度上反映出黄瓜的磷素代谢状况。在木质部汁液中,参与众多代谢途径的关键代谢物苹果酸的含量大幅下降,说明低磷胁迫影响了植物体内的正常生长代谢,限制了植物生长发育;能增强植物抗逆性的尸胺与四氨基丁酸的含量显著上升,说明植株正加强自身抗逆性以适应低磷胁迫;作为重要生长因子的软脂酸和肌醇的含量显著上升,说明植株增加了生长因子的产出以维持生长发育。在韧皮部汁液中,增强植物抗逆性的L-2-哌啶酸显著增加[27],也是植株抗逆性增强的体现;参与植株代谢的丝氨酸和亚油酸显著降低,显示出低磷胁迫对于植株生理代谢反应的抑制;诱导植株系统性获得抗性的脱氢枞酸显著降低[28],说明低磷胁迫下的植株对外界病菌局部侵染的抵抗力显著下降。
同时,与正常磷供应状态相比,低磷胁迫下木质部汁液的8种潜在生物标志物中有7种高于正常水平,而韧皮部汁液中的7种生物标志物含量则有6种低于正常水平,结合磷胁迫对木质部与韧皮部汁液内糖、氨基酸和无机酸含量的不同影响,发现在同样的低磷胁迫下,黄瓜木质部与韧皮部汁液的响应机制有明显差异,其他植物在同种非生物胁迫下也出现不同部位响应机制有明显差异的情况[29-30]。
3.3 易于实际检测的生物标志物
目前,对于植物体内代谢物的检测方法有核磁共振(NMR)、GC-MS、LC-MS等,这些检测方法都需要离体检测,且检测设备体型巨大、成本高昂。相对而言,借助敏感电极进行检测的传感器虽然精度有所不足,但是更方便、廉价,具有较高的普适性。现阶段有大量用于氨基酸、有机酸等有机物检测的传感器,也有直接植入植物体内、对植物某一生长指标进行长期检测的传感器。因此,相较于色谱、质谱等方法,通过体积小、成本低的传感器检测黄瓜磷胁迫下的生物标志物,检测成本更低,检测效率更高。目前,在木质部与韧皮部汁液发现的生物标志物中,苹果酸、四氨基丁酸、软脂酸、丝氨酸与亚油酸的传感器检测较为完善,相对于其他生物标志物,它们的实用性更强。
苹果酸、四氨基丁酸、软脂酸为木质部汁液中的生物标志物。DALAL等[31]基于苹果酸浓度这一果实成熟的重要指标,通过将苹果酸酶固定在工作电极表面,制备了羧化多壁碳纳米管(C-MWCNT)修饰的丝网印刷电化学传感器,可用于苹果酸检测。SANGUBOTLA等[32]以玉米汁为原料合成碳点(CDs),并用3-氨基苯基硼酸(APBA)和烟酰胺腺嘌呤二核苷酸磷酸(NADP+)进行功能化,得到了CANs;制备的CANs和酶GABase(四氨基丁酸氨基转移酶和琥珀酸半醛脱氢酶的混合物)能以较高的灵敏度对四氨基丁酸进行检测。DUVANOVA等[33]用PM聚酰亚胺(1, 2, 4, 5-苯四甲酸二酐和4, 4′-二氨基二苯氧基)修饰电极,制备出可以检测植物油中软脂酸浓度的分子印迹聚合物(MIPs)压电传感器。
丝氨酸与亚油酸为韧皮部汁液中的生物标志物。SINGH基于分子印迹技术,制备功能化金纳米粒子(AuNPs),并用其修饰EQCM金电极,使用4-氨基硫酚作为电聚合组分,使用半胱氨酸单元通过两性离子和氢键间的相互作用为识别氨基酸提供配体,制备出一种能够检测丝氨酸的压电传感器[34]。LU等[35]同时基于膳食脂肪的疏水性,采用氧化石墨烯和气味结合蛋白(OBPs)修饰丝网印刷电极,研制了一种用于脂肪味觉检测的味觉生物传感器,能够用于亚油酸的检测。
综上,现阶段已经有可用于苹果酸、氨酪酸、软脂酸、丝氨酸与亚油酸检测的传感器。相较于其他生物标志物,在通过传感器确定其在木质部或韧皮部汁液中的含量,并根据生物标志物的含量进行黄瓜磷匮乏诊断,更易于生产实际应用。
4 结论
低磷胁迫下,植物汁液内糖类、四氨基丁酸与有机酸的含量受到明显影响,且木质部与韧皮部汁液对低磷胁迫的响应机制有很大差异。其中,低磷胁迫下,木质部汁液中的糖无显著变化,氨基酸和有机酸多呈显著增加的趋势,而韧皮部汁液中糖、氨基酸和有机酸则以显著降低为主。同时,在黄瓜韧皮部汁液中筛选出苹果酸、四氨基丁酸等8种潜在生物标志物,在韧皮部汁液中筛选出L-2-哌啶酸、丝氨酸等7种潜在生物标志物,这些潜在生物标志物可用于黄瓜磷养分供应状况的评估,为植物的养分检测以及磷肥的精准供应提供指导。
References
[1] RODRÍGUEZ-CELMA J, CEBALLOS-LAITA L, GRUSAK M A, ABADÍA J, LÓPEZ-MILLÁN A F.Plant fluid proteomics: Delving into the xylem sap, phloem sap and apoplastic fluid proteomes.Biochimica et Biophysica Acta, 2016, 1864(8): 991-1002.doi: 10.1016/j.bbapap.2016.03.014.
[2] LUCAS W J, GROOVER A, LICHTENBERGER R, FURUTA K, YADAV S R, HELARIUTTA Y, HE X Q, FUKUDA H, KANG J, BRADY S M, PATRICK J W, SPERRY J, YOSHIDA A, LÓPEZ-MILLÁN A F, GRUSAK M A, KACHROO P.The plant vascular system: Evolution, development and functions.Journal of Integrative Plant Biology, 2013, 55(4): 294-388.
[3] 杨春, 谭太龙, 余佳玲, 廖琼, 张晓龙, 张振华, 宋海星, 官春云.大气CO2浓度倍增对油菜韧皮部汁液成分及根部氮素积累的影响.植物生态学报, 2014, 38(7): 776-784.doi:10.3724/SP.J.1258.2014.00073.
YANG C, TAN T L, YU J L, LIAO Q, ZHANG X L, ZHANG Z H, SONG H X, GUAN C Y.Effects of atmospheric CO2enrichment on phloem sap composition and root nitrogen accumulation in oilseed rape.Chinese Journal of Plant Ecology, 2014, 38(7): 776-784.doi: 10.3724/SP.J.1258.2014.00073.(in Chinese)
[4] ZHANG Y, MA X M, WANG X C, LIU J H, HUANG B Y, GUO X Y, XIONG S P, LA G X.UPLC-QTOF analysis reveals metabolomic changes in the flag leaf of wheat (L.) under low-nitrogen stress.Plant Physiology and Biochemistry, 2017, 111: 30-38.doi: 10.1016/j.plaphy.2016.11.009.
[5] 许彦阳, 姚桂晓, 刘平香, 赵洁, 王昕璐, 孙君茂, 钱永忠.代谢组学在农产品营养品质检测分析中的应用.中国农业科学, 2019, 52(18): 3163-3176.doi: 10.3864/j.issn.0578-1752.2019.18.009.
XU Y Y, YAO G X, LIU P X, ZHAO J, WANG X L, SUN J M, QIAN Y Z.Review on the application of metabolomic approaches to investigate and analysis the nutrition and quality of agro-products.Scientia Agricultura Sinica, 2019, 52(18): 3163-3176.doi: 10.3864/ j.issn.0578-1752.2019.18.009.(in Chinese)
[6] 吴昊, 于小红, 马光朝, 马致洁, 章从恩.基于LC-MS的甘草炮制雷公藤降低肝毒性的代谢组学研究.中草药, 2020, 51(21): 5501-5508.doi: 10.7501/j.issn.0253-2670.2020.21.014.
WU H, YU X H, MA G C, MA Z J, ZHANG C E.Metabolomics study on reduction of hepatotoxic ofprocessed by liquorice based on LC-MS.Acupuncture Research, 2020, 51(21): 5501-5508.doi: 10.7501/j.issn.0253-2670.2020.21.014.(in Chinese)
[7] SUNG J, LEE S, LEE Y J, HA S, SONG B, KIM T, WATERS B M, KRISHNAN H B.Metabolomic profiling from leaves and roots of tomato (L.) plants grown under nitrogen, phosphorus or potassium-deficient condition.Plant Science, 2015, 241: 55-64.doi: 10.1016/j.plantsci.2015.09.027.
[8] ZHAO X, CHEN M J, LI Z P, ZHAO Y, YANG H L, ZHA L, YU C X, WU Y J, SONG X X.The response ofto low-temperature stress based on metabonomics.Frontiers in Microbiology, 2020, 11: 1787.doi: 10.3389/fmicb.2020.01787.
[9] ZHANG J T, ZHANG Y, DU Y Y, CHEN S Y, TANG H R.Dynamic metabonomic responses of tobacco () plants to salt stress.Journal of Proteome Research, 2011, 10(4): 1904-1914.doi: 10.1021/pr101140n.
[10] JEON E, CHOI S, YEO K H, PARK K S, RATHOD M L, LEE J.Development of electrical conductivity measurement technology for key plant physiological information using microneedle sensor.Journal of Micromechanics and Microengineering, 2017, 27(8): 85009.doi: 10.1088/1361-6439/aa7362.
[11] LU L, HUANG M, HUANG Y X, CORVINI P F X, JI R, ZHAO L J.Mn3O4nanozymes boost endogenous antioxidant metabolites in cucumber () plant and enhance resistance to salinity stress.Environmental Science: Nano, 2020, 7(6): 1692-1703.doi: 10.1039/D0EN00214C.
[12] HE J, BOUWMEESTER H J, DICKE M, KAPPERS I F.Correction to: Transcriptional and metabolite analysis reveal a shift in direct and indirect defences in response to spider‑mite infestation in cucumber ().Plant Molecular Biology, 2020, 103(4/5): 507-509.doi: 10.1007/s11103-020-01009-8.
[13] LI T F, LU M, GAO Y H, HUANG X D, LIU G Y, XU D H.Double layer MOFs M-ZIF-8@ZIF-67: The adsorption capacity and removal mechanism of fipronil and its metabolites from environmental water and cucumber samples.Journal of Advanced Research, 2020, 24: 159-166.doi: 10.1016/j.jare.2020.03.013.
[14] 赵静, 郭勇祥, 林志豪, 陈晓鑫, 黄三文, 廖红.黄瓜磷效率评价及其基因型差异.广东农业科学, 2015, 42(19): 27-35, 2.doi: 10.16768/j.issn.1004-874x.2015.19.019.
ZHAO J, GUO Y X, LIN Z H, CHEN X X, HUANG S W, LIAO H.Evaluation of phosphorus efficiency and its genotypic variations in cucumber.Guangdong Agricultural Sciences, 2015, 42(19): 27-35, 2.doi: 10.16768/j.issn.1004-874x.2015.19.019.(in Chinese)
[15] 葛体达, 姜武, 宋世威, 黄丹枫.无机氮和氨基酸态氮处理对番茄幼苗木质部和韧皮部汁液中矿质养分的影响.园艺学报, 2009, 36(3): 347-354.doi: 10.16420/j.issn.0513-353x.2009.03.027.
GE T D, JIANG W, SONG S W, HUANG D F.Influence of inorganic and amino acid nitrogen on mineral nutrient contents in xylem and phloem sap of different tomato () cultivars.Acta Horticulturae Sinica, 2009, 36(3): 347-354.doi: 10.16420/j.issn.0513-353x.2009.03.027.(in Chinese)
[16] FAN H F, XU Y L, DU C X, WU X.Phloem sap proteome studied by iTRAQ provides integrated insight into salinity response mechanisms in cucumber plants.Journal of Proteomics, 2015, 125: 54-67.doi: 10.1016/j.jprot.2015.05.001.
[17] 甄丽莎, 谷洁, 胡婷, 刘晨, 贾凤安, 吕睿.石油烃类污染物降解动力学和微生物群落多样性分析.农业工程学报, 2015, 31(15): 231-238.
ZHEN L S, GU J, HU T, LIU C, JIA F A, LÜ R.Kinetics of petroleum hydrocarbon degradation in soil and diversity of microbial community during composting.Transactions of the Chinese Society of Agricultural Engineering, 2015, 31(15): 231-238.(in Chinese)
[18] AGUIRRE M, KIEGLE E, LEO G, EZQUER I.Carbohydrate reserves and seed development: An overview.Plant Reproduction, 2018, 31(3): 263-290.doi: 10.1007/s00497-018-0336-3.
[19] ZHAO D K, YU Y, SHEN Y, LIU Q, ZHAO Z W, SHARMA R, REITER R J.Melatonin synthesis and function: evolutionary history in animals and plants.Frontiers in Endocrinology, 2019, 10: 249.doi: 10.3389/fendo.2019.00249.
[20] LÓPEZ-BUCIO J, NIETO-JACOBO M F, RAMÍREZ-RODRÍGUEZ V, HERRERA-ESTRELLA L.Organic acid metabolism in plants: from adaptive physiology to transgenic varieties for cultivation in extreme soils.Plant Science, 2000, 160(1): 1-13.doi: 10.1016/s0168- 9452(00)00347-2.
[21] 程少禹, 宣铃娟, 董彬, 顾翠花, 申亚梅, 张明如, 戴梦怡, 王卓为, 章颖佳, 陆丹迎.‘红元宝’紫玉兰两次花芽分化差异代谢通路及关键调控基因筛选.园艺学报, 2020, 47(8): 1490-1504.doi: 10.16420/j.issn.0513-353x.2019-0963.
CHENG S Y, XUAN L J, DONG B, GU C H, SHEN Y M, ZHANG M R, DAI M Y, WANG Z W, ZHANG Y J, LU D Y.Identification of differential metabolic pathways and key regulatory genes in the two flower bud differentiation processes of.Acta Horticulturae Sinica, 2020, 47(8): 1490-1504.doi: 10.16420/j.issn.0513-353x.2019-0963.(in Chinese)
[22] 滑金杰, 王华杰, 王近近, 李佳, 江用文, 王岳梁, 袁海波.采用PLS-DA分析毛火方式对工夫红茶品质的影响.农业工程学报, 2020, 36(8): 260-270.doi: 10.11975/j.issn.1002-6819.2020.08.032.
HUA J J, WANG H J, WANG J J, LI J, JIANG Y W, WANG Y L, YUAN H B.Influences of first-drying methods on the quality of Congou black tea using partial least squares-discrimination analysis.Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(8): 260-270.doi: 10.11975/j.issn.1002-6819.2020.08.032.(in Chinese)
[23] 刘晓燕, 刘艳秋, 程孟春, 肖红斌.超高效液相色谱-质谱联用技术在药物肝损伤代谢组学研究中的应用.色谱, 2015, 33(7): 683-690.doi: 10.3724/SP.J.1123.2015.04007.
LIU X Y, LIU Y Q, CHENG M C, XIAO H B.Application of ultra high performance liquid chromatography-mass spectrometry to metabolomics study of drug-induced hepatotoxicity.Chinese Journal of Chromatography, 2015, 33(7): 683-690.doi: 10.3724/SP.J.1123.2015.04007.(in Chinese)
[24] LIU Y L, HOU W P, JIN J, CHRISTENSEN M J, GU L J, CHENG C, WANG J F.Epichloë gansuensis increases the tolerance of achnatherum inebrians to low-P stress by modulating amino acids metabolism and phosphorus utilization efficiency.Journal of Fungi (Basel, Switzerland), 2021, 7(5): 390.
[25] 于新超, 王晶, 朱美玉, 姜晶.碳水化合物代谢参与番茄响应低磷胁迫的分子机制.分子植物育种, 2015, 13(12): 2833-2842.doi: 10.13271/j.mpb.013.002833.
YU X C, WANG J, ZHU M Y, JIANG J.Molecular mechanism of carbohydrate metabolism participation in tomato response to low phosphorus stress.Molecular Plant Breeding, 2015, 13(12): 2833-2842.doi: 10.13271/j.mpb.013.002833.(in Chinese)
[26] GAO H Y, MAO H P, ULLAH I.Analysis of metabolomic changes in lettuce leaves under low nitrogen and phosphorus deficiencies stresses.Agriculture (Basel), 2020, 10(9): 406.
[27] 潘航, 冯缨, 王喜勇, 李岩.荒漠环境下10种沙拐枣的生理特征比较研究.草业学报, 2017, 26(6): 68-75.
PAN H, FENG Y, WANG X Y, LI Y.Examination and comparison of the physiological characteristics of tenspecies in a desert environment.Acta Prataculturae Sinica, 2017, 26(6): 68-75.(in Chinese)
[28] 黄子凌, 李大勇, 宋凤鸣.植物系统获得抗性中的系统信号及其作用机制.植物生理学报, 2020, 56(7): 1346-1360.doi: 10.13592/j.cnki.ppj.2020.0071.
HUANG Z L, LI D Y, SONG F M.Systemic signals and their mechanisms in plant systemic acquired resistance.Plant Physiology Journal, 2020, 56(7): 1346-1360.doi: 10.13592/j.cnki.ppj.2020.0071.(in Chinese)
[29] 郭鹏飞, 雷健, 罗佳佳, 刘攀道, 虞道耿, 罗丽娟.柱花草苯丙氨酸解氨酶(SgPALs)对生物胁迫与非生物胁迫的响应.热带作物学报, 2019, 40(9): 1742-1751.doi: 10.3969/j.issn.1000-2561.2019.09.011.
GUO P F, LEI J, LUO J J, LIU P D, YU D G, LUO L J.Response of phenylpropane ammonia-lyase on biotic and abiotic stress in.Chinese Journal of Tropical Crops, 2019, 40(9): 1742-1751.doi: 10.3969/j.issn.1000-2561.2019.09.011.(in Chinese)
[30] DU Y L, ZHAO Q, CHEN L R, YAO X D, ZHANG W, ZHANG B, XIE F T.Effect of drought stress on sugar metabolism in leaves and roots of soybean seedlings.Plant Physiology and Biochemistry, 2020, 146: 1-12.doi: 10.1016/j.plaphy.2019.11.003.
[31] DALAL A, RANA J S, KUMAR A.Ultrasensitive nanosensor for detection of malic acid in tomato as fruit ripening indicator.Food Analytical Methods, 2017, 10(11): 3680-3686.doi: 10.1007/s12161- 017-0919-x.
[32] SANGUBOTLA R, KIM J S.A facile enzymatic approach for selective detection of γ-aminobutyric acid using corn-derived fluorescent carbon dots.Applied Surface Science, 2019, 490: 61-69.
[33] DUVANOVA O V, KRIVONOSOVA I A, ZYABLOV A N, FALALEEV A V, SELEMENEV V F, SOKOLOVA S A.Use of piezoelectric sensors for the determination of oleic and palmitic acids in vegetable oils.Inorganic Materials, 2018, 54(14): 1387-1391.doi: 10.1134/S002016851814008X.
[34] SINGH A K, SINGH M.Designing L-serine targeted molecularly imprinted polymer via theoretical investigation.Journal of Theoretical and Computational Chemistry, 2016, 15(5): 1650041.doi: 10.1142/ S0219633616500413.
[35] LU Y L, HUANG Y X, LI S, ZHANG Q, WU J J, XIONG Z Y, XIONG L X, WAN Q Q, LIU Q J.Fat taste detection with odorant- binding proteins (OBPs) on screen-printed electrodes modified by reduced graphene oxide.Sensors & Actuators: B Chemical, 2017, 252: 973-982.doi: 10.1016/j.snb.2017.06.100.
Metabolites Changes of Cucumber Xylem and Phloem Sap Under Low Phosphorus Stress
LI QingLin*, ZHANG WenTao, XU Hui, SUN JingJing
College of Agricultural Engineering, Jiangsu University, Zhenjiang 212013, Jiangsu
【Background】 Xylem sap is responsible for the transport of water and nutrients for the aerial part, while phloem sap is mainly responsible for the transport of photosynthetic products.When plants are subjected to abiotic stress, the sap of xylem and phloem undergoes different changes.【Objective】 The aim of this study was to investigate the content changes of various metabolites in cucumber xylem and phloem sap under low phosphorus stress, and to explore the metabolic changes of cucumber under low phosphorus stress, so as to provide new ideas and basis for the diagnosis of cucumber phosphorus deficiency.【Method】 The xylem and phloem sap were collected from cucumber plants under normal phosphorus level (1.25 mmol∙L-1) and low phosphorus stress (0.3125 mmol∙L-1).These sap samples were analyzed qualitatively and quantitatively by GC-MS after trimethylsilyl derivatization.【Result】In xylem sap under low phosphorus stress, there was no significant change in carbohydrates, and the content of most amino acids increased significantly.Among organic acids, the malic acid showed a significant downward trend, while others, such as palmitic acid and oleic acid, were significantly higher than the normal levels.In phloem sap under low phosphorus stress, most carbohydrates and amino acids were lower than the normal level, and the contents of organic acids, such as oxalic acid and succinic acid, were also significantly reduced.Further, in order to screen potential biomarkers in cucumber xylem and phloem sap, the detection data were further analyzed by OPLS-DA and Student's t test.Eight potential biomarkers (VIP>1,<0.05) under low phosphorus stress were detected in cucumber xylem sap, which were cadaverine, malic acid, 4-aminobutyric acid, palmitic acid, myo-inositol, cellobiose acid, N, N-dimethyldodecamide, and glycerol monostearate.Seven potential biomarkers (VIP>1,<0.05) under low phosphorus stress were detected in cucumber phloem sap, which were serine, linoleic acid, 9-(3-methyl-5-pentylfuran-2-yl) nonanoic acid, dehydroabietic acid, N, N-dimethyldodecamide, 2, 2'-methylenebis (6-tert-butyl-4-methylphenol), and L-2-piperic acid.【Conclusion】 Under low phosphorus stress, the carbohydrates, amino acids and organic acids in the xylem and phloem sap of cucumber changed, but the change trends were not the same.Eight and seven biomarkers were screened from xylem and phloem sap, which could provide new ideas and basis for the diagnosis of cucumber phosphorus deficiency.Among the biomarkers, the detection methods of malic acid, 4-aminobutyric acid, palmitic acid, serine and linoleic acid have been relatively mature, and the cucumber phosphorus deficiency diagnosis method based on them was more practical.
cucumber; xylem; phloem; phosphorus stress; metabolomics; biomarkers
2021-08-13;
2021-10-13
国家自然科学基金(62101217)、江苏大学农业装备学部项目(NZXB20200203)、江苏省自然科学基金(BK20190858)、中国博士后基金(2019M661754)
通信作者李青林,E-mail:776767151@qq.com
(责任编辑 赵伶俐)
