牛源致脑炎大肠杆菌多表位抗原的制备及免疫效果的初步评价
2022-05-11海永慧钦倩李蓓蓓任静静马勋王鹏雁蒋建军
海永慧,钦倩,李蓓蓓,任静静,马勋,王鹏雁,蒋建军
(石河子大学动物科技学院,新疆 石河子 832000)
肠外致病性大肠杆菌(Extra-intestinal pathogenic Escherichia coli, ExPEC)可通过其特有的毒力因子定殖到肠道外的其它组织中,最终导致宿主发病[1]。可以引起牛羊呼吸道疾病和诱发奶牛脑炎[2]、乳房炎[3]等疾病。近几年以来,新疆规模化养殖场中由ExPEC引起的牛羊疾病时有发生,奶牛场的初生犊牛出现一种以神经症状和急性死亡为特征的病例[4]。2020年顾晓晓等[5]于石河子某规模化牛场死于脑炎的犊牛大脑中也分离出大肠杆菌,分离出的牛源ExPEC菌株伴有高耐药性,给牛源ExPEC感染的防控带来了挑战。
实验中所用的牛源致脑炎大肠杆菌S9922分离自新疆某奶牛场患病犊牛脑组织,经鉴定为肠外致病性大肠杆菌。前期对其进行全基因组测序及比较基因组分析,得到了69个E.coliS9922特有毒力基因,并从其中挑选了FimD、PilN和PilV 3个菌毛蛋白,进行生物信息学分析并筛选出这3个蛋白的B细胞优势表位。本实验将串联这3个蛋白的B细胞优势表位,表达纯化后,进行免疫效果的评价,为牛源致脑炎大肠杆菌多表位疫苗的研发提供试验数据。
1 材料与方法
1.1 菌株、实验动物
牛源致脑炎大肠杆菌S9922分离自新疆某奶牛场患病犊牛脑组织,由石河子大学动物科技学院微生物与免疫学实验室保存,pET32a质粒由本实验室保存,BL21(DE3)大肠杆菌菌株购自全式金生物,实验动物为6~8周龄健康的昆明系小鼠。
1.2 主要试剂与耗材
DNA Marker(DL 5000 plus)购自KaTaRa公司,质粒小提试剂盒、购自天根生化科技(北京)有限公司限制性内切酶BamHI、限制性内切酶XhoI、引物购自生工生物工程股份有限公司,亲和层析Ni柱购自美国Bio-Rad公司,兔抗His抗体、羊抗兔IgG-HRP、兔抗鼠IgG-HRP、增强型HRP-DAB底物显色试剂盒购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 多表位抗原的设计
实验前期已经预测出FimD蛋白的优势B细胞表位为:7-18、144-152、307-315、365-373;PilN蛋白的优势B细胞表位为:77-86、138-149、516-524。PilV蛋白的优势B细胞表位为:265-275、312-323、402-415。使用Linker序列GGGGS串联FimD、PilN和PilV的优势B细胞表位,并在两端加入限制性内切酶ECORI和HindIII送去上海捷瑞生物有限公司进行大肠杆菌偏爱密码子优化,并连接到表达载体pET32a上。
1.2.2 重组蛋白表达载体的酶切鉴定
将含有目的基因的重组表达载体命名为pET32a-FimD+PilN+PilV,将其转化到表达菌BL21(DE3)大肠杆菌中,提取质粒后,用限制性内切酶ECORI和HindIII,在37 ℃恒温水浴锅内酶切4 h,酶切结束后用1%琼脂糖凝胶电泳进行鉴定。
1.2.3 重组蛋白表达条件优化
将鉴定正确的重组表达菌,接种于Amp+ LB液体培养基中37 ℃振荡培养过夜,直至OD600值约为0.5~0.8,加入1.0 mmol·L-1的IPTG,在37 ℃、180 r·min-1条件下以不同诱导表达时间2、4、6 h进行优化表达。
1.2.4 重组蛋白表达、纯化及Western Blot检测
在最优表达条件下,进行重组蛋白诱导表达。取诱导后的菌液50 mL至离心管中,5 000 r·min-1离心10 min,弃上清,收集菌体加入8 mL Lysis Buffer,4 ℃过夜裂解菌体。将过夜裂解的菌体反复冻融3~5次后进行超声破碎,直到菌体清亮不挂壁。将裂解后的混合液以8 000 r·min-1,离心30 min,分别收集上清及沉淀,处理后进行SDS-PAGE电泳,确定蛋白表达形式。用镍柱进行重组蛋白的纯化,纯化后将重组蛋白放入透析袋中使用不同浓度的尿素和去离子水进行复性,最后用蔗糖浓缩半个小时,收集蛋白并测定浓度。重组蛋白进行SDS-PAGE电泳后,兔抗His抗体作为一抗,羊抗兔IgG-HRP作为二抗,进行 Western Blot检测。
1.2.5 小鼠免疫接种
将纯化好的重组蛋白与弗氏佐剂1∶1混合,用5 mL的注射器进行多次抽吸混合,直至形成粘稠的乳剂为止。取6~8周龄健康鼠30只,随机分为3组,每组10只,分别为试验组、对照组(弗氏佐剂组和无菌PBS组)。试验组小鼠用重组蛋白与弗氏佐剂充分乳化后,采用皮下多点注射的方式免疫小鼠,免疫剂量为50 μg·只-1,分别用等体积的弗氏佐剂与无菌PBS接种对照组小鼠。首免用弗氏完全佐剂,二免和三免均用弗氏不完全佐剂,首次免疫两周之后进行加强免疫,加强免疫7 d后进行第三次免疫。
1.2.6 小鼠血清制备
将进行免疫接种的试验组和对照组小鼠分别随机取3只,分别在第7天,第14天,第21天,第28天,第35天,对小鼠进行眼眶后静脉丛采血,收集血清,-20 ℃保存,用于血清特异性IgG抗体动态水平检测。将第三次免疫后7 d的试验组和PBS对照组小鼠进行眼眶后静脉丛采血,收集血清,-20 ℃保存,用于血清特异性抗体效价检测。
1.2.7 血清特异性抗体检测
用纯化好的重组蛋白4 ℃过夜包被2个酶标板,分别用于血清特异性抗体动态水平检测和血清特异性抗体效价检测;用TBST洗涤,5%脱脂奶粉作为封闭液,37 ℃封闭2 h;封闭完成后在1个酶标板中加入经过稀释、用于血清特异性IgG抗体动态水平检测的小鼠血清作为一抗;另一个酶标板加入用于血清特异性抗体效价检测的小鼠血清,按1∶100-1∶204 800梯度稀释;37 ℃孵育1 h后,用TBST洗涤;稀释到最适浓度的HRP标记的兔抗鼠IgG,37 ℃孵育1.5 h,TBST洗涤后加入单组分可溶性TMB显色液,37 ℃避光显色5 min,加终止液终止反应。测定OD450值。以OD待测/OD阴性≥2.1的最高稀释倍数作为抗体血清效价。
1.2.8 攻毒保护实验及组织载菌量测定
第三次免疫后7 d,将牛源致脑源大肠杆菌S9922菌液离心后,用PBS吹打混匀,并将菌量均调至2 LD50进行攻毒。攻毒前12 h对小鼠禁食、禁水。对小鼠进行腹腔注射攻毒,并在接下来的7 d监测各组小鼠的外观、精神情况等进行观察并对小鼠死亡情况进行记录,计算免疫保护率。进行攻毒保护试验7 d后,将活着的攻毒对照组和试验组小鼠处死,在无菌条件下取摘取它们的肝脏、脾脏和脑组织,置于灭菌EP管中称重,将组织剪碎研磨均匀后,加入1 mL灭菌PBS,进行10倍系列稀释,吸取100 μL倍比稀释后的组织液涂布至LB固体培养基上,37 ℃条件下培养12~24 h,进行标准细菌平板计数,计算每克组织中细菌数,用(lg CFU·g-1)表示,对结果用SPASS统计学软件进行统计分析。
2 结果
2.1 重组蛋白表达载体的双酶切鉴定
转化后的BL21(DE3)大肠杆菌,小量提取质粒后,经EcoRI和HindIII双酶切,474 bp处出现目的条带如图1所示,大小与预期结果一致,表明重组蛋白表达载体成功构建。

M:5 000 DNA Marker;1,2:pET32a-FimD+PilN+PilV双酶切产物;3:pET32a质粒。图1 pET32a-FimD+PilN+PilV重组质粒双酶切鉴定结果
2.2 重组蛋白诱导表达及纯化
将pET32a空载体作为对照,在IPTG的诱导下,将重组表达质粒pET32a-FimD+PilN+PilV在BL21(DE3)中表达0、2、4、6 h,将各个时间段表达产物进行SDS-PAGE电泳,结果显示,在37.87 kDa处有明显的蛋白条带,与预期大小基本一致。随着表达时间的增长,蛋白表达量逐渐增加,如图2所示。重组表达质粒 pET32a-FimD+PilN+PilV在BL21(DE3)大肠杆菌中表达6 h后,收集菌液,经反复冻融、超声破碎、离心之后,收集上清和沉淀,经SDS-PAGE聚丙烯酰胺凝胶电泳,结果如图2所示,重组蛋白在上清和沉淀都存在,但主要以包涵体的形式表达。经过纯化后得到大小为37.87kDa的单一条带,与预期重组蛋白的大小相符合。
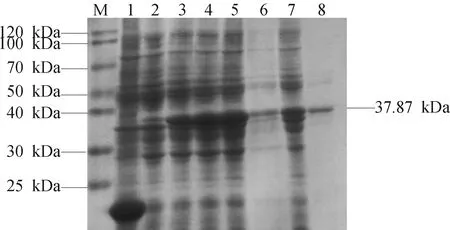
M:蛋白Marker;1:空载体诱导表达产物(8h);2-5:重组蛋白pET32a-FimD+PilN+PilV分别在 0、2、4、6h 的表达产物;6:超声破碎后上清;7:超声破碎后沉淀;8:纯化后重组蛋白。图2 重组蛋白pET32a-FimD+PilN+PilV表达形式分析与纯化结果
2.3 重组蛋白Western Blot检测结果
重组蛋白经SDS-PAGE电泳,进行Western Blot检测,在37.87 kDa大小处,出现一条特异性条带,与预期的重组蛋白大小相符,重组蛋白表达成功(图3)。

M:蛋白Marker;1:重组蛋白图3 重组蛋白Western Blot检测
2.4 重组蛋白免疫后特异性抗体检测结果
重组蛋白作为抗原包被酶标板,取免疫后收集的小鼠血清作为一抗,以HRP标记的羊抗鼠IgG作为二抗,结果显示(图4,表1),试验组在初次免疫后14 d产生的抗体OD450比7 d的高,初次免疫14天进行加强免疫后,抗体的产生速度显著加快,末次免疫后抗体OD450最高。对照组几乎检测不到抗体的存在,采集三免后的小鼠血清,进行抗体效价检测,产生的特异性抗体效价高达1∶204 800。
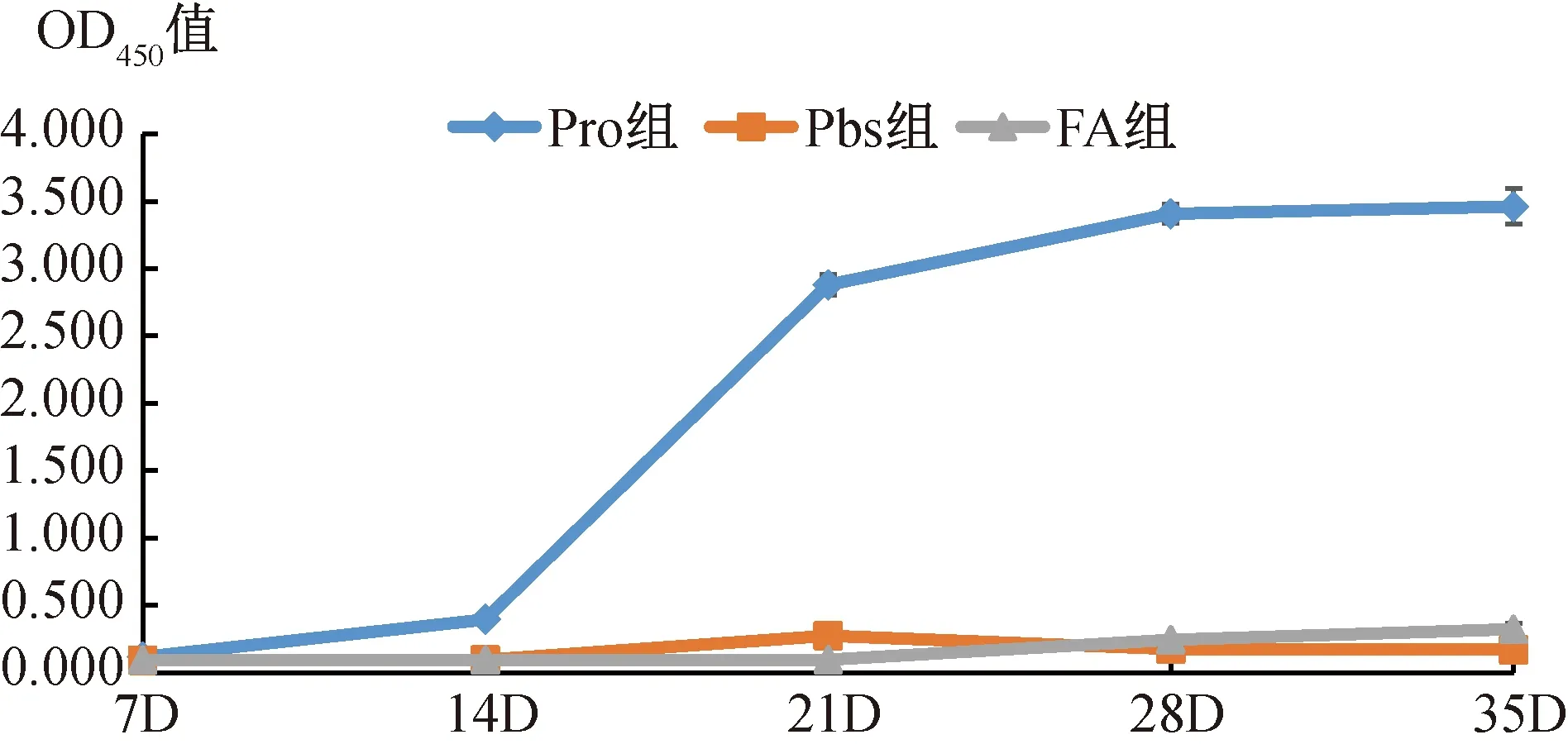
图4 重组蛋白免疫后特异性IgG动态水平

表1 重组蛋白诱导的特异性IgG水平
2.5 小鼠攻毒保护实验
第三次免疫后7 d,用牛源致脑源大肠杆菌S9922对对照组和试验组小鼠进行攻毒,结果显示,PBS组小鼠在攻毒后出现呼吸急促、精神沉郁、喜扎堆,眼睛周围有液体分泌物,睁不开眼,被毛散乱。试验组小鼠攻毒后出现呼吸急促、精神沉郁、喜扎堆。攻毒7 d后,试验组小鼠攻毒后存活率为66%,对照组小鼠攻毒后存活率为33%,小鼠存活情况如图5所示。
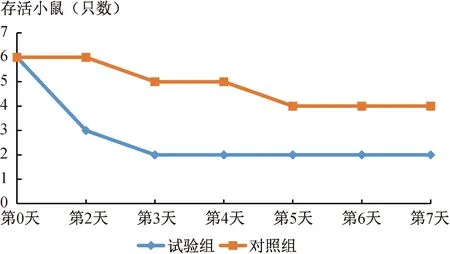
图5 各试验组小鼠在牛源致脑源大肠杆菌S9922攻毒后存活情况
2.6 小鼠肝、脾、脑载菌量的测定
肝、脾、脑载菌量测定结果经Spass软件进行分析后,结果如表2所示,对照组肝、脾、脑组织载菌量均显著高于试验组(P<0.05)。

表2 组织载菌量的测定结果(lg cfu/g)
3 讨论
大肠杆菌具有复杂多变的特性,不断地从无致病性的分离株进化为高致病性的菌株,导致严重的疾病,且血清型众多,还没有针对致病性大肠杆菌的广泛保护性疫苗[6]。目前用于ExPEC的疫苗主要以传统灭活苗为主,但此类疫苗免疫保护效果相对比较局限,且副作用大[7],此外,对于牛源大肠杆菌的疫苗大多都是针对产肠毒素大肠杆菌的疫苗,可用于牛源致脑炎大肠杆菌的疫苗鲜有报道。多表位疫苗克服了传统疫苗的缺点,能更高效地刺激产生特异性免疫应答,并消除针对不良表位的免疫应答[8]。相对于传统弱毒疫苗,其安全性更高[9]。
重组蛋白与佐剂充分混合制成疫苗后免疫小鼠产生的特异性抗体效价高达1∶204 800,攻毒后试验组小鼠存活率为66%,以上结果说明在重组蛋白疫苗的免疫应答中,所选表位可以引起高水平的体液免疫应答。针对产生的抗体效价很高,但疫苗保护率不是很高的情况,可知,特异性IgG水平不是影响疫苗保护效果的决定因素。我们推测,其中还可能存在其他原因,疫苗产生的不同的IgG抗体类型也可能影响保护效果。借鉴Yates等[10]人最近在HIV疫苗中的研究发现可知,针对同一表位的特异性抗体,因不同的IgG亚型,产生不同的保护效应。多表位疫苗由多个线性表位串联而成,在重组蛋白的不同折叠方式可能导致了新表位的产生,在弗氏佐剂作用下,有较多的新表位激起了抗体应答,但该新表位并不发挥保护作用[8]。又由于大肠杆菌的血清型较多,不同血清型间存在一定的交叉免疫反应,针对一种血清型的重组蛋白抗原,不能完全保护其他血清型大肠杆菌的感染;肠外致病性大肠杆菌又含有多个毒力因子,所以想要提高疫苗的保护效果,除了要考虑多血清型的问题,还要考虑不同毒力因子的问题;实验中进行攻毒实验的小鼠数量较少,且没有重复做攻毒保护实验进行验证,可能对攻毒保护率的测定有一定的影响。
本实验中选取的B细胞表位都是线性B细胞表位,而构象表位也在诱导免疫应答和免疫保护作用方面发挥重要作用[11]。其次B细胞主要增强体液免疫,细胞免疫还需要T细胞。抗细菌感染过程中,有学者研究表明,细胞与体液免疫应答共同发挥作用。一些疫苗能够诱导高水平的体液免疫应答,但是并不能有效的预防感染[9]。有研究报道,在预防金黄色葡萄球菌定殖和感染过程中,T细胞和B细胞共同发挥作用[12]。使用单个T细胞表位或B细胞表位构成的表位疫苗免疫接种小鼠,由于诱导的免疫应答方式较为单一,并不能有效地抑制小鼠体内的细菌定殖。与单一表位相比,由T细胞表位和B细胞表位构成的表位疫苗能显著地抑制了金黄色葡萄球菌在小鼠各脏器中的定殖[13]。
pET32a-FimD+PilN+PilV重组蛋白多表位疫苗诱导了高水平的体液免疫应答,并且显著减少了牛源致脑炎大肠杆菌在小鼠脏器中的定殖,具有成为牛源致脑炎大肠杆菌多表位抗原候选疫苗的潜力。本实验只选用了FimD、PilN和PilV 3个蛋白的B细胞线性表位,如果增加这3个蛋白的T细胞表位是否会提高表位疫苗的保护效果,从而更有效地预防牛源致脑炎大肠杆菌,值得进一步研究。
