商陆皂苷甲对哮喘小鼠气道炎症的缓解作用及对肺组织中IL-6 和STAT3 表达水平的影响
2022-05-11宋艺兰王重阳姜京植李良昌延光海苏立明
王 静, 徐 畅, 宋艺兰, 王重阳, 姜京植, 李良昌, 延光海, 苏立明
(1. 延边大学 吉林省过敏性常见疾病免疫与靶向研究重点实验室,吉林 延吉 133002;2. 延边大学附属医院儿科,吉林 延吉 133002;3. 延边大学医学院解剖学教研室,吉林 延吉 133002)
哮喘是临床上一种常见的慢性病,随着哮喘逐年加重,患者的生命也随时面临严重威胁[1]。因此,为了缓解哮喘患者的痛苦,探究哮喘的发病机制迫在眉睫。哮喘患者发病时的主要症状包括呼吸困难、胸闷和反复咳嗽。哮喘主要累积小气道和大气道,由于嗜酸性粒细胞大量聚集在气管周围,如白细胞介素1β(interleukin-1β,IL-1β)和肿瘤坏死因子α(tumor necrosis facter-α,TNF-α)促炎因子表达增加,从而使气道形成炎症状态,最终导致呼吸时气流阻塞[2]。哮喘发生时辅助T 细胞2(T helper cell 2,Th2) 的功能亢进,炎症因子白细胞介素4(interleukin-4,IL-4)和白细胞介素13(interleukin-13,IL-13)等分泌增加,而辅助T 细胞1(T helper cell 1,Th1)型细胞受到抑制,γ 干扰素(interfern-γ,IFN-γ)分泌不足。白细胞介素6(interleukin-6,IL-6)是重要的促炎细胞因子之一,其通过膜结合和可溶性受体这2 种生物学途径发挥不同作用。研究[3]显示:在炎症发生时,IL-6 信号通路通过可溶性白细胞介素6 受体(interleukin-6 receptor,IL-6R)来发挥促炎作用,IL-6 信号通路激活后通过信号传导及转录激活蛋白(signal transducer and activator of transcription,STAT)依赖和STAT 独立这2 种不同的信号模块对炎症反应进行调节。其中,信号传导和STAT3 信号通路属于STAT 独立信号模块[4]。研究[5-6]显示:在细胞实验中,抑制STAT3 蛋白的表达可以有效减少受刺激剂处理的气道平滑肌细胞中炎性细胞因子IFN-γ、IL-2 和IL-12 水平。因 此,IL-6/STAT3信号通路可能是调控哮喘炎症机制的重要靶标。商陆皂苷甲(esculentoside A,EsA) 是一种从植物商陆根中分离出的三萜类皂苷[6]。已有研究[7-8]证实:EsA 具有抗炎、增强免疫力和抗肿瘤等多种药理作用。研究[7]显示:EsA 可以治疗多种呼吸系统炎症,并增强患者免疫功能。李柳美等[9]研究显示:EsA 可明显提高细胞凋亡蛋白表达,以提升其抗肿瘤活性。目前尚无关于EsA 在哮喘小鼠模型中对IL-6/STAT3 信号通路影响的相关报道。本研究建立卵清蛋白(ovalbumin,OVA)诱导的小鼠哮喘模型,探讨EsA 对哮喘小鼠气道炎症的作用及IL-6/STAT3 信号通路的影响。
1 材料与方法
1.1 实验动物、主要试剂和仪器选取清洁级雌性BALB/c 小鼠40 只(6~8 周龄),体质量(20±2) g,购自延边大学实验动物管理中心,动物使用许可证号:SYXK (吉) 2020-0010。整个实验过程中维持小鼠自由进食饮水,饲养环境中湿度保持在40%~50%,温度保持在18 ℃~22 ℃。本实验已获得延边大学医学院伦理委员会批准,并严格按照《实验动物管理条例》法规中的要求。OVA、氢氧化铝凝胶和EsA 购自美国Sigma 公司,HE 染色试剂盒购自中国Solarbio 公司, Diff-Quik 购自美国AbMole 公司,小鼠IL-4 和IFN-γ ELISA 试剂盒购自美国Abcam 公司,荧光标记PC5.5-CD3e、FITC-CD4+、APC-IL-4 和PC7-IFN-γ 的细胞因子抗体购自美国BD Pharmingen 公司,IL-6、STAT3、β-actin 和Anti-Rabbit IgG 抗体购自美国Abcam 公司。小鼠给药雾化仪购自日本欧姆龙公司, 离心机购自中国湘仪离心机仪器公司,CytoFLEX 流式细胞仪购自美国BECKMAN 公司,Epoch 全波长酶标仪和AI 600 超灵敏化学发光成像仪购自美国Bio-Tek 公司。
1.2 实验动物分组、模型制备和给药40 只小鼠随机分为空白对照组、OVA 组、低剂量EsA 组和高剂量EsA 组,每组10 只。小鼠适应性饲养1 周,除空白对照组外,其他各组小鼠采用腹腔注射(100 μg OVA 和1 mg 氢氧化铝混合溶于0.2 mL 生理盐水中)致敏,分别于第1、7 和14 天致敏。从第21 天开始采用1% OVA 激发,每1 d 为1 个激发周期,每个激发周期激发1 次,共进行3 次,第23 天为末次激发。空白对照组小鼠以生理盐水致敏和激发。空白对照组和OVA 组应用0.2 mL 生理盐水灌胃给药。低剂量EsA 组和高剂量EsA 组小鼠 分 别 按 体 质 量(10 和20 mg·kg-1) 灌 胃 给药,从第17 天开始,连续给药7 d,每天1 次。
1.3 小鼠支气管肺泡灌洗液(broncho-alveolar lavage fluid,BALF)收集给药结束后,麻醉小鼠至死,将小鼠固定于手术台,切开颈部皮肤,暴露气管,将气管切开小口后置入细软管,通过细软管注入预冷的1 mL PBS 缓冲液,按摩后回收BALF,要求回收量达80% 以上。
1.4 HE 染色观察各组小鼠肺组织病理形态表现切开小鼠胸腔取肺,左肺固定,石蜡包埋后切成5 μm 切片,进行后续染色。烤片2 h 后,在二甲苯中进行约20 min 的脱蜡过程,之后将脱蜡后的切片置于梯度酒精中使其水化20 min,使用清水冲片,再将其置入苏木素中约7 min,取出后使用流水将载玻片上的多余染液冲掉,再将切片放入0.5%伊红染液中约30 s 后取出在清水中冲洗,观察是否染色均匀。待切片染色后再次用梯度酒精和二甲苯进行脱水和透明,最后在二甲苯挥发后用中性树脂胶进行封片,在显微镜下观察并拍照。
1.5 流式细胞术检测各组小鼠BLFA 中IL-4 和IFN-γ 水平BALF 离 心,加 破 膜 剂 暗 处 孵 育10 min。2 mL PBS 缓冲液洗涤后离心,弃上清。加固定剂,室温暗处孵育15 min,离心5 min,弃上清。加入荧光标记的细胞因子抗体(PC5.5-CD3e、 FITC-CD4+、 APC-IL-4 和PC7-IFN-γ),混匀,室温暗处孵育30 min,2 mL PBS 缓冲液洗涤后离心,弃上清,加入500 μL PBS 缓冲液上机。
1.6 ELISA 法检测各组小鼠BALF 中细胞因子水平将BALF 取出,将其全部溶解后,按照ELISA 试剂盒说明书操作,配制工作液和洗涤液,使用不同浓度的样本配制出具有浓度梯度的标准品,将样本和标准品添加至相应孔中,设空白对照孔,37 ℃下水浴放置2 h,用洗板机洗涤3 次,添加生物素化抗体。 37 ℃水浴再放置2 h,第2 次用洗板机洗3 次,加入酶结合物工作液,使二者发生反应。 37 ℃下再放置1 h,洗板机洗涤3 次。最后,添加显色底物,37 ℃下放置20 min ,加入终止液。其反应所生成的颜色反应可采用酶标仪在其特定吸收光区域检测,再根据标准曲线所得方程式计算出BALF 中IL-4 和IFN-γ 水 平。
1.7 直接计数法计算各组小鼠BALF 炎症细胞数量BALF 离心,采用600 μL PBS 缓冲液将其进行细胞重悬,并反复吹打溶液混至均匀,每次取200 μ L 混悬液,离心机离心甩片5 min,转速1500 r·min-1。根据Diff-Quik 溶液和试剂盒说明书进行染色,并在细胞仪上根据细胞形态和染色特征等将细胞分类和计数。由2 名独立研究者采用单盲研究确定,并在显微镜下从3 个随机位置分析至少200 个细胞。
1.8 流式细胞术检测各组小鼠组织中嗜酸性粒细胞数量BALF 离心,加固定剂,室温暗处孵育15 min,离心后弃上清。加入荧光标记的嗜酸性粒细胞抗体 (APC-CD45.2 和PE-siglec-F),混匀,室温暗处孵育30 min,2 mL PBS 缓冲液洗涤后离心,弃上清,加入500 μL PBS 缓冲液上机。
1.9 免疫组织化学法检测各组小鼠肺组织中IL-6和STAT3 蛋白的表达肺组织切片再经过烤片、脱蜡和梯度酒精脱水等程序后,采用枸橼酸溶液对样本浸泡并加热达一定温度使抗原修复。放置温度达室温后,采用PBS 缓冲液进行洗涤,根据免疫组织化学试剂盒说明书完成后续步骤的操作,再放置一抗(IL-6 和STAT3)后,于4 ℃冰箱中过夜,最后经DAB 显色,苏木素复染,并用清水冲洗,透明,二甲苯挥发后,封片。在Cytation5 微孔成像仪下观察并拍照。
1.10 免疫荧光法检测各组小鼠肺组织中IL-6 和STAT3 表达水平肺组织切片经过烤片、脱蜡和梯度酒精脱水后进行抗原修复,待温度降至室温后,用预冷PBS 缓冲液冲洗3 次,每次3 min,5%山羊血清封闭30 min,预冷PBS 缓冲液冲洗3 次,每次3 min。用5% 山羊血清封闭,约30 min ,使用一抗(IL-6 和STAT3)染色,并在4 ℃冰箱中过夜。第2 天,用预冷PBS 缓冲液冲洗15 min,加相对应二抗,37 ℃下放置2 h,在避光的环境下用预冷PBS 缓冲液再洗15 min,最后,加入DAPI,封片,在Cytation5 微孔成像仪下观察、拍照。
1.11 Western blotting 法检测各组小鼠肺组织中IL-6 和STAT3 蛋白表达水平小鼠肺组织在样品缓冲液中溶解后变性。采用BCA 蛋白测定试剂盒检测总蛋白和细胞核蛋白的浓度。采用SDSPAGE 凝胶电泳分离蛋白质样品,并转移到硝化纤维素膜上。再用5% 脱脂奶粉封闭1 h,与一抗IL-6、STAT3 和β-actin 在4 ℃环境下共同孵育一夜。用二抗在室温(25 ℃)下孵育2 h,加显影剂上机检测。采用Image J 软件分析条带灰度,以β-actin 为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 条带灰度值。
1.12 统计学分析采用SPSS 20.0 统计软件进行统计学分析。各组小鼠BALF 中炎症细胞、嗜酸性粒细胞、中性粒细胞和淋巴细胞数,IL-4、IFN-γ、IL-1β 和TNF-α 水平,肺组织中IL-6 和STAT3 蛋白表达水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠肺组织病理形态表现空白对照组小鼠肺组织的支气管结构轮廓清楚,气道管壁薄厚均匀,肺泡壁结构相对完整;OVA 组小鼠肺组织出现广泛的支气管周围和血管周围炎性细胞浸润,支气管部分损伤;与OVA 组比较,低剂量EsA 组和高剂量EsA 组小鼠肺组织中炎性细胞浸润明显减少,气道损伤减轻。见图1。

图1 各组小鼠肺组织病理形态表现(HE,×100)Fig.1 Morphology of lung tissue of mice in various groups(HE,×100)
2.2 各组小鼠BLFA 中细胞因子水平流式细胞术检测结果显示:与空白对照组比较,OVA 组小鼠BALF 中IL-4 水平升高(P<0.05),IFN-γ 水平降低(P<0.05);与OVA 组比较,低和高剂量EsA 组 小 鼠BALF 中IL-4 水 平 降 低(P<0.05),IFN-γ 水平升高(P<0.05)。见图2。ELISA 法检测结果显示:与空白对照组比较,OVA 组小鼠BALF 中IL-1β 和TNF-α 水 平 明 显 升 高(P<0.01);与OVA 组比较,低和高剂量EsA 组小鼠BALF 中IL-1β 和TNF-α 水 平 明 显 降 低(P<0.01)。见图3。

图2 流式细胞术检测各组小鼠BALF 中IL-4 和IFN-γ 水平Fig.2 Levels of IL-4 and IFN-γ in BALF of mice in various groups detected by flow cytomtry.

图3 ELISA 法检测各组小鼠BALF 中细胞因子TNF-α(A)和IL-1β(B)水平Fig.3 Levels of TNF-α(A)and IL-1β(B)in BALF of mice in various groups detected by ELISA method
2.3 各组小鼠BLFA 中炎症细胞数量通过Diff-Quik 染色计数BALF 中炎症细胞数量。与空白对照组比较,OVA 组小鼠BALF 中总炎症细胞、嗜酸性粒细胞、中性粒细胞和淋巴细胞数量升高(P<0.05);与OVA 组比较,低和高剂量EsA 组小鼠BLFA 中总炎症细胞、嗜酸性粒细胞、中性粒细胞和淋巴细胞数量明显降低(P<0.05)。见图4。流式细胞术检测BLFA 中嗜酸性粒细胞表达结果与Diff-Quik 染色结果一致。见图5。

图4 Diff-Quik 染色检测各组小鼠BALF 中炎症细胞数量Fig.4 Number of inflmmatory cells in BALF of mice in various groups detected by Diff-Quik staining
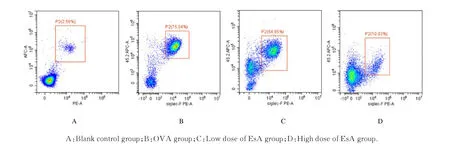
图5 流式细胞术检测各组小鼠BALF 中嗜酸性粒细胞数量Fig.5 Levels of eosinophlls in BLFA of mice in various groups detected by flow cytomotry
2.4 各组小鼠肺组织中IL-6 和STAT3 蛋白表达水平分别采用免疫组织化学法、免疫荧光法和Western blotting 法检测各组小鼠肺组织中IL-6 和STAT3 表达情况。与空白对照组(7.15±1.42,6.04±0.45)比较,OVA 组小鼠肺组织中IL-6 和STAT3蛋白表达水平(36.20±3.84,41.38±1.02) 升高(P<0.05 或P<0.01),低(32.04±1.33,19.35±0.56) 和高剂量EsA 组(9.13±1.05, 10.05±1.49) 小鼠肺组织中IL-6和STAT3 蛋白表达水平降低(P<0.05 或P<0.01)。见图6~8。

图6 免疫组织化学法检测各组小鼠肺组织中IL-6 和STAT3 蛋白表达情况(Bar=50 μm)Fig.6 Expressions of IL-6 and STAT3 proteins in lung tissue of mice in various groups detected by immunohistochemistry(Bar=50 μm)
3 讨论
哮喘的发生主要是由气道慢性炎症所导致,其症状发展主要经历了嗜酸性粒细胞浸润和气道黏膜表面上皮细胞脱落[10-12]。当外源性的刺激原通过各种途径进入到体内,被抗原递呈细胞内吞并激活免疫细胞,活化的免疫细胞合成多种活性介质,导致平滑肌收缩、黏液分泌增加和炎性细胞浸润。本研究结果显示:EsA 可明显降低OVA 引起的哮喘小鼠的嗜酸性粒细胞、中性粒细胞和淋巴细胞炎症细胞浸润。EsA 能够避免气管周围大量的嗜酸性粒细胞浸润。
哮喘的特点是Th1/Th2 细胞无法达到平衡,Th2 类细胞工作异常,使细胞因子激活的数量多于正常水平,从而导致生成IgE,引起过敏性气道炎症发生。研究[13]显示:哮喘发生Th2 亢进时,炎症因子IL-4 表达增加。研究[14]表明:Th1 细胞产生的IFN-γ 拮抗Th2 介导的免疫应答,从而对治疗哮喘具有积极的作用。本研究结果表明:EsA 可以通过调节IL-4 和IFN-γ 来改善Th1/Th2 的免疫失调。支气管上皮细胞炎症时产生的促炎细胞因子在哮喘发生发展中扮演着重要的角色,如IL-1β 对于Th1、Th2 和Th17 的炎症具有促进其产生的作用。研究[15]表明:在OVA 诱导哮喘小鼠模型组BALF 中IL-1β 表达水平明显升高。研究[16]显示:TNF-α 在哮喘发病时,能够使血管发生炎症损伤,炎性细胞浸润,且其是造成该状况的主要原因。本研究结果表明:EsA 对IL-1β 和TNF-α 的表达具有抑制作用。
喻强强等[17]已证明IL-6/STAT3 通路参与哮喘大鼠气道炎症的发生和发展阶段。张建文[18]发现IL-6/STAT3 信号通路在儿童喘息性支气管炎中发挥重要作用。研究[19]显示:在患有临床活动性和内源性哮喘患者BALF 中IL-6 水平升高。STAT3 是一种信号转导和转录激活因子,介导细胞对白细胞介素和其他生长因子的反应。研究[20]发现:哮喘气道炎症的形成有STAT3 和Akt/GSK-3β 通路的参与。本研究结果表明:EsA 可以降低OVA 诱导哮喘小鼠肺组织中IL-6 和STAT3 表达。
综上所述,EsA 预处理可以减轻OVA 组小鼠气道病变,减少促炎因子的产生,并降低肺组织中IL-6 和STAT3 的表达水平。EsA 可能是治疗哮喘的一种潜在的抗炎药物。

图7 免疫荧光法检测各组小鼠肺组织中IL-6 蛋白表达情况(Bar=50 μm)Fig.7 Expressions of IL-6 protein in lung tissue of mice in various groups detected by immunofluorescence method(Bar=50 μm)

图8 Western blotting 法检测各组小鼠肺组织中IL-6和STAT3 蛋白表达电泳图Fig. 8 Electrophoregram of expressions of IL-6 and STAT3 proteins in lung tissue of mice in various groups detected by Western blotting method
