水稻响应盐胁迫关键转录因子的鉴定
2022-05-10张斌杨昕霞
张斌 杨昕霞
(湖南科技学院 湖南省银杏工程技术研究中心,永州 425199)
作为我国主要作物之一,水稻在粮食生产中占据着重要位置。但是,我国盐碱地总面积达9 913万hm2,约占全国土地面积的1/10[1]。盐胁迫会使水稻受到渗透胁迫、离子毒害、氧化胁迫和营养胁迫,影响水稻生长发育,严重时甚至会导致植株死亡[2-3],因此,有关水稻耐盐机制的研究备受关注。面对盐胁迫,植物在分子水平、生理代谢和形态结构上进化出复杂的调控机制,如调节关键基因的表达来改善代谢水平和形态结构[4]。转录因子(transcription factor,TF)通过激活或抑制靶标基因的转录表达,调控一系列的胞内信号转导过程,在应激反应中起着重要的调控作用[5]。根据国家水稻数据中心网站(https://www.ricedata.cn)公布的数据,发现有大量功能基因和调节基因参与胁迫应答,然而利用RNASeq分析响应盐胁迫相关TF的报到却很少。因此,本研究利用盐胁迫下水稻转录组数据分析与之相关的TF基因,通过蛋白互作筛选出重要模块基因进行功能富集分析鉴定出关键TF基因,并进行qRTPCR验证,为后续进行水稻遗传改良提供了候选基因。
1 材料与方法
1.1 材料
水稻盐胁迫的转录组数据从(https://www.ncbi.nlm.nih.gov/bioproject/PRJNA530826/)下载。水稻种子为日本晴(Nipponbare)。
1.2 方法
1.2.1 差异表达基因的筛选 利用hisat2软件建立索引以及比对到参考基因组,通过stringtie软件进行转录本组装、合并和定量,筛选出网站(http://planttfdb.gao-lab.org/)中所有TF基因所对应的表达数据,通过DESeq2软件进行差异分析。以P值≤0.01且|log2foldChange|≥2为条件筛选盐胁迫1 h(0 h vs 1 h)、3 h(0 h vs 3 h)和6 h(0 h vs 6 h)时间段的差异表达TF基因,利用ggplot2软件绘制差异表达TF基因的样品间PCA图,样品相关性热图、火山图和韦恩图。
1.2.2 蛋白互作网络构建、重要模块筛选和关键TF鉴定 利用数据库(http://string-db.org),设置参数interaction score≥0.15,构建蛋白互作网络;利用MCODE插件,筛选核心模块;核心模块中的差异表达TF基因为关键TF基因。
1.2.3 重要模块中基因的富集分析 设置FDR值≤0.05,利用在线软件(http://systemsbiology.cau.edu.cn/agriGOv2/)对重要模块中的基因进行GO富集分析;设置P值≤0.05,利用在线软件(http://kobas.cbi.pku.edu.cn/kobas3/genelist/)对重要模块中的基因进行KEGG富集分析,利用ggplot2插件进行绘图。
1.2.4 qRT-PCR检测基因表达 水稻种子发芽后培养14 d(28℃,14 h白天/10 h黑夜),将幼苗转移到含200 mmol/L NaCl的1/10的MS培养基中,0 h、1 h、3 h和6 h采集茎叶组织,液氮中速冻,-80℃下保存。利用TRIzol法提取总RNA,添加Dnase I去除DNA污染,反转录试剂盒SuperScript III First-Strand Synthesis SuperMix(Thermo)合成 cDNA。利用ABI7500定量PCR仪进行qRT-PCR检测,2-ΔΔCT法计算基因相对表达水平。反应程序:94℃预变性32 min;94℃变性 10 s,60℃退火 10 s,72℃延伸10 s,40 个循环 ;总体系 20 μL :10 μL SYBR Green Mix(Thermo),8 μL RNAase-free水,0.5 μL 引物,1.0 μL模板。Os10g0510000为内参,引物序列见表1。

表1 qRT-PCR反应引物序列和基因注释信息Table 1 Primer sequence for qRT-PCR and gene annotation information
2 结果
2.1 样本关系分析
从图1中可知,相同处理测序样品间距离较近,不同处理及品种间样品基因表达水平存在明显差异,距离较远;根据重复性分析结果,相同处理样品间测序样品间重复性高,系统误差较小,结果可信度高。

图1 测序样品关系Fig. 1 Relationship among sequencing samples
2.2 差异表达基因筛选
盐胁迫1 h检测到125个差异表达TF基因,85个上调,40个下调(图2-A);3 h检测到162个,88个上调,74个下调(图2-B);6 h 检测到172个,88个上调,84个下调(图2-C)。盐胁迫1、3和6 h共有26个相同差异表达TF基因(表2),分别有49个、75个和89个独特差异表达TF基因(图2-D)。

表2 26个相同差异表达TF基因在STRING中的注释Table 2 Notes of 26 identical differentially expressed TF genes in STRING
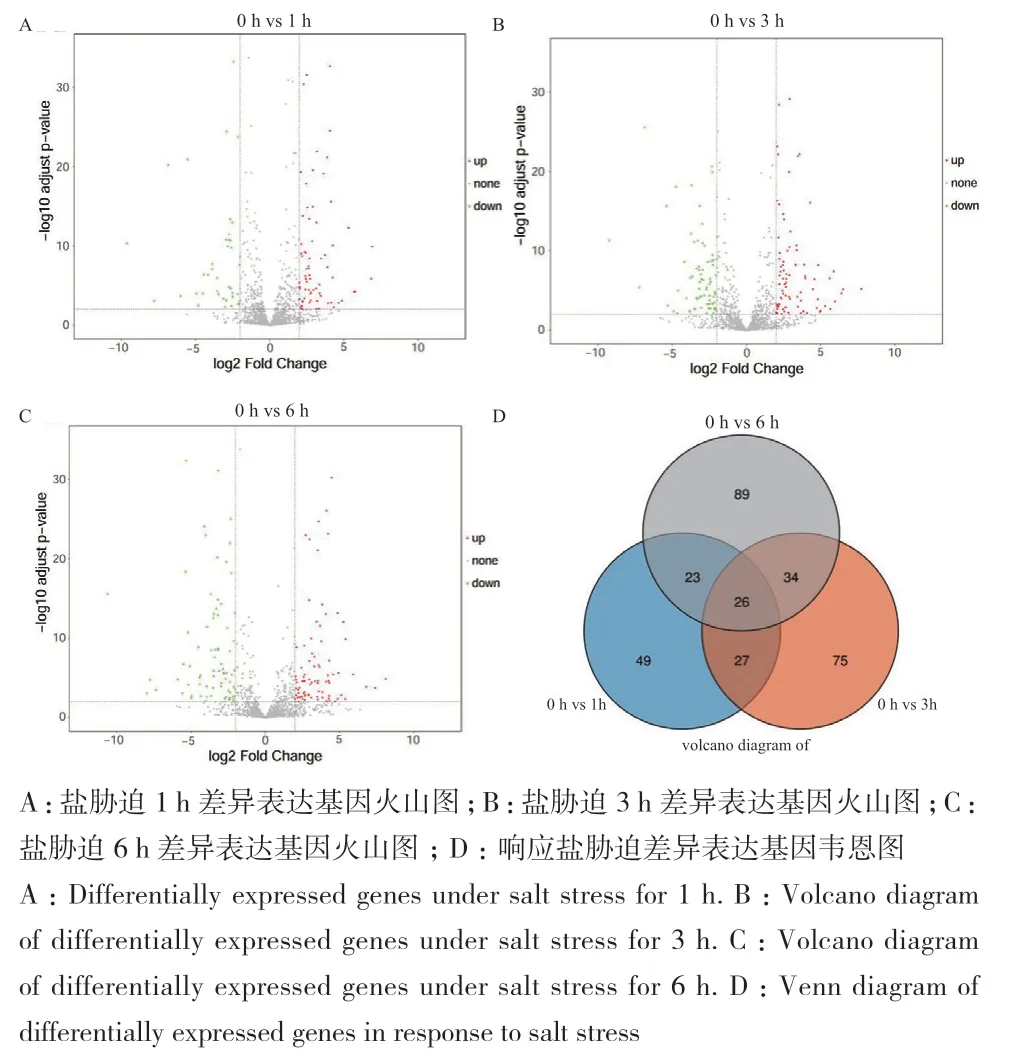
图2 盐胁迫差异表达基因和相同差异表达基因筛选图Fig. 2 Screening of differentially expressed genes(DEGs)and identifical DEGs under salt stress
2.3 基因互作网络与关键基因筛选
26个相同差异表达TF基因主要有:ERF、C2H2、MYB、NAC和HSF家族,其中ERF家族数量最多,占总数的26.9%(图3-A)。利用在线数据库分析26个差异表达TF的蛋白互作关系,筛选出含有14个基因的重要模块(图3-B);在重要模块中,有 6个 HSP70、3个 HSP90、5个 HSF基 因, 其中Os03g0745000和Os06g0553100为关键TF基因(图3-C)。

图3 相同差异表达基因分类、重要模块筛选和关键TF筛选图Fig. 3 Classification of the identical differentially expressed genes,important module and key TF screening
2.4 重要模块基因GO和KEGG富集分析
核心模块中14个基因的GO分析显示分子功能主要富集在ATP结合、细胞组分主要富集在细胞质膜囊泡组分上和生物学过程主要富集在对胁迫的反应上(图4-A-C)。KEGG分析显示14个基因主要富集在内质网蛋白质加工和内吞作用的通路上(图4-D)。

图4 重要模块基因GO和KEGG富集图Fig. 4 GO and KEGG enrichment map of important module genes
2.5 TF基因差异表达验证
为验证测序结果的可靠性,在水稻幼苗经盐胁迫处理1 h后,选取2个已报道盐胁迫相关基因Os03g0322900和Os11g0454300进行qRT-PCR检测,验证盐胁迫处理是否适当;并对Os03g0745000和Os06g05531005两个关键TF基因进行验证。结果显示,在盐胁迫后Os03g0322900和Os11g0454300表达量显著升高(图5-A),表明模拟盐旱胁迫处理适当。Os06g0553100和Os03g0745000两个关键TF基因表达上调与测序结果一致(图5-B),进一步说明了通过转录组鉴定水稻中响应盐胁迫关键TF基因的可靠性。

图5 盐胁迫相关基因表达验证Fig. 5 Expression verification of salt stress related genes
2.6 盐胁迫不同时段相关基因的表达检测
验证测序可靠后,检测了重要模块中4个基因在不同盐胁迫时间点(0、1、3和6 h)的表达水平,相关注释信息(表2)。从图6可以看出,随着盐胁迫时间的延长,两个关键转录因子和热激蛋白的表达量都呈现先上升后下降的表达模式。

图6 盐胁迫不同时段相关基因的表达检测Fig. 6 Expression detection of related genes at different time points of salt stress
3 讨论
TF通过激活或抑制靶标基因的转录表达,在植物应对逆境胁迫的过程中发挥重要作用。目前已鉴定与胁迫相关TF基因家族有NAC、MYB、WRKY、bZIP和ERF/DREB等[8]。本研究对水稻盐胁迫1、3和6 h三个时间点的转录组原始数据进行分析,共有26个相同差异表达TF基因,主要为ERF、C2H2和HSF等家族基因,说明这些TF在参与响应盐胁迫过程中发挥一定的功能。盐胁迫可以引起蛋白质的错误折叠和组装,从内质网中输出错误折叠蛋白质到溶酶体中降解的过程中,需要消耗ATP。研究结果显示重要模块中的14个基因GO分析主要富集在ATP结合、对胁迫的反应和细胞质膜囊泡组上;KEGG分析显示主要富集在内质网蛋白质加工和内吞作用等途径上。HSP70是蛋白质质量控制系统组件之一,在内质网应激中具有重要作用[9]。HSP70的缺失赋予酵母镉耐受性,与HSP101和sHSP共同作用促进细胞毒性聚集物的去除[10];可以通过影响HsfAs和HSP101的活性负调控拟南芥的耐热性[11];拟南芥过表达OsHSP增加了耐热性和耐盐性[12]。Leng等[13]认为 HSP70参与拟南芥的发育调控和非生物胁迫反应。本研究重要模块中14个基因含有6个HSP70基因。热激转录因子(heat shock transcriptional factor,Hsf)通过调控一系列热激蛋白基因的转录和表达,参与生物与非生物胁迫的反应过程。本研究鉴定Os03g0745000和Os06g0553100同属Hsf基因。Os03g0745000受多种胁迫的诱导,与OsHsfB4b相互作用[14-16];在热激反应中OsHsfB4b参与水稻细胞质OsClpB基因的转录调控[17];同一家族成员OsHsfA2e在拟南芥中过度表达可以增强耐热性和耐盐性[18]。本研究表明,随着盐胁迫时间的延长,两个关键Hsf和两个HSP70基因的表达量呈现出先上升后下降的趋势,因此,我们推测这两个Hsf可能通过调控热激蛋白基因的转录表达,影响蛋白质折叠和组装,从而在水稻响应盐胁迫过程中发挥重要作用,但是需要进一步研究来验证。
4 结论
水稻在盐胁迫1 h、3 h和6 h三个时间点共有26个相同的差异表达TF;通过蛋白互作筛选出14个基因的核心模块;GO分析14个基因显著富集在ATP结合、对胁迫的反应和细胞质膜囊泡组上;KEGG分析显著富集在内质网蛋白质加工和内吞作用途径上。鉴定出Os03g0745000和Os06g0553100两个关键Hsf,qRT-PCR检测结果也进一步验证了其可靠性。
