大黄鱼来源波罗的海希瓦氏菌SB-19的hfq基因功能分析
2022-05-09江京洋韦旭航朱军莉冯立芳
江京洋,韦旭航,朱军莉,吴 敏,冯立芳*
(浙江工商大学食品与生物工程学院,浙江 杭州 310018)
大黄鱼(Larimichthys crocea)又称黄鱼、黄花鱼、黄瓜鱼,是我国四大传统海产品(大黄鱼、小黄鱼、带鱼、乌贼)之一,其2019年的全国养殖量22.6万 t,居海水养殖鱼类之首,为我国东南沿海的重要经济鱼类[1]。大黄鱼体色金黄,含有丰富的微量元素、维生素、蛋白质、不饱和脂肪酸,肉质细致滑嫩,深受消费者喜爱,因此大黄鱼的市场需求极大。大黄鱼常因运输工具的颠簸导致死亡,故其常以冷藏方式进行运输和销售。随着冷藏时间的延长,大黄鱼在内源酶作用下发生自溶、脂肪氧化、以及耐冷细菌的繁殖并代谢,导致鱼体腐败和产生臭味变质,这部分适合生存和繁殖的细菌就是水产品贮藏过程中的特定腐败菌[2]。
波罗的海希瓦氏菌(Shewanella baltica)为革兰氏阴性杆菌,隶属交替单胞菌目(Alteromonadales)希瓦氏菌科(Shewanellaceae)希瓦氏菌属[3],能还原氧化三甲胺(trimethylamineN-oxide,TMAO)为三甲胺(trimethylamine,TMA),产生胺类化合物、硫化氢,具有较强的致腐能力,是大黄鱼、南美白对虾等海产品在冷藏过程中常见的特定腐败菌[4-5]。在海产品腐败过程中,特定腐败菌会合成并释放群体感应信号分子——自诱导物(autoinducer,AI),以调控菌体密度和生理行为,并加速海产品腐败变质[6]。在波罗的海希瓦氏菌中已鉴定到两种信号分子——二酮哌嗪类化合物(diketopiperazines,DKPs)和AI-2,二者均参与细菌的群体感应事件[7-8]。
RNA噬菌体Qβ复制酶的宿主因子Hfq是一种RNA分子伴侣蛋白,亦是一个结构保守的六聚体蛋白,存在于革兰氏阳性和阴性菌[9]。Hfq通过正向和负向两种调控方式,调节细菌的小RNA(sRNA)和信使RNA(mRNA)的碱基配对,从而影响翻译的进程和RNA的稳定性[10]。Hfq调控细菌多种代谢通路,影响的生理生化表型包括:生长速率、泳动能力、趋化能力、毒力、抗逆境能力以及群体感应现象等[11]。例如,在哈维氏弧菌(Vibrio harveyi)的群体感应调控系统中,Hfq在细胞密度较低的情况下与群体调控RNA(quorum regulatory RNAs,Qrr RNA)结合,抑制LuxR的转录和降低群体感应现象[12]。在单核细胞性李斯特菌(Listeria monocytogenes)中,hfq基因缺失株的毒力和生物被膜形成能力显著降低[13]。在奥奈达希瓦氏菌(S.oneidensis)中,hfq基因缺失株的指数期生长速率变慢、稳定期细胞密度降低[14]。在大肠杆菌(Escherichia coliK-12)中,hfq基因突变株不仅表现为生长速率变慢和稳定期细胞密度降低,还表现为细胞体积增大、渗透敏感性增强、抗紫外线能力减弱等[15]。但在金黄色葡萄球菌(Staphylococcus aureus)中,hfq基因表达水平较低,且hfq基因缺失株的生长速率和抗逆境能力与对照组无差异[16]。这说明Hfq在不同物种中存在功能趋异现象。
目前有关波罗的海希瓦氏菌中Hfq功能的研究还鲜见报道,亦未知Hfq与水产品腐败的相关性。鉴于此,本实验从波罗的海希瓦氏菌SB-19株中鉴定到1个hfq基因,并构建hfq基因敲除株,通过分析细菌的生长速率、群体感应现象、抗逆境能力、致腐能力,旨在为海产品腐败菌的Hfq功能研究和明晰其致腐机制提供理论基础。
1 材料与方法
1.1 材料与试剂
波罗的海希瓦氏菌SB-19株为本课题组前期分离自冷藏大黄鱼,经生化鉴定和全基因组测序[17],菌株保存于-80 ℃冰箱[17]。
所有培养基 青岛海博生物技术有限公司;聚合酶链式反应(polymerase chain reaction,PCR)扩增、RNA抽提、cDNA反转录试剂盒、实时荧光定量PCR(realtime PCR)检测试剂盒 宝日医生物技术(北京)有限公司;其余生化试剂 国药集团化学试剂有限公司。
1.2 仪器与设备
QuantStudio 6 Flex荧光定量PCR仪 美国Applied Biosystems公司;7890/5975气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)仪 美国安捷伦科技有限公司;970CTR荧光分光光度计 上海精科实业有限公司;Victor X酶标仪 美国PerkinElmer公司;UV2550紫外分光光度计 日本岛津公司。
1.3 方法
1.3.1 Hfq序列分析
以本课题组前期测序、组装、预测后的波罗的海希瓦氏菌SB-19株基因组为对象,构建本地BLAST数据库,将从NCBI网站查找并下载的波罗的海希瓦氏菌、奥奈达希瓦氏菌、腐败希瓦氏菌(S.putrefaciens)以及大肠杆菌Hfq的氨基酸序列进行比对,筛选条件为E-value>103。使用Clustalx软件对筛选所得波罗的海希瓦氏菌SB-19株、希瓦氏菌属和大肠杆菌的Hfq序列进行同源序列比对。
1.3.2 real-time PCR的检测
将活化菌株按照体积分数1‰的接种量接入LB肉汤中,并在30 ℃摇床160 r/min进行培养,每隔4 h取样一次,提取细菌总RNA,样品中DNA残留消化后即反转录为cDNA。以16S rRNA为内参基因,进行real-time PCR扩增,采用2-ΔΔCt法计算hfq基因的相对表达水平[18]。
1.3.3 波罗的海希瓦氏菌hfq基因敲除株的构建
根据波罗的海希瓦氏菌SB-19株的hfq基因及其两侧序列,设计PCR扩增hfq基因上游和下游的同源臂片段引物(表1),然后用PCR扩增和回收纯化。巢式PCR将hfq基因上、下游片段与Cm基因表达框进行连接,按照本课题组前期操作过程[17]进行PCR片段的转染和敲除株的筛选。

表1 实验所用PCR引物Table 1 Primers used for PCR in this study
1.3.4 细菌生长曲线的测定
将活化的波罗的海希瓦氏菌SB-19株野生型(wide type,WT)与hfq基因敲除株(knock out,KO)分别接种到去离子水中,调整菌体浓度107CFU/mL,10 倍梯度稀释至菌体浓度为106CFU/mL后转接至装LB肉汤的试管中,使起始菌体密度约为105CFU/mL,在30 ℃或4 ℃摇床160 r/min进行培养。每隔4 h取100 μL进行平板涂布,在30 ℃培养24 h、4 ℃培养144 h计数,绘制细菌的生长曲线。细菌的生长动力学模型参考李学英等[19]提出的修正后Gompertz方程:
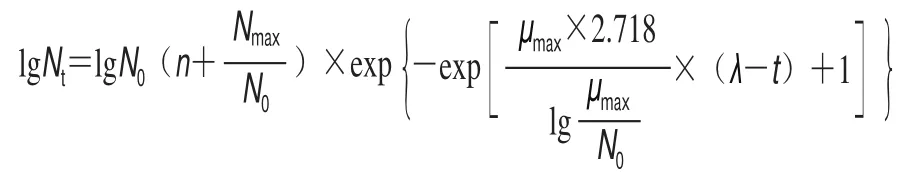
1.3.5 DKPs和AI-2的检测
将活化的WT和KO菌株按照1‰接种于LB肉汤中,并在30 ℃摇床160 r/min进行培养,每隔6 h取样一次。
DKPs的检测:10 000 r/min离心10 min后取上清液,用等体积氯仿萃取并收集有机相,经旋转蒸发后再次用氯仿溶解提取物,定容至1 mL后用GC-MS检测,色谱和质谱条件同本课题组前期操作[20]。DKPs生成量以μg/mL表示。
AI-2的检测:10 000 r/min离心3 min,上清液用0.22 μm滤纸过滤,另将活化后培养至稳定期的哈维氏弧菌BB170用AB培养基作1∶5 000稀释,分别将10 μL待测上清液和90 μL稀释的BB170菌液添加至96 孔酶标板。在30 ℃孵育0.5 h,用荧光分光光度计在490 nm波长处检测荧光强度[8]。AI-2水平以哈维氏弧菌BB170诱导荧光强度表示。
1.3.6 生物被膜的检测
将活化后培养至稳定期的WT和KO菌株按照体积比1∶100分别接种至含LB培养基的96 孔板中,在30 ℃生化培养箱培养24 h。将96 孔板中菌液倾倒干净,随后用无菌水清洗3次,置于超净台风干。每孔加入0.2%结晶紫溶液200 μL,静置染色15 min。弃去结晶紫溶液,用无菌水清洗干净,再用33%冰醋酸溶液溶解,最后用酶标仪测量595 nm处吸光度。
1.3.7 胞外蛋白酶活性的检测
将1.5%琼脂与10%脱脂牛奶混匀后灭菌制备脱脂牛奶琼脂平板,取活化后培养至稳定期的WT和KO菌液5 μL点样,随后置于30 ℃生化培养箱培养24 h,测量蛋白水解圈直径。
1.3.8 细菌抗逆能力的检测
将活化后培养至稳定期的WT和KO菌株按照体积分数1‰接种于不同胁迫条件中,以检测细菌的抗逆境能力。NaCl胁迫:活化菌株接种至含不同质量浓度NaCl(2、3、4 g/100 mL)的LB肉汤中;营养胁迫:活化菌株接种至用灭菌超纯水稀释(1∶2、1∶4、1∶8,V/V)的LB肉汤中;重金属胁迫:活化菌株接种至含不同浓度Cu2+(0.05、0.15、0.3 mmol/L)的LB肉汤中;消毒剂胁迫:活化菌株接种至含不同质量浓度NaClO(0.1、0.15、0.2 g/100 mL)的LB肉汤中。经30 ℃摇床160 r/min培养24 h,然后用紫外分光光度计检测菌液OD600nm。
1.3.9 灭菌鱼汁中挥发性盐基氮(total volatile basic nitrogen,TVB-N)和TMA的测定
灭菌鱼汁的制作过程参照前期实验[17],取新鲜大黄鱼背部肌肉与纯净水按照1∶2(g/mL)混合,均质机拍打成匀浆后煮至70 ℃以沉淀蛋白质,上清液用定性滤纸过滤后煮沸15 min,然后在室温下5 000 r/min离心30 min,再次过滤取上清液,每升上清液中添加终浓度0.1 mol/L磷酸盐缓冲液(0.056 mol/L KH2PO4、0.044 mol/L K2HPO4,pH 6.6)、0.02 mol/L氧化三甲胺、0.4 mmol/LL-半胱氨酸、0.3 mmol/LL-甲硫氨酸,最后经121 ℃高压灭菌制备成灭菌鱼汁。将活化后培养至稳定期的WT和KO菌株按照体积分数1‰接种于灭菌鱼汁中,置于4 ℃生化培养箱。采用半微量定氮法测定鱼汁中的TVB-N生成量,采用苦味酸法测定鱼汁中的TMA生成量[21]。
2 结果与分析
2.1 波罗的海希瓦氏菌SB-19株hfq基因的鉴定与表达规律
Hfq在革兰氏阴性和阳性菌中均有分布,是一个结构保守的蛋白质[9]。在本实验中,经本地BLAST比对后从波罗的海希瓦氏菌SB-19株中筛选到1个Hfq,且其与目前已报道的波罗的海希瓦氏菌完全一致(图1A),与奥奈达希瓦氏菌、腐败希瓦氏菌以及大肠杆菌的Identity值分别为97.8%、98.9%和75.6%,这说明波罗的海希瓦氏菌hfq基因是一个结构保守的基因。Hfq最早发现为大肠杆菌Qβ噬菌体在RNA复制过程中所必需的一种宿主因子,随后又证实Hfq对细菌的生理活动大有裨益,如提高细菌的耐热能力,hfq基因缺失株则表现出较低的环境适应能力和抗逆能力等[22]。由此推测波罗的海希瓦氏菌SB-19株的hfq基因可能具有类似的生物学功能。
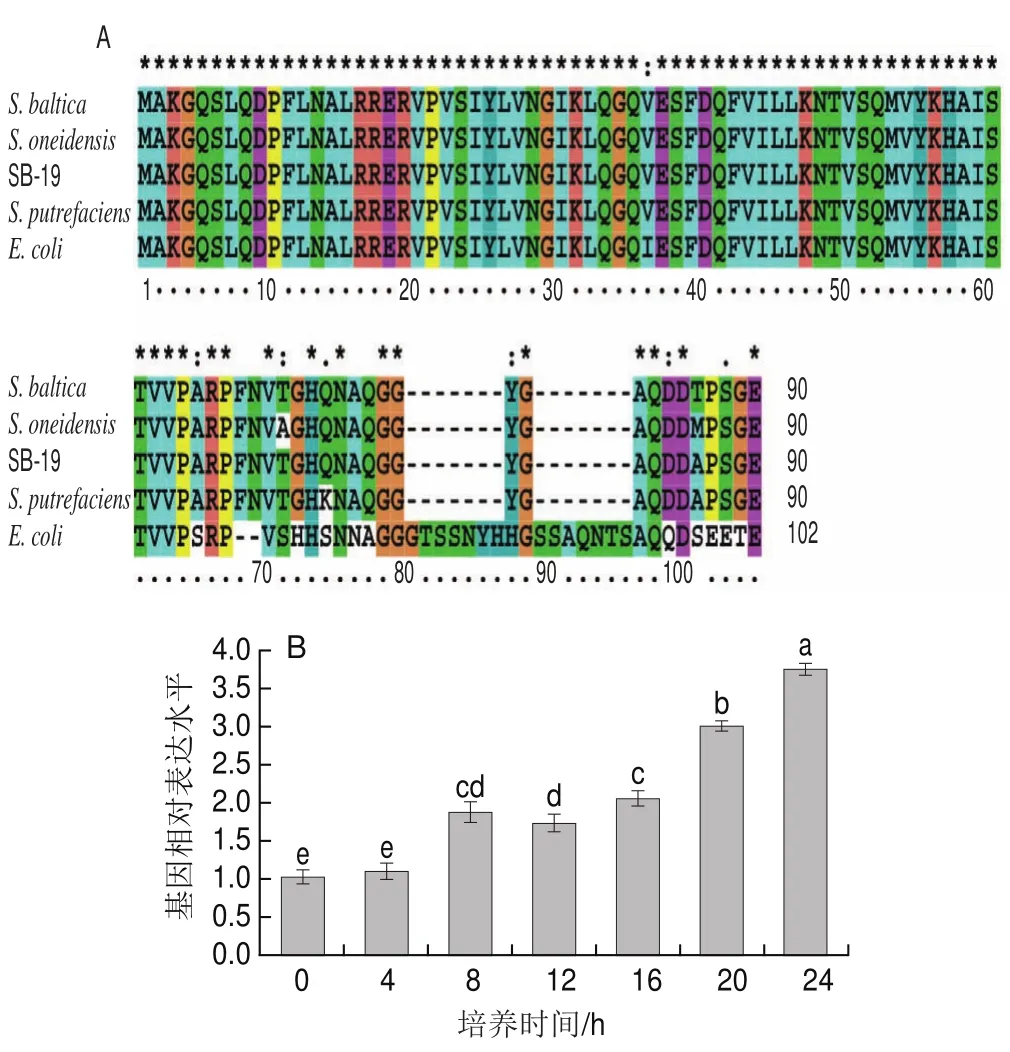
图1 Hfq氨基酸序列比对(A)和hfq基 因表达水平在波罗的海希瓦氏菌生长期间的变化规律(B)Fig.1 Amino acid sequence alignment of Hfq (A) and relative expression level of hfq gene determined by qPCR in S.baltica during a 24 h culture period (B)
为分析波罗的海希瓦氏菌SB-19株hfq基因的功能,检测其在迟缓期、对数期、稳定期这3个重要的细菌生长阶段的表达水平。由图1B可知,在细菌培养至4 h的延缓期,hfq基因表达水平尚未发生显著变化;在细菌进入对数生长时期第8小时,hfq基因表达水平较起始提高了1 倍;此后hfq基因的表达水平持续升高,直至稳定期第24小时,hfq基因表达水平较起始提高了3.7 倍。该现象与铜绿假单胞菌(Pseudomonas aeruginosa)和嗜肺军团菌(Legionella pneumophila)类似,hfq基因表达水平会随着这两种细菌生长时期的推进而提高[23-24]。这说明hfq基因在波罗的海希瓦氏菌SB-19株生长的对数期和稳定期发挥重要作用。
2.2 hfq基因缺失对波罗的海希瓦氏菌SB-19株生长速率的影响
WT株在30 ℃培养条件下生长迅速,一般在20 h左右即可进入稳定期,其最大比生长速率(μmax)为0.203 7,稳定期的最大细菌数为8.31f0.11(lg(CFU/mL))。hfq基因KO株在30 ℃培养条件下,其生长曲线与WT株接近,只是在对数期的生长速率相对略低,其μmax为0.170 5,稳定期的最大细菌数为8.25f0.12(lg(CFU/mL)),与WT株的细菌密度无显著性差异(图2A)。Brennan等[14]发现奥奈达希瓦氏菌中,hfq基因的缺失会导致突变株的生长速率变慢,稳定期的细菌密度降低;但Bohn等[16]观察到金黄色葡萄球菌的hfq基因突变株生长速率与对照组接近。表明hfq基因在不同菌株内发挥不同程度的生物学效应,而当波罗的海希瓦氏菌SB-19株处于最佳生长条件下,hfq基因为非必要因子。
在4 ℃低温培养条件下,WT株生长速率显著降低,μmax为0.030 1,但其稳定期的最大细菌数(8.16f 0.13(lg(CFU/mL)))接近于30 ℃培养条件。然而KO株在4 ℃低温培养条件下生长速率更低,其μmax仅为0.010 2,且稳定期的最大细菌数较相同条件下WT株降低了约2个数量级(图2B)。此结果提示hfq基因有助于波罗的海希瓦氏菌SB-19株抵御低温胁迫,即该基因可能参与细菌的抗环境胁迫过程。
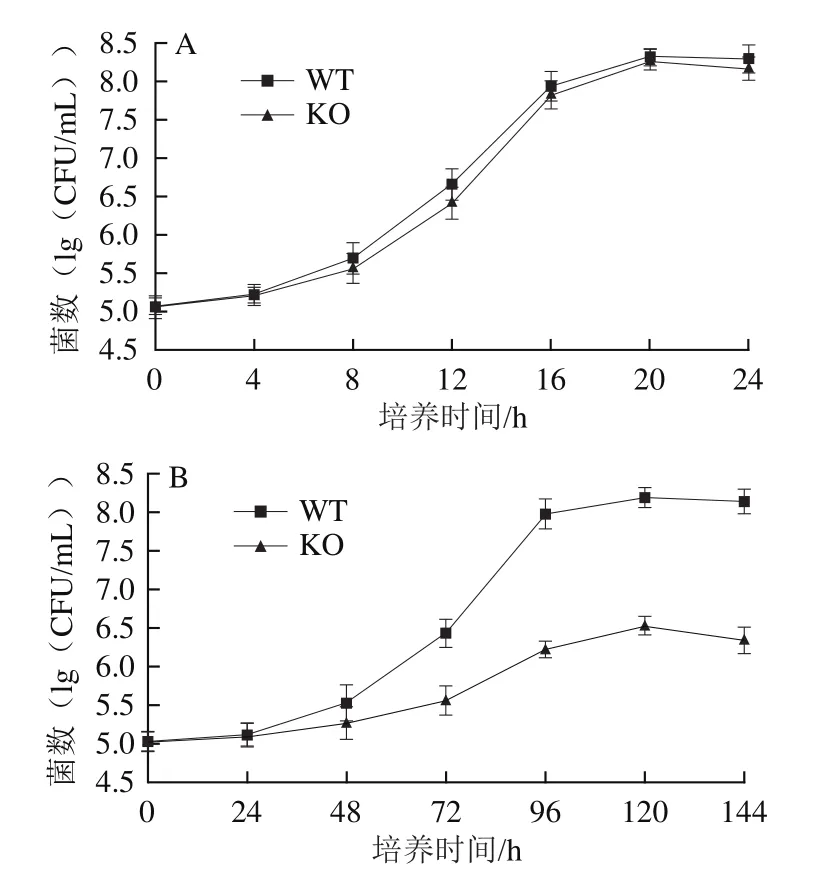
图2 WT株和KO株在30 ℃(A)和4 ℃(B)的生长曲线Fig.2 Growth curves of WT and KO strains at 30 (A) and 4 ℃ (B)
2.3 hfq基因对波罗的海希瓦氏菌SB-19株信号分子分泌和群体感应的影响
波罗的海希瓦氏菌在生长过程中会产生群体感应现象,其分泌的信号分子DKPs和AI-2均调控细菌的群体感应过程[8,17]。DKPs是由两个氨基酸经肽键连接而成的环二肽,存在于细菌、放线菌、真菌等,具有抗菌、神经保护、免疫抑制等多种生物学活性和药理学活性[25]。在细菌30 ℃培养的最初6 h,WT株和KO株的DKPs生成量非常接近,培养12 h,WT株的DKPs生成量达到(10.46f 0.34)μg/mL,显著高于KO株的(9.21f0.32)μg/mL(图3A);而此时WT株的细菌数(6.65f0.20(lg(CFU/mL)))也高于KO株(6.41f0.21(lg(CFU/mL)))(图2A),所以WT株与KO株之间DKPs的差异可能是由细菌数量的不同所造成。随着培养时间的延长(18 h和24 h),细菌进入稳定期,此时细菌对DKPs的消耗量大于生成量,培养液中DKPs含量逐渐降低,KO株的DKPs生成量略高于WT株,无显著差异,这说明hfq基因不参与信号分子DKPs的分泌过程。AI-2在革兰氏阳性和阴性细菌中均有发现,是细菌种间交流的信号分子,参与生物被膜形成等群体感应现象[26]。WT株和KO株在24 h内均以接近水平生成AI-2,且KO株AI-2水平在12~24 h期间略高于WT株(图3B),这表明hfq基因同样不参与信号分子AI-2的分泌过程。
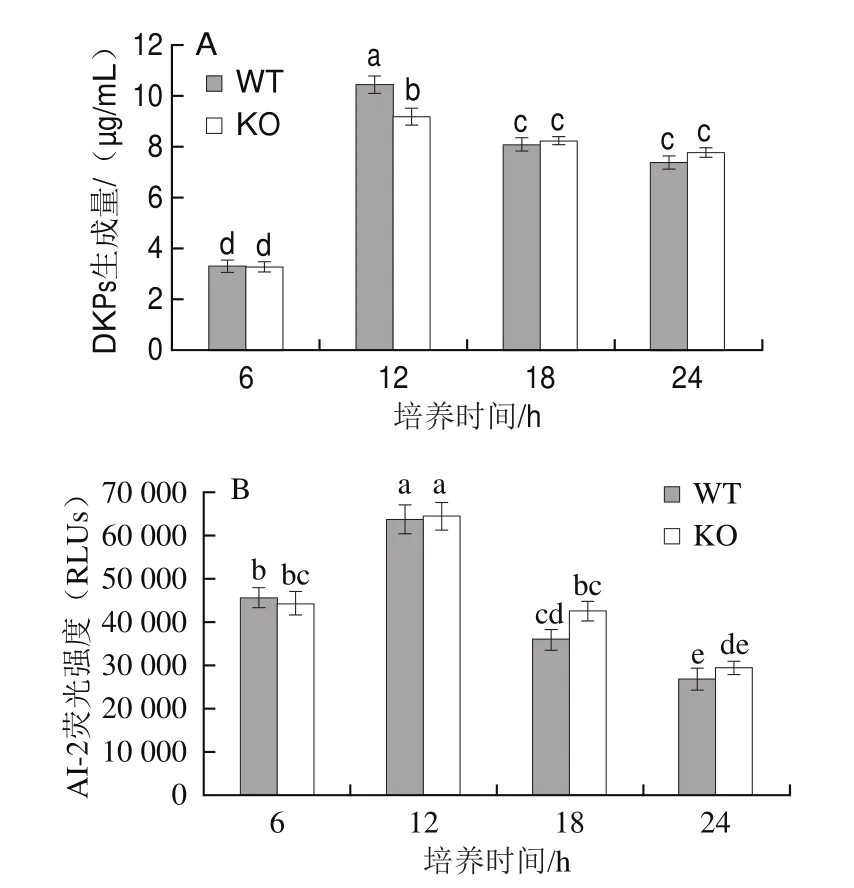
图3 WT株和KO株分泌信号分子DKPs(A)和AI-2(B)的水平Fig.3 Levels of DKPs (A) and AI-2 (B) secreted by WT and KO strains
生物被膜是微生物在附着表面分泌的带有黏性基质的胞外聚合物,有助于增强微生物抵御环境胁迫的能力[27]。经培养24 h后,WT株的生物被膜形成量高于KO株,且二者存在显著差异(P<0.05)(表2),说明hfq基因参与波罗的海希瓦氏菌SB-19株的生物被膜形成过程。在单核细胞性李斯特菌中也有类似现象,其hfq基因缺失株不仅表现为生物被膜形成能力降低,而且对小鼠的致毒能力也明显下降[13];嗜水气单胞菌有2个hfq基因拷贝,hfq2基因缺失株会表现出生物被膜形成能力的降低[28],推测hfq基因参与细菌的群体感应调控通路,与其生物被膜的形成密切相关。
腐败菌通过分泌胞外蛋白酶水解水产品中的蛋白质和氨基酸,以获取自身繁殖所需的营养物质,这进而加剧水产品的腐败变质。在波罗的海希瓦氏菌中添加信号分子DKPs会促进细菌胞外蛋白酶的活性和增强致腐能力[17]。在本实验中,WT株和KO株经培养24 h后,WT株的胞外蛋白酶水解圈直径显著大于KO株(P<0.05)(表2),说明hfq基因也参与了波罗的海希瓦氏菌SB-19株的胞外蛋白酶分泌过程,即Hfq调控该菌的群体感应事件,但不参与信号分子的分泌过程。

表2 培养24 h WT株和KO株的生物被膜和胞外蛋白酶水解活力Table 2 Biofilm formation ability and extracellular protease activity of WT and KO strains
2.4 hfq基因对波罗的海希瓦氏菌SB-19株抗逆境能力的影响
在单核细胞性李斯特菌中,hfq基因的缺失会导致突变株对高盐、乙醇、H2O2的适应能力显著降低[29],大肠杆菌中hfq基因的缺失也会降低其抗紫外线能力[15]。与对照组相比,在NaCl暴露条件下,2 g/100 mL NaCl略微促进了WT株和KO株的生长,而随着NaCl质量浓度的提高,WT株和KO株菌株密度均降低,且KO株始终低于WT株(图4A)。在营养胁迫条件下,当LB营养肉汤添加量为1/2时,WT株与KO株的OD600nm分别较对照组减少了19.07%与62.87%;随着LB营养肉汤含量的持续降低,WT株与KO株的OD600nm持续降低,但KO株始终低于WT株(图4B)。在重金属胁迫条件下,0.05 mmol/L Cu2+不影响WT株的密度,但此时KO株OD600nm较对照组降低了33.31%;当Cu2+浓度继续升高,WT株也表现出密度降低,只是相同条件下其OD600nm高于KO株(图4C)。在消毒剂胁迫条件下,0.1 g/100 mL NaClO不干扰WT株的生长,而此时KO株非常敏感,密度较对照组降低了75.31%;NaClO质量浓度为0.15 g/100 mL时,WT株OD600nm较对照组降低了60.90%,KO株此时几乎不生长(图4D)。上述结果表明,Hfq参与了波罗的海希瓦氏菌SB-19株对盐分、营养、重金属、消毒剂等胁迫环境的适应过程,推测其通过影响sRNA与mRNA二者之间的结合来调节抗逆基因翻译或蛋白质降解,从而改变细菌的环境适应能力,hfq基因缺失降低了波罗的海希瓦氏菌SB-19株的抗逆境能力。
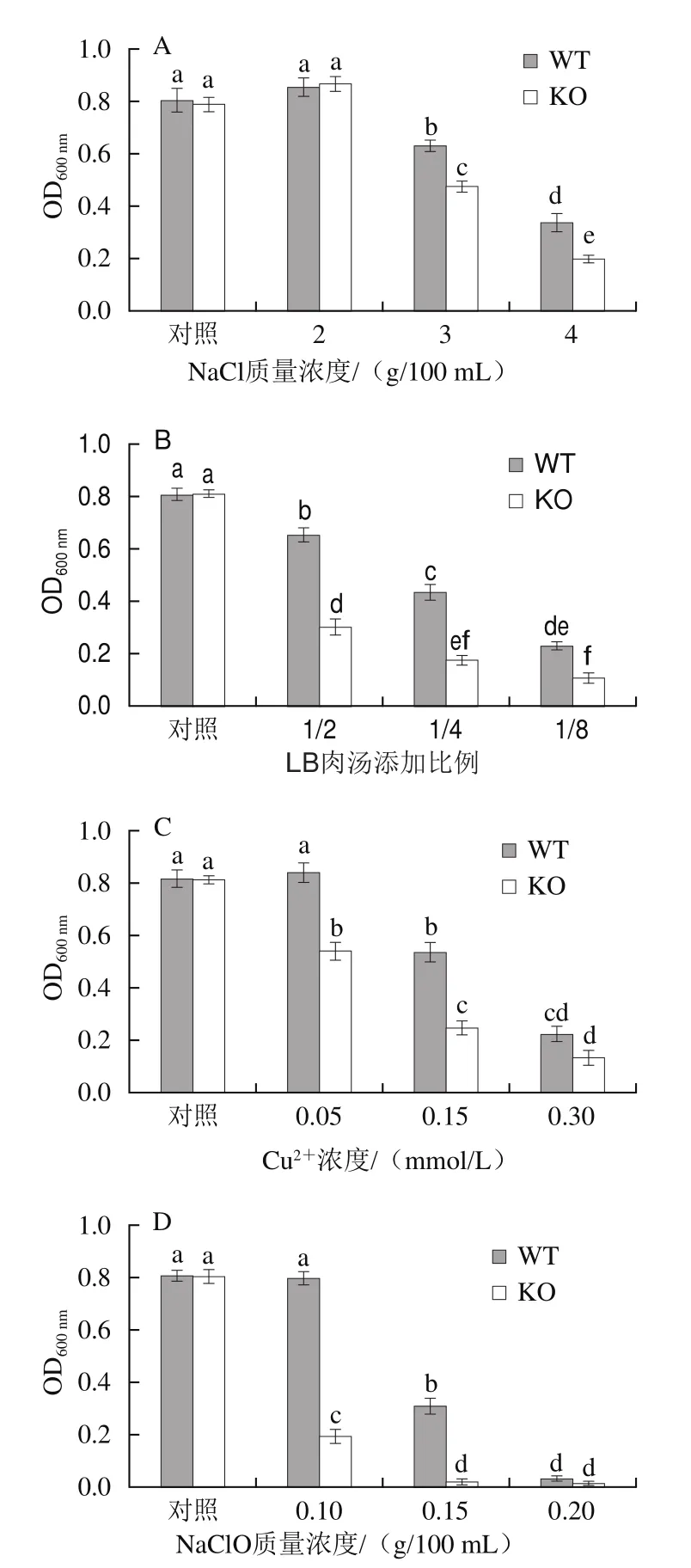
图4 WT株和KO株抗NaCl(A)、营养(B)、重金属Cu2+(C)和NaClO(D)胁迫Fig.4 Resistance of WT and KO strains to salt (A), nutrient (B), heavy metal (C), and disinfectant (D)
2.5 hfq基因对波罗的海希瓦氏菌SB-19株致腐能力的影响
水产品中蛋白质在腐败过程中被分解为氨和胺类等碱性含氮物质,即TVB-N;海水鱼富含TMAO,在腐败菌作用下TMAO脱氧还原成有臭味的TMA,因此TVB-N和TMA含量已成为鉴定水产品腐败的重要指标[2]。在4 ℃冷藏条件下,接种WT株和KO株的灭菌鱼汁内TVB-N和TMA含量随着培养时间的延长而持续增加。在培养3 d,接种WT株的鱼汁内TVB-N质量浓度达到(35.55f 3.32)mg/100 mL,超过了30 mg/100 mL的感官可接受阈值[30];接种KO株的鱼汁在培养第4天时超过此阈值,且其所产生TVB-N含量始终低于同一时期WT株(图5A)。TMA生成规律与TVB-N相似,接种WT株的灭菌鱼汁在相同培养时间始终高于KO株(图5B);上述TVB-N和TMA含量的变化说明hfq基因缺失后波罗的海希瓦氏菌SB-19株的致腐能力也相应减弱。hfq基因缺失削弱了波罗的海希瓦氏菌SB-19株的致腐能力。
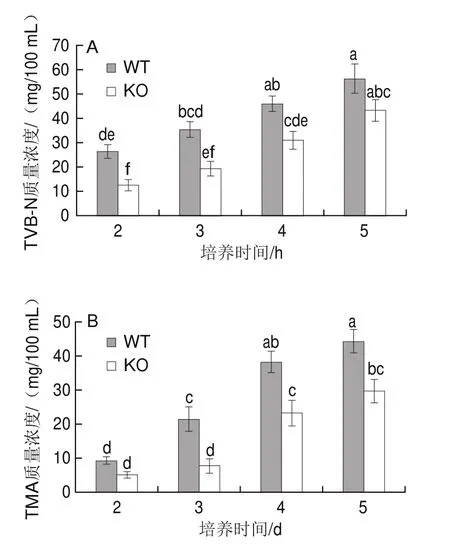
图5 接种WT株或KO株灭菌鱼汁的TVB-N(A)和TMA(B)生成量Fig.5 Levels of TVB-N (A) and TMA (B) in sterilized fish juice inoculated with WT or KO strain
Hfq在RNA翻译水平存在正负两种调控途径:1)负向调控:Hfq与调控靶标mRNA的sRNA结合,阻止靶标mRNA在核糖体就位,进而阻碍靶标mRNA的翻译;有些靶标mRNA的5’非翻译区碱基发生自我配对形成茎环结构,也会阻碍靶标mRNA的翻译;2)正向调控:Hfq与调控靶标mRNA的sRNA结合,形成的复合体阻止靶标mRNA在5’非翻译区形成茎环结构,保证后续的翻译顺利进行[10]。哈维氏弧菌中Hfq以负向调控方式发挥作用:当细胞密度较低时,Qrr1-5产生的sRNA在Hfq作用下会抑制受体蛋白LuxR的表达;当细胞密度较高时,qrr基因不发生表达,失去Hfq抑制的LuxR结合信号分子,进而激活下游的群体感应事件,如诱导细菌发出荧光[12]。对于波罗的海希瓦氏菌SB-19 WT株,随着细菌密度的增加,其所分泌的信号分子水平升高,hfq基因表达水平也随之上升,细菌表现出的群体感应现象和灭菌鱼汁的腐败程度愈发明显;而对于KO株,随着细菌密度的增加,虽然其分泌的信号分子水平与WT株接近,但其群体感应和灭菌鱼汁的腐败程度却低于同时期的WT株,这说明波罗的海希瓦氏菌SB-19株的Hfq以正向调控方式发挥作用,这为今后研究海产品中特定腐败菌的致腐能力奠定了理论基础。
3 结 论
波罗的海希瓦氏菌SB-19株中存在一个hfq基因,且该基因表达水平随着细菌的生长而升高;在4 ℃培养条件下,与WT株相比,KO株的生长速率明显迟滞且稳定期细菌密度较低,显示hfq基因在波罗的海希瓦氏菌SB-19株的生长对数期和稳定期发挥重要作用。WT株与KO株所分泌信号分子DKPs和AI-2水平接近,可见hfq基因不参与信号分子的分泌过程;然而,KO株却表现为更低的生物被膜形成能力和胞外蛋白酶活性;接种KO株的灭菌鱼汁也产生较少的TVB-N和TMA,说明Hfq正向调控波罗的海希瓦氏菌的群体感应事件,但不参与信号分子的分泌过程。此外,KO株对盐分、营养、重金属、消毒剂等胁迫条件更为敏感,推测Hfq通过影响sRNA与mRNA二者之间的结合来调节抗逆基因的翻译或蛋白质的降解,从而改变细菌的环境适应能力。综上所述,波罗的海希瓦氏菌SB-19株中Hfq是一个全局性调控因子,整体调节该菌的诸多生理活动。本实验为波罗的海希瓦氏菌的基础生物学研究和海产品微生物的致腐机制提供理论基础。
