马铃薯糖苷生物碱对枸杞根腐病的诱抗效应及抗性相关酶活性的影响
2022-05-09张金花何静张小彦李彦湘张恒张树衡丁德东李柄霖
张金花,何静,张小彦,李彦湘,张恒,张树衡,丁德东,李柄霖
(甘肃农业大学林学院,甘肃 兰州 730070)
枸杞根腐病是一种危害性很大的维管束系统病害,在枸杞整个生育期都可发病,一般于6月中旬发病,7~8月为发病盛期[1]。主要危害根茎部和根部,发病初期病部呈褐色至黑褐色,逐渐腐烂,后期外皮脱落,只剩下木质部,剖开病茎可见维管束褐变[2],发病初期不易发现,一经发现,则被害根部腐烂已经很严重,难以治愈,是一种毁灭性病害[3]。腐皮镰刀菌(Fusariumsolani)是该病的主要致病菌之一[4]。该菌在土壤中以菌丝体形式长期存活,从植株的根部入侵,沿维管束扩展蔓延,最终导致植株死亡[3]。近几年来,随着枸杞栽培面积快速增加,枸杞根腐病害也随之增加,给杞农造成了很大损失[5]。现阶段化学防治是控制该病害的主要手段,生产上一般采用石硫合剂、代森锰锌、50%托布津可湿性粉剂、40%灭病威等进行灌根处理[6]。然而,化学药剂的大量使用会带来诸多负面影响,如生产成本高、污染环境、破坏生态平衡以及对人畜健康也存在潜在威胁[7]。因此寻找安全、无污染的绿色防控措施已成为当务之急。近年来活性物质诱导植物产生抗病性的研究成为植物病害防控的新兴领域[8],目前己发现多种活性物质具有明显的诱导抗性作用,如苦参碱[9]、丁香酚[10]、桂枝主要活性物质[11]和姜黄素类似物等[12]。
诱导植物抗病性,别称系统获得抗性(SAR),即利用生物或非生物因子预先处理植物,使原来的感病反应产生局部的或系统的抗病性[13],已经成为植物病害防治中很有发展前景的技术途径之一,对生产无公害植物产品更具有重要的意义[14],是生物防治的延伸,是目前植物病害防治研究领域的热点之一。马铃薯糖苷生物碱(potato glycoalkaloids,TGA)是马铃薯产生的一类次级代谢产物,属于甾体类物质,主要成分为α-茄碱和α-查茄碱[15],约占总糖苷生物碱含量的95%[16]。研究表明,马铃薯糖苷生物碱是一种植物源活性物质,具有广泛的生物活性[17],具有对环境污染小易降解,且资源丰富可再生等优点[18],因此有很好的药用价值和开发潜力[19],除此之外,具有一定的毒性,可以帮助植物抵抗和防御外界有害物的侵染或生长[20],从而增强植物的抗病性。目前,马铃薯糖苷生物碱在食品、医药、饲料等领域中的功能已经得到广泛认可[21],关于马铃薯糖苷生物碱对枸杞根腐病的诱导抗性方面的研究还鲜有报道。
本研究以马铃薯糖苷生物碱为材料,通过其对枸杞根腐病的诱导抗性作用发挥的最佳浓度、最佳间隔期与持续时间以及对枸杞PPO、POD、SOD、PAL抗性相关酶酶活性的研究,以探明其对枸杞根腐病的诱抗效应,以期为枸杞根腐病生物防治新途径提供理论参考.
1 材料与方法
1.1 材料
1.1.2 供试材料 供试枸杞为宁杞1号2年生盆栽苗,供试药剂为马铃薯糖苷生物碱。
1.1.3 供试菌种 供试菌种为枸杞根腐病病原菌—腐皮镰刀菌(Fusariumsolani),由甘肃农业大学林学院森林保护实验室提供,试验前在PDA(马铃薯葡萄糖琼脂培养基,potato dextrose agar)平板上纯化备用。
1.2 方法
1.2.1 马铃薯糖苷生物碱的提取 马铃薯糖苷生物碱的提取采用乙酸-氨水沉淀法[22],即得质量浓度为5.000 0 g/mL。根据显色原理可在530 nm处测定消光值,从标准曲线上查出样品液TGA浓度,计算出TGA含量为0.502 5 mg/g。
1.2.2 诱导效应研究 (1)诱导效果最佳浓度的筛选:选用生长状况大致相同的健壮枸杞苗株,分别用0.312 5、0.625 0、1.250 0、2.500 0、5.000 0 g/mL TGA 2 mL根茎注射[23](皮层多点注射)处理5 d后挑战接种(以甲醇+接种、清水+接种为对照),采用伤根灌根法[24]每盆接种1.0×106个/mL菌悬液500 mL(取生长7 d的腐皮镰刀菌),每个处理5盆,3次重复。接种后插上编号标签,每隔2 d浇灌清水保持土壤湿润,各处理于接种后第20天调查叶和根的发病情况,以枸杞叶和根的病情指数计算诱导抗性效果。(2)诱导抗性最佳间隔期与持续时间的测定:基于上述试验,2.500 g/mL TGA 2mL诱导枸杞后第1、5、10、15、20、25、30、35天分别挑战接种,以确定抗性最佳间隔期及持续期,并在最佳间隔期重复诱导,按上述方法和材料挑战接种,统计及诱导效应计算同上。
1.2.3 病情指数分级标准 枸杞叶片发病程度分级参考方中达《植病研究法》[25],枸杞根部发病程度分级参考李姝江方法[26],分级标准如下:Ⅰ级:叶片萎蔫数<植株叶片总数10%,无脱落,代表值0;Ⅱ级:叶片萎蔫数占叶片总数11%~30%,无脱落,代表值1;Ⅲ级:叶片萎蔫数占叶片总数31%~50%,有少量脱落,代表值2;Ⅵ级:叶片萎蔫数占叶片总数51%~70%,有少量脱落,代表值3;Ⅴ级:叶片萎蔫数占叶片总数70%以上,部分脱落,代表值4。Ⅰ级:根部健康,代表值0;Ⅱ级:根茎部表皮褐变,剖开茎部褐变面积少于5%,根须腐烂在15%以下,代表值1;Ⅲ级:根茎部表皮褐变腐烂或剖开茎部褐变面积在5%~30%,根须腐烂在30%以下,代表值2;Ⅵ级:根茎部表皮明显褐变,茎部褐变面积大于30%~50%,根须腐烂在50%以下,代表值3;Ⅴ级:根部明显腐烂,茎部褐变面积大于50%,代表值4。参照张中霄[27]等人的方法计算病情指数。


1.2.4 取样及抗性相关酶酶活性的测定 马铃薯糖苷生物碱诱导+接种标记为TGA,对照甲醇+接种、清水+接种分别标记为JCK、QCK,然后每5 d 10:00 定时采样 1 次,迅速用蒸馏水将泥沙洗净,所有采集的样品均来自植株根部,称取0.500 0 g用锡箔纸包好后做好标记,放入液氮中速冻,然后放入-80 ℃冰箱保存备用。
POD活性测定[28]:取样品0.5 g加少量提取介质(含1% PVP的50 mmol/L pH 7.8 PBS)冰浴研磨匀浆,于4 ℃、10 000 r/min下离心20 min,上清液即为待测酶液;反应体系:2.6 mL 0.3%愈创木酚、0.3 mL 0.6% H2O2、0.1 mL酶液。测定2 min内D470值的变化。(2)PPO活性测定[29]:取样品0.5 g加2.0 mL预冷的提取缓冲液,冰浴研磨匀浆,于4 ℃下10 000 r/min离心20 min,上清液即为待测酶液;反应体系:0.1 mL酶液,2.0 mL 50 mmol/L pH7.5 PBS,0.5 mL 0.1 mol/L邻苯二酚,加入邻苯二酚启动反应,测定2 min内D420处吸光值变化,酶活性以每小时内吸光度变化0.01为1个活性单位(U)酶活性单位为U/(h·g)。(3)SOD活性测定[30]:取样品0.5 g加入2.0 mL预冷的提取介质,冰浴研磨匀浆,于在4 ℃、10 000 r/min离心20 min。反应体系:1.5 mL 50 mmol/L pH 7.8磷酸缓冲液、0.3 mL 130 mmol/L L-蛋氨酸、0.3 mL 750 μmol/L氯化硝基四氮唑蓝、0.3 mL 100 μmol/L EDTA-Na2、0.5 mL蒸馏水、0.3 mL 20 μmol/L 核黄素、加入100μL酶液后在25 ℃,3 000~4 000 lx的光照20 min,测定560 nm的吸光值,酶活性采用抑制NBT光化学还原50%为SOD酶的一个活性单位(U)表示。(4)PAL活性测定[28]:取样品0.5 g加5.0 mL提取介质(含0.05 mol/L硼酸缓冲液、2% PVP、5.0 mmol/L巯基乙醇、1 mmol/L EDTA-Na2),冰浴研磨匀浆,于4 ℃、10 000 r/min下离心20 min;反应体系:1.0 mL酶液,加入1.0 mL 0.02 mol/L L-苯丙氨酸,2.0 mL 0.1 mol/L硼酸缓冲液,1.0 mL蒸馏水,对照以提取介质为底物,不加L-苯丙氨酸,摇匀后置于30 ℃水浴保温60 min,加0.2 mL 6 mol/L HCL终止反应,对照管调零,测定波长290 nm的吸光度值,以每小时D290增加0.01为一个酶活性单位(U)。
1.3 数据分析
本试验数据采用Microsoft Excel 2016、Origin 2018软件完成,试验数据统计及方差显著性分析利用SPSS 22.0软件,采用单因素方差分析和Duncan新复极差法进行差异显著性检验,显著性水平为P<0.05。
2 结果与分析
2.1 诱导浓度对枸杞根腐病的诱导效果
由表1可知:质量浓度0.312 5~5.000 0 g/mL马铃薯糖苷生物碱对枸杞根腐病均具有一定的诱导效果,以2.500 0 g/mL诱导效果最显著,其病情指数、诱导效果与对照组JCK、QCK相比差异显著(P<0.05);叶和根的发病指数分别为33.33和31.67,病情指数分别下降了61.54%、62.27%、62.74%、64.15%;叶和根的诱导效果分别为62.31%、64.05%。叶:处理组不同质量浓度与对照组之间的病情指数差异均显著,且病情指数呈现先下降后上升的趋势,诱导效果与病情指数呈现的规律成负相关;其中,JCK与QCK对照组相比,其病情指数无显著性差异。以QCK为对照,JCK对照组对叶和根的诱导效果分别为5.16%、-0.47%,与其他处理组相比,JCK的诱抗作用较弱,说明甲醇对枸杞的影响比较小。试验结果表明:在0.312 5~5.000 0 g/mL质量浓度范围内,随质量浓度的增加枸杞叶和根的病情指数基本呈现由大到小的规律,诱导效果呈现由弱变强的规律;但到一定的浓度不再增加,质量浓度5.000 0 g/mL处理下叶和根的病情指数略大于2.500 0 g/mL。综上所述,质量浓度2.500 0 g/mL马铃薯糖苷生物碱对枸杞叶片和根部的诱导效果达62.00%以上,能够诱导枸杞获得系统抗病性。

表1 诱导浓度对枸杞根腐病的诱导效果
2.2 诱导抗性最佳间隔期与持续时间测定
由图1可知,随着诱导时间的递增,质量浓度2.500 0 g/mL 马铃薯糖苷生物碱对枸杞根腐病的诱导效果基本呈现先上升后下降的趋势,在30 d呈现略微上升的趋势。在诱导1~35 d时间范围内,马铃薯糖苷生物碱诱导枸杞抗根腐病的抗性效果在第10天达高峰,叶和根的诱导效果分别为62.20%、58.34%,第30天开始减退,因此,马铃薯糖苷生物碱对枸杞抗根腐病的抗性最佳间隔期和持续期分别为10 d、30 d;第35天与第30天相比,其抗性效果均略有上升的趋势,该趋势有可能与挑战接种的方式方法、机械损伤以及滞后诱导等有关。马铃薯糖苷生物碱诱导枸杞的抗性效果与对照JCK相比,叶和根的诱导效果均明显增强,且在诱导1~35 d时间范围内,JCK对枸杞的抗性效果比较弱,其病情指数之间无显著性差异,与马铃薯糖苷生物碱诱导枸杞抗根腐病的抗性效果的规律基本一致。可见,质量浓度2.500 0 g/mL 马铃薯糖苷生物碱诱导枸杞根腐病的抗性最佳间隔期为10 d,抗性持续期为30 d。
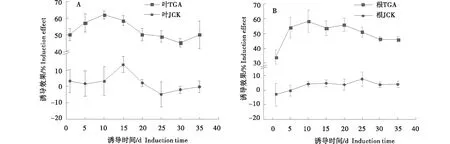
TGA:马铃薯糖苷生物碱;JCK:甲醇对照;诱导效果均以QCK为对照进行数据分析。TGA:Potato glycoalkaloids;JCK:methanol control;The induction effect was analyzed with QCK as the control.图1 诱导抗性最佳间隔期与持续时间的测定Figure 1 The best interval and duration of induced resistance
2.3 枸杞抗性相关酶活性的变化
2.3.1 马铃薯糖苷生物碱对枸杞POD活性的影响 枸杞经2.500 0 g/mL的马铃薯糖苷生物碱诱导处理后, 其POD活性随诱导时间的增大呈先升高后降低的趋势,在30 d后略微上升,对照组的POD活性变化起伏不大,相对比较平缓。2.500 0 g/mL马铃薯糖苷生物碱处理组枸杞的POD活性第10、15、20天的 POD活性均高于对照组,其余时间低于对照组;在诱导第10天,处理组的 POD 活性达到峰值为2.447 6 g/min,对照组JCK、QCK的POD 活性分别为1.799 6 g/min、1.443 3 g/min,处理组较对照组相比JCK、QCK升高了41.03%、26.47%(图2-A)。
2.3.2 马铃薯糖苷生物碱对枸杞PPO活性的影响 2.5 g/mL马铃薯糖苷生物碱处理组和对照组枸杞PPO活性总体变化趋势均表现为先上升后下降,与对照组的趋势基本一致。处理组在第10天时明显高于对照组,PPO活性达到最高,为0.029 0 g/min,而对照组JCK较处理组延迟1 d,在第15天升至最高达0.016 5 g/min,对照组JCK整体大于QCK;处理组在第10天时处理组的PPO活性分别较对照组JCK、QCK升高了63.61% 、6.77%(图2-B)。
2.3.3 马铃薯糖苷生物碱对枸杞SOD活性的影响 2.500 0 g/mL马铃薯糖苷生物碱处理组和对照组枸杞SOD活性呈迅速上升又缓慢下降的趋势,处理组的SOD活性在第5、10、15天均高于对照组。在诱导第15天时,处理组的SOD活性达到峰值,为264.147 0 U;处理组的SOD活性分别较JCK、QCK对照组升高了28.40% 和16.53%,表明马铃薯糖苷生物碱诱导的枸杞后表现出了一定的抗性(图1-C)。
2.3.4 马铃薯糖苷生物碱对枸杞PAL活性的影响 2.500 0 g/mL马铃薯糖苷生物碱处理枸后,PAL被诱导激活,活性增强,诱导第1天、30天处理组PAL活性低于JCK、QCK对照组,其余时间处理组均高于JCK对照组,其中,诱导第25天对照组PAL活性略低于处理组;处理组的PAL活性在第1天略有下降,至第5天迅速上升,第10天达到最高峰,为5 007.952 6 U,较JCK、QCK对照组分别提高了18.73%、19.06%,之后有所降低,但均高于对照组而对照组的PAL活性变化趋势不明显,变动幅度较小且趋于平缓(图1-D)。

TGA:马铃薯糖苷生物碱;JCK:甲醇对照;诱导效果均以QCK为对照进行数据分析。TGA:Potato glycoalkaloids;JCK:methanol control;The induction effect was analyzed with QCK as the control.图2 马铃薯糖苷生物碱诱导对枸杞抗性相关酶活性的影响Figure 2 Potato glycoalkaloids inductionon the activities of resistance related enzymerelated toLycium barbarum
3 讨论
马铃薯糖苷生物碱是一种具有多种功能植物源活性物质,具有低残留,对非靶标生物安全和不易产生抗药性等优点[31]。而且由于植物自身存在化学防御物质,该物质能通过防御相关基因的增强表达和抗病性相关化合物的增量合成提高植物的抗病性[32]。诱导因子施用的时机和浓度会直接影响诱导植物抗性的效果。诱导抗性只有发生在诱导物最适浓度、诱导间隔最大期时才能发挥最大效率。研究表明,不同浓度马铃薯糖苷生物碱可降低枸杞根和叶的病情指数,具有诱导枸杞对根腐病的抗性效应,且全株表现出系统抗病性;且诱导效果随着挑战接种时间间隔的延长呈现先增强后减弱的趋势,马铃薯糖苷生物碱对枸杞根腐病的抗性最佳间隔期为10 d、诱导抗性持续期为30 d。
本研究发现,马铃薯糖苷生物碱2.500 0 g/mL诱导效果最好,当浓度高于2.500 0 g/mL时,诱导效果则有所下降。表明在一定的浓度范围内,诱导剂可能与其诱导植物获得的抗病性呈正相关,当诱导剂浓度达到一定阈值时,能够充分激活植株体的相关抗病防御机制,但超过该浓度范围时,诱导剂对植株的诱导效果诱导效应不再增强反而降低诱导抗性的有效性,与王守正[33]、Dean等[34]的研究结果一致;与这可能与较高浓度的生物碱影响或干预了植株的正常代谢,甚至产生药害,影响植株的正常生长。许多研究表明,诱导处理和挑战接种的时间间隔长短会影响到诱导抗性的表现和诱导效果的好坏,这与植物对诱导刺激发生免疫应答或基因敏化需要一定的时间间隔有关,同时,这种时间间隔还因不同植物病害系统和诱导物的种类而异[35]。本试验中枸杞经马铃薯糖苷生物碱处理后不仅诱发地下部分的抗性,而且未处理的地上部分也表现出抗性,这说明马铃薯糖苷生物碱诱导枸杞对根腐病的抗性具有系统性,与植物获得系统性抗性的研究结果[36]一致。
在应用生物和非生物源诱导抗性因子处理植株后,可诱导植株对病原菌产生全面、系统的抗病性,这种抗病性的产生涉及多方面的变化,主要包括组织形态学和生理生化等方面的变化,从而产生对病原菌的抗性,提高植株的抗病能力。如Yang等[37]从石蒜中分离出的生物碱能提高抗性相关酶PAL、POD、SOD的活性,提高烟草的抗病性。另外,茉莉酸处理枸杞幼苗后7 d枸杞叶POD、PAL活性以及单宁的含量的增加,可以提高抗病性[38]。在本试验中,以2.500 0 g/mL马铃薯糖苷生物碱处理枸杞后,PPO、POD、PAL和SOD 4种与抗性相关酶的活性均有不同程度的提高,增加的幅度高于对照组,表明马铃薯糖苷生物碱诱导枸杞抗根腐病可能与抗性相关酶酶活性的升高有关,且随着诱导时间的延长,处理组的酶活性均表现为先上升后下降的趋势,对照组酶活的趋势相对比较平缓。但酶的活性易受处理方式造成的机械损伤、处理浓度和处理环境条件等因素影响,导致马铃薯糖苷生物碱的诱抗效果有所差异,在研究过程中应以上述因素为参照,构建切实、可行的应用体系。
4 结论
不同供试浓度马铃薯糖苷生物碱对枸杞根腐病均具有一定的诱抗效果,与对照相比,以2.500 0 g/mL马铃薯糖苷生物碱诱导处理后的枸杞叶片和根部病情指数最低,诱抗效果最强;在此最佳供试浓度下诱导处理枸杞后,其最佳诱导间隔期和诱导抗病持续期分别为10 d和30 d;且枸杞植株体内酶活变化明显,在一定诱导时间范围内,随着诱导时间的增加,PPO、POD、PAL和SOD抗性相关酶活性均呈现先上升后下降的趋势,并较对照有不同程度的升高,表明马铃薯糖苷生物碱可有效诱导枸杞抗根腐病,其诱导抗性与其激活枸杞抗性相关酶活性有关。另外,植物诱导抗性的反应还与其他抗性相关酶活性、代谢物质及病程相关蛋白的变化有关,也将是该试验进一步研究的重点内容。植物诱导抗病性的研究不仅可以揭示植物和微生物之间复杂的互作关系,具有十分重要的理论价值,而且对植物病害的防治工作也具有重要的应用价值和现实意义。植物诱导剂对环境无污染,有利于维持生态系统的平衡,同时也可促进我国农业朝着可持续农业的方向发展,有着许多化学药剂无可比拟的优点,植物诱导抗性已成为植物病理学科的研究热点,未来极具发展潜力。
