低物质的量比脲醛树脂的凝胶变化分析
2022-05-06张一甫谢赛情
李 吉, 张一甫, 熊 涛, 孙 鑫, 谢赛情
(广西大学 资源环境与材料学院,广西 南宁 530004)
脲醛树脂(UF)是木材工业中使用最广泛的胶黏剂[1-2],具有成本低、颜色浅、固化速度快等优点;但UF及其制品在生产及使用过程中存在甲醛释放,会对人体健康造成危害[3-4]。为了降低UF的甲醛释放量,人们已经开展了许多研究,但最为有效的方法是降低合成过程中甲醛与尿素的物质的量比(F/U)[3-5]。长期以来,低F/U的UF一直被认为具有胶体结构, 其稳定性与胶粒稳定性高度相关[6]。Pratt等[7]认为UF凝胶形成的主要原因是胶粒聚集。Motter[8]用凝胶渗透色谱(GPC)研究UF中的不溶相,发现当形成4~8个尿素单元的不溶线性脲基低聚物时,低聚物的溶解度达到极限,超过这个极限将形成初级胶粒。Ferra等[9]发现不溶相与可溶的连续相分子质量差异并不大,羟基含量的差异决定了两者的溶解度,并指出胶粒间氢键的相互作用影响了胶粒的聚集。氢键常常也会影响UF的胶合强度[10]、结晶度[11]、水解稳定性[12]等性能。Gao等[13]发现在UF中引入带负电的磺酸基团,其在胶粒间产生的静电斥力有助于体系稳定。为了详细研究UF中的不溶相,李爱萍等[14]利用FT-IR研究UF,发现不溶相的成分与线性羟甲基脲等物质有关。王春鹏等[15]对UF进行XRD研究,发现胶核中存在晶体结构。郝志显等[16]发现UF中沉淀的微小结晶构造是由线性分子(—[NHCONHCH2]n—)通过氢键作用形成的。UF溶液由不溶性分子聚集体及溶胀的可溶低聚物形成的颗粒组成,连续相中包含未反应的尿素和可溶性聚合物等,从小的低聚物到中等相对分子质量的聚合物[9]。UF作为一种多分散体系,成分复杂,稳定性受到多方面因素的影响;同时,离子对胶粒的影响以及胶粒间的相互作用也制约着体系的稳定,因此,不能简单用胶体的性质去分析研究UF。本研究主要通过观察UF在不同贮存时间及电解质影响下的羟甲基及游离甲醛含量、粒径分布(PSD)的变化,研究低甲醛和尿素物质的量比UF的凝胶变化;同时,借助Zeta电位仪、扫描电镜-能谱仪(SEM-EDS)、场发射透射电镜(FE-TEM)及激光粒度仪(LS)对影响UF稳定性的因素及胶粒的聚集情况进行了表征,分析胶粒的发展变化,进而揭示UF树脂的凝胶变化规律。
1 实 验
1.1 材料与仪器
尿素(U),工业级;37%甲醛(F)溶液,市售分析纯。氢氧化钠、甲酸,市售分析纯,分别配成质量分数25%的水溶液, 用于调节UF合成过程中的pH值;氯化钠、氯化镁、氯化铝、氯化铵,市售分析纯,分别配成质量分数25%的电解质溶液。以UF中非挥发性固体的量为基础,在UF中分别加入质量分数3%的电解质溶液。
NDJ-1型旋转黏度计;雷磁PHS-25型pH计;DZF- 6050真空干燥箱;NanoBrook Omni多角度粒度(0.001~10 μm)及高灵敏Zeta(ζ)电位分析仪,美国Brookhaven公司;SU8020扫描电镜-能谱仪(SEM-EDS),日本日立高新科技;TECNAI G2 F30型场发射透射电镜(FE-TEM),美国FEI公司;LS-POP(VI)激光粒度仪,珠海欧美克仪器有限公司。
1.2 合成方法
将甲醛的pH值调节到8.0~8.5,加入四口烧瓶中,升温至45 ℃,加入U1(第一批尿素),在25~30 min内升温至90~92 ℃,保温40 min。冷却至86~87 ℃,调节pH值至4.6~4.8,加热至90~92 ℃,当黏度到达约14 s时,将pH值调至5.8~6.0,加入U2(第二批尿素);当黏度达到约17 s时,将pH值调节到6.0~6.2,将温度降低到88~90 ℃,并加入U3(第三批尿素);当黏度达到约20 s时,将pH值调节到7.5~8.0,并将温度降低到80 ℃,添加剩余的U4(第四批尿素),冷却至50 ℃,调节pH值至8.0~8.5。制得甲醛和尿素物质的量比(F/U)值为1.0,初始性能为固体质量分数55.6%,贮存期40 d, 外观透明的UF。
1.3 测试与表征
1.3.1性能测试 树脂pH值、非挥发性固体的量、黏度、贮存期、游离甲醛及羟甲基含量的测试按照GB/T 14074—2017进行。
1.3.3TEM测试 将UF用蒸馏水稀释至固体质量分数为1%,小心将稀释的样品滴到孔径约为38 μm 铜网的炭涂层胶膜上并烘干,然后用1%醋酸铀酰溶液对铜网上的膜进行染色并再次烘干。在FE-TEM上,获得样品的清晰图像。
1.3.4粒度分布(PSD)测试 在40 mL蒸馏水中滴加4~5滴UF进行稀释,超声波(350 W)处理2 min。用激光粒度分析仪(LS)对样品进行测试,采样5次,得到PSD(0.2~500 μm)曲线。
1.3.5Zeta(ζ)电位及纳米粒度(DLS)测试 将质量浓度均为0.1 g/L的UF溶液及电解质溶液进行等体积混合,得到待测稀溶液样品。ζ电位测试:吸取样品加入比色皿至1/3处,插入电位专用铂电极进行测试,每个样品测量5次,取平均值。DLS(0.001~10 μm)测试:吸取样品充满比色皿,进行测试,每个样品测量5次,取平均值,得到稀溶液下的粒度结果。
2 结果与讨论
2.1 SEM-EDS分析
图1为固化UF薄膜表面和断面的SEM图像,薄膜上不同点的EDS分析结果见图2。

a.表面surface; b.断面cross section图1 UF固化样品的SEM图Fig.1 SEM images of UF cured sample
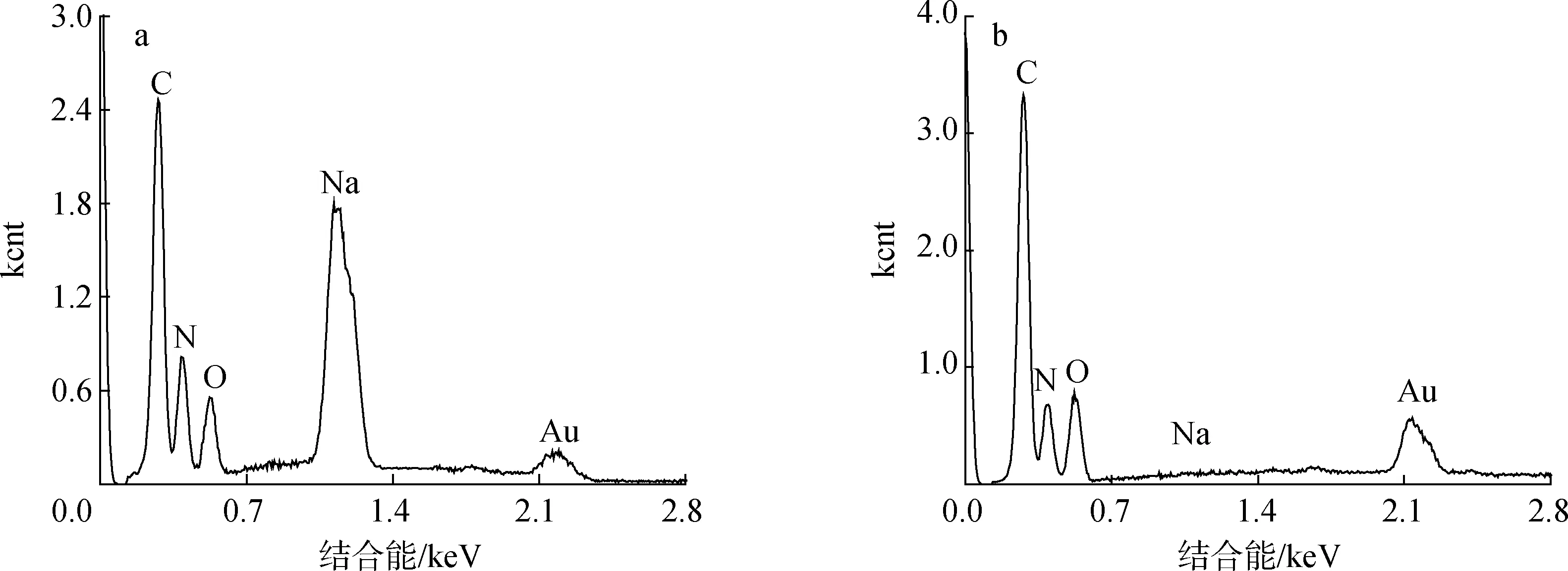
a.断面球形颗粒cross-sectional spherical particles; b.薄膜表面film surface图2 UF固化薄膜的EDS能谱Fig.2 EDS energy spectra of UF cured film
图1(a)中的薄膜表面较为光滑平坦,但出现了许多孔隙和凹槽结构,被认为是加热固化过程中,UF中的水和游离甲醛挥发所致。图1(b)是对薄膜断面的观察,断面出现了大量球形颗粒的聚集,这也证实了低物质的量比UF具有胶体结构的说法。通过利用软件对球形颗粒的直径进行测量,得到平均直径约为0.47 μm。颗粒聚集体的产生可能是UF在加热固化过程中,水分不断减少,UF的浓度逐渐增大,水的溶剂化作用减弱,胶粒间的氢键作用逐渐显现导致的。固化薄膜的表面和断面不同形态差异,可能是由于UF在不使用固化剂的情况下,固化反应主要是通过在高温下蒸发水进行,从而在表面形成孔隙和凹槽结构[17]。EDS分析结果显示断面的球形颗粒相比于薄膜表面显示出更高的钠元素含量,而两者的碳、氮、氧元素含量差异并不大。钠元素的差异可能是由于离子对维持胶体颗粒的稳定起着重要作用,有研究表明,质子化的甲醛与溶液中的其他阳离子如Na+等共同组成扩散层,以维持体系稳定[18]。
2.2 不同贮存时间下的UF变化分析
3.3.4 直流电源一般有多个整流模块并联运行,方便进行容量冗余备份,单个整流模块的失效并不影响给信号源的供电,系统具有更高的可靠性。
2.2.1羟甲基及游离甲醛的量 图3和图4分别为UF在室温(25 ℃)贮存过程中羟甲基及游离甲醛含量与外观的变化。
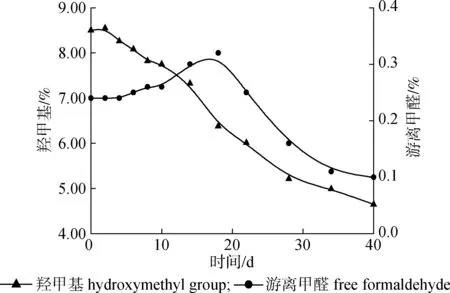

图3 UF中羟甲基及游离甲醛的量随贮存时间的变化 图4 UF的外观随贮存时间变化
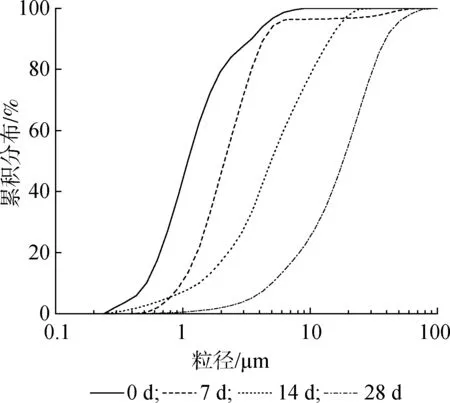
图5 UF在不同贮存时间下的PSD结果Fig.5 PSD results of UF under different storage time
在贮存前7天,UF外观呈透明状,图3中的羟甲基及游离甲醛含量的变化趋势总体比较平稳。随着贮存时间的延长,两者呈现截然不同的变化趋势,羟甲基含量呈下降趋势,而游离甲醛含量先上升后下降。图3的含量变化可以结合UF溶液组成得到解释。在贮存期内,UF可溶连续相中未反应的尿素、甲醛及含有较多亲水基团—OH、—NH2的聚合物之间的缩合反应仍在继续[9],因此,羟甲基含量的减少可能是由于发生了进一步的缩合反应。Pratt等[7]提出的胶体理论认为,溶液中质子化的游离甲醛对不溶胶体相起着保护作用,随着胶体相的聚集,最终形成颗粒聚集体,质子化的甲醛将进入溶液中,引起游离甲醛含量的变化。故胶粒间的聚集可能是导致甲醛含量升高的直接原因;同时,随着亲水基团如—OH、—NH2等的减少,UF的水溶性下降,聚集程度进一步增大,进入溶液中的甲醛大于被消耗掉的甲醛,导致游离甲醛含量在贮存14~18天左右达到最大值,此时溶液外观呈浑浊状(图4),之后可能是由于缩合反应以及溶液中的甲醛容易被氧化成甲酸等原因,游离甲醛含量开始下降。
2.2.2粒度分布 图5为UF在不同贮存(25 ℃)时间下的粒度分布(PSD)。在贮存7 d时UF的平均粒径(D50)从1.58 μm 增长至2.12 μm,增长趋势并不明显;而到贮存14 d时,D50为4.92 μm,增长明显,而这也正是游离甲醛含量增长明显的阶段,说明颗粒聚集体的增长与游离甲醛含量上升存在联系。当贮存至28 d时,粒径在1 μm以下的胶粒基本消失,平均粒径为6.23 μm,表明贮存过程可能伴随着更大尺寸胶粒的发展,即小颗粒被消耗,大颗粒相应地生长。


a.0 d; b.7 d; c.14 d; d.28 d图6 UF在不同贮存时间下的TEM图片Fig.6 TEM images of UF under different storage time
结合图3和图6,随着贮存时间进一步延长,羟甲基及游离甲醛的量下降加剧,UF中的聚集体尺寸进一步增大。由此可以看出,UF的凝胶变化既有胶体性质的体现,同时可能也伴随着化学反应(见图7)。
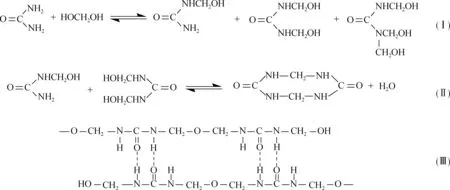
图7 UF中可能发生的化学反应(Ⅰ~Ⅱ)和胶粒间可能的氢键作用(Ⅲ)Fig.7 Possible chemical reactions in UF(Ⅰ-Ⅱ), and possible hydrogen bonding between colloidal particles(Ⅲ)
2.3 不同电解质影响下的UF变化分析
2.3.1UF稀溶液的变化 UF是一种高度分散的固液两相体系,其稳定性主要取决于胶粒的尺寸大小、浓度及表面所带电荷[18]。ζ电位是表征胶粒之间相互作用的重要参数,ζ电位正负代表胶粒所带电性,数值大小代表其稳定性强弱。表1显示了不同贮存(25 ℃)时间下,不同离子对UF稀溶液(0.1 g/L)中胶粒的ζ电位及纳米粒度(DLS)的影响结果。由表1可知,Na+、Mg2+及NH4+加入UF稀溶液后,胶粒的ζ电位的绝对值都呈下降趋势,但差异并不大。按照胶体双电层理论,ζ电位绝对值下降,胶粒尺寸应该增大,但根据DLS的结果表明,胶粒尺寸却明显下降,Na+、Mg2+、NH4+这3种离子对胶粒尺寸的影响也各不相同,加入NH4后胶粒尺寸减小最明显,其次是Na+、最后是Mg2+;从离子的电荷影响来看,加入Mg2+的情况受价态影响更多。
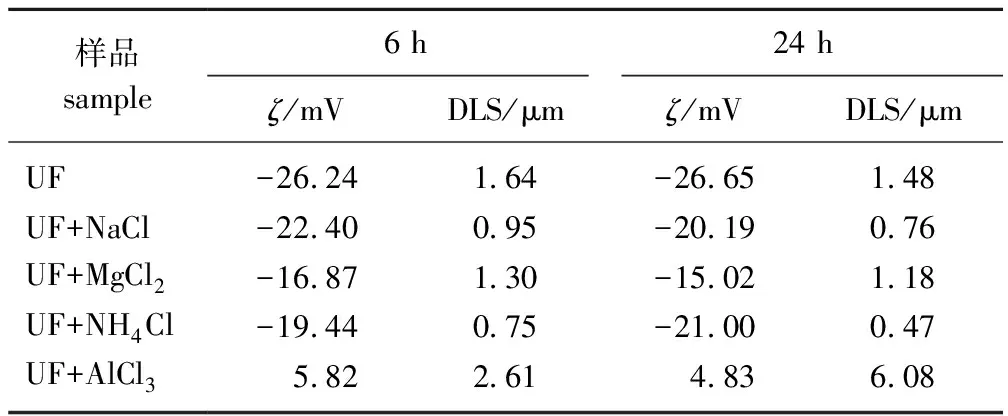
表1 UF稀溶液在不同贮存时间下的ζ电位及粒度(DLS)1)Table 1 Zeta potential and particle size(DLS) of dilute UF solution under different storage time

在UF稀溶液中加入Al3+后,体系的pH值发生明显变化且呈急剧下降的趋势。从表1中可以看出,UF溶液的ζ电位也发生了明显变化,ζ电位的符号由负变正,胶粒尺寸明显增大,说明此时体系很不稳定。这主要是由于Al3+作为高价金属离子,容易吸附在胶粒表面,导致胶粒ζ电位发生明显改变,颗粒间的排斥势垒降低,同时Al3+水解产生的H+使溶液pH值显著下降影响稳定性,进而导致胶粒尺寸明显增长。由此可见,pH值的变化对胶粒的影响明显,但不同离子对UF的影响差异较大,作用机理也不同。
2.3.2UF溶液的变化 为进一步分析不同电解质对UF的影响,在原始UF中加入质量分数3%的电解质溶液进行研究。与稀溶液不同的是,稀溶液中水的溶剂化作用占主导,而在UF体系中,各类可溶聚合物及单体物质(如游离甲醛、尿素)均影响着体系的稳定性。图8(a)和(b)显示了UF在中性电解质影响下贮存14及28 d的PSD结果,D50从4.92和6.23 μm降低到NaCl中的4.23和6.12 μm,MgCl2中的4.14和6.10 μm,与表1中的DLS出现相同的趋势,表明中性电解质NaCl、MgCl2对减小UF胶粒尺寸,维持体系稳定有利。这主要是由于三者的pH值相近,pH值是影响体系稳定的直接原因。离子在胶粒周围减弱了线性分子链之间的静电斥力,导致体积收缩,表现出UF的水溶性增加,最终显示出UF胶粒及聚集体的尺寸减小[9]。
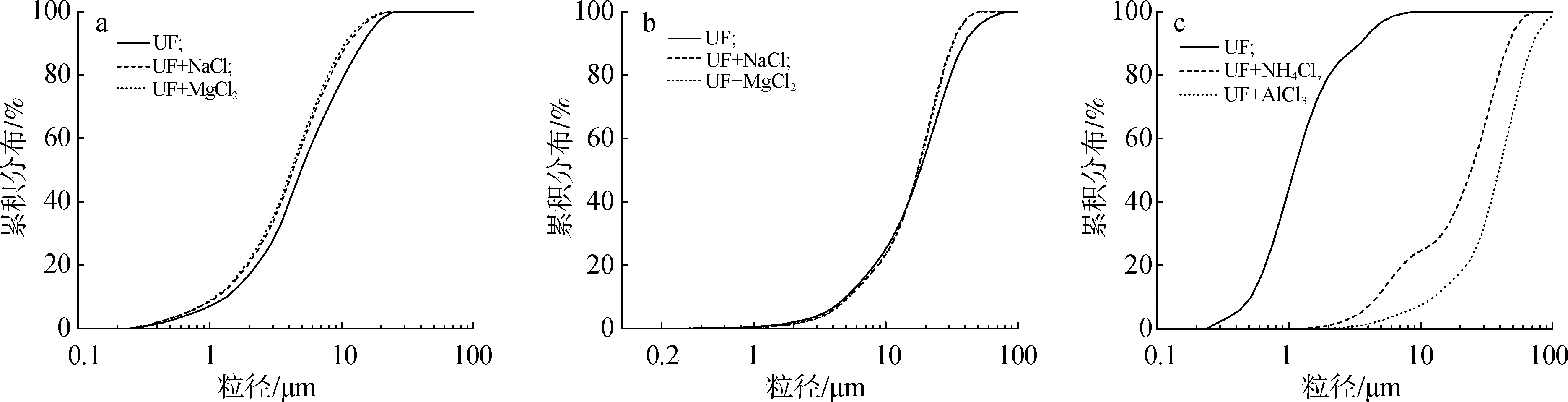
a.中性电解质neutral electrolytes(14 d); b.中性电解质neutral electrolytes(28d); c.酸性电解质acidic electrolytes图8 UF在不同电解质影响下的PSD结果Fig.8 PSD results of UF under the influence of different electrolytes
接下来,通过在UF中分别引入酸性电解质NH4Cl和AlCl3,来改变UF的pH值进行分析,结果如图8(c)和表2所示。
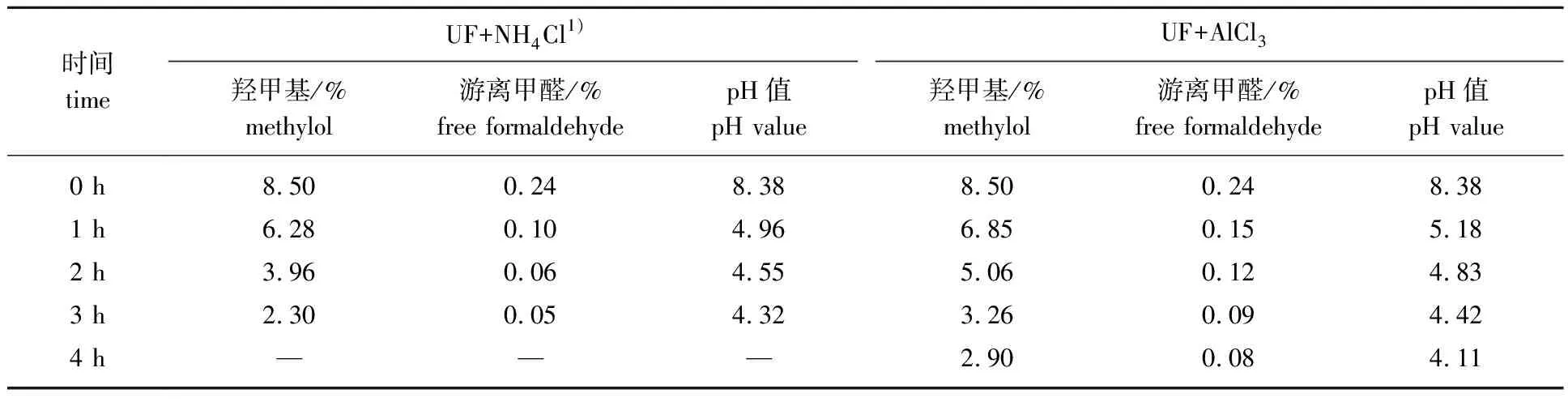
表2 UF在酸性电解质影响下的羟甲基及游离甲醛含量变化结果Table 2 Change of hydroxymethyl and free formaldehyde content of UF under the influence of acidic electrolytes
由表2可知,加入酸性电解质后,UF中的游离甲醛及羟甲基含量与pH值在短时间内急剧下降,但2种电解质影响下的凝胶时间及含量变化略有差异。在UF中加入NH4Cl,NH4Cl会同甲醛反应生成(CH2)6N4及H+,以此来消耗溶液中的游离甲醛,同时NH4Cl水解也会生成H+来影响UF的稳定性,而加入AlCl3主要是通过Al3+的水解生成H+以及Al3+自身对UF胶粒的吸附来影响稳定性。
从表2可以看出,在酸性条件下,随着时间的延长,羟甲基和游离甲醛的量明显下降,说明UF中可能发生了化学变化。在酸性电解质提供的酸性环境中,UF连续相中未反应的尿素、甲醛、低相对分子质量的缩合物,以及含有较多的亲水基因(—NH2、—CH2OH)的聚合物之间的缩合反应加剧,使得聚合物的链长明显增加;同时,酸性条件下有更大的驱动力来形成稳定的微晶结构[12],使其最终形成较大尺寸的聚集体,如图9给出了其中可能发生的某个反应式。图8(c)所示的是UF在酸性电解质影响下凝胶前的PSD结果,D50从1.58 μm增加到NH4Cl中的12.92 μm及AlCl3中的16.77 μm,明显可以看出,图8(c)相比图5及图8(a)和(b)显示出更大尺寸的聚集体,说明酸性电解质明显加速了UF凝胶的进程,但加入NH4Cl及AlCl3的UF凝胶时间及粒径尺寸的差异,可能是由于NH4Cl消耗了更多的游离甲醛,减少了起保护作用的质子化甲醛,而AlCl3可能与UF生成了螯合树脂[20],相比于前者,总体减缓了凝胶进程。
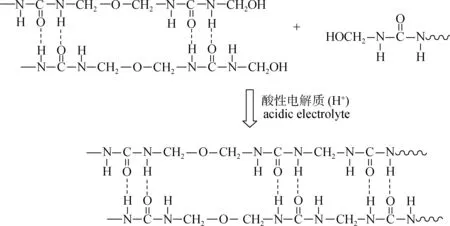
图9 UF在酸性电解质影响下的粒度增长Fig.9 Particle size growth of UF under the influence of acidic electrolyte
3 结 论
以尿素和甲醛制备了低物质的量比(F/U=1.0)的UF,然后采用Zeta电位仪、SEM-EDS、TEM和DLS等考察了贮存时间、电解质对UF凝胶变化规律的影响。分析结果表明:随贮存时间延长,UF的凝胶过程伴随着胶粒的融合,即小颗粒被消耗,大颗粒地相应生长;pH值对UF的凝胶影响显著,凝胶过程既有胶体性质的体现,同时可能也伴随着发生了化学反应;胶粒表面更高的离子物种含量,可能有助于胶粒的静电稳定,不同离子对胶粒的影响方式不同;稀溶液中胶体性质不明显,可能是水破坏了胶粒间的氢键作用;聚集体尺寸的增长导致了UF的凝胶,但凝胶时间与电解质的种类有关。
