晋谷21号成熟胚再生体系的优化
2022-05-06王玉玲张世芳尹艺臻马春英王育选刘清丽
王玉玲,张世芳,尹艺臻,马春英,王育选,刘清丽,赵 娟
(1.山西农业大学 农学院,山西 太谷 030801;2.辽宁农业职业技术学院,辽宁 营口 115009)
谷子(Setaria italica)又称为粟,是禾本科狗尾草属最古老的作物之一[1]。谷子因兼具水分利用率高、抗旱性强、耐瘠薄等特性,是北方旱作生态农业建设的主体作物和应对未来日益变暖气候及干旱生态环境的战略储备作物,在目前的种植业结构调整中起着重要作用[2]。由于建立稳定高效的再生体系是分子、遗传等相关研究在谷子上开展应用的前提条件和关键环节[3-4],已建立多个谷子品种的离体再生体系,并开展了不少关于谷子转基因、突变体诱变和筛选等工作,但与水稻(Oryza sativaL)、拟南芥(Arabidopsis thaliana)等模式植物相比,谷子离体再生和遗传转化效率还比较低,且在不同品种间存在明显差异,需要针对特定品种进行离体再生体系培养方案的优化。
RAO等[5]用成熟胚作外植体培养获得愈伤组织和再生植株,发现谷子不同基因型再生能力存在差异。国内较早的是许智宏等[6]利用谷子以及狗尾草的幼穗作外植体成功诱导植株再生。王节之等[7]研究了常用激素对谷子幼穗组培的影响,探索出了幼穗愈伤诱导和植株再生的较理想的激素配比。王寒玉[8]对谷子成熟胚茎尖进行了愈伤诱导并优化了培养条件,发现晋谷21号等4个谷子品种均有较强的愈伤诱导率,但没有对愈伤的分化进一步研究。袁进成等[9]对不同谷子品种成熟胚作了愈伤诱导和分化研究,发现成熟胚再生能力对基因型有很大依赖。李惠[10]以晋谷21号为材料,建立了谷子幼穗的离体再生体系,并对谷子成熟胚进行了愈伤组织的诱导研究,但诱导率和分化率都较低。
晋谷21号米质优异,抗旱性强、抗谷瘟病、高抗锈病,是目前种植面积最大的优质米开发品种,加强晋谷21号遗传和组织培养研究对谷子优质育种至关重要。虽然前期试验已经初步建立晋谷21号成熟胚愈伤组织再生体系,但存在愈伤组织诱导不稳定、诱导率和分化率较低等问题。本试验在前期研究基础上,从多方面对晋谷21号成熟胚愈伤组织诱导及植株再生体系进行优化,以期建立晋谷21号成熟胚愈伤组织诱导和分化体系,为晋谷21号遗传改良提供技术支持。
1 材料和方法
1.1 试验材料
晋谷21号谷子(Setaria italica)(登记编号:GPD谷子(2017)140009),由山西农业大学经济作物研究所提供。
1.2 试验方法
1.2.1 成熟胚灭菌 取晋谷21号种子用砂纸轻轻打磨剥去谷壳,挑选饱满无损伤去壳种子,用流水冲洗20 min,无菌水冲洗2次,75%乙醇浸泡30 s后,转至20%NaClO溶液浸泡20 min,期间不断振荡,无菌水冲洗4次,置于无菌滤纸上晾干后,接种于附加不同成分的培养基中,每培养瓶接种7粒种子,每个处理组接种12瓶。
1.2.2 愈伤组织诱导培养基的筛选 以MS+2.0 mg/L 2,4-D为基本培养基,添加不同种类和浓度的植物激素(KT、TDZ、6-BA、NAA、ABA)进行愈伤组织诱导(表1)。培养条件为温度(25±1)℃,暗培养15 d。根据愈伤组织诱导率和诱导出愈伤组织的生长状态筛选适宜的培养基。
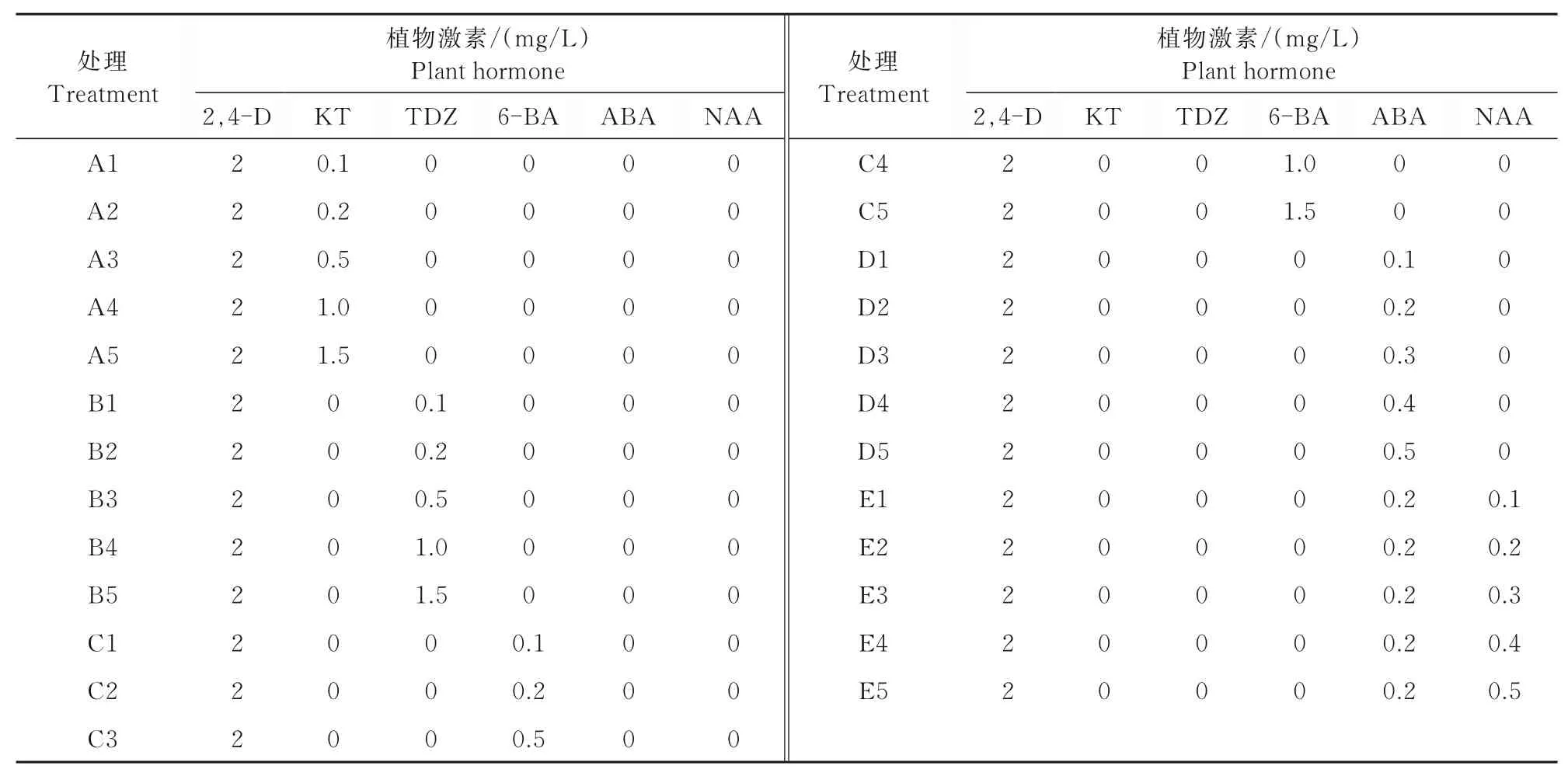
表1 愈伤组织诱导培养基Tab.1 Callus induction medium
以上述试验筛选出的最适培养基MS+2.0 mg/L 2,4-D+0.2 mg/L 6-BA为基本培养基,附加不同浓度的蔗糖和Ag NO3进一步优化愈伤组织诱导培养基(表2)。
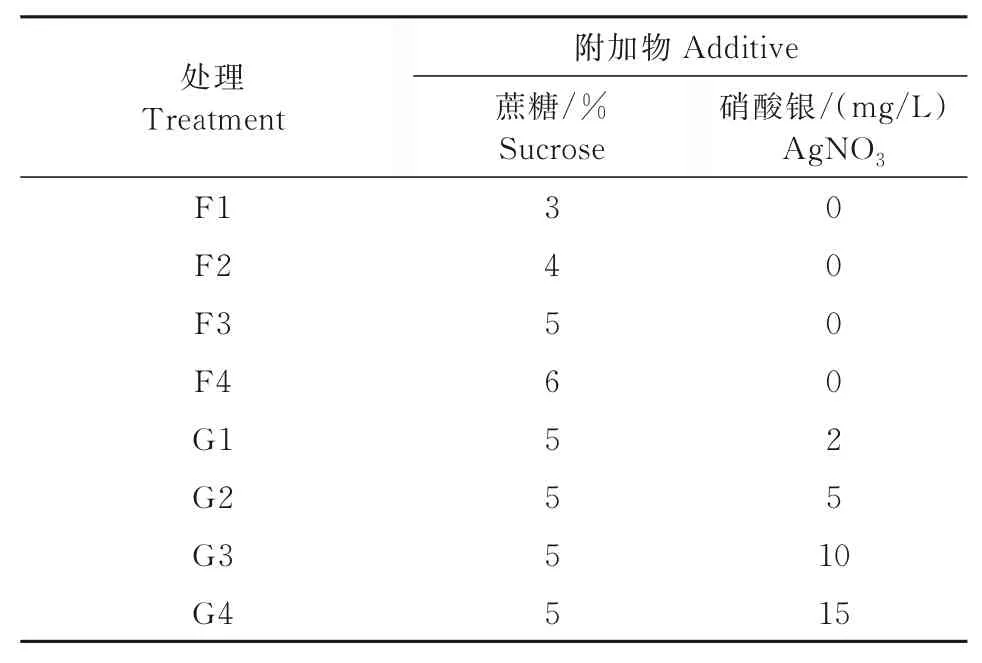
表2 附加蔗糖和Ag NO3的愈伤组织诱导培养基Tab.2 Callus induction medium supplemented with sucrose and Ag NO3
1.2.3 愈伤组织继代 诱导出愈伤组织后,以MS+2.0 mg/L 2,4-D+0.2 mg/L 6-BA+5.0%蔗糖 和MS+0.5 mg/L 2,4-D+0.2 mg/L 6-BA+5.0%蔗糖为愈伤组织继代培养基,分别以带种子和切除种子2种方式对愈伤组织进行继代培养。
1.2.4 愈伤组织分化 采用L25(56)正交表设计试验,试验因素为蔗糖、琼脂、PP333(表3)。以前期王晓璐等[11]筛选出的MS+1.0 mg/L 6-BA+0.5 mg/L NAA为基本培养基,在其中加不同浓度蔗糖、琼脂、PP333,将愈伤组织接种至25种分化培养基上(培养基编号为1~25号,CK为对照)。光照时间为16 h/d,光强2 000 lx,培养35 d后调查愈伤组织分化情况,统计分化率。
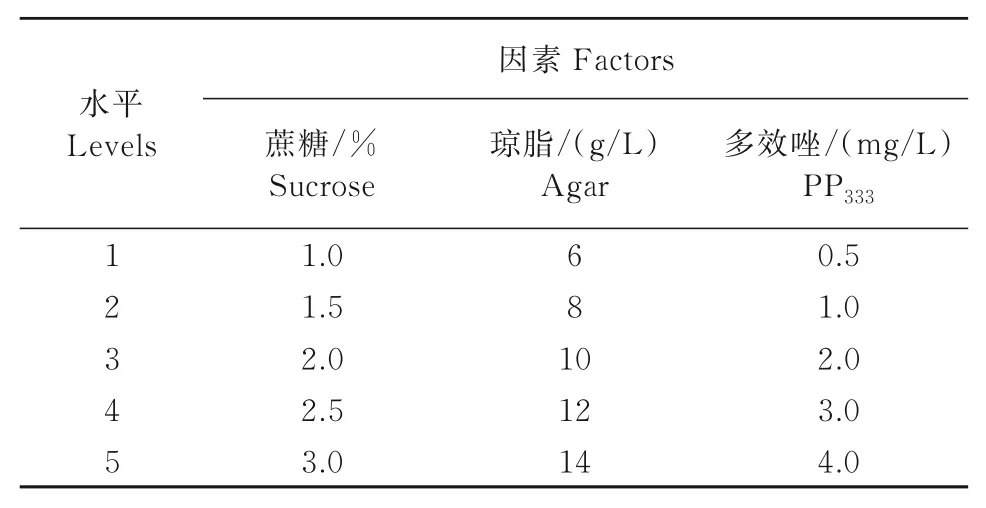
表3 L25(56)愈伤组织分化正交试验设计Tab.3 Orthogonal experiment design of L25(56)callus differentiation
1.2.5 分化苗生根 分别以MS、1/2 MS(大量和微量减半)和MS+1.0 mg/L NAA为生根培养基,将生长健壮的分化苗接种到培养基上,培养28 d后,观察分化苗的生根情况。
1.3 数据分析
采用Excel 2013软件进行数据统计,用SPSS 19.0软件进行数据分析。
2 结果与分析
2.1 不同激素对谷子愈伤组织诱导的影响
晋谷21号种子接种到诱导培养基上3 d后可见愈伤组织开始发生,但生长缓慢,7 d后生长加速。各培养基均可诱导愈伤组织产生,但晋谷21号种子诱导率和愈伤组织生长状态在不同培养基中差异明显。
不配比任何细胞分裂素时,诱导率为82.14%,诱导出的愈伤组织白色透明、呈黏稠状,后经分化培养不能获得分化苗(图1)。培养基中配比3种细胞分裂素(KT、TDZ、6-BA)后,愈伤组织分化率随每种激素附加浓度不同发生变化(图2)。配比6-BA时以0.2 mg/L诱导率最高,为91.67%,且愈伤组织生长旺盛,颜色淡黄致密,质量好,经分化培养可获得分化苗;配比KT时以0.5 mg/L愈伤组织诱导率最高,为83.33%,诱导出的愈伤组织呈乳白色,结构略松散;添加TDZ时以0.1 mg/L愈伤组织诱导率最高,为88.1%,略低于添加6-BA,诱导出的愈伤组织较添加KT的更致密,经分化培养也可获得分化苗。可见,与细胞分裂素配比比单独附加2,4-D诱导愈伤组织效果更好,KT、TDZ、6-BA在各自适宜浓度提高了愈伤组织诱导率,且明显改善了愈伤组织质量。
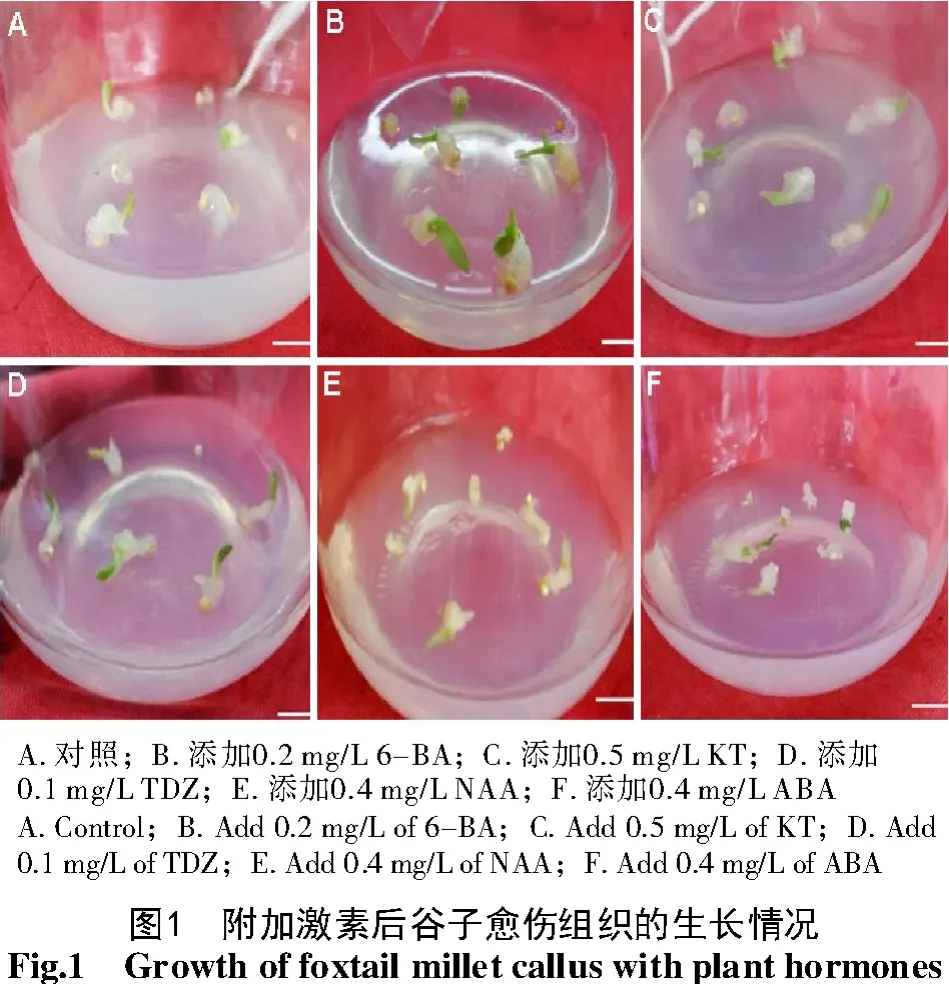
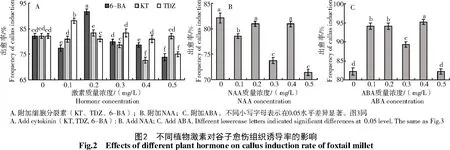
不同质量浓度NAA与2,4-D复配时并未明显提高诱导率。在不同复配方案中,不添加NAA,诱导率最高,其次是添加0.4 mg/LNAA,诱导率为80.95%,且诱导出的愈伤组织生长量小,增殖缓慢,颜色偏暗黄,可见,单独附加2,4-D效果优于其与NAA复配使用。
培养基中添加不同质量浓度ABA后,可显著提高愈伤组织诱导率,ABA浓度为0.4 mg/L时诱导率最高,达95.24%,且诱导出的愈伤组织色白致密,但与培养基中添加0.2 mg/L 6-BA相比,在相同培养期内,其生长缓慢,增殖量小。
综上,兼顾愈伤组织诱导率和生长状态,晋谷21号愈伤组织诱导培养基添加激素以MS+2.0 mg/L 2,4-D中添加0.2 mg/L 6-BA为好,0.1 mg/L TDZ次之,其可作为6-BA的替换激素。
2.2 蔗糖和AgNO3对谷子愈伤组织诱导的影响
由图3可知,随着培养基中蔗糖浓度升高,晋谷21号种子愈伤组织诱导率呈先增后降的趋势,附加蔗糖浓度为5%时,愈伤组织诱导率达最高,为95.24%。愈伤组织呈亮黄色致密结构,且生长速度快,增殖量大且质地好,质量明显优于原培养基中添加3%蔗糖处理。
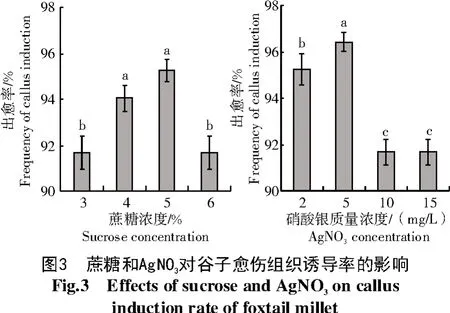
由图4可知,培养基中添加Ag NO3后,也可明显提高愈伤组织诱导率,Ag NO3质量浓度为5 mg/L时达到最高(96.43%),诱导出的愈伤组织呈淡黄色或浅白色,较为致密,但其生长速度较为缓慢,相同培养期内,其生长量明显小于不添加Ag NO3的培养基。故晋谷21号种子愈伤组织诱导的适宜培养基为MS+2.0 mg/L 2,4-D+0.2 mg/L 6-BA+5.0%蔗糖,诱导率较之前提高了2.38百分点,有利于进一步的分化。
2.3 继代培养对愈伤组织生长的影响
为探究影响愈伤组织继代过程中的因素,将诱导出的愈伤组织在不同培养基、不同继代方式下(带种子和不带种子)进行继代培养。由表4可知,在设定的2种培养基中,带种子继代和不带种子继代对愈伤组织的生长没有明显影响,均随着继代时间的延长出现生长缓慢、褐化现象。由图5可知,继代培养7 d后,愈伤组织生长良好;培养14 d后部分愈伤组织出现水质化、边缘褐化;培养21 d后愈伤组织大多发生严重褐化。可见,不同培养基和继代方式对愈伤组织的质量影响不大,继代培养时间周期是影响愈伤组织生长的主要因素,所以,晋谷21号谷子愈伤组织继代培养时间以不超过14 d为宜。

表4 继代后愈伤组织生长变化情况Tab.4 Changes of callus growth after subculture

2.4 蔗糖和不同添加物对愈伤组织分化的影响
由表5、图6可知,在含不同成分的25组培养基中,愈伤组织的分化率及分化苗的生长情况存在较大差异。其中,25号培养基分化率最高,为28.33%,较对照提高了8.33百分点,且分化苗生长健壮;其次为13号和20号培养基,分化率均为26.67%(较对照提高了6.67百分点),但分化苗的生长情况不同,13号培养基中分化健壮,苗最高可达6 cm左右,20号培养基中分化苗矮壮,苗高2~3 cm,其他培养基中的愈伤组织分化率部分低于对照,最低仅为5.00%,但分化苗普遍比对照生长旺盛。由愈伤组织分化率及分化苗生长状态筛选出3种适宜晋谷21号愈伤组织分化的培养基,即25号(MS+1.0 mg/L 6-BA+0.5 mg/L NAA+3.0%蔗糖+14 g/L琼脂+3.0 mg/L PP333)、20号(MS+1.0 mg/L 6-BA+0.5 mg/L NAA+2.5%蔗糖+14 g/L琼脂+4.0 mg/L PP333)和13号(MS+1.0 mg/L 6-BA+0.5 mg/L NAA+2.0%蔗糖+10 g/L琼脂+4.0 mg/L PP333),其中25号培养基分化率最高。对比其他培养基可知,筛选出的这3种培养基均提高了琼脂和PP333用量,尤其附加较高浓度的PP333可以明显促进晋谷21号愈伤组织的分化,且在提高分化率的同时获得生长健壮的分化苗。因此,在愈伤组织分化培养基中添加1.0 mg/L 6-BA、0.5 mg/L NAA、3.0 mg/L PP333、3.0%蔗糖、14 g/L琼脂分化率最高,较之前提高了15百分点,且分化出的谷苗健壮。

2.5 不同种类培养基对分化苗生根的影响
将长势良好的分化苗接种到MS、1/2 MS(大量和微量减半)和MS+1.0 mg/L NAA等3种培养基上培养21~28 d后,培养基中所有分化苗均可生根,但生根情况有所不同。由图7可知,在MS培养基中,分化苗根系黄白较细,分化苗长势一般;而在1/2 MS和MS+1.0 mg/L NAA 2种培养基上较MS生出的根更壮,分化苗长势也更好,尤其是在1/2 MS培养基上,根黄白也最粗壮,分化苗长势最好,可用于移栽。在MS+1.0 mg/L NAA中,谷苗生根良好,但在生根过程中谷苗易发生部分褐化。所以,选择1/2 MS培养基为晋谷21号最适生根培养基。

3 讨论
3.1 不同激素对谷子愈伤组织诱导的影响
植物激素对培养物的生长和分化起着重要调控作用,是愈伤组织诱导、分化和生根等培养过程中最主要的筛选因素。大量研究结果表明,2,4-D对诱导愈伤组织效果好,王晓璐等[11]的试验结果也证实了这一观点,也初步筛选了其与6-BA配比使用的情况,但未对其他细胞分裂素进行筛选。本试验中,分别用KT、TDZ和6-BA与2,4-D配比添加,发现在附加不同种类和浓度细胞分裂素的培养基上愈伤组织诱导率和生长状态不同,但配比添加总体优于2,4-D单独添加,KT、TDZ、6-BA在各自适宜浓度提高了愈伤组织诱导率,且明显改善了愈伤组织质量。其中,以配比低质量浓度0.2 mg/L 6-BA为最好,愈伤组织生长速度快,增殖量大且结构致密,后经分化培养,可获得优质分化苗。宗越等[12]对毛建草愈伤组织诱导的研究表明,6-BA浓度高时容易造成毛建草茎段的褐变死亡,导致愈伤组织的诱导率降低,这与本试验结果一致。配比0.1 mg/L TDZ也可获得胚性愈伤组织,但诱导率略低于6-BA,可作为6-BA的替换激素添加。多种作物的离体培养研究表明,在培养基中附加ABA可以提高愈伤组织质量[13-14]。本试验发现,在培养基中添加适量ABA可明显提高晋谷21号愈伤组织诱导率和质量,但相同培养期内愈伤组织生长量会减少,建议根据具体试验时对愈伤组织的要求选择是否添加ABA。有研究表明,不同种类生长素复配使用诱导愈伤组织,可提高愈伤组织质量[15]。本试验中以2.0 mg/L 2,4-D与低浓度NAA复配诱导谷子种子愈伤组织,结果发现复配使用效果不佳,不仅诱导率降低,诱导出的愈伤组织质量也较差。
3.2 蔗糖和AgNO3对谷子愈伤组织诱导的影响
蔗糖在组织培养中起到提供碳源和调节渗透压的作用。有研究表明,用高浓度蔗糖预处理水稻愈伤组织,调节细胞渗透压,可以提高细胞质浓度,能够在超低温过程中有效保护细胞结构,避免细胞毒害作用[16]。本试验表明,提高培养基中蔗糖浓度可显著提高愈伤组织诱导率,且愈伤组织增殖快,增殖量大,质地紧实,胚性强,这与STRATUS[17]的研究结果一致。Ag+是乙烯的强烈抑制剂,有关Ag NO3在组织培养中的作用报道结果不一。袁进成等[18]研究表明,适宜浓度的Ag NO3可以促进冀谷11号愈伤组织的诱导和分化,而赵虹[19]在小麦基因枪转化体系的建立试验中发现,其作用效果并不明显。本试验表明,培养基中添加少量Ag NO3可提高晋谷21号愈伤组织诱导率,但诱导出的愈伤组织生长缓慢慢,增殖量少。
3.3 继代培养对愈伤组织生长的影响
继代培养也会影响愈伤组织的胚性。周杰[20]研究表明,继代培养可以提高籼稻成熟胚愈伤组织的胚性。李双成等[21]研究发现,一些籼稻成熟胚愈伤组织经第1次继代后就全部褐化。本试验发现,晋谷21号愈伤组织以不同培养基带种子或不带种子进行继代培养后,胚性没有明显变化,但随着培养时间的延长愈伤组织会逐渐发生褐化,故其适宜的继代培养周期为不超过14 d为宜。
3.4 蔗糖和不同添加物对愈伤组织分化的影响
愈伤组织分化率较低,是前期试验初步建立晋谷21成熟胚愈伤组织再生体系遇到的另一个关键问题。本试验在优化愈伤组织诱导培养基提高其诱导率和质量的同时,对蔗糖和2种附加物(琼脂、PP333)进行筛选,以促进愈伤组织分化,提高分化率。有研究表明,对愈伤组织进行适当干燥处理后,可改善其状态和质量,提高分化率[17]。本试验中将培养基琼脂浓度由6%提高到14%,起到干燥处理的作用,促进了晋谷21号愈伤组织分化,这与赵虹[19]、米庆莉等[22]、赵成章等[23]的研究结果一致。水稻、大麦、玉米等作物上的研究结果表明,培养基中添加适量PP333可促进愈伤组织分化,且获得的分化苗生长旺盛、抗逆性强[24-26];杨彩梅等[27]研究发现,低浓度PP333处理也可使唐菖蒲愈伤组织分化芽的数量明显增加;薛寒青等[28]研究发现,采用PP333处理的切花百合试管苗苗质优于对照。本研究表明,分化培养基中添加适量多效唑可显著提高愈伤组织的分化率和分化苗的质量。
3.5 不同类型培养基对分化苗生根的影响
谷子分化苗易生根,ANJALI等[29]研究表明,以不同浓度的萘乙酸(0、1.0、2.0、3.0 mg/L)和苄基氨基嘌呤(0、1.0 mg/L)诱导生根,在不含植物激素的MS培养基上,继代培养10 d后生根效果最好,MS培养基中生长素或细胞分裂素的存在完全抑制了根系的诱导。智邵川等[30]通过对构树进行不同培养基的培养,结果表明,适当降低培养基大量元素浓度有利于构树生根,各培养基培养效果表现为培养基1/2 MS>1/4 MS>MS。本试验中,谷子分化苗在3种培养基上均可生根,但在1/2MS培养基中效果最好,这与上述研究结果基本一致。
4 结论
本研究选用晋谷21号成熟胚为试验材料,在试验中配比使用不同种类、浓度植物激素,添加不同浓度蔗糖和附加物来优化培养方案,最终确定了晋谷21号各阶段的最适培养基和激素浓度。诱导愈伤组织的最适培养基为:MS+2.0 mg/L 2,4-D+0.2 mg/L6-BA+5.0%蔗糖,诱导率为95.24%,较前期王晓璐等[11]提高了2.38百分点;愈伤组织分化的适宜培养基有3种,分别为MS+1.0 mg/L 6-BA+0.5 mg/L NAA+4.0 mg/L PP333+2.5%蔗糖+14 g/L琼脂,MS+1.0 mg/L 6-BA+0.5 mg/L NAA+3.0 mg/L PP333+3.0%蔗糖+14 g/L琼脂和MS+1.0 mg/L 6-BA+0.5 mg/L NAA+4.0 mg/L PP333+2.0%蔗糖+10 g/L琼脂,分化率最高为28.33%,较前期提高了15百分点,在这3种培养基中愈伤组织分化率高且分化出的谷苗生长健壮;最适生根培养基为1/2 MS。本研究对晋谷21号成熟胚组织培养(包括诱导愈伤、继代、分化和生根培养)进行了优化,建立了完整、优良的谷子优质品种晋谷21号成熟胚的组织培养和再生体系,为晋谷21号的深入遗传研究奠定了技术基础。
