口腔鳞状细胞癌组织miR-31-5p、LATS2表达变化及其临床意义
2022-05-04成思源杨文华孙庚林
成思源,杨文华,孙庚林
1 天津市北辰医院口腔科,天津300400;2 天津医科大学总医院口腔科
口腔癌是发生在口腔内恶性肿瘤的总称,其中90%以上为口腔鳞状细胞癌(OSCC)[1-2]。近年来,随着人民生活水平提高,吸烟、酗酒、咀嚼槟榔等不良生活习惯增多,以及人乳头瘤病毒感染增加,OSCC 的发病率不断上升。目前,外科手术仍然是OSCC 最有效的治疗手段,但术后复发和转移的风险较高,而现有的治疗策略对术后复发和转移的效果不佳[3]。因此,深入研究OSCC 发病的分子机制,探索新的分子治疗靶点,对改善患者预后意义重大。微小RNA(miRNA)是一类短链非编码小RNA分子,能够在转录后水平负向调控靶基因的表达。近年研究发现,miRNA 能够作为癌基因或抑癌基因参与肿瘤的发生、发展[4]。miR-31-5p是miRNA家族中的一员。有研究报道,miR-31-5p在结直肠癌和膀胱癌组织中异常表达,并且其异常表达与肿瘤细胞增殖、侵袭和迁移密切相关[5-6]。大肿瘤抑制激酶2(LATS2)是一种能够抑制肿瘤发生、发展的激酶。有研究报道,LATS2 在非小细胞肺癌和乳腺癌组织中低表达,并且其低表达能够促进肿瘤细胞增殖、侵袭和迁移[7-8]。但目前临床鲜见miR-31-5p、LATS2在OSCC 组织中表达的报道,并且其表达与患者临床病理特征和预后的关系尚不清楚。本研究探讨了OSCC 组织miR-31-5p、LATS2 表达变化及其临床意义。现报告如下。
1 资料与方法
1.1 临床资料 选择2017年1月—2018年10月天津市北辰医院收治的OSCC患者97例。所有患者经术后组织病理检查明确诊断。纳入标准:①符合OSCC 诊断标准;②接受口腔癌根治术、下颌-唇劈开术或拉通术治疗;③初诊,术前未接受任何抗肿瘤治疗;④临床病理资料和术后随访资料完整。排除标准:①年龄<18岁者;②合并其他部位恶性肿瘤者;③合并心、肝、肾等重要脏器严重疾病者;④合并全身感染性疾病者。其中,男65例、女32例,年龄36~78(58.25 ± 8.65)岁;肿瘤直径:≥3 cm 65 例,<3 cm 32例;组织分化程度:低分化21 例,中高分化76 例;TNM 分期[9]:Ⅰ、Ⅱ期51例,Ⅲ、Ⅳ期46例;有淋巴结转移41例,无淋巴结转移56例。本研究经天津市北辰医院医学伦理委员会批准(伦理批号:2022022501),所有研究对象或其家属知情同意并签署书面知情同意书。
1.2 miR-31-5p、LATS2 mRNA 表达检测 采用RTqPCR 法。收集术中切除的OSCC 组织及其配对的癌旁组织(距肿瘤组织边缘>5 cm,并经组织病理检查明确为正常口腔黏膜组织),液氮下速冻。取冻存的OSCC 组织及其配对的癌旁正常组织,液氮下充分研磨后,采用TRIzol 法抽提组织总RNA,经Nano-Drop 2000C 超微量分光光度计鉴定,提取的总RNA浓度和纯度合格。按PrimeScriptTMRT Master Mix(Perfect Real Time)说明将总RNA 反转录为cDNA。反转录条件:42 ℃1 h,95 ℃5 min。以cDNA 为模板,按实时荧光定量PCR 试剂盒说明进行PCR 扩增。所有引物序列由武汉金开瑞生物工程有限公司设计合成。引物序列:miR-31-5p 上游引物5′-CCCTCGAGACATTTGAAAGCCATTAGACT-3′、下游引 物5′-GCGTCGACAGGTTGAGCGAGCGAAG-3′,U6 上游引物5′-CTCGCTTCGGCAGCACA-3′、下游引物5′-AACGCTTCACGAATTTGCGT-3′;LATS2 上游引物5'-AAGAGCTACTCGCCATACGCCTTT-3'、下游 引 物 5'-AGCTTTGGCCATTTCTTGCTCCAG-3',GAPDH 上游引物5'-AACTTTGGCATTGTGGAAGG-3'、下 游 引 物5'-ACACATTGGGGGTAGGAACA-3'。PCR 反应体系共10.0 μL:5 × SYBR Premix Ex Taq 5 μL,cDNA 模板1 μL,上下游引物各0.2 μL,ROX参考染料0.2 μL,DEPC 处理水3.4 μL;反应条件:95 ℃预变性90 s,95 ℃变性30 s、63 ℃退火30 s、72 ℃延伸15 s共40个循环。扩增反应结束后,绘制熔解曲线,收集循环阈值(CT)数。以U6 或GAPDH为内参,采用2-ΔΔCT法计算miR-31-5p、LATS2 mRNA相对表达量。
1.3 miR-31-5p 与LATS2 的结合位点预测 通过https://starbase. sysu. edu. cn/在线网站,预测miR-31-5p与LATS2的靶向结合位点。
1.4 随访 所有患者出院后通过门诊复查或电话形式定期随访3 年,随访截至2021 年10 月,统计患者生存情况,计算3年累积生存率。
1.5 统计学方法 采用SPSS26.0 统计软件。计量资料经Shapiro-Wilk 检验符合正态分布,以±s表示,结果比较采用独立样本t检验;计数资料比较采用χ2检验。相关性分析采用Pearson 相关分析法。影响因素分析采用多因素Cox 比例风险回归模型。生存分析采用Kaplan-Meier 法,生存率比较采用Log-Rank检验。P<0.05为差异有统计学意义。
2 结果
2.1 OSCC 组织与癌旁正常组织miR-31-5p、LATS2 mRNA 表达比较 OSCC 组织与癌旁正常组织miR-31-5p 相对表达量分别为3.258 ± 0.562、1.096 ± 0.220,LATS2 mRNA 相对表达量分别为1.216 ± 0.252、3.354 ± 0.449。OSCC 组织miR-31-5p 相对表达量高于癌旁正常组织,LATS2 mRNA 相对表达量低于癌旁正常组织(t分别为35.314、40.900,P均<0.01)。
2.2 OSCC 组织miR-31-5p 表 达与LATS2 mRNA 表达的关系 经在线网站预测,miR-31-5p与LATS2存在靶向结合位点,见图1。Pearson 相关分析显示,OSCC 组织miR-31-5p 表达与LATS2 mRNA 表达呈负相关关系(r=-0.688,P<0.01)。

图1 miR-31-5p与LATS2的靶向结合位点示意图
2.3 miR-31-5p、LATS2 mRNA 表达与OSCC 患者临床病理特征的关系 见表1。

表1 miR-31-5p、LATS2 mRNA表达与OSCC患者临床病理特征的关系
2.4 miR-31-5p、LATS2 mRNA 表达与OSCC 患者预后的关系 97 例OSCC 患者中,miR-31-5p 表达≥3.258 者55 例、miR-31-5p 表 达<3.258 者42 例,LATS2 mRNA 表达≥1.216 者40 例、LATS2 mRNA 表达<1.216 者57 例。 miR-31-5p 表 达≥3.258 者与miR-31-5p 表达<3.258 者3 年累积生存率分别为60.00%、78.57%,LATS2 mRNA 表达≥1.216 者 与LATS2 mRNA 表达<1.216 者3 年累积生存率分别为80.00%、59.65%。miR-31-5p表达≥3.258者3年累积生存率低于miR-31-5p表达<3.258者,LATS2 mRNA表达≥1.216者3年累积生存率高于LATS2 mRNA表达<1.216 者(χ2分别为5.829、6.616,P均<0.05)。见图2、3。
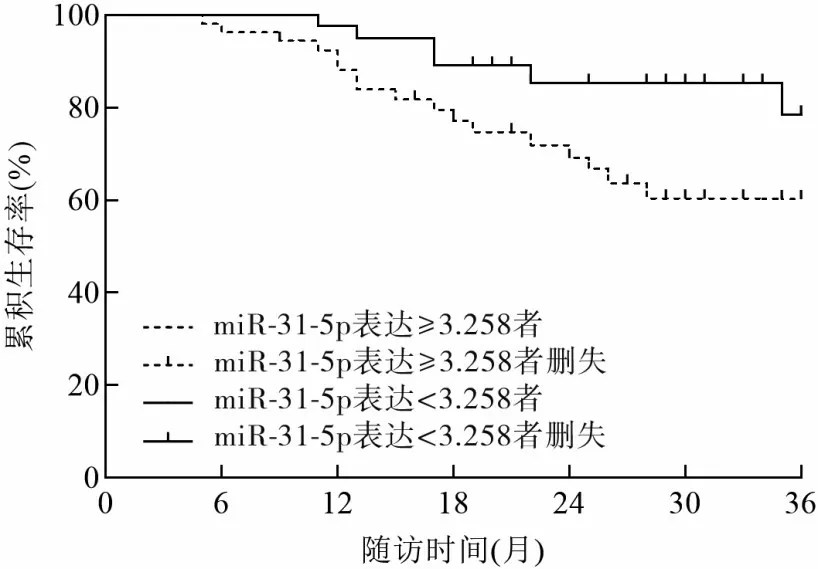
图2 OSCC患者不同miR-31-5p表达者的生存曲线

图3 OSCC患者不同LATS2 mRNA表达者的生存曲线
2.5 OSCC 患者预后的影响因素分析 所有患者术后随访4~36个月,中位随访时间26个月,随访期间死亡31 例。OSCC 患者死亡者与存活者临床病理资料比较见表2。

表2 OSCC患者死亡者与存活者临床病理资料比较[例(%)]
以随访时间为时间变量,以OSCC 患者预后(存活=0,死亡=1)为因变量,以单因素分析中有统计学差异的指标为自变量,纳入多因素Cox 比例风险回归模型。结果显示,TNM 分期Ⅲ、Ⅳ期及有淋巴结转移、miR-31-5p 表达≥3.258 为OSCC 患者死亡的独立危险因素,而LATS2 mRNA 表达≥1.216 则为其独立保护因素(P均<0.05),见表3。

表3 OSCC患者预后影响因素的多因素Cox比例风险回归分析结果
3 讨论
口腔癌是口腔颌面部常见的恶性肿瘤,其中90%以上为OSCC。OSCC是起源于口腔黏膜上皮并伴有鳞状分化的上皮性恶性肿瘤,患者预后主要取决于肿瘤临床分期。临床上60%以上的OSCC 患者确诊时已属晚期,并有10%~40%患者出现淋巴结转移或远处转移。尽管近年来广泛开展多学科综合治疗,在一定程度上延长了OSCC 患者的生存期,但晚期OSCC 患者5 年生存率仍不足50%[10-11]。因此,深入研究OSCC 发病的分子机制,探索新的分子治疗靶点,对改善患者预后意义重大。
miRNA 是一类长度为18~25 个核苷酸的内源性非编码单链小分子RNA,通过与mRNA 的3′非翻译区特异性结合,降解mRNA或阻碍其翻译,从而调控靶基因的表达。近年研究发现,miRNA能够作为癌基因或抑癌基因参与肿瘤的发生、发展[4]。已有研究报道,miR-770 能够靶向调节Sir2 相关酶类7/Smad4信号通路促进OSCC细胞侵袭和迁移[12]。miR-31-5p是miRNA 家族中的一员,基因定位于人染色体9p21.3。柴晶晶等[13]研究报道,miR-31-5p在结直肠癌细胞中表达下调,而上调miR-31-5p 表达则能抑制结直肠癌细胞增殖、侵袭并促进其凋亡。YU等[14]研究发现,miR-31-5p 在肺腺癌细胞中表达上调,并且miR-31-5p能够靶向下调特异性AT序列蛋白2而促进肺腺癌细胞上皮间质转化。由此可见,miR-31-5p可作为抑癌或促癌基因参与多种肿瘤的发生、发展。本研究结果发现,OSCC 组织miR-31-5p 相对表达量高于癌旁正常组织,并且OSCC 组织miR-31-5p 表达与肿瘤组织分化程度、TNM分期、淋巴结转移有关,提示miR-31-5p 在OSCC 中发挥促癌基因作用,其表达上调能够促进肿瘤恶性进展。这可能与miR-31-5p能够增强肿瘤细胞线粒体活性有关。线粒体是细胞内能量生成的关键细胞器,在细胞新陈代谢、迁移、凋亡等过程中发挥重要作用。线粒体功能障碍是肿瘤发生、发展的重要原因[15]。王恩程等[16]研究发现,沉默miR-31-5p 能够通过破坏OSCC 细胞的线粒体活性,抑制OSCC 细胞增殖并诱导其凋亡。本研究结果显示,miR-31-5p表达≥3.258者3年累积生存率低于miR-31-5p 表达<3.258 者;多因素Cox 比例风险回归分析显示,miR-31-5p 表达≥3.258 是OSCC 患者死亡的独立危险因素。结果提示miR-31-5p 表达与OSCC患者预后有一定关系。
LATS 是AGC 家族中的一种丝氨酸/酪氨酸蛋白激酶,C 端序列高度保守而N 端序列变化多样,其功能亦具有多样性。LATS2 是LATS 家族的重要成员,在各种组织中广泛表达,以肌肉和心脏中表达最高。LATS2 基因定位于人染色体13q11~12 区域,该区域与多种抑癌基因的早期杂合性丢失抑制有关,提示LATS2 可能是一种抑癌基因。近年研究报道,LATS2在非小细胞肺癌、卵巢癌等恶性肿瘤细胞中低表达,上调LATS2 表达能够抑制肿瘤细胞增殖、分化和迁移等[17-18]。本研究结果显示,OSCC 组织LATS2 mRNA 相对表达量低于癌旁正常组织,并且OSCC 组织LATS2 mRNA 表达与肿瘤组织分化程度、TNM分期、淋巴结转移有关。提示LATS2在OSCC中发挥抑癌基因作用,LATS2 mRNA 表达降低可促进肿瘤恶性进展。这可能与LATS2 能够参与组成Hippo 信号通路有关。Hippo 信号通路上游膜蛋白受体作为胞外生长抑制信号的感受器,在感受到胞外生长抑制信号后可激活一系列激酶级联磷酸化反应,使下游Yes 相关蛋白(YAP)、具有PDZ 结合基序的转录共激活因子(TAZ)磷酸化,从而抑制肿瘤细胞增殖、分化、迁移等[19]。LATS2 拥有PPXY 基序,能够结合并磷酸化带有WW 结构域的YAP、TAZ,从而组成Hippo 信号通路,使YAP、TAZ 失去促癌作用[20]。本研究结果显示,LATS2 mRNA 表达≥1.216者3 年累积生存率高于LATS2 mRNA 表达<1.216者;而多因素Cox 比例风险回归分析显示,LATS2 mRNA 表达≥1.216 是OSCC 患者预后的独立保护因素。结果表明,LATS2 表达与OSCC 患者预后密切相关。
本研究经在线网站预测发现,miR-31-5p 与LATS2 存在靶向结合位点;相关性分析发现,OSCC组织miR-31-5p 表达与LATS2 mRNA 表达呈负相关关系。提示miR-31-5p、LATS2 可能共同影响OSCC患者预后。YUAN等[21]通过双荧光素酶报告基因试验证实,miR-31-5p 能够靶向下调LATS2 表达使Hippo信号通路失活,从而促进OSCC 生长。由于肿瘤恶性程度高、伴有淋巴结转移、耐药性高等原因,晚期OSCC 患者术后预后较差,5 年生存率较低。本研究结果亦发现,TNM 分期Ⅲ、Ⅳ期和有淋巴结转移是OSCC患者死亡的独立危险因素。
综上所述,OSCC 组织miR-31-5p高表达、LATS2低表达,二者表达变化与肿瘤组织分化程度、TNM分期、淋巴结转移以及患者预后有关。但目前miR-31-5p 和LATS2 在OSCC 发生、发展中的具体分子机制尚不完全清楚,仍需进一步研究。
