去甲肾上腺素在百草枯中毒致肺纤维化小鼠模型中的作用研究
2022-05-01汤涛陈铜兵王辉
汤涛 陈铜兵 王辉
[摘要]目的探讨去甲肾上腺素(NE)在百草枯中毒导致肺纤维化中的作用。方法选取苏州大学附属第三医院急诊科收治的41例百草枯中毒患者和6只实验小鼠的血浆,实验组和对照组小鼠各3只,实验组用百草枯处理,高效液相色谱电化学法检测血浆中 NE 浓度。采用微渗透泵构建小鼠模型,实验组9只,对照组小鼠3只,实验组用百草枯加 NE 处理,对照组仅用百草枯处理。模拟 NE 受体阻断剂普萘洛尔对百草枯中毒引起的肺纤维化模型,实验组和对照组小鼠各18只,实验组用百草枯加 NE 加普萘洛尔处理,对照组中普萘洛尔换成等量的乙醇。结果研究显示百草枯中毒患者的 NE 水平显著提高,而中毒实验小鼠 NE 并没有提高。体外细胞实验显示, NE 在体外可诱导人肺泡Ⅱ型上皮细胞发生上皮间质转化,从而协同百草枯中毒致肺纤维化,小鼠实验发现实验组用 NE 处理的小鼠肺纤维化程度高于对照组。普萘洛尔实验显示,实验组加了普萘洛尔后百草枯中毒小鼠的肺纖维化程度明显低于对照组。结论 NE 可能是导致临床百草枯中毒致肺纤维化疗效不佳的重要原因,普萘洛尔在临床上对百草枯中毒所致的肺纤维化有一定的预防作用。
[关键词]百草枯;肺纤维化;去甲肾上腺素;间质转化;普萘洛尔
[中图分类号] R965 [文献标识码] A [文章编号]2095-0616(2022)08-0027-05
The study on effect of norepinephrine in mouse models of pulmonary fibrosis induced by paraquat poisoning
TANG Tao CHEN Tongbing WANG Hui
Department of Pathology, the First People’s Hospital of Changzhou, Jiangsu, Changzhou 213003, China
[Abstract] Objective To investigate the effect of norepinephrine in pulmonary fibrosis induced by paraquat poisoning. Methods The plasma of 41 paraquat poisoning patients who were admitted to the emergency department of the Third Affiliated Hospital of Soochow University and plasma of 6 experimental mice were selected, with 3 mice each in the experimental group and the control group. The experimental group was treated with paraquat, and the high-performance liquid chromatography with electrochemical detection was used to determine the concentration of norepinephrine in plasma. A micro-osmotic pump was used to construct a mouse model, with 9 mice in the experimental group and 3 mice in the control group. The experimental group was treated with paraquat plus norepinephrine, and the control group was treated with paraquat only. A model of pulmonary fibrosis induced by paraquat poisoning with propranolol, a norepinephrine receptor blocker, was established. There were 18 mice in each of the experimental group and the control group. The experimental group was treated with paraquat plus norepinephrine plus propranolol, and propranolol in the control group was replaced with the same amount of ethanol. Results The study showed that the level of norepinephrine in paraquat poisoned patients was significantly increased, while it did not increase in poisoned experimental mice. In vitro cell experiments showed that norepinephrine induced epithelial-mesenchymal transition in human alveolar type Ⅱ epithelial cells in vitro, thereby cooperating with paraquat poisoning to induce pulmonary fibrosis. Experiments in mice found that the degree of pulmonary fibrosis in mice treated with norepinephrine in the experimental group was higher than that in the control group. The propranolol experiment showed that the degree of pulmonary fibrosis in the paraquat poisoned mice in the experimental group with addition of propranolol was significantly lower than that of the control group. Conclusion Norepinephrine may be an important reason for the poor efficacy of clinical pulmonary fibrosis induced by paraquat poisoning. Propranolol has a certain clinical preventive effect on pulmonary fibrosis induced by paraquat poisoning.
[Key words] Paraquat; Pulmonary fibrosis; Norepinephrine; Mesenchymal transition; Propranolol
百草枯(paraquat, PQ)中毒是较常见的农药中毒之一,毒性可累及全身多个脏器,但主要以肺为靶器官,早期临床表现为急性肺损伤,后期可出现肺泡内和肺间质纤维化[1-2]。肺纤维化是 PQ 中毒患者致死的主要原因,病死率高达70%[3]。全球关于 PQ 中毒致肺纤维化的防治在细胞和动物实验中已经取得不错的疗效[4-6],然而在实际临床治疗中, PQ 中毒致肺纤维化的疗效还不尽如人意,特别是在提高生存率方面。不同于实验动物,人作为高级情感动物,PQ 中毒患者常处于应激状态。人应激状态下,机体分泌以去甲肾上腺素(norepinephrine, NE)为代表的压力相关激素[7-9]。是否正是由于人长期处于应激状态而实验动物没有处于应激状态才导致人的 PQ 中毒致肺纤维化的疗效远低于实验动物?基于此,本研究通过细胞实验和小鼠动物实验探讨 NE 在 PQ 中毒致肺纤维化中的作用。
1材料与方法
1.1 细胞及试剂
1.1.1 细胞株肺癌人类肺泡基底上皮细胞 A549肺癌胞株购于中国科学院典型培养物保藏委员会细胞库。A549细胞株可合成卵磷脂,并且含有高度不饱和脂肪酸,广泛用于Ⅱ型肺上皮细胞模型在药物代谢的体外模型。
1.1.2 试剂 DMEM 细胞培养液购于 Invitrogen 公司;胎牛血清购于美国Hyclone公司; E-cadherin 和 Vimentin 抗体购于北京中杉金桥生物有限公司。1.2 方法
1.2.1 细胞培养 A549细胞用含10%灭活胎牛血清、100 U/ml 青霉素、100 U/ml 链霉素和2 mmol/L 谷氨酰胺的高糖 DMEM 完全培养液,于37℃、体积分数为5% CO2培养箱中培养,每2~3天用0.25%胰蛋白酶和0.5% EDTA 混合液传代。
1.2.2 PQ 中毒致肺纤维化小鼠模型建立外源性 NE 微渗透泵实验鼠模型,其中小鼠许可证号:SYKX(苏)2016-0049。将含有 NE 的微渗透泵植入实验雌性 C57BL/6小鼠背部皮下,可缓慢持续释放 NE。为解决 NE 半衰期过短的问题,本研究在动物实验部分采用小鼠皮下植入含 NE 的微渗透泵(Alzet model 1004,Durect, Cupertino, CA),24 h 不间断(最长达4周)持续给予外源性 NE。该泵的工作原理是利用胶囊与所植入部位的组织或器官之间的渗透压的差异运作。各组小鼠的泵内预先被注入含有56 mM 的 NE,总体积为100μl 的生理盐水(每天1μmol/100 g)。以不含有药物的生理盐水组作为对照组。每只泵内还要加入0.2%的抗坏血酸作为抗氧化剂。另外,在植入小鼠体内前所有微渗透泵要在无菌生理盐水浸泡48 h 以保证在植入体内后即刻开始释放药物。PQ 中毒致肺纤维化模型采用大小实验鼠均有相关报道,本研究 PQ 中毒肺纤维化造模采用小鼠。8周龄的 SPF 级 C57BL/6雌性实验鼠于应激第2天一次性腹腔注射 P Q 溶液15 mg/kg 制成 PQ 致肺纤维化模型。PQ 的浓度各文献报道不一,普遍波动于10~20 mg/kg,观察时间2~4周。本研究采用方案为15mg/kg,观察3周。1.2.3 高效液相色谱电化学法检测 PQ 中毒患者血浆 NE 水平收集2017年1月至2019年10月苏州大学附属第三医院急诊科收治的41例 PQ 中毒患者血液,采用高效液相色谱电化学法检测 NE 浓度,PQ 中毒患者血液采集时间为入院第1、8、15天,以20例正常人的血浆 NE 浓度作为对照组。
1.2.4 NE 处理 PQ 中毒小鼠动物模型实验中设计两组动物,单纯对照组3只, PQ 组9只分三个亚组,造模后分别于第7、14、21天处死小鼠并取出肺组织评价造模效果。结果显示造模基本稳定可靠。在后续的动物实验中,用 PQ 中毒致肺纤维化而不含应激因素作为对照组。设两组,PQ 对照组, PQ+NE 组。每组18只,每组分三个亚组,每亚组6只分别用于 PQ 处理第7、14、21天三个阶段分别处死小鼠,并进行病理检测和评价。
1.2.5 普萘洛尔干预百草枯中毒小鼠模型小鼠实验设两组, PQ+NE+乙醇组, PQ+NE+普萘洛尔(每天1μmol/100 g)组。每组18只,每组分三个亚组,每亚组6只分别用 PQ+NE+乙醇和 PQ+NE+普萘洛尔(每天1μmol/100 g)处理,对照组的乙醇注射量与实验组的普萘洛尔注射量相同,都是腹腔注射。在第7、14、21天三个阶段分别处死小鼠,进行病理检测和评价。
1.2.6 免疫荧光、电子显微镜扫描免疫荧光、电子显微镜扫描等实验技术具体操作流程按相关技术指导、参考文献、试剂盒说明及实验室操作手册进行[10]。
2结果
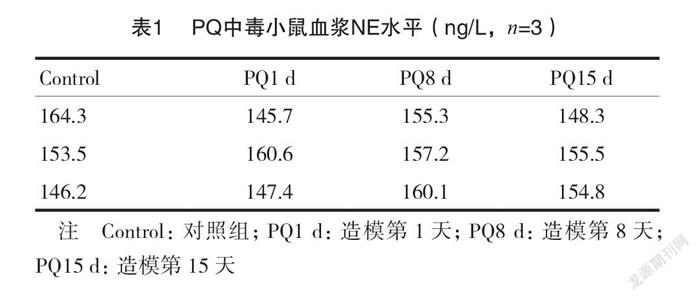
2.1 PQ中毒小鼠血浆NE水平
本研究首先证实 PQ 中毒小鼠并不处于应激状态。实验中设计两组,对照组3只, PQ 组3只,造模后分别于第1、8、15天取血100μl,對照组也是同时取血100μl。采用高效液相色谱电化学法检测血浆中 NE 浓度,结果显示对照组小鼠和 PQ 中毒组小鼠血浆 NE 浓度都在(150±15) ng/L 范围。即小鼠 PQ 中毒后血浆中 NE 浓度相比于对照组没有明显改变,见表1。
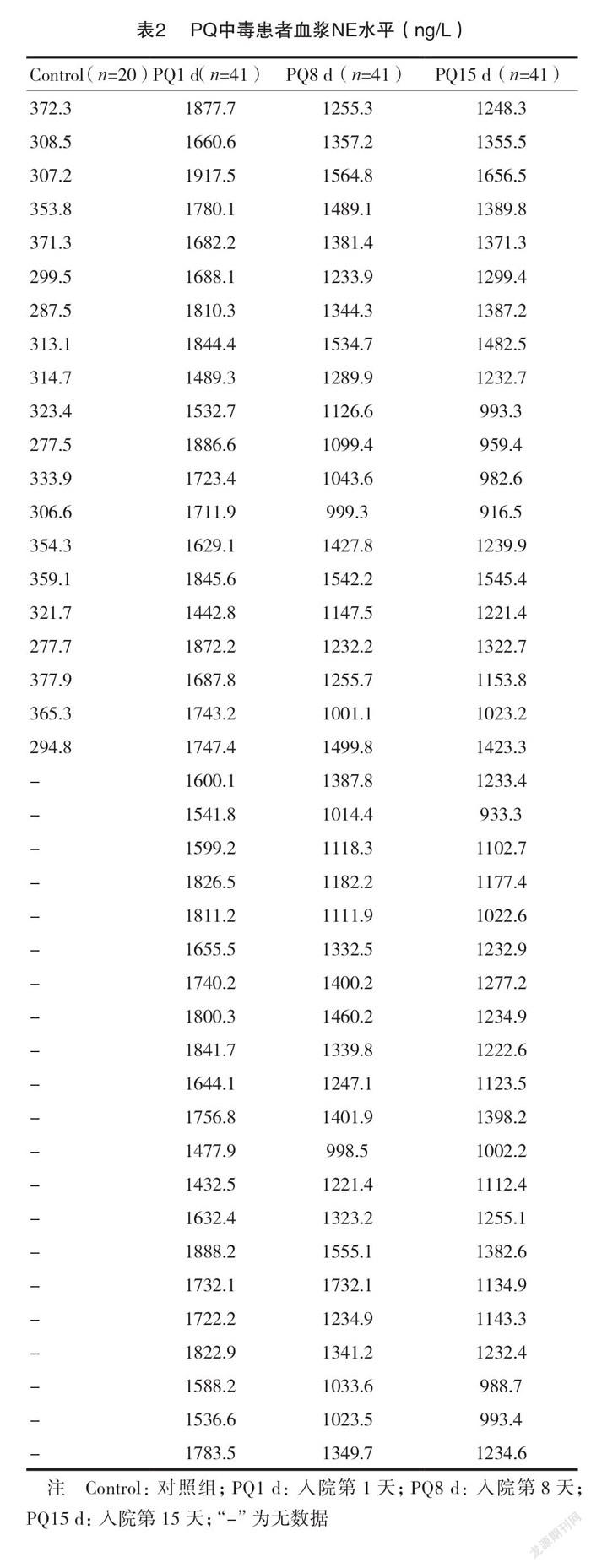
2.2 PQ中毒患者血浆NE水平
正常人的血浆 NE 浓度为(308±70)ng/L,41例 PQ 中毒患者入院当天血浆 NE 浓度高达正常对照人群的4.9倍[(1502±416)ng/L],而且入院第8 和15天的血浆 NE 水平仍维持在正常水平的4.0倍[(1226±339)ng/L]和4.2倍[(1285±372)ng/L],见表2。研究结果证实患者在 PQ 中毒后血浆 NE 长期保持在较高水平,即 PQ 中毒后患者长期处于应激状态。
2.3 NE能诱导肺泡Ⅱ型上皮细胞A549发生上皮间质转变
使用10μM 的 NE 处理 A549细胞株4 d, A549细胞形态会发生改变,可由椭圆形或多边形的上皮细胞形态转变为梭状的成纤维细胞样形态,扫描电子显微镜下观察,微绒毛和伪足都明显增多,见图1。免疫荧光染色显示细胞免疫表型也发生改变,上皮标记 E - c a d h e r i n 表达缺失,间叶组织标记 Vimentin 表达获得,见图2。
2.4 NE协同PQ致肺纤维化
小鼠模型病理常规 HE 染色结果显示,与单纯 PQ 组相比,小鼠背部皮下被植入含 NE 的微渗透泵模拟应激状态下(PQ+NE)两周后肺纤维化程度加重,表现在肺泡间隔的弥漫性纤维化,肺内血管壁增厚,出现蜂窝样变。见图3。
2.5 普萘洛尔对百草枯中毒患者肺纤维的作用
病理常规 HE 染色显示,背部皮下被植入含 NE 的微渗透泵模拟应激状态(PQ+NE)并腹腔注射普萘洛尔(每天1μmol/100 g)的小鼠与注射乙醇的对照组相比,两周后,实验组肺纤维化程度明显低于对照组,见图4。
3讨论
PQ 是一种速效非选择性高效接触型除草剂,对周围环境无害,故而曾经在农业领域得到广泛应用[11-12]。百草枯中毒时,导致肺纤维化损伤和肾小管坏死[13]。早期采用强化免疫抑制剂治疗可减轻中重度 PQ 中毒所诱发的各脏器功能损害,尤其是减轻肺纤维化[14-15]。
本研究通过对 PQ 中毒患者和小鼠动物实验的研究发现,百草枯中毒患者体内 NE 浓度持续较高,而中毒小鼠体内 NE 浓度无明显改变。由于 NE 是具有代表性的压力相关激素,人在应激状态下才会浓度上升[16]。课题组用 NE 處理 A549细胞株,发现 A549细胞发生了上皮间质转变(epithelial– mesenchymal transition, EMT),提示在 NE 作用下 A549细胞已经发生了 EMT。既往研究已经证明肺泡上皮细胞在各种因素下转变分化为间质型肌成纤维细胞即 EMT,是形成肺纤维化的重要机制[17-18]。本研究进一步通过小鼠动物实验初步观察到小鼠背部皮下被植入含 NE 的微渗透泵模拟应激状态下(PQ+NE)两周后,结果显示肺纤维化程度加重。本研究的实验结果在活体水平提示 NE 对 PQ 致肺纤维化起到了协同作用,细胞和动物实验也证实 NE 对 PQ 致肺纤维化起到了协同作用。提示 NE 可能是导致人与动物模型百草枯中毒疗效差的原因。本研究使用了 NE 受体的阻断剂普萘洛尔,结果显示普萘洛尔通过阻断百草枯患者压力相关激素 NE 的上调从而起到改善肺纤维化的作用。提示普萘洛尔可以对 PQ 中毒患者的肺纤维化有一定的预防作用,对百草枯的治疗有重要的临床意义。研究结果为百草枯中毒患者的治疗提供了新的思路和见解,具有重要的临床意义。
综上所述,PQ 中毒患者的治疗效果一直不太理想,所以需要从多角度多维度展开研究,本研究已经发现普萘洛尔可以通过阻断 PQ 患者压力相关激素 NE 的上调从而起到改善肺纤维化作用,对百草枯中毒的治疗有新的启示。本研究从NE 入手,通过小鼠实验从新的角度验证了普萘洛尔可以对百草枯中毒起到一定的治疗作用。在今后的研究中,科研工作者们可以从多个通路对 PQ 中毒展开研究,以期在不久的将来完全治愈 PQ 中毒。
[参考文献]
[1] Dinis-Oliveira RJ,Duarte JA,Sánchez-Navarro A,et al.Paraquat poisonings: mechanisms of lung toxicity, clinical features, and treatment[J]. Crit Rev Toxicol,2008,38(1):13-71.
[2] Smith LL.Mechanism of paraquat toxicity in lung and itsrelevance to treatment[J]. Hum Toxicol,1987,6(1):31-36.
[3]中国医师协会急诊医师分会.急性百草枯中毒诊治专家共识[J].中华危重病急救医学,2013,33(6):484.
[4] Liu MW,Su MX,Tang DY,et al .Ligustrazinincreases lung cell autophagy and ameliorates paraquat-induced pulmonary fibrosis by inhibiting P I3K/Akt/mT OR and hedgehog s ignalling via increasing mi R-193a expression[J].B M C Pulm Med,2019,19(1):35.
[5] AhlameSaidi, Mariana Kasabova, Lise Vanderlynden,et al.Curcumin inhibits the TGF-beta1-dependent differentiation of lung fibroblasts via PPARgamma-driven upregulation of cathepsins B and L[J].Sci Rep,2019,9(1):491.
[6] Hongliang Zhang,Bing Xiao, Li Jiang,et al.Inhibitionof mesenchymal stromal cells’chemotactic effect to ameliorate paraquat-induced pulmonary fibrosis[J]. Toxicol Lett,2019,307:1-10.
[7] Thaker PH,Han LY,Kamat AA,et al.Chronic stresspromotes tumor growth and angiogenesis in a mouse model of ovarian carcinoma[J].Nat Med,2006,12(8):939-944.
[8] Schmidt C,Kraft K.Beta-endorphin and catecholamineconcentrations during chronic and acute stress in intensive care patients[J].Eur J Med Res,1996,1(11):528-532.
[9] Nicolas Borderies, Pauline Bornert, Sophie Gilardeau,et al.Pharmacological evidence for the implication of noradrenaline in effort[J].PLoS Biol,2020,18(10):e3000793.
[10] MATHIAS UHLEN,MAX J.KARLSSON,WENZHONG,et al.A genome-wide transcriptomic analysis of protein-coding genes in human blood cells[J]. Science,2019,366(6472):eaax9198.
[11] Meredith TJ,Vale JA.Treatment of paraquat poisoningin man: methods to prevent absorption[J].Hum Toxicol,1987,6(1):49-55.
[12] Bismuth DC,Garnier R,Baud FJ,et al.ParaquatPoisoning[J]. Drug Safety,1990,5(4):243-251.
[13] Bharadhan Somu,Sujay Halkur Shankar,UpendraBaitha,et al.Paraquat poisoning[R]. QJM,2020,113(10):752.
[14] Goldstein DS,McewenB.Allostasis, Homeostats,and the Nature of Stress[J].Stress: The International Journal on the Biology of Stress,2002,5(1):55-58.
[15] Robert M.Sapolsky.The influence of social hierarchy onprimate health[Z]. Science,2005,308(5722):648-652.
[16] Arun Kumar Yadawa, Rashmi Richa, ChandraMohini Chaturvedi.Herbicide Paraquat provokes the stress responses of HPA axis of laboratory mouse, Musmusculus[J].PesticBiochemPhysiol,2019,153:106-115.
[17] LinshenXie,Dingzi Zhou,JingyuanXiong,et al.Paraquat induce pulmonary epithelial-mesenchymal transition through transforming growth factor-beta1- dependent mechanism[J]. Exp ToxicolPathol,2016,68(1):69-76.
[18] Han YY,Shen P,Chang WX.Involvement ofepithelial-to-mesenchymal transition and associated transforming growth factor-β/Smad signaling in paraquat-induced pulmonary fibrosis[J].Mol Med Rep,2015,12(6):7979-7984.
(收稿日期:2021-09-16)
