IRF1受到miR-23a调控抑制舌鳞癌细胞增殖并促进凋亡
2022-04-28孙继红陶亚东武俊华徐树雷
孙继红, 柳 雪, 陶亚东, 刘 慧, 霍 峰, 武俊华, 徐树雷
(1.承德医学院校医院, 河北 承德 067000 2.承德医学院附属医院, 河北 承德 067000 3.河北省军区承德离职干部休养所, 河北 承德 067000)
在常见的恶性肿瘤中头颈部肿瘤排名第六位,90%为头颈部鳞状细胞癌和口腔鳞状细胞癌[1]。其中口腔舌鳞状细胞癌(oral tongue squamous cell carcinoma,OTSCC)是最常见的口腔鳞状细胞癌。根据肿瘤调查统计数据,口腔癌的5年生存率约为53%,而口腔舌鳞癌的5年生存率仅为33%~40%[2]。OTSCC通常根据临床症状,淋巴结肿大和远处转移情况评估肿瘤,并进行治疗计划分期[3]。但是这种分期系统不能为早期OTSCC提供准确的预测。因此,我们要寻找更可靠的预后标志物,以便更好地鉴别早期OTSCC具有侵袭性行为。证据显示20%~40%的患者在发病前已经有隐匿性转移[4]。干扰素调节因子(interferon regulatory factor,IRF)是一类重要的转录调节因子,该家族基因主要由IRF1-IRF9等9个成员组成。干扰素调节因子-1 (Interferon regulatory factor-1,IRF1)是IRF家族的一种肿瘤调节因子,调节干扰素的表达[5]。随着研究的深入,IRF1在炎症、免疫反应、细胞增殖、细胞周期进展、T细胞分化和DNA损伤期间的基因表达调控中的功能越来越多被报道被揭示。IRF1基因改变和/或低表达与较差的临床结果、较高的癌症易感性和较低的免疫治疗应答有关,提示IRF1在白血病、乳腺癌、宫颈癌和结直肠癌等多种癌症类型中具有抑癌作用[6]。然而,IRF1在肝癌和食管癌中的致癌能力最近有报道[7]。这些研究表明IRF1在癌症中起到抑癌基因的作用,并且与癌症类型相关。在本研究中,我们发现IRF1在口腔舌鳞癌细胞中表达显著降低。而且过表达IRF1后可以抑制口腔舌鳞癌细胞的增殖,并促进细胞凋亡。故此我们大胆推测IRF1在口腔舌鳞癌细胞中起到抑癌基因作用,并且进一步探求了IRF1的上游表达调控因子,以期能够揭示IRF1在口腔舌鳞癌细胞中的作用机制,为口腔舌鳞癌细胞的早期诊断和治疗提供分子依据。
1 材料与方法
1.1主要试剂及仪器:(1)Tca-8113细胞:(天津赛尔生物技术有限公司);(2) IRF1过表达和敲降质粒:(天津赛尔生物技术有限公司);(3) 胰蛋白酶:(GIBCO BRL,美国);(4) 1640培养基:(GIBCO BRL,美国);(5)Opti-MEM:(GIBCO BRL,美国);(6)乙二胺四乙酸二钠(EDTA-Na2):(天津市化学试剂批发公司);(7) PBS (含137 mmoL/L NaCl,2.7 mmoL/L KCl,10 mmoL/L Na2HPO4,2 mmoL/L KH2PO4);(8) 胎牛血清(FBS):(GIBCO,美国);(9)6孔,12孔,24孔培养板,T25细胞培养瓶:(Orange Scientific,比利时);(10)CO2恒温培养箱:(Thermo Forma,美国);(11)5415D型离心机:(Eppendorf,德国);(12)TUNEL细胞凋亡原位检测试剂盒:(Roche,瑞士) ;(13)脂质体Lipofectamine2000 Reagent:(Invitrogen,美国);(14)12对口腔舌鳞癌组织及其癌旁正常组织:(承德医学院附属医院口腔科)。
1.2细胞转染:首先进行细胞接种,100万个细胞接种至25mL细胞培养瓶中,培养过夜,次日转染。质粒的质量(μg)与脂质体的体积比例为1∶1,配制好质粒与脂质体混合物后,静置20min后再加入细胞培养瓶中。转染4h后,更换细胞培养液。
1.3TUNEL方法:细胞转染后24h,调整细胞浓度,按照4000个/孔接种14孔板。每组实验设置3个副孔。待细胞贴壁后,加0.1ppc的紫杉醇诱导凋亡1h。处理标志为:细胞部分变圆,部分形态正常。样本固定:待6孔板中细胞晾干之后,每孔加入1mL新鲜配制的固定液室温15~25℃固定细胞1h, (固定液:4%多聚甲醛溶于PH7.4 的PBS 中,新鲜配制); 漂洗;加入1mL封闭液,室温15~25℃封闭10min;(封闭液:无水甲醇稀释的3%H2O2)。漂洗;加入1mL通透液,冰上放置2min;(通透液:0.1%TritonX-100溶于0.1%柠檬酸钠,需新鲜配制)。制作阳性对照样本:样本在Triton X-100通透液处理、PBS浸洗后,用DNA酶1反应液,处理30min。配制TdT酶反应液:平衡液 45μL,荧光标记液1μL,TdT 酶 4μL,共50μL 。标记:漂洗2次; 标记 60min;漂洗;染色5min。荧光显微镜下观察,可以使用的激发波长范围为450~500nm,发射波长范围为515~565nm(绿色荧光);凋亡指数是指每张TUNEL阳性切片选取5个阳性细胞(表达绿色荧光的细胞为阳性)数最多的高倍视野(400),计算500个舌鳞癌细胞中阳性细胞所占的百分比。
1.4实时定量PCR实验(Real-time PCR):混匀后37℃1min,50℃ 60min,70℃ 15min。cDNA产物置于冰盒中待用,或-20℃保存备用。①按照所需用量增加配比体积。配置比例如下:2 × Master Mix,5μL;10uM 的PCR特异引物F,0.5μL;10uM 的PCR特异引物R,0.5μL水,2μL。②加样 取8μL混合液分别加入至每个孔中,再按照实验分组分别加入相应的cDNA,2μL/孔;封膜,混匀,瞬离;置于冰板上备用。③设置如下反应程序:95℃,8min;95℃,10s;60℃,60s;42个循环。④计算结果:收集结果,实验中设置5个副孔,去掉最高值和最低值,取3个副孔的平均数,采用2-△△Ct法分析数据。Folds=2-△△Ct,△△Ct=(Ct1~Ct2)-(Ct3~Ct4)
1.5MTT实验:细胞转染18h后,消化,计数,以每孔6000个细胞种于96孔板,在细胞转染后不同天数的同一时间进行检测,依此加入MTT液与DMSO,然后测定A570。实验中设置5个副孔,去掉最高值和最低值,取3个副孔的平均数。
1.6荧光报告载体实验:通过Targetscan软件预测到miR-23a可以与IRF1 3’UTR相结合,结合位点序列为:AATGTGA,将该序列突变为TAAGAGT。将包含结合位点长度为150bp的野生型和突变型IRF1 3’UTR(IRF13’UTR,IRF1 3’UTR mut)构建到pCD3/EGFP载体中。以50nmoL/L ASO-NC,ASO-23a,或者200ng pcDNA3,pri-miR-23a和IRF13’UTR,IRF13’UTR mut质粒共转24孔板中的Tca8113细胞,并添加1.0μL Lipofectamine 3000转染试剂,转染4h后换液;转染48h后收集细胞进行裂解,并利用双荧光素酶试剂盒进行分析。实验中设置5个副孔,去掉最高值和最低值,取3个副孔的平均数。
1.7Western blot:裂解细胞,取上清液。配制10%凝胶,上样,分离,转膜,封闭,加入抗体,IRF1抗体和GAPDH抗体分别按照1∶200和1∶500的比例加入相应的膜中,置于4℃过夜。次日洗膜后,将二抗按照1∶1000的比例加入膜中室温作用2h。曝光,照相。用LabWorks TM凝胶成像及分析系统对胶片进行摄像,软件分析得到各组蛋白条带亮度值,并以对照组为标准值1,绘制柱状图。实验均重复3次。
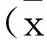
2 结 果
2.1IRF1在舌鳞癌组织中表达水平降低:结果显示,与癌旁正常组织相比,IRF1在舌鳞癌组织中表达平均下降至对照组的38%,最低下降至11%,其中有一例下降至对照组98%(图1)。结果表明在12对舌鳞癌组织中,与癌旁组织相比,IRF1的表达水平明显下降,差异有统计学意义。

图1 12对舌鳞癌组织中IRF1的表达水平Real-time PCR检测舌鳞癌组织及其癌旁组织中的IRF1。
2.2IRF1 抑制舌鳞癌细胞的生长活性:由于IRF1在舌鳞癌组织中表达降低,我们构建了IRF1的过表达质粒,通过细胞转染提升Tca8113细胞内的表达水平。如图2所示,过表达IRF1后,Tca8113细胞的生长活性与对照组相比明显下降,差异有统计学意义。转染后24h检测细胞活性,过表达IRF1组下降至对照组的87%;转染后48h检测细胞活性,过表达IRF1组下降至对照组的75%;转染后72h检测细胞活性,过表达IRF1组下降至对照组的61%。上述结果表明IRF1可以抑制舌鳞癌细胞的生长活性。
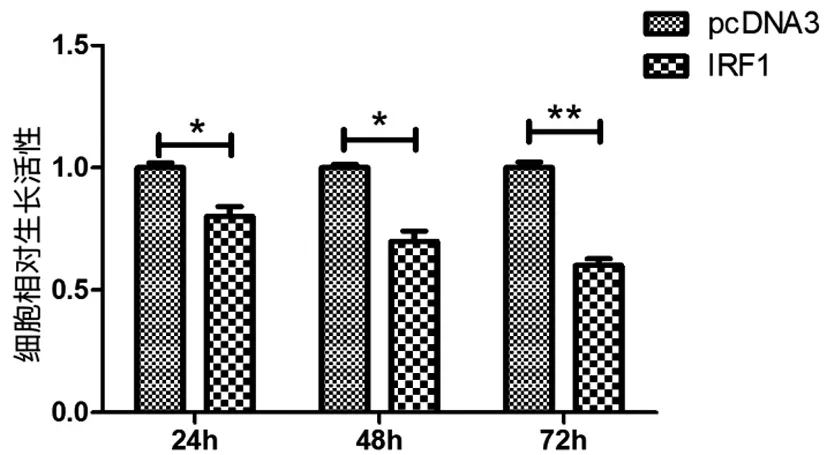
图2 IRF1对Tca8113细胞生长活性的影响在Tca8113细胞中转染IRF1过表达质粒后,分别在24h,48h,72h应用MTT实验检测细胞的生长活性。
2.3IRF1促进舌鳞癌细胞的凋亡:基于以上结果,IRF1在舌鳞癌组织中表达异常降低,且IRF1可抑制舌鳞癌细胞的生长活性。我们应用紫杉醇诱导细胞凋亡(浓度为0.1ppc),在细胞转染后24h加入紫杉醇,诱导凋亡1h,通过TUNEL实验检测IRF1对舌鳞癌细胞凋亡的影响。如图3A所示,过表达IRF1后,IRF1过表达组比IRF1-对照舌鳞癌细胞Tca8113的凋亡细胞明显增加,凋亡指数由0.9%增加到8.4%(图3B),差异有统计学意义。结果表明IRF1可以促进舌鳞癌细胞的凋亡。

图3 IRF1对Tca8113细胞凋亡的影响(A)在Tca8113细胞中转染IRF1过表达质粒,转染后加入0.1ppc紫杉醇诱导24h后,拍照检测凋亡细胞数目。(B) 对视野内的细胞计数并统计出凋亡指数。
2.4IRF1是miRNA-23a的直接靶基因:如图4所示,生物信息学软件预测miR-23a的种子序列可以与IRF1的3’UTR相结合。IRF1野生型的3’UTR与miR-23a有7个结合位点,也称作种子序列。我们将野生型的IRF1 3’UTR构建荧光报告质粒pcDNA3-EGFP-IRF1 3’UTR。 我们将种子序列中突变了四个位点, 作为突变型的IRF1 3’UTR mut,构建荧光报告质粒pcDNA3-EGFP-IRF1 3’UTRmut。用于接下来的荧光报告载体实验。如图5所示,我们将野生型荧光报告载体pcDNA3-EGFP-IRF1 3’UTR,图中简写为EGFP-IRF1 3’UTR转染进舌鳞癌细胞Tca8113中,同时过表达miR-23或封闭miR-23a,结果显示过表达miR-23a后,pri-miR-23a组比pcDNA3组荧光强度降低了55%;封闭miR-23a后,ASO-23a组比ASO-NC组荧光强度增强了1.7倍,差异有统计学意义。我们将突变型的荧光报告载体pcDNA3-EGFP-IRF1 3’UTRmut,同时过表达或者封闭miR-23a,结果显示,pri-miR-23a组比pcDNA3组荧光强度增强1.1倍;封闭miR-23a后,ASO-23a组比ASO-NC组荧光强度降低至97%,两组差异均无统计学意义。综上,荧光实验结果显示miR-23a可以直接靶定IRF1 3’UTR野生型,并且抑制其下游的荧光基因表达,导致荧光表达降低。
图4 miR-23a与IRF1mRNA3‘UTR相结合的种子序列以及突变型
图5 荧光报告载体实验结果构建IRF13’UTR的野生型及突变型荧光报告载体,转染进舌鳞癌细胞中,同时过表达或者封闭miR-23a检测各组荧光强度
2.5舌鳞癌组织中miR-23a的表达水平:如图6所示,我们用实时定量PCR检测miR-23a的表达水平,在12对舌鳞癌组织中结果显示,在舌鳞癌组织中miR-23a表达升高,癌组织与癌旁正常组织相比miR-23a的表达水平平均升高32.5倍,最低9.2倍,最高57.4倍,差异有统计学意义。结果表明,在舌鳞癌组织中miR-23a的表达水平异常升高,起致癌基因作用,促进舌鳞癌发生发展。
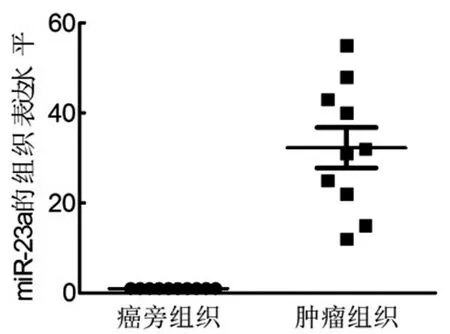
图6 miR-23a在舌鳞癌组织中的表达水平应用real-time PCR检测miR-23a在舌鳞癌组织中的表达水平
2.6封闭miR-23a表达后,舌鳞癌细胞活性明显降低:上述结果显示IRF1在舌鳞癌组织中水平异常降低,上游受miR-23a调控,在舌鳞癌组织中miR-23a表达水平升高。我们大胆推测升高的miR-23a通过靶定IRF1的3‘UTR降低了IRF1的表达水平。我们合成了miR-23a的反义寡核苷酸序列ASO-23a,以此封闭舌鳞癌细胞中异常高表达的miR-23a,无意义序列ASO-NC作为对照。将ASO-23a转染进Tca8113细胞后,ASO-23a与细胞内高表达的miR-23a相结合,解除了miR-23a对IRF1的负性调控。我们应用MTT实验检测封闭miR-23a后,舌鳞癌细胞活性的改变。如图7所示,转染24h后检测舌鳞癌细胞的生长活性,与ASO-NC组相比,ASO-23a组下降了14%;转染48h后检测舌鳞癌细胞的生长活性,与ASO-NC组相比,ASO-23a组下降了24%;转染72h后检测舌鳞癌细胞的生长活性,与ASO-NC组相比,ASO-23a组下降了39%(图7)。结果表明,与ASO-NC组相比,ASO-23a组的细胞活性明显下降,且差异有统计学意义。封闭miR-23a与过表达IRF1的细胞活性检测结果一致,都降低舌鳞癌细胞的生长活性。
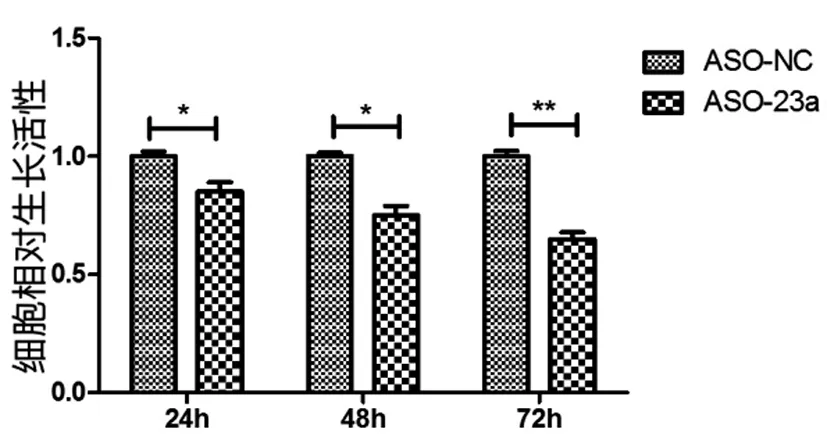
图7 封闭miR-23a后MTT的实验结果在Tca8113细胞中转染ASO-23a和ASO-NC,在转染后24h,48h和72h检测舌鳞癌细胞的生长活性。
2.7封闭miR-23a表达后,舌鳞癌细胞的凋亡明显增强:我们应用紫杉醇诱导细胞凋亡(浓度为0.1ppc),在细胞转染后24h,将细胞转接种至14孔板中,加入0.1ppc紫杉醇,药物诱导细胞凋亡作用1h后,通过TUNEL实验检测IRF1对舌鳞癌细胞凋亡的影响。我们封闭细胞内源性miR-23a后应用TUNEL实验检测舌鳞癌细胞的凋亡活性。如图8所示,与ASO-NC组相比,ASO-23a组的细胞凋亡数目明显增加,且差异有统计学意义。如图8A所示,封闭miR-23a后,ASO-23a组比ASO-NC组舌鳞癌细胞Tca8113的凋亡细胞明显增加,凋亡指数由1.2%增加到7.8%(图8B),差异有统计学意义。结果表明封闭miR-23a与过表达IRF1所得的结果一致,都可以促进舌鳞癌细胞的凋亡。
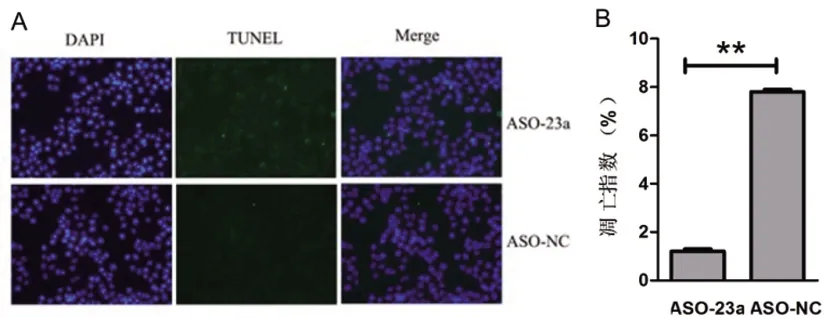
图8 封闭miR-23a后TUNEL的实验结果在Tca8113细胞中转染ASO-23a和ASO-NC,在转染后的24h应用0.1ppc紫杉醇诱导细胞凋亡1h。(A)用荧光显微镜拍照计数凋亡细胞的数目。(B) 对视野内的细胞计数并统计出凋亡指数。
3 讨 论
本研究发现IRF1在舌鳞癌的表达降低,并且IRF1可以抑制舌鳞癌细胞的细胞生长活性并且增强其细胞凋亡。我们通过TargetScan预测并经荧光报告载体实验验证IRF1上游受miR-23a调控,miR-23a通过靶定IRF1的3‘UTR降低了IRF1的表达,同时在舌鳞癌组织中miR-23a表达明显高于对应癌旁正常组织。
miRNA是非编码RNA,长度为19-25个核苷酸。它是一种新型的基因表达调控分子,可以通过调控许多基因的表达来参与各种肿瘤的发生发展[8]。此前已有研究表明,部分miRNAs与OTSCC的发生发展密切相关[9]。microRNA-21和microRNA-375可以作为口腔鳞癌的生物标志物。miR-21可降低OTSCC细胞系中HPGD的表达,荧光素酶报告基因实验证实了miR-21直接靶向HPGD mRNA。也证实了PGE2介导的miR-21的上调,提示OTSCC细胞中存在参与miR-21、HPGD和PGE2的正前馈环,有助于肿瘤的发生。miR-498和miR-940影响OTSCC细胞的侵袭和迁移能力[10]。而miR-101参与了舌鳞癌细胞的上皮间质转化和肿瘤细胞转移过程。hsa-miR-222通过直接顺式调控机制(靶向MMP1 mRNA)和间接反式调控机制(靶向SOD2间接控制MMP1基因表达)调控MMP1表达。hsa-miR-222在OTSCC侵袭中发挥重要作用,可能成为转移性疾病风险OTSCC患者新的治疗靶点。
miR-23a直接和间接调控多种基因表达和信号转导,介导肿瘤发生、肿瘤增殖、生存、细胞迁移和侵袭以及抗肿瘤治疗的反应,在癌症诊断、预后和治疗应用中发挥重要作用。例如,肺癌患者血清中循环miR-23a水平升高,miR-23a水平与促血管生成活性呈正相关。结肠癌患者血清标本外泌体中miR-301a和miR-23a表达水平升高,可以作为结直肠癌早期检测的非侵入性生物标志物[11]。在前列腺癌中,青藤碱通过抑制miR-23a的表达水平,进而前列腺癌细胞的增殖、迁移、侵袭均受到抑制,同时细胞凋亡增加。然而,关于miR-23a在OTSCC中的表达及在OTSCC诊断中的意义的研究较少。
据报道,IRF1也可以通过结合其特定靶基因的启动子来发挥其生物学功能。例如,IRF1可以结合ras相关基因RASSF5的启动子,通过促进RASSF5表达下调RAS-RAC1通路从而抑制结直肠癌细胞的转移和增殖。在结肠癌中,IRF1表达显著降低,而且体外试验表明IRF1抑制结肠癌细胞的增殖和迁移并且可以调节细胞的周期分布。在非小细胞肺癌中IRF1发挥潜在的抑癌作用,表皮生长因子和缺氧同时抑制IRF1的表达,且与其不良预后相关。在本研究中,我们发现12份OTSCC标本中,有11份标本的IRF1水平较正常对照显著降低(P<0.001)。体外试验表明,在OTSCC细胞中过表达IRF1后,细胞生长活性显著降低,且细胞凋亡率增加。这些结果表明IRF1在OTSCC进程中起到抑制作用,这与IRF1在胰腺癌,乳腺癌,胃癌和前列腺癌中的表达模式一致[12,13]。
封闭miR-23a后,舌鳞癌细胞增殖和凋亡表型与过表达IRF1后表型改变一致。我们通过转染miR-23a的反义寡核苷酸序列,封闭了舌鳞癌细胞中异常高表达的miR-23a,通过MTT实验与TUNEL实验检测细胞的增殖与凋亡的改变,与过表达IRF1所得的表型改变一致。由于封闭了高表达的miR-23a,解除了对IRF1的抑制作用,相当于过表达了IRF1,故二者的细胞表型变化一致。
综上,本研究表明IRF1在舌鳞癌的发生发展中起到抑癌基因的作用。IRF1上游受到miR-23a的调控,在OTSCC组织中miR-23a表达明显升高,下调了IRF1的表达水平,从而促进了OTSCC细胞的增殖,抑制了细胞凋亡。
