甲状腺腺瘤与乳头状癌的CT、MRI研究
2022-04-27张雪瑞白汉林刘士梅
张雪瑞 白汉林 刘士梅
河南医学高等专科学校附属医院医学影像科 (河南 新郑 451191)
甲状腺腺瘤(thyroid adenoma,TA)是常见的甲状腺良性肿瘤,其发病率较高,延误治疗或无效治疗可能会诱发甲亢的生成。此外,少数甲状腺结节为恶性肿瘤,甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是最为常见的甲状腺恶性肿瘤,恶性程度较低,在患者早期、无转移时进行手术切除、治疗效果较好[1-2]。随着甲状腺内微小甲状腺癌发生率越来越高[3],常规超声检查已不能满足临床诊断需求。CT的密度分辨率高,可发现机体细小的病变,准确捕获异常生物学信息;同时MRI 对于软组织的辨别力较高,血管流控效应优势使MRI在头颈部肿瘤甄别中的应用较广泛[4-5]。本研究对多名TA、PTC患者进行CT、MRI检查、对比相关参数,以探究CT、MRI对TA、PTC的甄别效用,为临床诊断提供参考。
1 资料与方法
1.1 一般资料随机选取2020年1月至2020年12月在本院接受治疗的PTC患者138例,后经手术病理检测,将其中70例PTC患者计为PTC组,68例TA患者计为TA组。PTC组:21例男性患者,49例女性患者;年龄30~50岁,平均年龄(40.64±7.81)岁;病程1~5年,平均病程(3.81±1.10)年。TA组:20例男性患者,48例女性患者;年龄32~49岁,平均年龄(41.00±7.90)岁;病程1~5年,平均病程(3.77±1.10)年。上述两组患者的性别、年龄、病程差异均无统计学意义(P>0.05),本研究经伦理委员会允许。
纳入标准:患者为单发病灶;患者此前并无甲状腺癌手术治疗史;患者甲状腺结节大于1cm;患者自愿参与此次研究。排除标准:患者MRI、CT图像不清晰,伪影较多;不配合检查者;患者此前接受过颈部穿刺活检。
1.2 方法
1.2.1 CT检查 采用美国GErevolution 512 CT(图像重建矩阵为512×512)对患者进行CT平扫。患者平躺与操作台,扫描范围由耳下直至主动脉弓,设置参数:管电压120kV、管电流300mA,FOV 32cm。扫描时提醒患者勿吞咽,扫描结束后采集数据。
1.2.2 常规MRI扫描 采用飞利浦3.0T MRI对患者进行检查,患者取仰卧位,采用头颈部线圈,双手垂直放于身侧;扫描位置为主动脉弓至舌骨,扫描过程中提醒患者禁吞咽,依次行横断位T1WI、T2WI、T2WI抑脂以及STIR扫描。进行脂肪抑制平面回波EPI扫描,b值取0、300、800s/mm2。
1.2.3 DCE-MRI扫描。为患者连接高压注射器,静脉注射对比剂,注射速度为2.5mL/s;同时启动DCE-MRI序列(T1WI-quick 3D横断位抑脂),进行持续动态增强扫描数据采集;采集次数为15次,层厚3mm、层间距0.2mm、TR 10.5ms、TE 4.89ms、FOV 220mm×220mm,采集时间为6min13s。
1.3 图像处理(1)CT:两名影像医师对CT图像进行分析,记录其结节形态、边缘、密度、囊性变、钙化情况,要求双方最终结果诊断相同,意见不一致时需重新测量、评估。(2)MRI:扫描结束后,收集数据,传入工作站;采用Mapping对图像进行分析,得到最大强化率(maximum enhancement rate,MER)、不同b值下的指数表现扩散系数(eADC)图以及扫描时间-信号强度曲线。最后由2名高资影像诊断医师对生成的影像资料进行测量分析,在eADC图中选择测量16mm2以上ROI的以测量eADC值;并根据KUHL标准对DCE-MRI扫描时间-信号强度曲线分为3类,Ⅰ型:速升速降型;Ⅱ型:速升缓降型;Ⅲ型:缓升缓降型。最后结果也需一致,存在争议的诊断结果需双方进行协商、再次评估直至意见一致。
1.4 统计学方法采用SPSS 20.0软件处理数据。CT征象以及DCE-MRI扫描时间-信号强度曲线类型以n(%)表示,行χ2检验;MRI参数MER、eADC值均为计量资料,以(±s)表示,两组间行独立t检验。CT以及多参数MRI对PTC、TA的甄别价值对比采用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析,检验水准为α=0.05。
2 结 果
2.1 两组患者的DCE-MRI检查结果对比PTC患者的DCEMRI扫描时间-信号强度曲线中,主要为Ⅲ型、其次为Ⅱ型,而TA患者主要为Ⅰ型,两者曲线类型差异具有统计学意义(P<0.05),见表1。
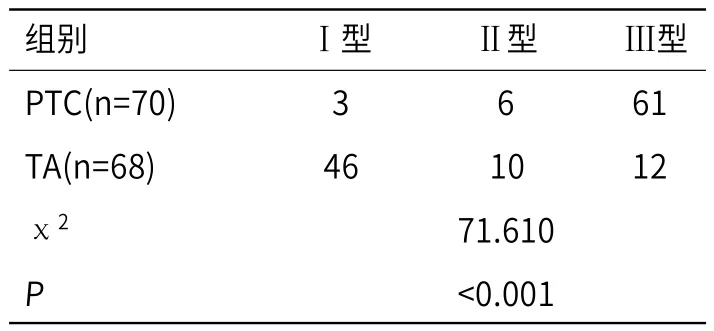
表1 两组患者的DCE-MRI检查结果对比(例)
2.2 两组患者MRI结果对比PTC患者的MER小于TA患者,b=300、800s/mm2时的eADC值大于TA患者(P<0.05),见表2。
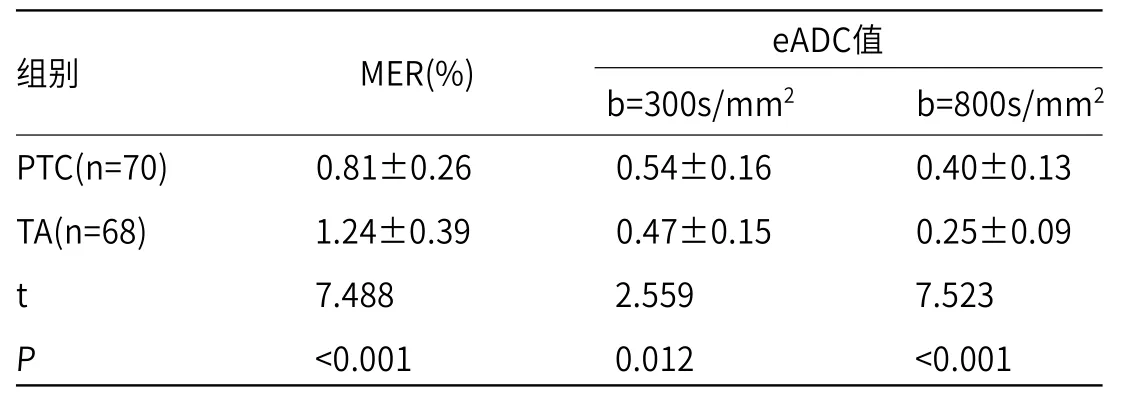
表2 两组患者MRI结果对比
2.3 两组患者CT征象情况的比较两组患者的形态、边缘、密度、囊性变、钙化情况均具有统计学意义(P<0.05),见表3。
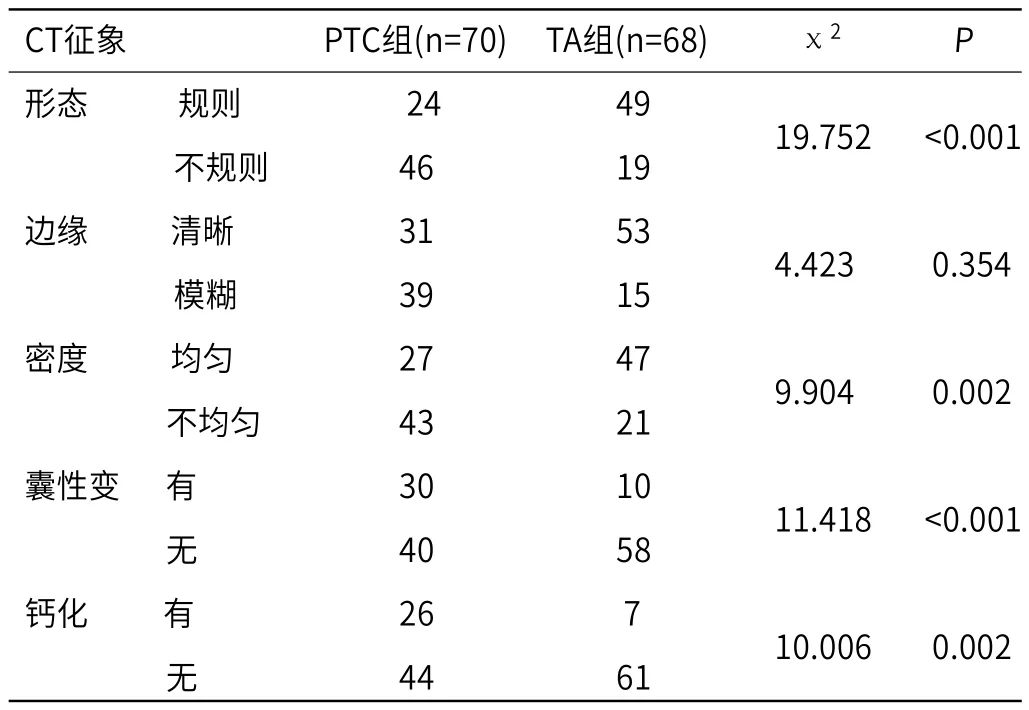
表3 两组患者CT征象情况的比较(例)
2.4 多参数MRI和CT诊断结果对比多参数MRI诊断PTC的敏感度、特异度分别为92.86%、91.18%,高于对照组的85.71%、86.76%(P<0.05),见表4~5。阳性为PTC患者,阴性为TA患者。
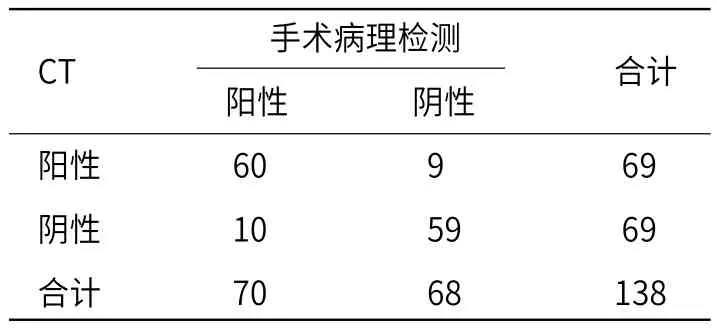
表4 CT对PTC、TA的甄别结果(例)
2.5 PTC与TA的CT、MRI研究见图1~5。
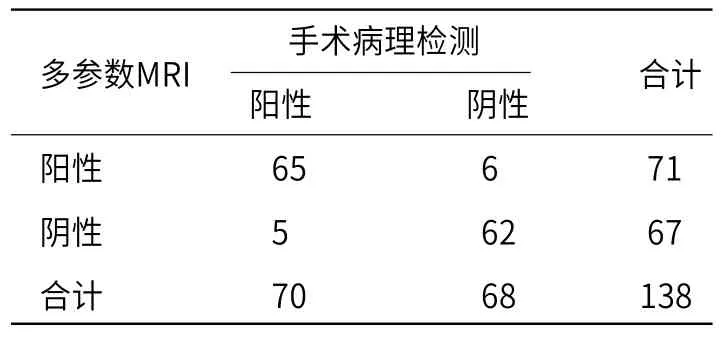
表5 多参数MRI对PTC、TA的甄别结果(例)
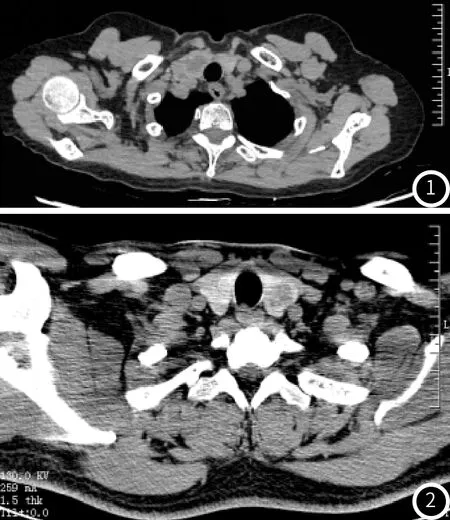
图1 TA患者CT平扫影像资料,甲状腺右叶类圆形低密度影,边缘尚清,边缘可见结节状钙化。图2 PTC患者CT平扫影像资料,甲状腺左叶不规则形低密度影,边缘不清,内部密度不均匀。
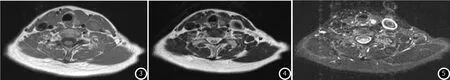
图3 PTC患者的MRT1加权像(T1WI):甲状腺左叶可见结节状稍短T1信号影,边缘光滑。图4 PTC的MR T2加权像(T2WI):甲状腺左叶可见结节状稍长T2信号影,边缘光滑。图5 PTC的MR T2压脂像:甲状腺左叶可见结节状高信号影,边缘光滑。
3 讨 论
超声、术病理检查对于TA、PTC甄别均存在一定局限性[6],寻找更为简单、有效的检查方式对于提高PTC患者的预后具有重要意义[7-8]。
本研究结果显示,PTC、TA的CT征象形态、边缘、密度、囊性变、钙化均存在差异,但是其敏感度、特异度确低于多参数MRI。分析原因,可能是因为甲状腺的解剖结构特殊,滤泡细胞易遭受破坏,因此在CT检查中PTC、TA均表现为局部低密度,可从结节的钙化、边缘、形态等信息进行甄别[9-10]。在本研究中,5例PTC患者被诊断为TA,这是因为其中2例甲状腺结节病灶边界较为完整、光滑,2例内部钙化细微,还有1例患者病灶内存在较多的粗钙化,因此误认为是良性结节。同时若患者结节内坏死彻底,也会影响影像医师的判断。
PTC病灶组织细胞密度增加、结缔组织增生,病灶局部水分子扩散性降低,导致ADC值降低;而对于TA患者而言,病灶小,大量的滤泡结构以及细胞外的体液会增强水分子扩散程度、ADC值降低[11]。同时,eADC可不受T2穿透效用干扰,图像质量高于ADC图,所以本研究对患者进行不同b值下eADC值分析,结果显示PTC患者eADC值大于TA,同时PTC患者的MER也较低。谌业荣等[12]表示,eADC图弥散区域在是不同于周边组织的高亮区域,所以可避免在灰度翻转时病灶、背景对比削弱,因此有利于观察病灶的内部结构,不同b值时eADC值有助于鉴别诊断甲状腺瘤,本研究与其结果一致。
在TIC曲线中,曲线上升段表示对比剂在血管内的速度,代表反应微血管的数量;对比剂从血管向组织间隙扩散过程为曲线峰后部分,可反映血管壁的通透性[13-14]。本研究结果显示,PTC患者的DCE-MRI扫描时间-信号强度曲线多为Ⅲ型,是因为PTC有丰富的瘤内乳头、微滤泡,细胞外间隙小,微血管密度低;同时淋巴受阻易导致对比剂反流,因此曲线会缓慢上升,后持续消退。本研究结果还显示,TA患者多为Ⅰ型,是因为TA有丰富、发育良好的微血管,滤泡排列紧密、细胞增殖程度低,所以呈现快速上升、后又快速下降的趋势,最后缓慢下降[15]。ROC分析显示,多参数MRI对PTC、TA甄别的AUC高于CT诊断,这可能是因为MRI可从多种参数对甲状腺结节的良恶性进行分析,CT评估依据较为单一,因此前者的准确度更高。
综上所述,多参数MRI和CT均能够鉴别PTC、TA,但相对而言多参数MRI对于两种甲状腺肿瘤的鉴别诊断价值更高。
