2,4-表油菜素内酯处理对不同温度贮藏中小白菜品质和生理生化的影响
2022-04-26王军萍宋留丽郁志芳
王军萍,宋留丽,2,郁志芳,
(1.南京农业大学食品科技学院,江苏 南京 210095;2.安徽师范大学生命科学学院,安徽 芜湖 241003)
小白菜(Brassica chinensisL.)为十字花科芸薹属绿叶蔬菜,其含水量高、组织脆嫩、呼吸旺盛、水分蒸发快,贮藏期间易发生萎蔫、黄化等情况,品质劣变迅速,贮藏时间短。其中,黄化是小白菜采后衰老过程中最为显著的外在表现,这一现象主要是源于叶绿素的快速降解。叶绿素降解的主要途径是脱镁叶绿酸a单加氧酶(Pheophorbide a monooxygenase,PaO)途径[1]和氧化漂白途径[2]。参与PaO途径的主要酶有叶绿素酶(chlorophyllase,CLH)、脱镁螯合酶(Mg-dechelatase,MDCase)和脱镁叶绿素水解酶(pheophytin pheophorbide hydrolase,PPH)[3]。过氧化物酶(peroxidase,POD)和脂氧合酶(lipoxygenase,LOX)是氧化漂白途径中的主要酶,参与活性氧的生成。果蔬在衰老或受到胁迫时,大量自由基在叶绿体、线粒体和过氧化物酶体中产生,如超氧阴离子(superoxide anion,O2-·)和过氧化氢(hydrogen peroxide,H2O2)[4]。自由基会直接攻击DNA、蛋白质和脂类,引发氧化应激,造成细胞膜脂过氧化,生成丙二醛(malondialdehyde,MDA)[5]。MDA的积累增加了细胞膜的通透性,不仅会造成叶绿体和线粒体等细胞器的损伤,而且加大了叶绿素降解酶与叶绿素相互接触的机会,最终加速叶绿素的降解[6]。超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase, CAT)和抗坏血酸过氧化物酶(ascorbate peroxidase,APX)等抗氧化酶能清除活性氧,减轻其对细胞的损伤。
目前,延缓小白菜叶绿素降解、维持其品质的主要方法有采后的1-甲基环丙烯[7]和硫化氢[8]处理,贮前真空预冷[9]、贮藏期间的光照处理[10]、超声波和气调贮藏[11]等。油菜素内酯(brassinolide,BR)作为一种天然的甾体类植物激素,具有安全、无害、高效、附加成本低等优点[12]。2,4-表油菜素内酯(2,4-epibrassinolide, EBR)是其中的一种人工合成类似物,近年来在园艺产品中得到了一定的研究。EBR通过诱导乌菜抗氧化酶活性减缓其品质下降,延长贮藏时间[13]。EBR可以抑制黄花菜体内H2O2的积累,减轻膜脂过氧化作用,保持膜的完整性,进而延缓果实的衰老进程[14]。研究还表明,低浓度EBR通过抑制乙烯合成途径中相关酶以及叶绿素降解酶的活性,有效抑制了西兰花叶绿素的降解和黄化,而高浓度处理则促进黄化[15]。然而,目前有关采后EBR处理对小白菜保鲜效果的研究还未见报道。
本文以‘上海青’为材料,研究采后EBR处理对2 ℃和20 ℃贮藏条件下小白菜品质和生理生化的影响,探讨EBR处理对不同温度下小白菜的保鲜效果和调控机制,旨在为绿色果蔬在实际生产中的贮藏保鲜应用提供理论依据。
1 材料与方法
1.1 材料与仪器
小白菜 品种为南京地产‘上海青’,于2020年11月1日购自江苏南京众彩批发市场,1 h内运回实验室。挑选成熟度一致、大小相近、无黄叶、无机械损伤的小白菜用于实验;2,4-表油菜素内酯(EBR,纯度≥95%)、氮蓝四唑(NBT) 上海瑞永生物科技有限公司;无水乙醇、氢氧化钠、磷酸氢二钠、磷酸氢二钾、磷酸二氢钾、氯化钾、甲醇、磷酸二氢钠 华大;碳酸钙、氯化羟胺、乙二胺四乙酸二钠(EDTANa2) 西陇科学股份有限公司;三氯乙酸、硫代巴比妥酸(TBA)、乙酸钠、愈创木酚、对氨基苯磺酸、H2O2沪试;硼酸、硼酸钠 上海凌峰化学试剂有限公司;吐温-20、蛋氨酸(Met) 北京索莱宝科技有限公司;亚油酸钠、核黄素、聚乙烯吡咯烷酮(PVP)、正己烷、ASA、Triton X-100、α-萘胺 麦克林;三羟甲基氨基甲烷(Tris) 北京博奥拓科技有限公司;叶绿素ab混合物(10%,BR) 上海源叶生物科技有限公司;以上试剂无特殊说明均为分析纯。
DJ300精密电子天平 北京赛多利斯系统有限公司;CR-400 CHROMA METER色差仪 日本柯尼卡美能达有限公司;Dansensor CheckMate3台式顶空分析仪 丹麦PBI Dansensor公司;Alpha-1860A紫外可见分光光度计 上海谱元仪器有限公司;H1750R台式高速冷冻离心机 湖南湘仪实验室仪器开发有限公司;HH-6数显恒温水浴锅 常州国华电器有限公司;XW-80A微型涡旋混合仪 上海沪西仪器厂有限公司;A11分析用研磨机 德国IKA;FE30实验室电导率仪 梅特勒-托利多仪器(上海)有限公司;4000LX日光灯 日本松下电器(中国)有限公司。
1.2 实验方法
1.2.1 样品处理与贮藏 将挑选好的小白菜随机分成两组,一组以1.0 mg/L的EBR溶液以100 mL/kg的量对小白菜进行喷洒处理,另一组作为对照(control,CK),用等量的蒸馏水进行喷洒处理。处理完成后,将小白菜表面水分晾干,用样品筐进行分装,并用黑色聚乙烯薄膜袋挽口套装,分别置于2 ℃和20 ℃条件下贮藏。贮藏期间,2 ℃下的小白菜在第0、3、7、12、18 d取样,20 ℃下的小白菜在第0、1、3、5、7 d取样。取样部位为小白菜由外向内第二层叶片,并避开主叶脉与叶片边缘。同时,用液氮速冻部分样品,置于−20 ℃冰箱。每个取样点设置三个生物学重复。
1.2.2 色差和叶绿素含量 色差利用手持式CR-400色差仪对样品的L*、C*、H值进行测定。每个处理选取15颗小白菜,每颗小白菜选取两个叶片,每个叶片选择中上部对称的两个点进行测定,并计算平均值。
叶绿素含量参考刘红艳[16]的方法并略加改动。称取0.5 g样品,加入0.1 g碳酸钙粉末及10 mL体积分数为95%的乙醇,充分研磨,避光浸提至组织变白,在4 ℃、12000×g下离心20 min,取上清液并定容,测定上清液在470、649、665 nm处的吸光值。按下列公式计算,最终结果表示为mg/g。

式中,Ca表示叶绿素a浓度,mg/g;Cb表示叶绿素b浓度,mg/g;Cchl表示总叶绿素含量,mg/g;A665nm表示在665 nm处的吸光值;A649nm表示在649 nm处的吸光值;V表示提取液总体积,mL;m表示样品质量,g。
1.2.3 呼吸强度 采用台式顶空分析仪测定呼吸强度。挑选3颗大小均一的小白菜,放入3 L的密闭玻璃罐中在20 ℃条件下放置2 h,各处理及平行样品的质量基本保持相近。按下列公式计算,最终结果表示为CO2mg·kg−1·h−1。
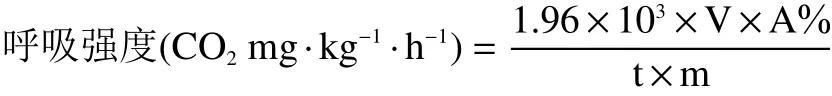
式中,1.96×103g/L为CO2密度;A%为呼吸仪测定的CO2数值;V为呼吸罐体积,L;t为测定时间,h;m为样品质量,kg。
1.2.4 叶绿素降解相关酶活性 粗酶液制备及酶活性测定参考FUNAMOTO等[17]方法并略有改动。准确称取1.0 g样品,加入6 mL预冷丙酮后充分匀浆,置于−20 ℃下20 min,于4 ℃、12000×g离心20 min,去除上清液,重复数次,直至沉淀无绿色为止。向沉淀中加入6 mL磷酸缓冲液(5 mmol/L,pH7.0,包括50 mmol/L KCl,0.24% Triton-X100),30 ℃抽提1 h,于4 ℃、12000×g离心20 min,取上清液为粗酶液用于酶活性的测定。
按照FUKASAWA等[18]方法制备100 μg/mL叶绿素a-丙酮、100 μmol/L叶绿酸a和10 μmol/L脱镁叶绿素a。
1.2.4.1 叶绿素酶(CLH)活性 取0.5 mL粗酶液,加入1.5 mL磷酸缓冲液(0.1 mol/L,pH7.5),0.7 mL 1.44%Triton-X100,0.3 mL 100 μg/mL的叶绿素a-丙酮溶液,混合液在30 ℃黑暗反应40 min后加入3 mL预冷丙酮终止反应,再加入3 mL正己烷萃取脱植基叶绿素a,剧烈摇动,4 ℃下12000×g离心10 min,以不加酶液作为对照。取丙酮层测定667 nm处吸光值。以每分钟内吸光度变化0.01为1个酶活力单位,单位记为U g−1FW。
1.2.4.2 脱镁螯合酶(MDCase)活性 取0.5 mL粗酶液,加入0.2 mL 1% TritonX-100,0.7 mL Tris-HCl缓冲液(50 mmol/L,pH8.0),0.3 mL 100 μmol/L叶绿酸a。混合液在30 ℃黑暗反应40 min后,于686 nm处测定吸光值。以每分钟内吸光度变化0.01为1个酶活力单位,单位记为U g−1FW。
1.2.4.3 脱镁叶绿素水解酶(PPH)活性 取0.5 mL酶液,加入75 μL 2% Triton X-100,0.1 mL 10 μmol/L脱镁叶绿素a,0.7 mL Tris-HCl(50 mmol/L,pH8.0),于暗处30 ℃反应60 min,加入3 mL丙酮终止反应。向其中加入3 mL正己烷萃取脱植基叶绿素a,剧烈摇动,4 ℃下12000×g离心10 min。取丙酮层测定535 nm处吸光值。以每分钟内吸光度变化0.01为1个酶活力单位,单位记为U g−1FW。
1.2.5 SOD、CAT、APX、POD和LOX活性测定
1.2.5.1 SOD活性 SOD测定采用NBT法[19]。称取0.5 g样品,加入6 mL磷酸钠缓冲液(50 mmol/L,pH7.8),匀浆,于4 ℃、12000×g离心20 min,收集上清液即为粗酶液。试管中加入0.1 mL粗酶液、1.5 mL磷酸钠缓冲液、0.3 mL Met、0.3 mL NBT、0.3 mL EDTA-Na2、0.3 mL核黄素、0.5 mL蒸馏水。暗中对照管加入核黄素后立即避光,全部试剂加完后摇匀。将测定管与光下对照管放在4000 LX日光灯下显色反应60 min。反应结束后用黑布遮盖终止反应。以暗中对照管作为调零管,取上清液测定在560 nm下光下对照管与测定管的吸光度。将抑制NBT光还原的50%为1个酶活性单位,结果表示为U g−1FW。
1.2.5.2 CAT活性 CAT活性测定参考曹建康等[19]并略有改动。称取0.5 g样品,加入6 mL磷酸钠缓冲液(50 mmol/L,pH7.0),于4 ℃、12000×g离心20 min,收集上清液即为粗酶液。反应体系中加入1.7 mL蒸馏水、1.0 mL Tris-HCl(pH7.0)、0.2 mL H2O2(200 mmol/L)、最后加入0.2 mL上清液启动反应,立即测定240 nm处吸光值的变化,以每克样品每分钟吸光度变化0.01为1个酶活性单位,结果表示为U g−1FW。
1.2.5.3 APX活性 APX活性测定粗酶液提取同CAT[19]。反应体系中加入0.1 mL酶液,1.4 mL APX反应液(50 mmol/L K2HPO4-KH2PO4缓冲液,pH7.0,内 含0.1 mmol/L EDTA-Na2,0.3 mmol/L ASA,0.06 mmol/L H2O2),立即测定290 nm处吸光值,以每克样品每分钟吸光度变化0.01为1个酶活性单位,结果表示为U g−1FW。
1.2.5.4 POD活性 POD活性的测定采用愈创木酚法[19]。称取0.5 g样品,加入5 mL磷酸钠缓冲液(100 mmol/L,pH6.0),匀浆,于4 ℃、12000×g离心20 min,收集上清液即为粗酶液。取酶液0.05 mL,加入3 mL POD反应混合液(含磷酸缓冲液,愈创木酚和H2O2)启动反应,每隔1 min记录470 nm处的吸光值,连续记录6 min。POD以每克样品每分钟内吸光值变化0.01为1个酶活力单位,结果表示为U g−1FW。
1.2.5.5 LOX活性 LOX活性测定参考曹建康等[19]并略有改动。取1.0 g样品,加入6 mL预冷的磷酸缓冲液(0.1 mol/L,pH7.5),匀浆,于4 ℃、12000×g离心20 min,上清液即为粗酶液。取0.1 mL粗酶液,加入4.75 mL乙酸钠缓冲液和0.15 mL亚油酸钠底物,于234 nm处测定吸光值。以每克样品每分钟吸光度变化0.01为1个酶活性单位,结果表示为U g−1FW。
1.2.6 O2-·、H2O2和MDA含量测定
1.2.6.1 O2-·含量 O2-·含量参考曹建康等[19]并略有改动。称取1.0 g样品,加入4 mL磷酸钠缓冲液(pH7.8,65 mmol/L),混匀后静置提取10 min,4 ℃、12000×g离心20 min。取3 mL上清液,加入1 mL pH7.8、65 mmol/L磷酸缓冲液和10 mmol/L盐酸羟胺1 mL,于25 ℃保温20 min。取出后再依次加入17 mmol/L的对氨基苯磺酸1 mL和7 mmol/L的α-萘胺溶液1 mL,在25 ℃下反应30 min,反应后测定530 nm处吸光值。标准曲线通过亚硝酸钾来制定,以超氧阴离子物质的量为横坐标,吸光值为纵坐标,标准曲线方程为:y=3.5879x+0.0014,R2=0.9998。最终的O2−·含量表示为nmol min−1g−1FW。

式中,n表示从标准曲线查得的超氧阴离子的量,μmol;V表示提取液总体积,mL;VS表示测定用样品液体积,mL;m表示样品质量,g;t表示样品与羟胺反应的时间,min。
1.2.6.2 H2O2含量 H2O2含量参考曹建康等[19]并略有改动。称取1.0 g样品,加入5 mL预冷丙酮,4 ℃、12000 ×g离心20 min。吸取1 mL上清液,加入0.1 mL 20%硫酸钛和0.2 mL浓氨水,25 ℃反应10 min后离心,去上清液,沉淀中加入2 mL丙酮进行洗脱,离心,去上清,重复两次,沉淀中加入2 mol/L的硫酸3 mL,等沉淀完全溶解后测定415 nm处吸光值,按同样的方法制作H2O2标准曲线,以H2O2物质的量为横坐标,吸光值为纵坐标,标准曲线方程为:y=1.6871x−0.0063,R2=0.9998。最终的H2O2含量表示为μmol g−1FW。计算公式如下:

式中,n表示标准曲线上查得样品中H2O2的量,μmol;V表示样品提取液总体积,mL;VS表示测定时用样品提取液的体积,mL;m表示样品质量,g。
1.2.6.3 MDA含量 MDA含量采用硫代巴比妥酸法[19]。称取2.0 g样品,加入5 mL 10%的TCA溶液,匀浆,于4 ℃、12000×g离心20 min,收集上清液。取2 mL上清液,加入2 mL 0.67%的TBA溶液,混匀,煮沸30 min,冷却之后测定532 nm和600 nm波长处的吸光值,按以下公式计算MDA含量。
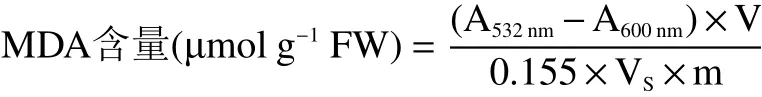
式中,V表示提取液总体积,mL;0.155表示消光系数155 μmol−1cm−1,为1 μmol丙二醛在532 nm处的吸光值;VS表示测定用样品液体积,mL;m表示样品质量,g。
1.3 数据处理
采用Excel 2013 进行基础数据整理,所有数据均为三生物学样品的平均值;应用IBM SPSS Statistics 25软件进行差异显著性分析,并将P<0.05定义为具有显著性差异;应用Origin 2021进行绘图。
2 结果与分析
2.1 采后EBR处理对小白菜2 ℃和20 ℃贮藏期间色泽、叶绿素含量和外观的影响
新鲜的小白菜随着贮藏时间的延长,叶片逐渐褪绿黄化。如图1A、B 所示,2 ℃和20 ℃贮藏期间,EBR处理和对照的小白菜L*值均持续上升,H值不断下降,其中,2 ℃条件下二个指标的变化速率较20 ℃条件下的变化速率更为平缓,表明低温较常温更能有效延缓小白菜色泽变化。EBR处理在2 ℃和20 ℃条件下均有效抑制L*值的上升和H值的下降,且20 ℃条件下EBR对二者抑制程度更显著。
由图1C~图1E可知,小白菜总叶绿素、叶绿素a和叶绿素b含量整体上随贮藏时间的延长而逐渐下降。20 ℃贮藏期间,各指标含量下降迅速,而2 ℃贮藏各指标下降缓慢。EBR处理在不同温度下延缓小白菜中叶绿素含量下降的程度有所不同。20 ℃贮藏期间,经EBR处理的小白菜总叶绿素、叶绿素a和叶绿素b含量均显著高于对照小白菜(P<0.05),贮藏结束时它们的含量均是对照小白菜的1.45倍以上。而在2 ℃条件下,EBR处理仅在贮藏后期可显著延缓叶绿素含量的下降(P<0.05)。表明EBR处理在2 ℃和20 ℃贮藏条件下均能延缓总叶绿素、叶绿素a和叶绿素b含量的下降,且在20 ℃下效果更明显。

图1 2 ℃和20 ℃贮藏期间EBR处理对小白菜L*值、H值和叶绿素含量的影响Fig.1 Effect of EBR on the lightness value, hue angle value, chlorophyll content of pakchoi during storage at 2 ℃ and 20 ℃
由图2可见,小白菜贮藏于2 ℃与20 ℃条件下,随贮藏时间延长,外观品质明显下降,出现黄化、腐烂、失水等现象,两温度下贮藏,其品质变化差异较大。20 ℃条件下,对照组在第5 d出现黄化,叶柄基部失水并有轻微腐烂迹象,第7 d叶片黄化和腐烂加重;EBR处理小白菜第5 d时仍保持良好的外观性状,第7 d黄化症状开始出现。2 ℃条件下,小白菜黄化速度明显减慢,在第18 d对照组出现轻微黄化,EBR处理小白菜仍保持良好的外观性状。由此可见,EBR处理在2 ℃和20 ℃贮藏条件下均能不同程度地延缓小白菜外观品质的下降,其中,20 ℃条件下保鲜效果更明显。

图2 2 ℃和20 ℃贮藏期间EBR处理对小白菜外观品质的影响Fig.2 Effect of EBR on the appearance quality of pakchoi during storage at 2 ℃ and 20 ℃
综上可见,与常温20 ℃贮藏相比,低温2 ℃贮藏更能使小白菜保持较好的色泽指标(低L*值,高H值),较高的总叶绿素、叶绿素a和叶绿素b含量,以及较好的外观品质。此外,EBR处理可有效延缓2 ℃和20 ℃贮藏期间小白菜L*值的上升,H值的下降,总叶绿素、叶绿素a和叶绿素b的降解,以及外观品质的劣变,其中,对20 ℃贮藏条件小白菜各指标的影响更明显。
2.2 采后EBR处理对小白菜2 ℃和20 ℃贮藏期间呼吸强度的影响
由图3可见,2 ℃条件下,两组小白菜呼吸强度先下降后上升,且EBR处理的小白菜呼吸强度在第7 d后显著低于对照小白菜呼吸强度(P<0.05)。20 ℃贮藏期间,两组小白菜呼吸强度整体呈现先上升后下降的趋势,在第3 d达到峰值。经EBR处理的小白菜在贮藏过程中呼吸强度均显著低于对照小白菜(P<0.05),贮藏第7 d,对照小白菜呼吸强度是EBR处理小白菜的1.29倍。图3还显示,20 ℃贮藏期间小白菜的呼吸强度始终显著的大于2 ℃的呼吸强度(P<0.05)。结果表明,低温贮藏比常温贮藏更能维持小白菜较低的呼吸强度,且EBR处理可以显著降低2 ℃和20 ℃下小白菜的呼吸强度,其中,对20 ℃贮藏的小白菜呼吸强度的抑制效果更为明显。

图3 2 ℃和20 ℃贮藏期间EBR处理对小白菜呼吸强度的影响Fig.3 Effect of EBR on the respiration intensity of pakchoi during storage at 2 ℃ and 20 ℃
2.3 采后EBR处理对小白菜2 ℃和20 ℃贮藏期间叶绿素降解酶活性的影响
由图4可知,2 ℃和20 ℃贮藏期间,小白菜CLH、MDCase和PPH活性整体呈先上升后下降的趋势。2 ℃贮藏前期CLH活性较低,说明低温能够有效降低CLH活性(图4A)。
20 ℃贮藏期间,两组小白菜CLH活性均在第5 d达到峰值,此时EBR处理小白菜CLH活性低于对照小白菜31.58%。2 ℃和20 ℃下,EBR处理小白菜MDCase活性均显著低于对照小白菜(P<0.05),且在第3 d时,其MDCase活性分别低于对照小白菜31.17%和33.82%(图4B)。在2 ℃和20 ℃贮藏过程中,EBR处理的小白菜PPH活性分别低于同时期对照小白菜(图4C)。综上,低温贮藏比常温贮藏更能维持小白菜较低的CLH、MDCase和PPH活性,且EBR处理可以有效降低2 ℃和20 ℃贮藏条件下小白菜叶绿素降解相关酶的活性,其中对20 ℃贮藏的小白菜叶绿素降解酶的抑制效果更为显著。

图4 2 ℃和20 ℃贮藏期间EBR处理对小白菜CLH、MDCase和PPH活性的影响Fig.4 Effect of EBR on the CLH,MDCase and PPH activity of pakchoi during storage at 2 ℃ and 20 ℃
2.4 采后EBR处理对小白菜2 ℃和20 ℃贮藏期间SOD、CAT、APX、 POD和LOX活性的影响
SOD、CAT和APX是具有清除活性氧作用的抗氧化酶。如图5(A)显示,2 ℃和20 ℃贮藏期间,小白菜SOD活性均先上升后下降。2 ℃贮藏3 d后,EBR处理的小白菜SOD活性显著高于对照小白菜(P<0.05);20 ℃贮藏过程中,EBR处理的小白菜SOD活性始终大于对照,在第5 d时,EBR处理的小白菜SOD活性是对照小白菜的1.62倍。图5(B)所示,2 ℃下CAT活性不断上升直至贮藏结束;而20 ℃下CAT活性先上升后下降,第3 d达到最大值。在两温度下,经EBR处理的小白菜CAT活性均显著高于对照小白菜(P<0.05)。

图5 2 ℃和20 ℃贮藏期间EBR处理对小白菜SOD、CAT、APX、POD和LOX活性的影响Fig.5 Effect of EBR on the SOD, CAT, APX, POD and LOX activity of pakchoi during storage at 2 ℃ and 20 ℃
图5(C)可见,2 ℃贮藏下,小白菜APX活性呈现波动变化;而20 ℃贮藏下,APX先上升后下降,且整体活性低于2 ℃下的APX活性。两贮藏温度下,EBR处理均能显著提高小白菜APX活性(P<0.05)。
图5(D)所示,2 ℃贮藏期间,小白菜POD活性整体呈现上升的趋势,EBR处理在贮藏后期显著降低小白菜的POD活性(P<0.05)。20 ℃贮藏期间,小白菜POD先上升后下降,EBR处理的小白菜POD活性显著低于对照小白菜(P<0.05),在第5 d达到峰值时,对照小白菜POD活性为7720 U g−1FW,EBR处理小白菜仅为6400 U g−1FW。由图5(E)可见,2 ℃和20 ℃贮藏期间,小白菜LOX活性持续上升,且以20 ℃上升较为迅速,低温可有效降低LOX活性。EBR处理在20 ℃和2 ℃贮藏后期均可以显著抑制小白菜LOX活性的上升(P<0.05)。
综上可见,与常温20 ℃贮藏相比,低温2 ℃贮藏更能使小白菜保持较高的SOD、CAT和APX活性,以及较低的POD和LOX活性。此外,EBR处理均可有效提高2 ℃和20 ℃贮藏期间小白菜SOD、CAT和APX的活性,抑制POD和LOX活性,从而提高小白菜的抗氧化能力,减轻膜脂过氧化作用,降低活性氧对细胞的损害。
图6(A~B)显示,2 ℃贮藏期间,小白菜O2−·和H2O2含量逐渐增加,EBR处理可以显著抑制两个指标的上升(P<0.05)。20 ℃贮藏期间,小白菜O2−·和H2O2含量先上升后下降,EBR处理显著抑制了小白菜O2−·和H2O2含量的增加(P<0.05)。图6(C)可见,2 ℃贮藏期间,小白菜MDA含量变化平缓且始终处于较低水平;20 ℃贮藏过程中,小白菜MDA含量迅速增加;EBR处理均能显著抑制2 ℃和20 ℃贮藏期间小白菜的MDA含量(P<0.05)。结果表明,2 ℃贮藏比20 ℃贮藏更能维持小白菜较低的O2−·和H2O2含量,EBR处理可有效抑制小白菜在2 ℃和20 ℃贮藏下O2−·和H2O2的产生,减少MDA积累,保持细胞膜的完整性。

图6 2 ℃和20 ℃贮藏期间EBR对小白菜O2−·、H2O2和MDA含量的影响Fig.6 Effect of EBR on the O2−·、H2O2 and MDA content of pakchoi during storage at 2 ℃ and 20 ℃
3 讨论与结论
小白菜作为一种典型的绿色叶菜,在采后贮藏和运输过程中很快发生萎蔫、黄化、脱帮和腐烂等问题,贮藏时间只有2~3 d,采后损耗十分严重。色泽是消费者判断蔬菜新鲜程度的重要指标,也是制约贮藏和运输的重要因素。本实验中,1.0 mg/L EBR采后处理小白菜可以使其保持较高的叶绿素含量及良好的外观品质,降低2 ℃和20 ℃贮藏期间小白菜呼吸强度,这与0.9 mg/L的EBR处理杏果实的研究结果一致[20]。
参与叶绿素降解的主要酶是CLH、MDCase和PPH,这些酶活性变化会影响叶绿素含量的高低。本研究发现,与20 ℃贮藏相比,2 ℃贮藏更能维持小白菜较低的CLH、MDCase和PPH的活性;同时EBR处理可以有效降低2 ℃和20 ℃贮藏条件下小白菜叶绿素降解相关酶的活性。以上结果表明,采后1.0 mg/L EBR可能通过抑制CLH、MDCase和PPH活性的上升,进而减缓叶绿素降解。已有相关的研究证明了这一点,EBR通过下调青花菜BoPPH和BoPaO等叶绿素降解基因的表达,抑制PPH和PaO活性,从而延缓青花菜黄化[15]。小麦中发现叶绿素酶和脱镁叶绿素水解酶是叶绿素降解途径关键酶[21],在油麦菜中叶绿素过氧化物酶是叶绿素降解的关键酶[22],本文的研究表明CLH而非PPH是小白菜叶绿素降解的关键酶。
本文研究表明POD和LOX也参与叶绿素的降解,这与以往的研究结论一致。菠菜[23]和西兰花[24]在黄化过程中均伴随着叶绿素含量的下降和POD活性的上升。LOX可以启动膜脂过氧化反应,催化不饱和脂肪酸氧化形成自由基而攻击分解叶绿素,同时,膜脂过氧化反应的产物MDA会损伤叶绿体膜,引发叶绿素的酶促反应,加速叶绿素降解[24−26]。因此,保持较低的POD和LOX活性有利于延缓植物叶绿素的降解。ZHAI等[27]研究发现,褪黑素处理通过降低梨果实中LOX活性,延缓了其叶绿素含量的下降。SOD、CAT和APX等抗氧化酶能清除活性氧,减轻对细胞的损伤。研究表明[28],EBR能通过上调植物抗性相关基因的表达提高抗氧化能力,减轻细胞受损的程度。张瑞杰[20]在用EBR处理杏果实时发现EBR能较好地保持杏果实叶绿体的完整性。李进等[29]通过外源喷施EBR提高了棉花的抗氧化酶活性,减少了自由基对叶绿体的破坏,使叶绿素和类胡萝卜素含量保持在较高的水平。本研究中,EBR处理均有效减少2 ℃和20 ℃贮藏期间小白菜抗氧化酶活性的下降,抑制POD和LOX活性上升,O2−·和H2O2的产生,MDA含量的积累,与前人研究结果一致。由此可推测,采后1.0 mg/L EBR可能通过维持SOD、CAT和APX活性,抑制POD和LOX活性上升,减少膜脂氧化,进而降低了O2−·、H2O2和MDA的积累,最终减少了叶绿素的降解,维持小白菜良好的生理指标。
本研究表明,与常温20 ℃贮藏相比,低温2 ℃贮藏更能保持小白菜较好的色泽指标和外观品质,较高的总叶绿素、叶绿素a和叶绿素b含量,较低的呼吸强度,O2−·、H2O2和MDA含量,以及叶绿素降解酶和膜脂过氧化酶活性,较高的抗氧化酶活性。1.0 mg/L EBR处理可以通过抑制2 ℃和20 ℃贮藏期间小白菜叶绿素降解相关酶活性上升,从而减少叶绿素的降解,同时通过维持小白菜较低的膜脂过氧化酶活性和较高的抗氧化酶活性,保持细胞膜结构完整性,进而减少小白菜贮藏期间品质和生理的下降,其中对20 ℃贮藏条件小白菜各指标的影响更为明显。以上的研究结果对EBR应用于绿色果蔬尤其是叶菜类的保鲜提供了理论依据,今后可进一步明确EBR在分子层面对小白菜品质和生理生化的调控机制。
