高氧离子电导钙钛矿的影响因素分析和设计策略
2022-04-26李文怀周嵬
李文怀,周嵬
(南京工业大学化工学院,江苏南京 211800;南京工业大学材料化学工程国家重点实验室,江苏南京 211800)
引 言
具有高氧离子电导率的氧离子导体广泛应用于燃料电池、氧传感器、氧泵以及透氧膜等设备。这些氧离子导体通常是氧化物,如萤石、褐铁矿和钙钛矿,它们依靠体相中的氧离子传输通道进行快速氧离子传输。越来越多的研究正在探索氧传输机制以提高氧导体的性能。由于钙钛矿作为最受欢迎的氧离子导体广泛应用于固体氧化物燃料电池(solid oxide fuel cell,SOFC)和其他氧传输设备[1−5],深入了解钙钛矿体相氧传输机理和影响因素对于这些设备性能的进一步提升具有重要意义。
钙钛矿氧化物,理想分子式为ABO3,其中O 一般代表的是氧,A 位是与氧离子形成12 配位的碱土、稀土类大半径的阳离子,B 位通常是与氧离子形成6 配位的过渡金属离子。实际上,钙钛矿结构具有很强的可调控性,可以允许一定的离子缺陷(A、B、O 都有可能),当小部分晶格氧从钙钛矿脱出并形成氧空位,这些空位就成为了氧离子传输的通道。研究者们常采用在A 位或B位掺杂不同价态的阳离子来实现体相高氧空位浓度,从而提高钙钛矿的氧传输性能。对于SOFC,钙钛矿SrCo0.8Nb0.1Ta0.1O3−δ(SCNT)和SrSc0.175Nb0.025Co0.8O3−δ(SSNC)因其高氧离子电导率和高电催化性能而被广泛用作阴极组件[6−7]。氧传感器常用的材料之一是掺杂钙钛矿SrTiO3,其固有的锶离子点缺陷和丰富的氧空位,使得它能够快速对氧物种发生响应[8]。具有丰富氧空位的钙钛矿 氧 化 物,例 如Ba0.5Sr0.5Co0.8Fe0.2O3−δ(BSCF) 和La0.5Sr0.5Co0.8Fe0.2O3−δ(LSCF),也广泛应用于透氧膜并实现高氧渗透性[9−10]。因此,钙钛矿氧化物的氧传输性能与其氧空位特性密切相关。
已经有许多研究揭示了钙钛矿氧化物的氧传输特性与其结构之间的相关性,并深入探索了钙钛矿氧化物体相中氧传输的过程和机制。一般来说,钙钛矿体相中氧的迁移是通过氧空位传输通道进行的,空位的移动被认为是一种常规的跳跃机制[11]。钙钛矿的氧传输性能很大程度上取决于体相氧空位的性质,并且受到晶体结构和阳离子性质的影响。例如,Mogensen 等[12]提出由离子半径失配引起的晶格畸变(晶格应力或偏离立方对称性)能够明显影响离子电导率的大小,并且晶格畸变的程度比许多其他晶体结构参数更加重要。
截至目前,研究者们提出了很多控制钙钛矿氧化物氧传输的影响因素,然而,这些影响因素之间的相关性和更深的作用机理还不是很清楚,这给设计合适的钙钛矿氧导体带来了一定的困难,进而影响SOFC、透氧膜等领域的商业化道路。本文将首先简要介绍钙钛矿体相中氧传输的机制,然后详细讨论影响氧传输性能的主要因素和相应的表征方法,接着介绍模拟计算在氧传输领域中的应用。最后,将给出对钙钛矿氧导体的氧传输性质的总结和展望。
1 机 理
钙钛矿氧化物有三种主要的结构类型被广泛应用于氧离子导体领域:简单立方型钙钛矿(ABO3)、层 状 钙 钛 矿(AA′B2O6) 和 Ruddlesden−Popper(An+1BnO3n+1)结构[13]。图1 显示了这些氧化物的晶体结构。三种结构的B位为过渡金属离子并与氧形成八面体结构(BO6),A 位为碱土金属或镧系元素离子(Lnn+)位于包含八面体的立方体的顶点上,与氧形成12配位。碱土金属离子和Lnn+的分布决定了不同的晶体结构以及氧缺陷的类型和位置,这是三种结构电子和离子导电特性差异化的主要原因[14]。对于立方型钙钛矿[图1(a)],碱土金属(Ca、Sr、Ba)或镧系元素(Ln = La、Pr、Nd 等)阳离子随机分布在A 位,氧空位也随机分布在由BO6组成的氧亚晶格上,因此氧的传输通道是三维随机分布的。对于层状钙钛矿,碱土金属和Lnn+的离子半径之间的差异诱导了阳离子排序,构成了交替层AO−BO2−A′O−BO2[图1(b)]。其中,Lnn+更容易失去氧,从而使得氧空位主要位于LnO 层上,这就导致了AA′B2O6中氧离子扩散的二维迁移路径[15]。在Ruddlesden−Popper 结构的A2BO4晶格中,A—O 和B—O 键长之间的明显差异造成了钙钛矿晶格层之间的不匹配,从而产生了特殊的层状结构AO−ABO3[图1(c)],这样的分层结构同样造成了氧离子的二维扩散。与层状钙钛矿不同的是,在A2BO4氧化物中,AO 层上的自由空间允许在四面体位点上引入间隙氧,从而导致氧的迁移通道从主要的氧空位变为氧间隙。由于三种钙钛矿具有不同的体相氧传输方式,且ABO3型钙钛矿的三维氧传输过程更具代表性,因此本文只讨论影响ABO3型钙钛矿氧传输的因素。
钙钛矿体相中的氧传输是一种基本且复杂的现象,其最明显的特征是阴离子和阳离子亚晶格会限制离子向其自身的亚晶格传输,同时传输过程仍然受到主体阳离子亚晶格的影响[16]。一般来说,晶体中的氧传输可以用扩散机制来描述,即氧从一个平衡位置移动到相邻位置,点缺陷(空位)在这种扩散过程中至关重要。而对于钙钛矿晶体材料,有一种普遍接受的机制:空位机制,也就是氧离子通过跳跃到相邻的氧空位而扩散,该扩散速率会深受系统中氧空位周围环境的影响。除此之外,氧空位的浓度对扩散动力学也有着至关重要的影响。最后,氧空位的分布,即迁移路径的分布,也是一个氧传输性质的重要影响因素。氧离子在立方钙钛矿体系中的迁移路径如图2 所示。总而言之,钙钛矿体相中的氧扩散非常依赖氧空位,氧空位不同方面的性质会直接影响氧扩散性能的表现。接下来,将主要讨论以下四个因素对钙钛矿体相氧传输性能的影响:晶体结构、平均金属−氧键能、氧空位的浓度和氧空位的分布。
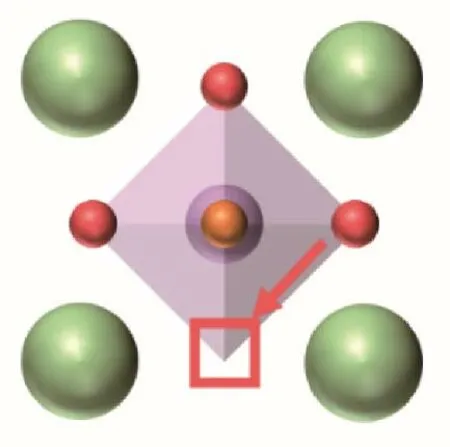
图2 立方钙钛矿氧空位迁移路径Fig.2 Oxygen migration path in the cubic perovskite structure
2 影响氧传输的因素
氧离子在钙钛矿体相中传输不仅会受到传输通道的数量及分布的影响,也受到其周围环境的作用。氧空位迁移能描述了氧离子在钙钛矿体相迁移路径中跳跃的难易程度,最能表示周围环境对氧空位迁移的影响。在过渡态理论体系中[17],以氧空位为迁移路径的氧离子交换率(v)由Boltzmann 关系表示为:

式中,EM是沿着这条路径的迁移能垒;v0是一个常数。氧空位迁移能取决于迁移路径附近的以下关键因素[18−19]:(1)氧迁移路径周围的阳离子,特别是氧迁移时穿过的阳离子对;(2)氧空位初始和最终位点附近的氧空位距离和位置;(3)氧空位初始和最终位点附近掺杂阳离子的距离和位置。因此,氧空位迁移能的大小主要与通往下一个空位的障碍以及打破氧与B位金属键(B—O键)的难度有关。前者主要受晶体结构影响,后者主要由B—O键能决定。
除了氧空位的周围环境,显然氧空位的浓度与分布也是影响钙钛矿体相氧传输的重要因素。考虑到氧扩散速率和空位之间的平衡,氧扩散速率DO与空位扩散速率Dv相关,其数学形式为:

式中,cv是空位浓度。值得注意的是,在cv较小时,DO几乎与cv成线性比例,这也进一步证明了空位浓度与氧扩散速率之间的强正相关性。
不仅如此,空位扩散率Dv与氧空位的均方位移〈R2〉也具有相关性,数学形式表示为:

这表明氧空位分布的均匀程度与扩散效率呈正相关。因此,氧空位的分布也是影响氧传输的重要因素。
2.1 晶体结构
2.1.1 晶体对称性 在理想的ABO3型钙钛矿中,A位离子具有与氧离子相同的尺寸,并且与氧离子一起构成最密立方堆积。而氧离子组成的八面体的中心恰巧由B 位离子填充,此时钙钛矿的结构最稳定。不仅如此,钙钛矿可以在保持结构稳定的前提下,容纳不同半径和价态的阳离子,因此可以通过掺杂实现高浓度的氧空位和高氧离子电导率。然而,不是任何半径的阳离子都可以掺入钙钛矿体相中,Goldschmidt 引入了一个称为容差因子t的几何参数来判定钙钛矿的结构是否稳定[20−21],它定义为:

式中,rA、rB、rO分别是An+、Bn+、O2−的半径。当t=1 时,该结构为理想的立方钙钛矿。而t与1 的差值越大,表明该结构偏离理想状态越明显,直至无法维持钙钛矿结构。据观察,保持钙钛矿氧化物结构稳定的t值范围为0.75 <t<1.1。t与1 的偏差将通过较低的对称性来适应结构变化,例如使O—B—O键弯曲,使得键角<180°,从而与O—A—O 键进行匹配,而形成正交和单斜晶系[22−23]。拥有不同晶体对称性的钙钛矿氧化物,其内部各原子之间的距离存在较大差异,因此氧在晶体内部迁移受到的作用力以及迁移路径的长短都不相同,造成了不同晶体对称性钙钛矿氧化物之间的氧传输性能的巨大差异。
Lybye 等[24]详 细 研 究 了La0.9Sr0.1B0.9Mg0.1O2.9(B=Al3+,Ga3+,Sc3+,In3+)四种钙钛矿的结构与其氧离子电导率的关系,发现高晶格对称性的钙钛矿具有最大的氧离子电导率,考虑到晶格应力,也可以解释为无应力晶格促使氧离子传输。除了常见的燃料电池电解质材料,在透氧膜上也发现了类似的规律。Wang 等[25]制 备 的Ce0.9Pr0.1O2−δ−Pr0.6Ca0.4FeO3−δ复 合 透氧膜表现出优异的透氧性能和抗CO2稳定性,其主要原因是钙钛矿相Pr0.6Ca0.4FeO3−δ的高晶体对称性。目前,普遍认为高对称的立方相有利于氧的渗透,因为氧离子在立方相中可以在三维方向上传递,而在正交或斜方相中会受到限制。例如,在属于正交晶系的La0.64(Ti0.92Nb0.08)O2.99化合物中,氧离子很容易在ab平面上迁移而很难沿c轴迁移[26]。
为了实现这种无应力晶格或者高对称性的钙钛矿结构,必须合理考虑构成钙钛矿的A 位和B 位的离子半径以使得钙钛矿的容差因子t接近于1。由式(4)可得,此时A位离子应尽可能等于氧离子的尺寸,也就是说,理想的A 位离子半径rm,A为1.40 Å(氧6 配位时的半径)(1Å=0.1 nm)。因此,La3+(12 配位下r= 1.36 Å) 和Sr2+(12 配位下r= 1.44 Å)通常是高氧离子电导率钙钛矿常用的A 位离子。同理,B 位离子半径应该足够匹配BO6八面体的空间大小(roh=0.58 Å)。考虑到实际钙钛矿中的高氧空位浓度,则合适的B 离子半径应大于roh的10%,得到rm,B=0.64 Å。对于这个值来说,Al3+(r=0.54 Å)略小,而Sc3+(r=075 Å)和In3+(r= 0.80 Å)太大了。Ga3+(r= 0.62 Å)与roh非常接近。因此,钙钛矿La0.9Sr0.1GaO2.9是常见高氧离子导体的母体材料。
与该rm,B相比,Mg2+半径(r=0.72 Å)偏高,在高氧离子电导率钙钛矿La0.9Sr0.1Ga0.9Mg0.2O2.8中会产生少许的晶格扭曲。Singhal 等[27]报道,用更小半径的Co或Ni 取代La0.8Sr0.2Ga0.8Mg0.2O2.8中的部分Mg2+,能够显著提高氧离子电导率,这表明晶体对称性的增加有利于增加氧离子电导率。不仅如此,Slater 等[28]采用粉末中子衍射详细研究了钙钛矿La0.9Sr0.1Ga0.8Mg0.2O2.85不同温度下的结构,结果指出当钙钛矿结构未变形时,氧离子能够容易地移动到相邻的氧空位位点。
但 也 有 例 外,Kajitani 等[29]研 究 了Al 掺 杂 对LaGa0.9Mg0.1O2.95钙钛矿氧化物的晶体结构和氧离子电导率的影响。他们发现随着掺杂量的增加,LaGa0.9−xAlxMg0.1O2.95的结构从正交变为菱形,最后变为立方。这说明Al 掺杂能够有效地形成具有更高对称性的晶格。但是,随着掺杂量的提升,LaGa0.9Mg0.1O2.95的氧离子电导率却降低了。这表明,不能只考虑晶体对称性对钙钛矿体相氧传输性能的影响。
2.1.2 晶格自由体积 如前所述,尽管通过在LaGa0.9Mg0.1O2.95掺杂Al形成立方钙钛矿,但并未提高体相氧离子电导率,这是因为Al的掺杂也同样改变了钙钛矿的晶格自由体积,这也是一个影响钙钛矿体相氧传输的重要因素。晶格自由体积(Vf)是描述钙钛矿单个晶胞剩余空间的重要参数,实际上代表了晶胞体积与晶胞内所有离子占据的体积总和之差。
Hayashi 等[30]报道,大的Vf对于钙钛矿结构中的氧离子传导是有利的。Nomura等[31]发现具有更大Vf(13 Å3)的La0.9Sr0.1GaO3−δ的 氧 离 子 电 导 率 高 于La0.9Sr0.1AlO3−δ(Vf=9 Å3)。Kajitani 等[29]研 究 了Al 掺 杂LaGa0.9Mg0.1O2.95钙钛矿氧化物的晶体结构和氧离子电导率的关系,发现随着Vf的降低,LaGa0.9−xAlxMg0.1O2.95的氧离子电导率降低。这些结果表明,晶格自由体积也是影响钙钛矿氧离子传导性能的重要因素。晶胞自由体积越大,氧离子迁移通道的半径越大,迁移越容易,迁移能就越小。
Gao 等[32]通 过 应 变 工 程 实 现 了 对La0.9Sr0.1Ga0.95Mg0.05O3−δ(LSGM)中的Vf和BO6八面体旋转的量化控制。结果发现,Vf和BO6八面体旋转均对钙钛矿结构中的氧离子迁移有重大影响,最佳结构是在具有大的Vf前提下产生一定的八面体旋转。随后的DFT 计算揭示出较大的Vf可以减少迁移能垒,而大的八面体旋转会产生低能量的迁移途径。作者设计的LSGM 超晶格结构能够同时具有大的Vf和一定的八面体旋转,这导致氧离子导电性的增强。不仅如此,大的Vf能够提高钙钛矿的氧离子电导率的结论也被很多研究者[33−38]在其他材料上得到验证。
然而,Vf并不是越大越好,根据Sammells 等[39]的实验结果,在BaTh0.9Gd0.1O3−δ钙钛矿结构中存在着使氧离子传导最佳的Vf(30~35 Å3)。而Kakinuma 等[40]通过研究Ba0.3Sr0.2La0.5(In1−xMx)O2.75(M = Sc 或Yb)体系的氧离子电导率与Vf之间的关系验证了这个猜想。他们发现这些体系钙钛矿的氧离子电导率随着Vf的增大而增加,但当Vf增大到24.3 Å3时,电导率反而下降。虽然对于不同的钙钛矿结构,最佳Vf值可能会存在差异,但是很多研究都表明过大的Vf会导致氧八面体的局部混乱,阻碍氧离子的传输[32,41−43]。
除晶格自由体积之外,也有研究者用临界半径(rc)来表示氧离子传输的通道大小,两者具有很强的相关性。对于rc,首先由Kilner 等[20]提出,他们指出要使一个氧离子在两个氧位点之间跳跃,它必须通过一个由三个阳离子接壤的间隙,并将该间隙的半径命名为临界半径(rc)。图3 显示了立方钙钛矿110平面中的这种间隙。rc主要受A 位和B 位的离子半径影响,当阳离子半径使rc越大时,空位运动的障碍越小,此时钙钛矿体相的氧离子电导率就会越高。值得注意的是,晶体结构对rc也有显著影响,通常认为立方钙钛矿比六方和斜方钙钛矿具有更大的,而晶体结构也很大程度上由构成钙钛矿的A 位和B 位离子半径所决定。值得注意的是,对于常见的高性能钙钛矿氧导体,计算得出的rc≤1.05 Å,明显小于Shannon[44]计算出的六配位氧离子半径1.40 Å。虽然氧离子在传输过程中,可暂时采用三配位将半径减小到1.36 Å,但是氧离子若想穿过比自身小的rc,必须依靠阳离子的热振动来使rc短暂增大。而阳离子的热移动的幅度与离子质量呈负相关。因此,氧离子电导率应随着金属离子质量的增加而降低。

图3 立方钙钛矿中的临界半径(rc)Fig.3 The critical radius(rc)in a cubic perovskite
如果同时考虑晶体对称性和Vf,可以发现在一个特定的钙钛矿结构中,往往不能同时实现两个参数各自的最优值。这一点也有研究者通过探究(La0.9Sr0.1)LnO3-δ(Ln = Al, Ga, Sc, In, Lu)体系得出,发现拥有最高氧离子电导率的为(La0.9Sr0.1)GaO3-δ钙钛矿,其实现了Vf和晶体对称性之间的平衡[31]。因此,如何调控晶体结构从而提高钙钛矿体相氧传输性能,还需要结合实际情况来选择适合的A 位和B 位离子。
2.2 平均金属-氧键能
氧离子在钙钛矿体相中的迁移必然伴随着其与金属离子的断键与成键。一般来说,断键越容易,氧离子越容易迁移,衡量断键难易程度的就是键能。常用平均金属−氧键能(average bonding energy, ABE)来表示钙钛矿体相中氧离子断键的难易程度。相比于A 位离子来说,B 位离子的尺寸和电荷是影响ABE的更重要的参数。因为BO6八面体构成钙钛矿结构的基本框架,并且氧与更小更近的B 位金属离子的成键要明显比A 位金属离子更强。所以,在研究氧离子迁移难易时,也有研究者将平均金属−氧键能简化为平均B位金属−氧键能。
有相当多的研究进一步证明了B位离子的大小的重要性。如在NdGaO3(rNd3+=1.27 Å)和PrGaO3(rPr3+=1.31 Å)中,即使当A 位阳离子小于理想半径rm,A时,氧离子电导率仍然相对较高,这是因为氧离子与B位阳离子之间存在合适的键能,使得其传输更加容易[45−47]。如果只考虑B—O 键能对氧离子传输的影响,应在A3+B3+O3型钙钛矿中寻找最佳的氧离子导体。Hayashi 等[30]也得出了这一相同的结论,B 位离子和氧离子之间的键能在A2+B4+O3和A1+B5+O3型钙钛矿中显著增加,而这会阻碍氧离子的传输。例如在SrTi0.8Ga0.2O2.9的氧化物离子电导率中,尽管rSr2+=1.44 Å和rTi4+=0.61 Å 非常接近于理想的A 位和B位离子半径rm,A和rm,B,但其在800℃下仅有1 mS/cm 的氧离子电导率[24]。然而,只考虑B—O 键能而忽略晶体结构对氧离子电导率的影响也是不可取的,大多数情况下Sr2+还是合适A位离子的选择。
对于B—O 键能,一般认为,这很大程度上是由B 位阳离子的种类和价态决定[48−49]。B 位金属在元素周期表的位置与其B—O 键能有一定的规律性,将在表征部分进行详细讨论。而相同元素的价态越高,其B—O键能越大。
因此,若想减小氧空位周围环境阻力以增加氧传输性能,必须先考虑A 位和B 位阳离子的基本性质,如原子序数、离子半径和氧化态,这些性质会从根本上改变氧空位迁移能的大小。除此之外,钙钛矿晶格可以容忍一定程度的阳离子非化学计量,而保持结构稳定。过去的研究表明,A 位和B 位整体缺陷都可以增强钙钛矿BSCF 作为透氧膜的氧渗透性能和作为SOFC 阴极的氧还原反应(ORR)活性[50−51]。实际上,A 位和B 位整体缺陷会改变临界半径,从而影响钙钛矿的氧传输性能。Ding 等[52]通过在钙钛矿SrCo0.8Nb0.1Ta0.1O3−δ(S100CNT)中引入A 位缺陷制备Sr0.95Co0.8Nb0.1Ta0.1O3−δ(S095CNT)降低了体相的ABE,从而降低了氧迁移能垒。这表明,A 位和B 位整体缺陷对氧离子电导率也有不可忽视的影响。
2.3 氧空位的浓度
氧空位是氧离子在钙钛矿中迁移的通道。因此,在保持晶体结构稳定的前提下,氧空位浓度越高,氧传输速率越快。空位浓度与氧扩散性能关系示意图如图4所示。作为钙钛矿中常见的点缺陷类型,氧空位很容易自发或被调控产生。在钙钛矿A位和B位掺杂不同价态的碱土金属或过渡金属是增加氧空位浓度的常用方法。例如,钙钛矿Ba0.5Sr0.5Co0.8Fe0.2O3−δ(BSCF)作 为SOFC 的 经 典 阴 极,是通过分别在SrCoO3−δ的A位和B位掺杂Ba和Fe合成的。拥有高氧空位浓度的BSCF 实现了高氧离子电导率和在500℃下0.135 Ω·cm2的低面积比电阻[53]。同样地,在钙钛矿SrTiO3的A 位掺杂La 可以合成具有高氧空位浓度的Sr0.995La0.005TiO3−δ(SLT),其作为氧传感器表现出了快速的氧响应速度[54]。然而,当掺杂浓度变得非常高时,氧空位过多可能会导致材料发生相变,变为类钙铁铝石结构。相对于钙钛矿结构而言,这些缺失的氧不能再被视为有效缺陷,并且难以移动[5]。

图4 钙钛矿体系氧迁移路径的示意图Fig.4 The schematic diagram of oxygen migrates in perovskite
因此,钙钛矿体相中氧空位的浓度可以通过简单的掺杂策略进行调控。然而,更重要的是钙钛矿需要在高氧空位浓度下不发生相变。研究表明,当t= 1 时,钙钛矿结构最稳定,可以容纳更多的氧空位[55]。
增加钙钛矿氧空位容纳上限的另一种策略是增大晶胞自由体积。氧空位的产生会导致B 位金属离子的化合价降低,从而增加B 位离子的半径,这容易引发钙钛矿的相变。而大的晶胞自由体积可以在保持结构稳定的前提下允许更大的B 位离子半径,换句话说,它可以容纳更多的氧空位。例如,掺 杂 钙 钛 矿BSCF 比La0.5Sr0.5Co0.8Fe0.2O3−δ(LSCF)具有更多的氧空位[56−58]。这是因为Ba2+半径大于Sr2+和La3+,所以BSCF 具有更大的晶胞自由体积从而增加了氧空位浓度上限。由此看来,具有高对称性和较大晶胞自由体积的钙钛矿不仅从空间结构上更利于氧离子传输,也更有利于氧离子传输通道的增加。
值得注意的是,A 位和B 位整体缺陷也是提高氧空位浓度的方法之一。这种整体缺陷会造成钙钛矿体相阳离子正电荷的缺失,使得材料产生更多氧空位以维持电中性。迄今为止,一些A 位整体缺陷的钙钛矿,已被开发作为SOFC 阴极的Sr0.95Nb0.1Co0.9O3−δ、 Ba0.9Co0.7Fe0.2Mo0.1O3−δ和Sr0.8Ce0.1Fe0.7Co0.3O3−δ,均显示出比未缺陷钙钛矿更高的氧空位浓度和更好的氧传输性能[59−61]。不仅如此,Kuai 等[50]通过在钙钛矿氧化物BaCo0.4Fe0.4Zr0.1Y0.1O3−δ中引入轻微的B 位阳离子缺陷,也使体相产生更高浓度的氧空位。
2.4 氧空位的分布
逐渐有研究表明,氧空位浓度不是越高越好。氧空位浓度过高会导致氧空位之间距离过近而形成有序结构,有序结构中的氧空位作为稳定结构的一部分,失去了传输氧离子的能力[62−63]。不仅如此,即使钙钛矿体相中的氧空位浓度较低,若是氧空位分布不均匀,局部也会形成有序的氧空位,这些局部有序的氧空位也不再是氧离子传输的通道,而是它们传输的障碍。
这种缺陷有序的现象与钙钛矿结构的基本性质有关。在钙钛矿结构中,存在三种缺陷与缺陷之间的相互作用,分别为空位(Vo)−空位、阳离子(Lnn+)−阳离子以及Vo−Lnn+缺陷簇。它们的大小与之间的缔合(结合)能有关,并受静电、电子和弹性应力的控制[64−65]。在这三种缺陷−缺陷相互作用中,Vo−Vo相互作用最强,其次是Vo−Lnn+和Lnn+−Lnn+相互作用。Vo−Lnn+相互作用主要影响空位相对于主体和掺杂离子的位置。例如,在掺杂钙钛矿中,由于弹性应力松弛,氧空位最靠近主体阳离子,其次是大半径的掺杂阳离子。Vo−Vo和Lnn+−Lnn+相互作用主要决定了这些缺陷的聚集或有序化趋势。而当氧空位分布不均且局部氧空位相互靠近时,Vo−Vo相互作用将起决定性作用。这些氧空位之间会有很强的作用力形成团簇,这会阻碍氧空位的传输。这也是钙钛矿体相氧空位浓度过高,氧传输性能反而下降的原因,如图5所示。
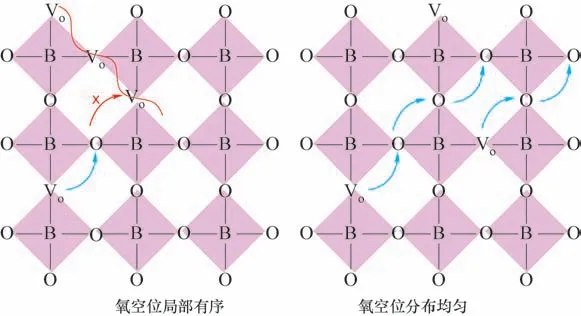
图5 氧空位局部有序影响氧传输示意图Fig.5 The schematic diagram of the local order of oxygen vacancy affecting oxygen transport
最初是在萤石氧化物中发现了氧空位局部有序的现象。Yamamura 等[66]发现随着掺杂比例增大,萤石氧化物Ce1−x−yLaxSryO2−δ的氧空位浓度增加,而理论晶格常数与实际晶格常数之间的差异越来越明显。这是由于随着氧空位浓度的增加,局部氧空位有序化程度更加明显,部分氧空位形成了新的结构,从而导致晶格常数降低。与萤石氧化物类似,后续也有报道指出钙钛矿在晶体结构中也存在局部有序的氧空位[67],这是通过扫描透射电子显微镜(scanning transmission electron microscopy, STEM)或其他先进检测技术观察到的,然而,很少有研究者将其直接与钙钛矿的体相氧传输性能联系起来。
总而言之,氧空位的分布对钙钛矿的氧传输性能起着重要作用,在设计高氧离子电导率的钙钛矿时,不能忽略这个重要因素。局部氧空位的有序化不仅会降低氧空位的有效浓度,而且局部有序形成的缔合结构会阻碍氧离子的进一步传输,而抑制氧空位的局部有序。换句话说,提高氧空位的有效浓度,需要氧空位的分布更加均匀,减少相互接触的机会。对于萤石氧化物,有研究指出采用多重掺杂效应,也就是将多种元素掺杂到主相中,可以抑制氧空位的有序化[66]。但在钙钛矿中,尚未出现抑制氧空位排序的报道。推测钙钛矿体相中也可能存在多重掺杂效应抑制局部氧空位有序化的现象。本课题组正在进行相关实验,并得到了初步的验证。利用两个半径和电负性都相似的Nb5+和Ta5+构建钙钛矿SrCo0.8Nb0.1Ta0.1O3−δ(SCNT)体系,通过SCNT 与单掺杂的SrCo0.8Nb0.2O3−δ(SCN)和SrCo0.8Ta0.2O3−δ(SCT)进行比较,再结合X 射线吸收谱和模拟计算结果,基本推断出共掺杂有助于抑制氧空位的有序化这一结论。
3 氧传输影响因素的验证
由于钙钛矿作为电化学元件重要组成部分时的器件整体性能评价不能直接表征材料的氧离子传输性能,因此通常采用透氧性能测试或电导率弛豫(electronic conductivity relaxation, ECR)技术测得材料的氧离子电导率或氧离子扩散系数对其氧离子传输性能进行比较[7,54,68]。透氧性能测试不仅可以得到材料的氧渗透通量,还可以得到材料的氧离子电导率,这对评价钙钛矿电化学元件的性能至关重要。为了进行透氧性能测试,通常需要将钙钛矿粉末烧结、压片和抛光,最后密封到致密陶瓷管上。将施加到富氧侧的环境空气用作吹扫气,从而在膜上产生氧分压梯度。渗透的氧气由配备毛细管分子柱和热导检测器的气相色谱仪进行检测。氧渗透通量可以使用式(5)进行量化:

式中,F是出口气体的流速;S是膜的几何表面积;cN、cO分别是吹扫侧流出物中氮和氧的测量浓度。而对于氧渗透通量和氧离子电导率之间可由Wagner公式进行转换[69]:
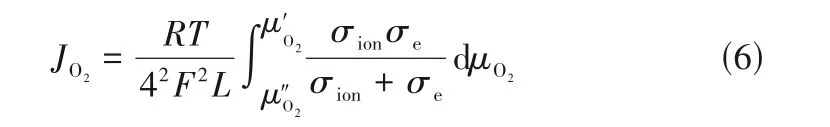
式中,σion、σe分别是材料的氧离子电导率及电子电导率;F是法拉第常数;T是热力学温度;R是气体常数;L是膜体的厚度;μ′O2、μ″O2分别是膜体高氧分压端及低氧分压端的氧化学势。一般而言,材料的电子电导率往往比氧离子电导率高1~3 个数量级,而且在理想状态的热力学系统中,氧化学势可以表示为:

则氧离子电导率与氧渗透通量的关系最终可以简化为:

式中,P'O2、P″O2分别是膜高氧分压端和低氧分压端的氧分压。
还可以采用ECR 技术测试钙钛矿的氧体扩散系数(Dchem)来描述氧传输性能的高低。首先将钙钛矿粉末烧结成致密的块状体,然后在管式炉中加热到一定温度后,瞬间改变氧分压,此时立即使用四探针直流方法测量电导率,最后对电导率弛豫曲线进行拟合得到Dchem[7]。其计算公式如下:

式中,σ(0)、σ(t)、σ(∞)分别是改变氧分压初始时刻、t时刻和稳定时刻的电导率;无量纲常数C1、C2、C3是块状体尺寸与扩散系数之间的比率,C1=l1/Ld,C2=l2/Ld,C3=l3/Ld,Ld=Dchem/kchem;kchem是氧表面交换系数;α1n、α2m、α3p分别是以下方程的第n、m、p根:C1=α1ntanα1n,C2=α2mtanα2m,C3=α3ptanα3p;n、m、p的值固定为10。
对于电化学元件,如SOFC 阴极,电化学阻抗谱(electrochemical impedance spectroscopy, EIS)技术也可用于测试钙钛矿的氧传输性能[70−71],结合阻抗拟合和弛豫时间分布函数(distribution function of relaxation times,DRT),可以定性研究待测样品的离子传导特性。接下来,将详细讨论如何对钙钛矿氧传输性能的影响因素进行表征和估算。
3.1 晶体结构
3.1.1 晶体对称性 容差因子t可以粗略判断钙钛矿结构的晶体对称性,更详细的结果可以通过实验手段来确认。X 射线衍射(X−ray diffraction,XRD)是一种常用且简便的表征钙钛矿晶体对称性的手段。不同晶体对称性的钙钛矿结构均能在谱图上表现出来,如图6所示[29]。通过XRD结合Rietveld等精修手段可以得出B—O—B 键长键角等更详细的结构参数。目前,常常采用原位XRD 分析技术得到材料在工作状态下的晶体结构,从而进行更深入的研究。通常为了更加准确地判定钙钛矿的结构,可以采用高倍率透射显微镜(high resolution transmission electron microscope, HRTEM)得到的晶格间距信息与XRD 谱图相互印证的方式来增加数据的可信度。值得注意的是,拉曼光谱(Raman spectra)常用于分子结构的表征,对部分钙钛矿的不对称结构非常敏感,也可以得到晶体对称性等结构信息[72−73]。
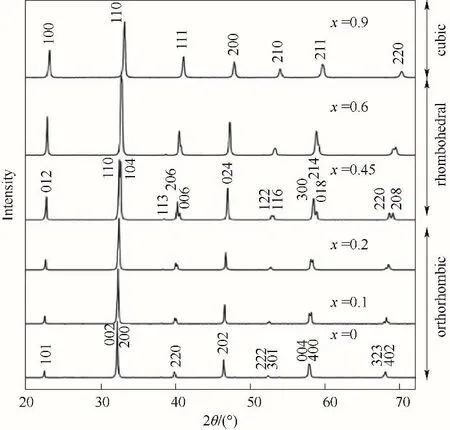
图6 常温下钙钛矿LaGa0.9−xAlxMg0.1O2.95的XRD谱图[29]Fig.6 Powder XRD patterns of LaGa0.9−xAlxMg0.1O2.95 at room temperature[29]
3.1.2 晶胞自由体积 简单钙钛矿的晶胞自由体积可按Fukunaga等[74]给出的经验公式直接计算:

式中,t是容差因子,可由式(4)直接计算得出。
临界半径(rc)可由晶格常数(a0)及A 位和B 位的离子半径求得。A 位和B 位离子半径可以根据Shannon[44]和Jia[23]的研究进行计算。例如,常用的A 位离子Ba2+、Sr2+、La3+、Pr3+在12 配位状态下的离子半径值分别为1.61、1.44、1.36、1.32 Å。常见的六配位B 位离子Co4+、Fe3+、Sc3+、Ti4+的离子半径分别为0.54、0.65、0.75、0.60 Å。临界半径可以用式(11)来量化:

式中,rA、rB分别是An+、Bn+的离子半径;a0是晶格常数。对于简单立方钙钛矿,晶格常数可以直接通过A位和B位的离子半径来计算[20]。
值得注意的是,中子和X 射线粉末衍射数据的Rietveld 联合分析可以方便、准确地获得待测钙钛矿氧化物的晶体结构信息[75−76]。本方法的意义在于,可以在材料的设计阶段便可以大致估算晶胞自由体积和临界半径的值,为合成实验提供一定的指导,节省大量的时间和精力。
3.2 平均金属-氧键能
如上文所述,平均金属−氧键能在某些情况下可以简化为平均B—O 键能,而且两者的表征方法基本是一致的,因此本节将重点讨论B—O 键能的计算和实验方法。
B—O 键能与B 位金属离子的电负性和价态密切相关[77−78]。钙钛矿中的B—O 键能可根据之前研究者们的相关工作进行估算[48−49]。B—O 键能的大小可以用式(2)来量化:
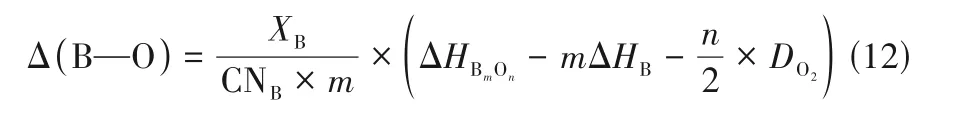
式 中,XB是B 位 金 属 的 摩 尔 分 数;CNB是6;ΔHBmOn、ΔHB分别是1 mol BmOn的生成焓及B 位金属在25℃的升华能;DO2是O2的离解能(500.2 kJ/mol)。而平均金属−氧键能(ABE)可以同理计算出A—O 键能,合并归一化即可。
氧气程序升温脱附(O2−temperature programmed desorption,O2−TPD)曲线是检测B—O 键能的一项重要技术[51]。在高温下,随着钙钛矿中B 位离子的热还原,氧会从钙钛矿体相中脱出(可使用质谱仪原位检测)。可以根据氧脱出峰的位置和强度来确定B—O键能的相对大小和性质[50],如图7所示。

图7 钙钛矿氧化物O2−TPD曲线[50]Fig.7 O2−TPD profiles of perovskite oxides[50]
3.3 氧空位的浓度
在室温下,钙钛矿氧化物的氧空位浓度通常通过碘滴定法(iodine titration,IT)测定。常见的操作步骤为:首先,将钙钛矿粉末溶解在酸化的硫酸铁溶液中。然后,亚铁离子将所有的B 位金属还原成低价。以二苯胺磺酸钠为指示剂,用标定的K2Cr2O7溶液滴定剩余的Fe(Ⅱ)至紫色。常见钙钛矿的氧空位浓度由式(13)确定[79−80]:

式中,δ是氧非化学计量比,这是表示氧空位浓度的另一种形式;W是样品的质量,mg;cFe2+和cK2Cr2O7分别是Fe(Ⅱ)溶液和K2Cr2O7标准溶液的浓度,mol/L;VK2Cr2O7是K2Cr2O7标准溶液的消耗体积,ml。该方法的误差来源于滴定误差,可以通过多次平行实验来尽量避免,总体而言准确度较高。值得注意的是,结合IT 和热重分析(thermogravimetric analysis,TGA),可以计算出不同温度下的钙钛矿体相氧空位浓度,这些信息对需要在高温条件下操作的设备非常重要,如SOFC 等[81]。中子和X 射线粉末衍射数据的精修分析也可以确定钙钛矿体相中氧空位浓度[6],但是实验室X 射线对样品中的氧元素不敏感,采用中子衍射可以很好地探测到氧的信息,准确度更高。
也有一些间接的方法来确定氧空位浓度。X射线光电子能谱(X−ray photoelectron spectroscopy,XPS) 和 X 射 线 吸 收 光 谱(X−ray absorption spectroscopy,XAS)能准确测定钙钛矿氧化物中金属离子的价态,根据电中性原理可间接获得氧的化学计量比(δ)[75−76]。上述手段再结合先进的原位测试技术,也可以得到高温下钙钛矿体相中的氧空位浓度[82]。值得注意的是,XPS 只能得到样品表面的价态信息(5 nm),而XAS 可以穿透样品,得到的价态信息比XPS 更准确。同样地,采用同步辐射X 射线代替实验室X 射线得到的价态结果误差不超过0.05,可以准确地测出样品中的氧空位浓度。
电子顺磁共振(electron paramagnetic resonance,EPR)技术也可以定性分析钙钛矿体相中的氧空位浓度[83],特征峰强度越高,氧空位浓度越高。也有报道指出,拉曼光谱也可以探测钙钛矿体相中的氧空位[84]。这是由于氧空位会降低钙钛矿晶格中BO6八面体的对称性,会在拉曼光谱中出现特征峰。值得注意的是,上述两种方法不能给出氧空位浓度的具体值,只能比较同一体系下不同样品氧空位浓度的相对大小。
3.4 氧空位的分布
目前,有关钙钛矿型氧化物中局部有序氧空位的报道相对较少,对于氧空位分布的均匀性还没有系统的表征方法。球差矫正的电子显微镜(spherical aberration corrected transmission electron microscope, AC−TEM)是直接观察氧空位的最佳设备。然而,它只能获得局部(10 nm)的氧空位分布,对钙钛矿晶格中氧空位的整体信息难以给出准确的判断。
Ou 等[85]发现,使用TEM 和电子能量损失谱可以在掺杂氧化铈中观察到局部氧空位有序,如图8所示。相似地,Tomura 等[67]利用扫描透射电子显微镜(scanning transmission electron microscopy,STEM)观 察 到 钙 钛 矿Bi1−xSrxFeO3−δ(BSFs)中 氧 空 位的局部有序性,如图9 所示。遗憾的是,目前的研究只能观察到局部氧空位有序的存在,而无法确定体相氧空位整体的均匀程度,从而难以对氧传输性能做出预测。

图8 掺Y氧化铈的Ce和Y的显微照片(a)以及Sm(b)、Dy(c)、Y(d)和Yb(e)掺杂氧化铈的选区电子衍射图案[85]Fig.8 Ce and Y maps of Y−doped ceria(a)and selected area electron diffraction(SAED)patterns of ceria doped with Sm(b),Dy(c),Y(d),and Yb(e)[85]

图9 (a)从110晶面入射光束方向拍摄的BSF30的HRTEM图像;(b)BSF30的SAED模式;(c),(d)分别沿001和110方向的(b)的线剖面;(e),(g)BSF30的放大图像;(f),(h)对应于(e),(g)的快速傅里叶变换图像[67]Fig.9 (a)HRTEM image of BSF30 taken from the(110)incident beam direction;(b)SAED pattern of BSF30;(c),(d)Line profiles of(b)along the 001 and 110 directions,respectively;(e),(g)Magnified images of BSF30;(f),(h)Fast Fourier transform(FFT)images corresponding to(e),(g),respectively[67]
4 模拟计算
模拟计算可以提供一些实验无法获得的信息,已经广泛应用于许多研究领域,包括钙钛矿晶格中的氧传输过程分析。第一性原理计算和其中最常用的密度泛函理论(density functional theory,DFT)计算方法,都能够准确地预测或获得所研究系统的物理和化学性质,应用于钙钛矿体相氧传输已经取得了许多优异的成果。
首先,模拟计算预测钙钛矿体相氧传输性能的两个最常用参数就是氧空位迁移能和氧空位形成能。氧空位迁移能代表了晶格中氧空位迁移的难易程度,是控制钙钛矿体相中氧传输的重要因素[6−7]。Gangopadhyay 等[86]用平面波DFT 预测钙钛矿BSCF 氧空位迁移的稳定性和活化能,并证实Co 和Ba 阳离子的存在会降低氧空位迁移的活化能。Tahini 等[87]使用第一性原理计算,从热力学、电子学和动力学的角度研究钙钛矿SrCoO3−δ中的氧空位,发现氧空位非常容易移动,迁移能量约为0.5 eV。这些发现可以帮助预测钙钛矿的氧传输特性,为材料的合成提供指导。
对于氧空位浓度,目前模拟计算还无法做出直接而准确的预测。但是氧空位形成能对氧空位浓度的影响至关重要,其大小决定了钙钛矿晶格中氧空位形成的容易程度,而模拟计算可以给出准确的计算结果。Hanselman 等[88]利用钙钛矿Ba1−xFeInxO3−δ作为模型,详细研究了原子尺度下的B 位掺杂对氧空位形成的作用。不仅如此,他们还计算了氧过剩能,这是评估体相氧离子扩散的可靠描述符。Aschauer 等[89]发现拉伸应变降低了钙钛矿CaMnO3−δ晶格中的氧空位形成能,这可能跟氧空位的增加导致的化学膨胀有关。根据进一步的第一性原理计算,氧空位形成能确实具有很强的应变依赖性。最近,Mao 等[90]利用理论计算详细研究了SrCoO3−δ基钙钛矿中B 位掺杂离子(Sc, Zr, Mo, Nb, Ta 等)的半径和电负性对氧空位迁移能和形成能的影响,发现了它们之间的强线性关系,如图10 所示。掺杂离子的平均半径的提高有利于降低氧空位形成能,但会提高氧空位迁移能;掺杂离子的平均电负性的提高有利于降低氧空位迁移能,但会提高氧空位形成能,同时掺杂离子的半径和电负性也存在着相关性。因此,掺杂离子的半径和电负性存在一个平衡值,使得钙钛矿体相氧传输性能最优,这 也 是 钙 钛 矿SrCo0.8Nb0.1Ta0.1O3−δ具 有 高 氧 离 子 电导率的原因。

图10 (a)氧空位形成能(蓝线)和氧空位迁移能(红线)与半径的相关性;(b)氧空位形成能(蓝线)和氧空位迁移能(红线)与电负性的相关性(紫红色圆形代表了单原子掺杂SrCoO3−δ基钙钛矿的最有希望区域)[90]Fig.10 (a)Correlation of VO formation energy(blue line)and oxygen transportation barrier(red line)against radius;(b)Correlation of VO formation energy(blue line)and oxygen transportation barrier(red line)against electronegativity(The pink circle area represents the promising zone of the best single metal atom doped SrCoO3−δ perovskite catalysts)[90]
模拟计算虽然不能得到钙钛矿晶格中氧空位的分布,但结合氧空位的迁移能和形成能,可以推断出氧空位在钙钛矿晶格中的迁移路径,这在实验上是不能观察到的[91]。氧空位的迁移路径对理解钙钛矿晶格中氧空位的传输机制也有着重要作用。Jones 等[92]利用原子模拟技术研究了钙钛矿氧化物LaFeO3−δ中氧迁移的多种途径并发现了此过程的最低活化能是通过两个O 位之间的弯曲路径,如图11所示。Yang 等[93]研究了ab双轴应变对钙钛矿BaTiO3−δ中氧空位及其迁移过程的影响。通过第一性原理总能量计算,发现Vc(氧空位位于c轴)和Vab(氧空位位于ab平面)之间的氧空位迁移路径呈“S”形,如图12所示。理论计算也可以用来计算氧空位的缔合焓,对分析钙钛矿体相氧空位的分布也有重要作用。

图11 氧离子在氧占据位和氧空位之间迁移的计算路径(曲线)的示意图(鞍点的位置用✕表示,灰色小球代表Fe离子)[92]Fig.11 Schematic representation of the calculated pathway(curved line)of oxide ion migration between occupied and vacant O2 sites(The position of the saddle point is shown with a cross.Small gray spheres represent Fe ions)[92]

图12 氧空位迁移的选择路径和计算程序的示意图(粉红色的水平虚线代表xy平面,移动的氧可以在z坐标固定的情况下传输并找到最低能量位置)[93]Fig.12 Schematic of chosen path and the calculation procedure for oxygen vacancy migration(The pink horizontal dotted line represents the xy−plane for the moving oxygen to relax and find the lowest energy position with the z−coordinate fixed)[93]
模拟计算结果也证实了之前关于晶体结构的结论:ABO3型钙钛矿结构中A 位和B 位阳离子的半径是影响离子电导率的重要因素。Cherry 等[11,57]使用定义好的电势计算了一系列不同的A 位和B 位阳离子半径的空位跳跃的迁移能量,结果表现出两个特点:首先,具有较小A 位离子半径的钙钛矿氧化物的体相氧空位迁移能较低,存在约0.95 Å的最佳值,低于此值迁移能会急剧上升。其次,氧空位迁移能随着B 位阳离子尺寸的增加而降低,存在0.75 Å 的最小值。为了进一步验证这些结果,研究者们还建立了容差因子(t)与氧空位迁移能的联系[94]。计算表明,当t≈0.81 时,钙钛矿体相的氧空位迁移能和氧扩散速率会更快,但该t值下钙钛矿结构并不稳定,因此实际情况下的工作效率可能会很低。
虽然模拟计算可以直接得到许多需要复杂实验过程的结果,但有时也会与实际情况存在偏差。通过模拟计算与实验结果相结合,对合理的科学研究进行修正,有利于指导下一步的实验方案。
5 结 论
本文综述了影响ABO3型钙钛矿氧传输性能的主要因素。钙钛矿晶格中氧传输的机制是空位机制,这意味着氧离子需要通过跳跃到相邻的空位而扩散。其中,影响钙钛矿氧传输性能的因素主要有四个:晶体结构、平均金属−氧键能、氧空位浓度和氧空位分布。晶体结构和平均金属−氧键能最终由A 位和B 位阳离子的基本性质决定,例如原子序数、离子半径和氧化态。掺杂策略是提高钙钛矿体相氧空位浓度的有效手段。除此之外,增加晶格常数以允许更大的失配也可以增加钙钛矿体相的氧空位浓度。至于氧空位的分布,关于其影响钙钛矿晶格氧传输的相关报道还很少,这可能是一个新的重要研究方向。为了更好地预测材料的性能并高效筛选高氧离子电导率的钙钛矿,还介绍了这些影响因素常用的表征方法。最后,总结了一些用于研究钙钛矿晶格中氧传输特性的理论计算结果。值得注意的是,晶体结构、平均金属−氧键能、氧空位浓度和氧空位分布也会相互影响。目前合理的设计高氧离子电导率的钙钛矿材料的策略应该是选择合适半径的A 位和B 位离子,使得尽可能保持立方结构的情况下增大晶胞自由体积,然后选择合适的掺杂离子调节B—O 键能以及提高氧空位浓度,最后可以尝试多掺杂策略提高氧空位分布的均匀性。同时,在未来提高钙钛矿晶格氧扩散速率可以继续从以下几方面进行突破。
(1)寻找更简便的描述符。目前存在很多影响钙钛矿晶格氧扩散速率的因素,然而它们之间也会互相影响,无法从单一影响因素来预测氧传输性能的好坏,这会给挑选合适的材料增加困难。未来可以通过建立合适的体系,逐步探究影响钙钛矿氧传输性能的主要和次要因素。然后按照合适的权重或者增加修正项的方式建立准确而简单的描述符,促进高氧离子电导钙钛矿的开发。
(2)原位观测氧传输过程。氧在微观层面的传输很可能与在宏观层面的理解有所差别。例如,氧离子的半径与其外层电子云息息相关,然而电子云并不是电子真实填充于此,只是电子出现的概率,这会导致实际氧在晶格内传输存在突破半径大小限制的可能。因此,通过近些年迅速发展起来的原位技术结合精密的表征,例如原位球差矫正的透射电子显微镜,可以准确捕捉氧在晶格内的运动,进而更加准确地理解材料结构与性能之间的关系。
(3)准确表征氧空位的分布。氧空位作为氧在晶格内传输的重要通道,其分布与氧传输性能关系较为密切。然而,目前对氧空位分布的研究还比较少,主要是缺少合适的表征方法,只能通过间接手段或者局部信息来推测整体的氧空位分布情况。下一步,探究高效的钙钛矿晶格中氧空位有序程度的表征手段,从而完善对钙钛矿氧传输性能的预测方法。
(4)更加符合实际的模拟计算。目前有很多采用模拟计算研究钙钛矿氧传输性质的工作,但大多都只建立静态单一的模型,缺少对氧分压、温度、电势和形貌等材料工作状态下的考虑,这与实际的氧传输情况可能会有差别,进而导致计算结果的误差。同时,模拟计算也是寻找氧传输性能描述符的重要手段,未来也期待在这方面有更大作用。
