桑芪首乌片对自发性高血压大鼠血管内皮细胞的影响※
2022-04-22铁明慧吕锐萍魏丹霞陈维军郭施余陈斌
铁明慧 吕锐萍 魏丹霞 陈维军 郭施余 陈斌
血管内皮功能障碍(Endothelial dysfunction,ED)是高血压及其靶器官损害发生、发展的重要机制,也是高血压治疗方法的潜在靶向目标[1]。血管紧张素Ⅱ(Angiotensin Ⅱ,Ang Ⅱ)在内皮细胞损伤中发挥着多种生物学效应,如介导氧化应激反应、激活凋亡信号通路、促进血栓形成、纤维化与血管重构等,最终参与内皮功能障碍的发生[2-4]。桑芪首乌片是云南省荣誉名中医陆家龙教授治疗高血压病的经验方经制剂工艺优化而成的固定剂型[5],既往研究表明:桑芪首乌片可降低自发性高血压大鼠(spontaneously hypertensive rats,SHR)血浆AngⅡ水平,对RAS作用具有多途径、多环节、多靶点的综合影响[6]。本实验将探讨桑芪首乌片对SHR血管内皮保护作用的影响。
1 材料与方法
1.1 实验动物雄性SPF 级SHR30 只,8 周龄,体重235~245 g;Wistar-kyoto(WKY)大鼠10 只,8 周龄,体重260~280 g。均购自成都达硕实验动物有限公司,合格证号为51203500008304,实验动物生产许可证号为SYXK(川)2020-232。经适应性喂养2 w 后进行实验。
1.2 伦理审查本研究获云南中医药大学第三附属医院实验动物伦理委员会批准,批准编号:R-0602017G014。
1.3 药物及试剂桑芪首乌片(专利号:ZL 2016 1 0148818.7),由桑寄生、黄芪、制首乌、钩藤、天麻、三七等11味中药组成[7],中药原材料购于云南白药集团股份有限公司(批号:2013002134),成人(标准体重)临床日剂量为生药158 g,由昆明市中医医院制剂中心制成浸膏,每克相当于生药材5.8 g;厄贝沙坦片,规格150 mg/片(Sanofi Winthrop Industrie,国药准字J20130049),以上药物实验时用0.1%DMSO 溶解成高浓度溶液后,再用纯净水稀释成所需浓度。荧光标记鼠抗兔CD45 抗体(FITC-anti-Rat CD45,生产批号为204426,购自Biolegend 公司);鼠抗兔CD31抗体(PEmouse anti-Rat CD31,生产批号为555027,购自BD 公司);改良Masson 三色染色液(生产批号为0311A20,购自Sigma公司)。
1.4 仪器及设备BP-600A全自动大小鼠无创血压测量系统(成都泰盟);NovoCyte 流式细胞仪(美国艾森生物科学公司);DNM-9602 酶标仪(北京普朗);BA400Digital 三目摄像显微镜(厦门麦克奥迪实业集团有限公司)。
1.5 实验方法
1.5.1 实验分组及给药 将SHR 适应性饲养2 w后,测定血压,收缩压高于21.4 kPa(160.71 mmHg)者为合格研究对象进入实验[8]。根据体重将30 只SHR随机分组编号,即:桑芪首乌片组(SQ组)、厄贝沙坦片组(EB 组)和模型组,并以WKY 大鼠为正常对照组。参照药理试验中大鼠与人体间的等效剂量换算[9],SQ组给予桑芪首乌片浸膏2.8 g·kg-1·d-1,EB组给予厄贝沙坦片15.625 mg·kg-1·d-1(相当于成人临床剂量150 mg/d),模型组、正常对照组均给予生理盐水。给药容量为10 mL/kg,各组每日灌胃给予相应的药物,每周称量体重1次,并且依据体质量调整给药量。实验期间各组均饲予普通饲料,并自由饮水,给药时间为28 d。
1.5.2 大鼠血压测量 正式测量前先进行为期5 d的测压训练,待大鼠适应环境、血压稳定后,开始实验观察。于8:00~13:00 的固定时间测量血压,将大鼠放入(37±1)℃电热恒温箱内预热15 min后,测定大鼠尾收缩期动脉压(Systolic blood pressure,SBP)及舒张期动脉压(diastolic blood pressure,DBP)。每只大鼠尾动脉收缩压经无创血压仪连续测量3 次,取平均值为该次测量的血压值。
1.5.3 循环内皮细胞计数
1.5.3.1 血液样本采集及红细胞裂解 于给药后第28 d,采用EDTA-K2抗凝管经腹主动脉采血并混匀,500 r/min 离心5 min,离心弃上清,加入6~10 倍细胞体积的红细胞裂解液,轻轻吹打混匀,室温裂解5 min。裂解过程中宜适当摇动以促进红细胞裂解。400~500 r/min离心5 min,弃红色上清。重复裂解过程3 次,细胞沉淀加入10 mL PBS 重悬沉淀,500 r/min 离心5 min,弃上清,重复洗涤3 次,用1 mL PBS重悬。
1.5.3.2 流式检测循环内皮细胞 取100 μL 细胞悬液,加入10 μL PE-mouse anti-Rat CD31 抗体,及10 μL FITC-anti-Rat CD45 抗体,混匀后,室温避光孵育20 min,1500 r/min 离心5 min,弃上清,加入2 mL PBS缓冲液洗涤;1500 r/min离心5 min,弃上清,重复洗涤3 次,加入1 mL PBS 缓冲液重悬细胞沉淀,上机检测。调整FSC、SSC电压,获取10000个细胞进行分析。以对数FSC作X轴,对数SSC作Y轴,选取单核细胞圈门,另开一个窗,以对数FITC-CD45 作X 轴,PECD31作Y 轴,以对照管调整坐标的位置,分析CD31+/CD45-细胞的百分比。
1.5.4 HE 染色检测 大鼠取血后,迅速取胸主动脉,置于4%多聚甲醛中固定,浸蜡包埋,常规切片,HE 染色观察血管组织形态学变化。采用Pannoramic 250 数字切片扫描仪对切片进行图像采集,每张切片先于40倍下观察全部组织,观察大体病变,选择要观察的区域采集400倍图片,观察具体病变。
1.5.5 Masson 染色检测 大鼠取血后,迅速取胸主动脉,置于4%多聚甲醛中固定,浸蜡包埋,常规切片,切片常规脱蜡至水,天青石蓝染色液、Mayer苏木素染色液及丽春红品红染色液分别进行染色,阳性表达:胶原纤维、软骨呈蓝色,肌纤维、纤维素、肌肉、神经胶质、胞浆呈红色,红细胞呈橘红色,胞核呈黑蓝色。所得切片采用Pannoramic 250数字切片扫描仪对切片进行图像采集,每张切片先于100 倍下观察全部组织,再根据组织大小及表达情况分别选取3 代表性区域采集400 倍图像。用Image-Pro Plus 6.0 图像分析系统测定所采集全部图像的光密度(integrated optical density,IOD)和面积(Area),测量出血管壁厚度(Wall thickness,WT)、内径(Luminal diameter,LD)、中膜厚度(Mesdia thickness,MT)、血管横截面积(WalL crosssectional area,WCSA)、管腔面积(Luminall cross-sectional area,LCSA),以及壁厚内径比(WT/LD)、壁腔横截面积比(WCSA/LCSA),另在20 倍下拍照观察血管结构。
1.6 统计分析采用SPSS 22.0 统计软件进行数据处理,计量数据以均数±标准()表示。对数据进行方差齐性检验,若满足正态性和方差齐性,多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD 检验;若方差不齐,则采用非参数检验。以P<0.05 表示具有统计学差异。
2 结果
2.1 对SHR 收缩压及舒张压的影响经适应性喂养2周后,模型组、EB组及SQ组的SBP和DBP均显著高于正常对照组(P<0.01),并达到高血压状态,而模型组、SQ 组及EB 组各组间SBP 和DBP 比较,差异无统计学意义(P>0.05),说明造模成功。给药期间:与正常对照组相比,模型组不同时间段SBP 均升高(P<0.01),且呈逐渐上升趋势;与模型组相比,EB组和SQ组不同时间段均能有效降低SBP 和DBP(P<0.05,P<0.01),但EB 组与SQ 组两组组间比较无统计学差异(P>0.05)。结果见表1、表2。
表1 各组大鼠不同时间SBP监测结果(,mmHg)
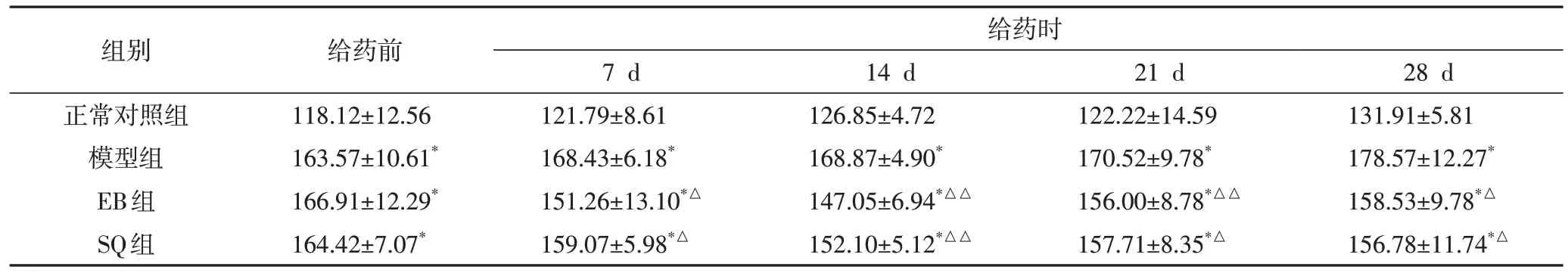
表1 各组大鼠不同时间SBP监测结果(,mmHg)
注:与正常对照组,*P<0.01;与模型组比较,△P<0.05,△△P<0.01
组别正常对照组模型组EB组SQ组给药前118.12±12.56 163.57±10.61*166.91±12.29*164.42±7.07*给药时28 d 131.91±5.81 178.57±12.27*158.53±9.78*△156.78±11.74*△7 d 121.79±8.61 168.43±6.18*151.26±13.10*△159.07±5.98*△14 d 126.85±4.72 168.87±4.90*147.05±6.94*△△152.10±5.12*△△21 d 122.22±14.59 170.52±9.78*156.00±8.78*△△157.71±8.35*△
表2 各组大鼠不同时间DBP监测结果(,mmHg)
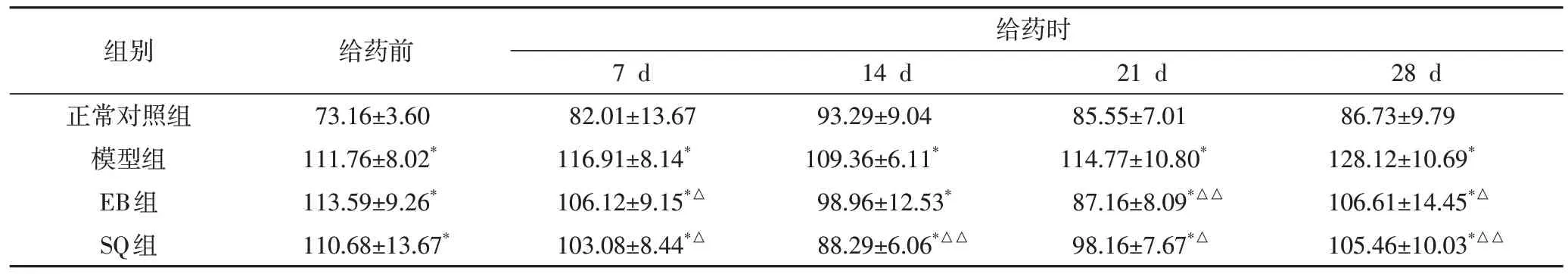
表2 各组大鼠不同时间DBP监测结果(,mmHg)
注:与正常对照组,*P<0.01;与模型组比较,△P<0.05,△△P<0.01
组别正常对照组模型组EB组SQ组给药前73.16±3.60 111.76±8.02*113.59±9.26*110.68±13.67*给药时28 d 86.73±9.79 128.12±10.69*106.61±14.45*△105.46±10.03*△△7 d 82.01±13.67 116.91±8.14*106.12±9.15*△103.08±8.44*△14 d 93.29±9.04 109.36±6.11*98.96±12.53*88.29±6.06*△△21 d 85.55±7.01 114.77±10.80*87.16±8.09*△△98.16±7.67*△
2.2 循环内皮细胞计数结果实验4 w 后,与正常对照组比较,模型组、EB组循环内皮细胞计数明显升高,差异有统计学意义(P<0.01),SQ 组循环内皮细胞计数升高,但差异比较无统计学意义(P>0.05);与模型组比较,EB组、SQ组循环内皮细胞计数均有显著降低,差异有统计学意义(P<0.01);EB组与SQ组两组循环内皮细胞计数无统计学意义差异(P>0.05)。见表3。
表3 各组大鼠循环内皮细胞检测结果(,‰)

表3 各组大鼠循环内皮细胞检测结果(,‰)
注:与正常对照组,*P<0.01;与模型组比较,△△P <0.01。
组别正常对照组模型组EB组SQ组循环内皮细胞计数比例0.43±0.29 17.10±7.80*1.15±0.51*△△0.96±0.63△△
2.3 对胸主动脉病理形态的影响实验4 w 后,与正常对照组相比,模型组大鼠血管组织内皮损伤明显,内膜不完整,明显增厚,可见受损变性的内皮细胞脱落于管腔内,肌纤维排列不整齐,粗细不一,平滑肌细胞明显增殖,胶原纤维减少,外膜增厚;EB 组大鼠血管内膜完整光滑,可见极少量受损变性的内皮细胞脱落于管腔内;SQ组大鼠血管内膜轻度损伤,内膜相对完整,可见少量内皮细胞脱落,中膜增厚,肌纤维排列紊乱,外膜较厚。结果显示,桑芪首乌片对高血压血管损伤具有一定的保护作用。见图1。2.4 Masson 染色结果利用Image-Pro Plus 6.0 图像分析系统测定显示:与正常对照组相比,模型组、SQ组及EB 组LD、WCSA、LCSA、WT、MT 明显增大(P<0.05 或P<0.01);与模型组比较,SQ 组、EB 组LD、WT/LD、WCSA、LCSA、WCSA/LCSA、WT、MT 均明显减少,差异具有统计学意义(P<0.05或P<0.01);对比EB组,SQ组LD、WT/LD、WCSA、LCSA、WT、MT有所增大,但差异无统计学意义(P>0.05)。结果表明,桑芪首乌片能够降低血管纤维化水平。见表4、表5、图2。
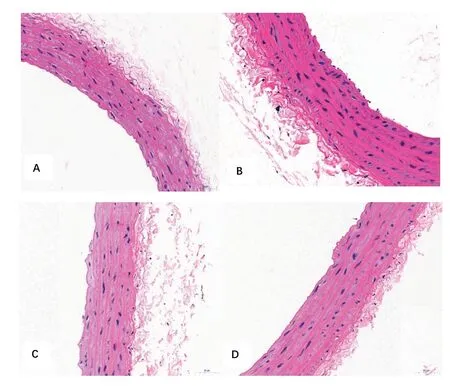
图1 各组大鼠主动脉的病理检测情况(HE,400×)
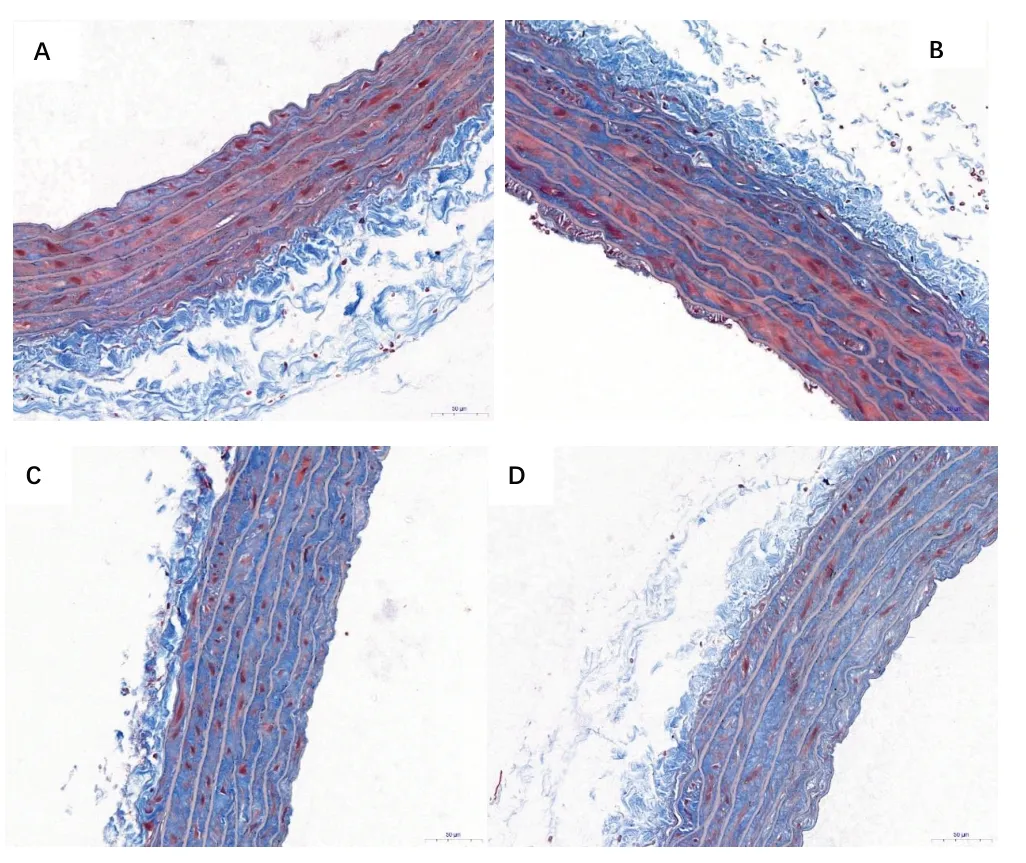
图2 各组大鼠Masson染色下纤维组织(HE,400×)
表4 各组大鼠胸主动脉血管内径变化情况(,mm2)
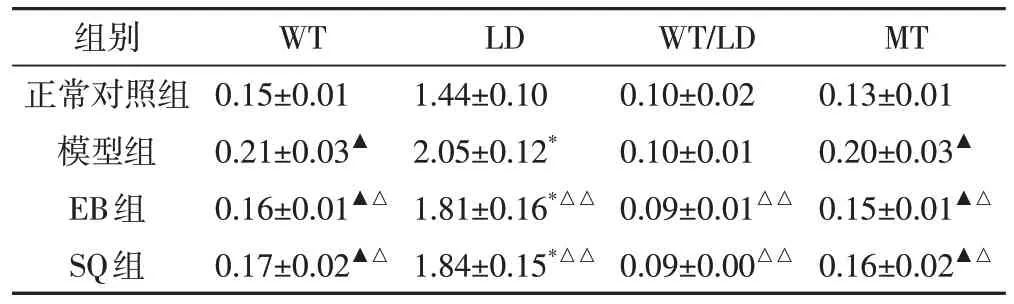
表4 各组大鼠胸主动脉血管内径变化情况(,mm2)
注:与正常对照组比较,▲P<0.05,*P<0.01;与模型组比较,△P <0.05,△△P<0.01
组别正常对照组模型组EB组SQ组WT 0.15±0.01 0.21±0.03▲0.16±0.01▲△0.17±0.02▲△LD 1.44±0.10 2.05±0.12*1.81±0.16*△△1.84±0.15*△△WT/LD 0.10±0.02 0.10±0.01 0.09±0.01△△0.09±0.00△△MT 0.13±0.01 0.20±0.03▲0.15±0.01▲△0.16±0.02▲△
表5 各组大鼠胸主动脉血管面积变化情况(,mm2)
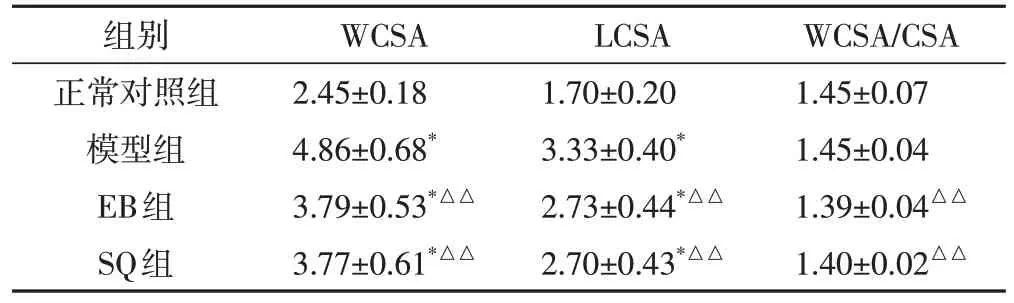
表5 各组大鼠胸主动脉血管面积变化情况(,mm2)
注:与正常对照组比较,▲P<0.05,*P<0.01;与模型组比较,△P<0.05,△△P<0.01
组别正常对照组模型组EB组SQ组WCSA 2.45±0.18 4.86±0.68*3.79±0.53*△△3.77±0.61*△△LCSA 1.70±0.20 3.33±0.40*2.73±0.44*△△2.70±0.43*△△WCSA/CSA 1.45±0.07 1.45±0.04 1.39±0.04△△1.40±0.02△△
3 讨论
高血压是目前严重威胁人类身体健康的慢性心脑血管病,有着极高的发病率和致死率,全世界每年由高血压并发症引起的死亡人数高达940万人[10]。根据我国流行病学研究,血压120~129/80~84 mmHg和130~139/85~89 mmHg 的中年人群,10 年后分别有45%和64%发展成为高血压患者[11-12]。因此,高血压早期干预能够有效降低心血管事件。血管内皮是血流和血管壁之间的机械和生物屏障,具有合成、释放多种血管活性物质,从而调节血管张力、凝血、炎症、免疫、物质转运和诱导血管平滑肌细胞分化的功能[13-14]。肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosteronesystem,RAAS)作为心血管重要的神经-内分泌系统,其多种代谢产物作用于内皮细胞受体和信号通路发挥维持血压和调控心血管系统稳态,其中Ang II 是该系统最主要的病理效应分子[15-16]。研究表明,Ang II引起血管平滑肌收缩,激活炎性因子和氧化应激、诱导血管平滑肌细胞增殖,造成内皮细胞的功能失调和结构损伤[17]。通过降低Ang II的合成和阻断受体信号通道,能够提高内皮细胞对血清NO 的生物利用度,减轻高血压患者的炎症和氧化应激反应,从而改善外周血管内皮功能[18]。课题组既往实验表明:桑芪首乌片能够降低Ang II 水平,多途径作用于RAAS 系统发挥降压效果[6],因此,本实验中选择厄贝沙坦片为阳性对照药,观察桑芪首乌片通过抑制Ang II对SHR血压及内皮细胞的影响作用。
内皮细胞衰老或受损后从基底脱落,循环于外周血中,称循环内皮细胞(circulating endothelial cells,CECs)。正常人体内CECs的数量非常少,然而在内皮受损的病理状态下,循环内皮细胞会发生数量和形态学的变化。有人认为,CECs 是目前在活体内的唯一可以直接反映血管内皮损伤的标志物,可用来评判内皮功能和稳态[19]。本研究表明,SHR 随着周龄增长血压持续升高,至10 周龄左右血压趋于稳定并达到高血压状态。与正常对照组相比,模型组的CECs 显著升高,表明高血压状态下血管存在内皮结构和功能的破坏。经厄贝沙坦片和桑芪首乌片干预后,两组CECs均有不同程度的下降,提示厄贝沙坦片和桑芪首乌片在降低血压的同时,能够改善内皮细胞损伤,推测可能与桑芪首乌片降低RAAS中Ang II水平有关。
目前对于内皮功能紊乱及高血压发生的先后顺序尚无定论[20]。但能肯定的是,持续性的内皮功能紊乱可加速内皮细胞衰老、凋亡,血管平滑肌细胞异常增殖、迁移,以及细胞外基质纤维化、钙化,造成血管重构,是高血压持续发展和靶器官损害的高危因素[21-22]。本实验中发现,胸主动脉的形态学方面,模型组的血管壁厚度、腔壁横截面均较正常对照组明显增加,且HE 染色结果显示,SHR 内膜不光滑,血管壁明显增厚,中膜平滑肌细胞增殖肥大,肌纤维排列紊乱,证实了高血压状态下大血管出现管腔扩大、管壁增厚,中膜平滑肌细胞增殖、结构紊乱及内膜内皮细胞脱落等血管重构特征。经桑芪首乌片及厄贝沙坦片干预后,两组血管形态学指标均下降。而HE 染色同时提示EB 组、SQ 组的内膜较光滑,中膜厚度较模型组明显减少,内皮损伤和血管平滑肌细胞异常增殖不同程度受到抑制,降低了血管重构情况,对血管起到保护作用。结合CECs 指标的变化,推测可能的机制是:桑芪首乌片降低Ang II 水平,从而阻断了炎性因子和氧化应激反应的过度激活对内皮细胞的损伤,保护了血管内皮的完整性,延缓血管重构的进程。
桑芪首乌片中桑寄生、制何首乌为君药,两者性微温而质润,即所谓阴中之阳药,温而不燥,具有滋补肝肾,平调阴阳之功;黄芪、三七、天麻、钩藤共为臣药,具有益气活血、平肝息风之功;白芍、当归、黄柏、浮小麦、炒麦芽共为佐药,行养血和营、清肝肾浮火、健脾行气之效,使得肝肾精血生化有源,气机升降有常。全方合用,达到补阴而潜阳亢,益阳而通脉络,以恢复人体“阴平阳秘”的状态,使得血液运行有常,血压随之得降的目的。现代药理研究显示:桑芪首乌片中多种药物,如黄芪、制何首乌、钩藤、三七等的有效活性成分都能影响血管内皮重构过程,改善血管内皮功能障碍而发挥血管保护效应[23-25]。可见,中医药治疗高血压血管内皮功能障碍具有多靶点、多途径的优势。
综上所述,桑芪首乌片在降血压的同时,能明显降低自发性高血压大鼠CECs 计数,病理组织学提示大血管内皮细胞损伤和血管平滑肌细胞异常增殖不同程度受到抑制,具有保护血管内皮功能及结构完整性的作用。但桑芪首乌片降压效果与内皮功能改善、抑制RAAS 系统以及改善血管重构途径之间的关系尚有待于更深入的研究,如何明确这些靶点和阐明作用机制是今后研究的方向和思路。
