链霉菌3-10发酵液及提取物的稳定性研究
2022-04-22吴明德张静杨龙李国庆
吕 昂,吴明德,张静,杨龙,李国庆*
(1.湖北省农业科学院农业质量标准与检测技术研究所,武汉 430064;2.农产品营养质量与安全湖北省重点实验室,武汉 430064;3.华中农业大学植物科学与技术学院,武汉 430070)
链霉菌Streptomyces是自然界中分布广泛的一类放线菌,目前发现的链霉菌主要来源于土壤,在海洋、空气、植物内部同样也发现了多种链霉菌[1-4]。据统计,现有已知的90%活性物质来源于链霉菌[5]。在农业上,源于链霉菌的杀菌剂有米多霉素、有效霉素、武夷菌素、诺沃霉素等[6-9];杀虫剂有阿维菌素、多杀菌素等[10,11];除草剂有双丙氨磷、Herboxidiene等[12,13]。链霉菌还可以产生一些有益于植物生长的小分子化合物或酶类,如植物生长激素类化合物、几丁质酶、葡聚糖酶等[14-16]。在植物病虫害的生物防治中,主要应用的是链霉菌的活菌剂和发酵液及提取物[17]。目前,成功开发为商品制剂的链霉菌活菌剂有灰绿链霉菌Streptomycesgriseoviridis(Mycostop®)[18]和龟裂链霉菌S.rimosus(Rhizovit®)[19],我国的泾阳链霉菌菌肥5406也被广泛使用[20]。前人研究发现白黄链霉菌S.alboflavusTD-1发酵液可以抑制灰霉病菌的孢子萌发,提高番茄苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)、过氧化物酶(POD)的酶活力,从而促进番茄更好地抵御植物病原真菌[21],唐德链霉菌S.tendaeXJ193发酵液对草莓灰霉病菌、桃褐腐病菌、黄瓜枯萎病菌等多种植物病原真菌具有明显的抑菌活性[22],链霉菌LA-5发酵液对番茄果实灰霉病的防效可达83.4%[23]。
链霉菌3-10属于嗜酸链霉菌类群,链霉菌3-10的发酵液对灰霉病菌、油菜菌核病菌、立枯丝核菌等植物病原真菌具有良好的抑制作用[24],使用菌株 3-10孢子液灌根后可抑制油菜根肿病的发生[25]。同时,研究还发现,菌株3-10抗真菌物质粗提物对多种植物病原真菌有抑制作用,对多种真菌引起的草莓贮藏期腐烂病有防治作用[26]。因此,链霉菌 3-10的代谢产物和活菌均具有开发成为生防产品的潜力。但是,目前对于菌株3-10提取物在环境中的稳定性没有报道。本研究主要通过提取物对灰霉病菌的抑菌活性试验,筛选一种能高效地将无菌发酵液中的抑菌成分提取出来的有机溶剂,研究外界环境(温度、酸碱、紫外线)及提取物所处状态(液态、干粉)对抑菌活性的影响,为实际应用链霉菌3-10及其提取物提供理论依据和数据支持。
1 材料与方法
1.1 供试菌株
菌株:灰霉病菌BotrytiscinereaB05.10和链霉菌菌株Streptomycessp.3-10保存于本实验室。
1.2 培养基及主要试剂和仪器
马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯200 g,葡萄糖20 g,琼脂粉15 g,蒸馏水定容至1000 mL;马铃薯葡萄糖培养液(PDB):去皮马铃薯200 g,葡萄糖20 g,蒸馏水定容至1000 mL;ISP-2培养基:酵母浸膏4 g,麦芽提取物10 g,葡萄糖4 g,琼脂粉15 g,pH调节至6.0左右,蒸馏水定容至1000 mL。上述培养基分装后于121 ℃灭菌20 min,备用。
试剂:乙酸乙酯、正丁醇、三氯甲烷、四氯化碳、石油醚、环己烷、浓盐酸、氢氧化钠均为国药试剂分析纯级(国药集团化学试剂有限公司)。
仪器:R-250 Rotavapor® 旋转蒸发仪(瑞士Büchi),生化培养箱HP400S型(武汉瑞华仪器设备有限责任公司),pH计(型号 Delta 320,德国 Mettler-Toledo),真空冷冻干燥机(北京松源华兴科技发展有限公司)。
1.3 发酵液的制备
将链霉菌3-10划线于ISP-2培养基,28 ℃培养5 d后加适量无菌水用接种环刮洗菌落表面,三层擦镜纸过滤、稀释后得到孢子悬浮液(浓度1×109孢子/mL),将所得到的孢子悬浮液以1%体积比接种到PDB培养液中,在28 ℃、150 r/min振荡培养3 d,得到链霉菌的发酵液。将发酵液以8000 r/min离心10 min,上清液用0.22 μm细菌过滤器过滤,得到无菌发酵液。
1.4 抗真菌物质提取
选取极性不同的正丁醇、乙酸乙酯、三氯甲烷、四氯化碳、石油醚和环己烷作为提取溶剂,从链霉菌3-10发酵液中提取抗真菌物质,通过测定提取物(有机相)和发酵液中残留的抗真菌物质(水相)的生物活性比较不同溶剂的提取效果。具体操作程序:将500 mL无菌发酵液分别与500 mL不同的提取溶剂混合,超声波提取10 min、置于摇床150 r/min振荡培养10 min,静置12 h,使混合液分层,用梨型分液漏斗分液,分别收集提取后的水相和有机相,将提取后的水相置于旋转蒸发仪中,在40 ℃下减压蒸馏,以除去其中残留的有机溶剂。将各溶剂提取后的有机相置于旋转蒸发器中,在40 ℃下减压蒸馏至干燥,用5 mL甲醇溶解,将其作为抗菌物质提取物,用蒸馏水稀释50倍,采用带毒平板法测定抗真菌活性。
乙酸乙酯提取物(Ethyl acetate extract,简称EA提取物)的获得,根据上述1.3的方法大量获得链霉菌3-10的发酵液,获得的发酵液加入等体积的乙酸乙酯后充分混匀、静置、待其分层后取上层乙酸乙酯相,置于旋转蒸发仪40 ℃下减压蒸馏置干燥,称重后一定体积甲醇溶解。
1.5 发酵液和提取物抗菌活性的稳定性测定
将链霉菌3-10发酵液和EA提取物用于本试验。将EA提取物称重、甲醇溶解,再用无菌蒸馏水配制成浓度为200 μg/mL的溶液,用于下列试验。(1)热稳定性试验。将含有链霉菌3-10的发酵液或EA提取物溶液的塑料离心管分别置于40 ℃、60 ℃、80 ℃和100 ℃的水浴锅中,在处理10、30和60 min后分别取出10 mL样品置于冰上冷却,以不经过热处理的发酵液和EA提取物溶液作为对照。(2)酸碱稳定性试验。分别用盐酸溶液(2.0 mol/L)和氢氧化钠溶液(2.0 mol/L)将发酵液和EA提取物溶液的pH值分别调节至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0和 13.0,以未经调节pH值的发酵液和EA提取物溶液为对照,置于4 ℃冰箱中,24 h后取出发酵液和EA提取物溶液,将其pH值调回至6.5(发酵液最终pH值)。(3)紫外线照射试验。取10 mL发酵液和EA提取物溶液至培养皿(直径60 mm),将培养皿开盖置于磁力搅拌器上匀速搅拌,在磁力搅拌器正上方放置1个紫外灯管(UV-C, 30 W),灯管与培养皿中液面之间的垂直距离为15 cm,照射时间为 0(对照)、1、5、10、15、20、25、30、45和60 min。
1.6 EA提取物在不同状态下的贮存稳定性测定
测定EA提取物在液体和干燥状态下贮存抗菌活性的稳定性。液体贮存试验是用无菌蒸馏水和甲醇将EA提取物分别配制成水溶液和甲醇溶液(浓度均为10 μg/mL),分装至塑料管中(2 mL大小,每管1 mL)。干燥状态贮存是将EA提取物冷冻干燥,制备成干粉,取0.1 g干粉,装于塑料管(2 mL)中。将不同处理塑料管分别置于4 ℃、20 ℃、28 ℃和37 ℃下存放,在放置当天(0 d)以及贮存10、30、60和100 d后,取出管中所有的EA提取物干粉或溶液测定抗真菌活性。
1.7 抗菌活性测定
以灰霉病菌菌株 B05.10为靶标菌测定不同有机溶剂提取物和余液及乙酸乙酯提取物抗菌活性。测定方法是带毒平板法,将2 mL发酵液(包括提取后的发酵液水相)或EA提取物(母液浓度:10 μg/mL)与18 mL PDA培养基混合均匀(二者的比例是1:9),以添加PDB的PDA为阴性对照。在不同平板中接种菌株B05.10菌丝琼脂块(直径5 mm),在20 ℃培养3 d,测量各平板中的菌落直径,将含有抗菌物质处理菌落直径与阴性对照中的菌落直径进行比较,计算抑菌百分率。抑菌百分率(%)=(阴性对照菌落直径—处理菌落直径)/阴性对照菌落直径×100[27]。
1.8 数据统计与分析
试验数据采用SPSS 17.0和Excel软件进行统计和分析。
2 结果与分析
2.1 不同有机溶剂的提取效果
使用不同极性的有机溶剂提取链霉菌3-10产生的抗菌物质,筛选最佳提取溶剂。结果表明:乙酸乙酯是最佳提取溶剂,乙酸乙酯提取物(EA提取物)对灰霉病菌菌丝生长的抑制作用最强,抑菌率为 96.6%(图1,2),而乙酸乙酯提取后的余液抑菌率仅为3.7%(图1);正丁醇和三氯甲烷提取效果中等(图1,2);四氯化碳、石油醚和环己烷的提取效果最差(图1,2),该结果表明,链霉菌3-10发酵液中的抗真菌物质能被乙酸乙酯很好地提取出来。
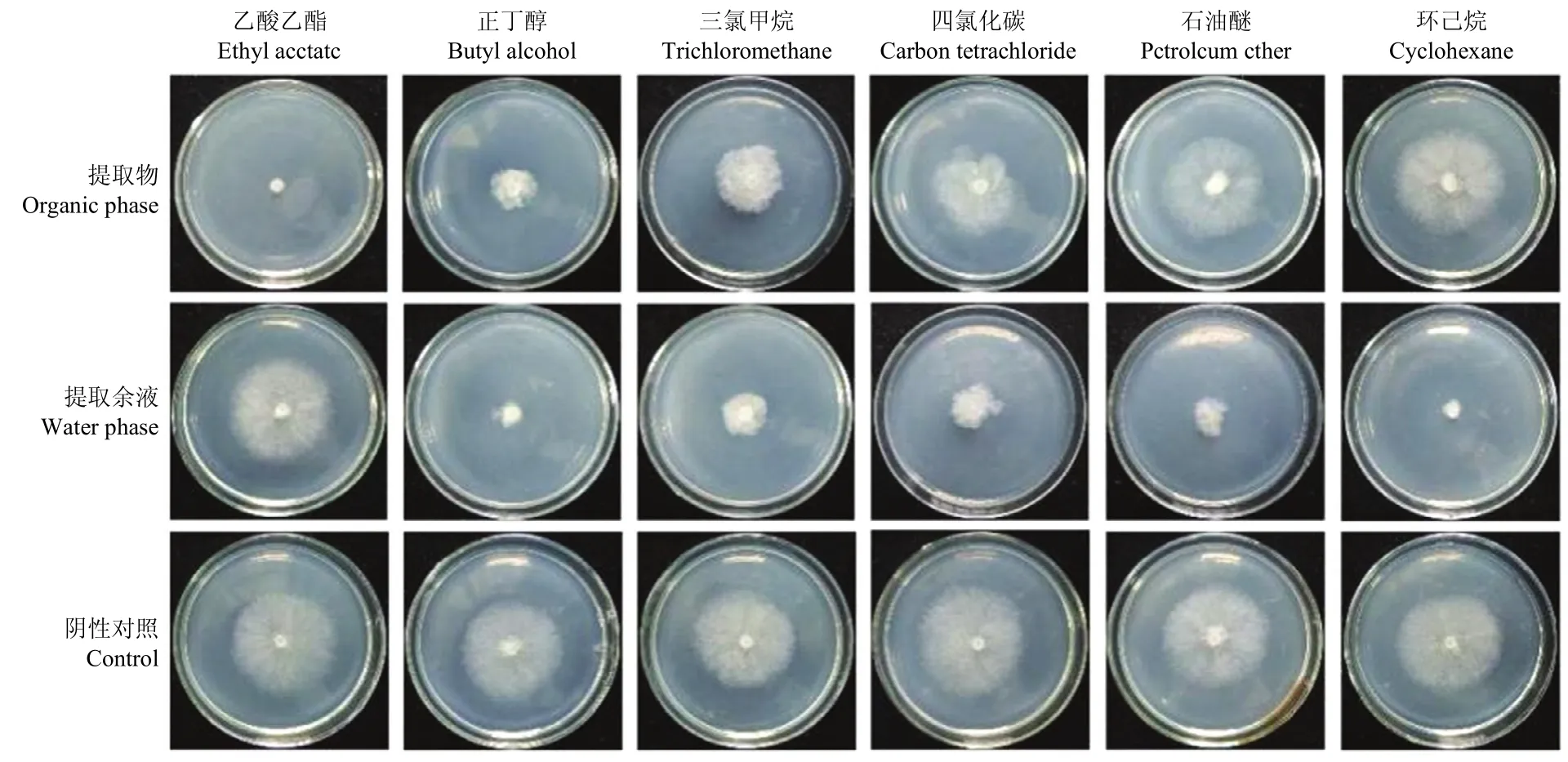
图1 不同有机溶剂提取物对灰霉病菌菌丝生长的抑菌效果Fig.1 Antifungal activity of crude extract and extract residue against mycelial growth of B.cinerea

图2 不同溶剂提取物及余液对灰霉病菌菌丝生长的抑菌率Fig.2 Inhibition rate of crude extract and extract residue against mycelial growth of B.cinerea
2.2 发酵液和提取物中抗菌物质的稳定性
在热稳定性试验中,40 ℃处理至60 min后,菌株3-10发酵液和EA提取物的抑菌率未明显下降。60 ℃处理至60 min,发酵液和EA提取物的抑菌率分别下降至65.3%和55.3%。80 ℃和100 ℃高温处理后抑菌活性显著下降,80 ℃处理10 min发酵液和EA提取物抑菌活性开始下降,处理60 min后发酵液和EA提取物的抑菌率分别下降至49.2%和33.2%;100 ℃处理10 min后发酵液和EA提取物的抑菌率分别下降至57.4%和52.1%,处理至60 min时几乎失去抑菌活性,这说明链霉菌3-10中的抗菌物质对80 ℃以上的高温比较敏感(图3)。

图3 温度对发酵液和提取物抑菌活性的影响Fig.3 Effect of temperature on antifungal activity of the cultural filtrate and crude extract from Streptomyces sp.3-10
在酸碱稳定性试验中,发酵液和EA提取物在pH为2~6的酸性环境中能保持良好的抑菌活性,发酵液和EA提取物在pH 2处理后抑菌活性分别为93.5%和90.3%,在pH 6处理后抑菌活性分别为95.3%和92.1%。pH 8以上的碱性环境会破坏发酵液和EA提取物的生物活性,发酵液和EA提取物在pH为8的条件下处理,抑菌活性开始下降,在pH为13的条件下抑菌率分别下降至47.3%和33.2%,发酵液的抑菌活性下降比提取物的缓慢,这可能是因为发酵液中存在一些缓冲酸碱的物质(图4)。

图4 酸碱度对发酵液和提取物抑菌活性的影响Fig.4 Effect of ambient pH on antifungal activity of the cultural filtrate and crude extract of Streptomyces sp.3-10
在紫外线照射稳定性试验中,发酵液和提取物经过紫外线照射后,抑菌活性显著下降。EA提取物在紫外线照射1 min,抑菌活性下降至83.5%;照射20 min,抑菌率下降至9.7%;发酵液在紫外线照射10 min,抑菌率下降至85.2%;照射60 min,抑菌率仍有43.2%。发酵液经过紫外线照射后抑菌活性下降比提取物缓慢,这可能是因为发酵液中含有糖和一些大分子物质作为保护剂延缓了紫外线对发酵液抑菌活性的影响(图5)。以上结果表明,链霉菌3-10的发酵液及提取物对80 ℃以上的高温、碱性环境和紫外线照射比较敏感。
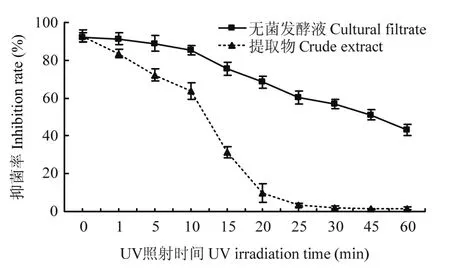
图5 紫外线照射对发酵液和提取物抑菌活性的影响Fig.5 Effect of UV irradiation on antifungal activity of the cultural filtrate and crude extract of Streptomyces sp.3-10
2.3 不同状态下提取物稳定性
提取物在水中时,其稳定性较差,4 ℃条件下贮存超过30 d后,抑菌活性有明显下降,抑菌率下降至83.4%,随着贮存时间的延长,EA提取物的抑菌活性随之下降;到100 d时,抑菌率下降至44.5%;20 ℃时贮存至第30 d时,EA提取物的抑菌率下降至64.5%,100 d时,EA提取物抑菌率下降至39.1%;28 ℃时贮存30 d时,EA提取物的抑菌率仅为21.7%;60 d时无生物活性;EA提取物在37 ℃贮藏10 d时抑菌率下降至11.4%,30 d时无生物活性。EA提取物在水溶液条件下,在低温(4 ℃)下可以贮藏30 d,在室温(20 ℃~28 ℃)时,贮藏不宜超过30 d,不宜处于37 ℃的高温条件下(图6)。
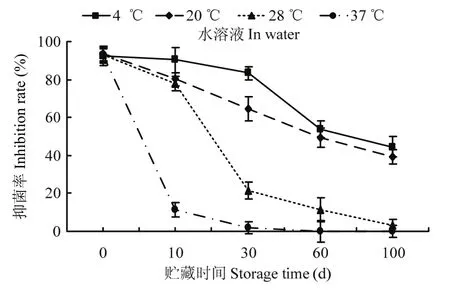
图6 提取物在水中贮存温度和时间对抑菌活性的影响Fig.6 Effect of temperature and storage period on antifungal activity of the crude extract in water solution of Streptomyces sp.3-10
提取物溶解在甲醇中时,其稳定性较好。在4 ℃和20 ℃时,贮存100 d EA提取物抑菌率分别为83.1%和66.2%;在28 ℃和37 ℃时,贮存至第30 d EA提取物抑菌率分别为77.5%和63.7%;随着时间延长至100 d,提取物的抑菌率下降至53.9%和43.7%。EA提取物在甲醇溶解的条件下,贮存在4 ℃时可以保持良好的抑菌活性,在室温(20 ℃~28 ℃)条件下贮存不宜超过100 d,在37 ℃条件贮存不宜超过30 d(图7)。

图7 提取物在甲醇中贮存温度和时间对抑菌活性的影响Fig.7 Effect of temperature and storage period on antifungal activity of the crude extract in methanol solution of Streptomyces sp.3-10
将EA提取物制备成固体粉末时最为稳定,在低温(4 ℃)至室温(20 ℃~28 ℃)条件下可以保持良好的抑菌活性,贮存100 d EA提取物抑菌率分别为90.3%、92.5%和89.5%;在37 ℃条件下,贮存100 d提取物的抑菌率下降至80.2%(图8)。该结果表明,EA提取物在水中的稳定性较差,在甲醇中能在低温条件下可以保持较好的抑菌活性;将提取物冷冻干燥后制备成干粉最有利于提取物的贮存,在低温至室温条件下提取物均能保持良好的抑菌活性。
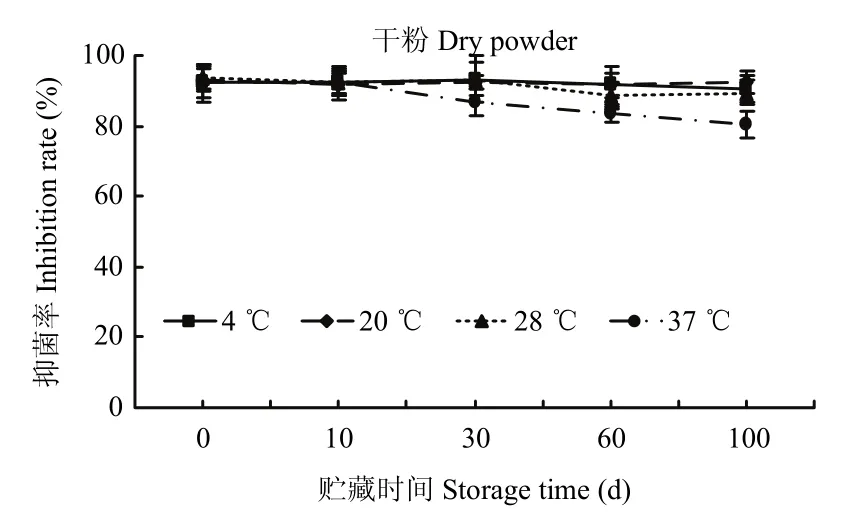
图8 提取物制备成干粉后贮存温度和时间对抑菌活性的影响Fig.8 Effect of temperature and storage period on antifungal activity of the crude extract lyophilized powder of Streptomyces sp.3-10
3 讨论
微生物产生的农用抗生素在使用时进入外界环境后,会受到光照、温度、湿度等自然环境的影响。目前,链霉菌产生发酵液对植物病原真菌的抑制作用和稳定性研究报道较多,但发酵液的提取物稳定性报道相对较少。杨勇等[28]研究了黄麻链霉菌AUH-1发酵液的抑菌活性和稳定性,发酵粗提液在100 ℃处理30 min、经紫外线照射50 min仍有较好的抑菌活性,耐受酸碱。范万泽等[29]报道了娄彻氏链霉菌ZZ-9发酵液在100 ℃高温、长时间(16 h)紫外线照射、强酸(pH=2)和强碱(pH=12)的条件下亦仍能保持较好的抑菌活性。张雨阳等[30]发现黄三素链霉菌15-6的发酵液在80 ℃以上的高温、酸性(pH=1~6)或碱性(pH=8~13)条件下对胶孢炭疽菌的抑菌效果降低。蒋桂芳等[31]报道了拮抗放线菌 F2发酵液的稳定性,在 70 ℃以上的高温会降低发酵液对辣椒炭疽病菌的抑制作用,在环境pH为3~10的条件下、紫外线照射30 min对发酵液的抑菌活性影响不大,室温或4 ℃条件下储藏15 d的发酵液仍能保持较好的抑菌活性。
本研究采用不同极性的有机溶剂对链霉菌3-10发酵液中的抑菌物质进行提取,获得的提取物及提取后余液对灰霉病菌菌丝生长的抑菌活性测定后发现,乙酸乙酯提取物活性最强且提取后余液抑菌活性很弱,说明乙酸乙酯能有效地将无菌发酵液中的抑菌活性物质提取出来,所以选取乙酸乙酯作为提取溶剂。稳定性试验表明,发酵液和提取物对 80 ℃以上的高温比较敏感,在酸性(pH=2~6)条件下发酵液和提取物均能发挥较好的抑菌活性,碱性(pH=8~13)条件会降低二者的抑菌活性,紫外线照射会破坏发酵液和提取物的抑菌活性。提取物贮存条件试验表明,提取物在水中、甲醇中和制备成干粉的3种状态下,在水中可以短期贮存,在甲醇中的贮存时间比在水中长,但这两种状态只能处于低温和室温,高温条件下提取物在水中容易丧失生物活性,提取物制备成干粉后在低温、室温和高温的条件下贮存100 d后均能保持良好的生物活性,比较适合长期贮存。
已有的研究报道了链霉菌3-10的乙酸乙酯提取物可以抑制多种植物病原真菌的菌丝生长和孢子萌发,提取物中具有抑菌活性的主要成分是reveromycin A,但是对于发酵液及EA提取物的稳定性没有报道[26]。Reveromycin A是一种螺环化合物,可以抑制肿瘤细胞增殖、抑制酵母细胞生长[32],reveromycin A在酸性条件下才能保持良好的生物活性[33,34]。在本研究中同样发现经过酸性处理后的发酵液和EA提取物都能保持较好的抑菌活性,经过碱性处理后抑菌活性有所下降,这可能是因为碱性破坏了reveromycin A的分子结构而导致抑菌活性降低。在reveromycin A的分子中存在多个碳碳双键结构,容易受到紫外光激发从而改变其分子状态,这可能是提取物受到紫外线照射后抑菌活性迅速下降的原因。
本研究以灰霉菌为生物活性测定的指示菌,测定了链霉菌3-10发酵液和EA提取物在不同的温度、酸碱度、紫外线照射和不同存在状态下的活性保持能力,为链霉菌3-10的田间应用提供了指导信息。此外,本研究中链霉菌3-10发酵液和EA提取物的稳定性试验均为对植物病原真菌生长的室内测定,而在田间环境中的生物活性测定需要进一步研究和验证。
