酶解水蛭地龙混合药渣的工艺研究及其产物的抗凝活性评价
2022-04-21李淑楠金慧倪开岭于洋李正王娜
李淑楠 ,金慧 ,倪开岭 ,于洋 ,李正 ,王娜
(1.天津中医药大学,天津 301617;2.牡丹江友搏药业有限责任公司,牡丹江 157000)
地龙和水蛭中因含有抗凝活性的化学物质而广泛用于预防高危性心血管疾病和治疗多种栓塞及血栓[1-2]。在相关中成药的生产过程中,往往是通过溶剂提取法、酶解法等技术对地龙和水蛭的活性物质进行提取[3],再加工成不同剂型。这些方法普遍存在提取率低的问题[4],使得地龙和水蛭的药渣中尚含有未被充分提取的活性物质、大量粗蛋白、少量粗多糖等营养成分,以及多种氨基酸和微量元素等[5]。在实际生产过程中,对地龙和水蛭药渣的处理主要采取直接填埋或堆肥的方法。这不仅会造成资源浪费,还会因动物药渣的腐败而影响环境[6]。采用适当方法,对地龙和水蛭药渣进行再次开发,不仅可以实现资源的充分利用,还能降低药渣对环境的影响,提高药厂的经济效益,具有重要的研究价值。
1 仪器与材料
1.1 仪器 CP1003电子天平、AB135-S电子天平、AL204电子天平(梅特勒-托利多仪器有限公司);FE20实验室pH计(梅特勒-托利多仪器有限公司);ZWF-200恒温培养振荡器(上海智城分析仪器制造有限公司);CL-2型恒温加热磁力搅拌器、DF-101S集热式恒温磁力搅拌器(巩义予华仪器有限责任公司);DK-98-II电热恒温水浴锅(天津市泰斯特仪器有限公司);ZRD-7080全自动新型鼓风干燥箱(上海智城分析仪器制造有限公司);LD-4台式离心机(常州天瑞仪器有限公司);移液枪(德国艾本德股份有限公司);DZF-6021真空干燥箱(上海一恒科学仪器有限公司)。
1.2 材料 经粉碎的水蛭地龙混合药渣(某中药厂提供);0.9%氯化钠溶液(河北应天成药业股份有限公司);酸性蛋白酶(泰安信得利生物工程有限公司);风味酶、中性蛋白酶购于襄阳新叶生物科技有限公司;碱性蛋白酶(24万U/g 50 g)、木瓜蛋白酶(60万U/g 20 g)、复配蛋白酶购于南宁东恒华道生物科技有限责任公司;胃蛋白酶(1∶3000)、胰蛋白酶(1∶250)、凝血酶(1 000 units/0.85 mg solid)购于北京索莱宝科技有限公司;纤维蛋白原、凝血酶购于索莱宝生物科技有限公司;PBS磷酸盐缓冲液、琼脂粉购于天津索罗门生物科技有限公司);其他试剂均为分析纯。
2 实验方法
2.1 酶解水蛭地龙混合药渣 本实验采用胃蛋白酶、酸性蛋白酶、风味酶、中性蛋白酶、木瓜蛋白酶、复配蛋白酶、胰蛋白酶、碱性蛋白酶解水蛭地龙混合药渣,分别在厂家给出的最佳工艺条件下进行。
2.1.1 样品制备方法 称取5 g药渣,加入不同种类蛋白酶,于70 mL生理盐水中混合均匀,在恒温振荡培养器中进行反应,实验条件见表1。其中,酶底比为反应过程中酶的质量用量与药渣的质量之比。待反应结束,离心,取上清液,于4℃保存备用。

表1 酶种类筛选实验条件Tab.1 Experimental conditions for screening enzyme species
对每种酶设置药渣对照组(药渣+生理盐水)及酶对照组(酶+生理盐水),反应条件分别与样品组保持一致。设置药渣对照组以消除药渣自身含有的抗凝活性成分对酶解效果的影响,设置蛋白酶对照组以消除蛋白酶对抗凝活性测试的影响。
2.2 水解产物体外抗凝活性对比
2.2.1 凝血酶滴定法 0.5%纤维蛋白原溶液的配制:精密称取0.015 g纤维蛋白原,加入3 mL PBS缓冲液,37℃水浴溶解。现用现配。
凝血酶溶液的配制:以PBS缓冲液为溶剂,将1 000 U/0.85 mg凝血酶溶解并定容至100 mL,配制成浓度为10 U/mL凝血酶溶液。4℃冷藏保存备用。
参照 2015版《中国药典》操作方法[7],取 100 μL 2.1.1项下制备的各溶液,加入200 μL 0.5%纤维蛋白原溶液,37℃温育2 min。每隔4 min滴加2 μL 10 U/mL凝血酶溶液,直至凝固,以倒立时无液滴流下为标准。记录滴加次数。滴加次数越多,说明使溶液凝固所需的凝血酶越多,即溶液的抗凝效果越好。
2.2.2 纤维蛋白原平板溶圈法 2.5%琼脂溶液的配制:称取0.825 g琼脂粉,加入33 mL PBS缓冲液,电热套加热至溶液澄清透明,即为溶解。
将纤维蛋白原平板法[8]稍加改进,采用双层板结构。取经消毒的φ15 cm培养皿,趁热加入33 mL 2.5%琼脂溶液作为下层板,静置10 min,待其凝固。配制36 mL 0.5%纤维蛋白原溶液(方法参照2.2.1项下),取10 U/ml凝血酶溶液4 mL,温育至37℃,随后加入到纤维蛋白原溶液中,快速混匀,倒入培养皿中作为上层板,静置30 min,待其凝固成板。将0.9%氯化钠溶液、各酶酶解液及其平行对照溶液取5 μL进行点样,间距大于2 cm,放入恒温培养箱中,37℃温育6 h,记录直径大小并计算纤溶面积。其中,△S表示每个样品组的面积减去对应酶对照组和药渣对照组的面积。纤溶面积越大,说明溶解的纤维蛋白原越多,即溶液的抗凝效果越好。见表2。
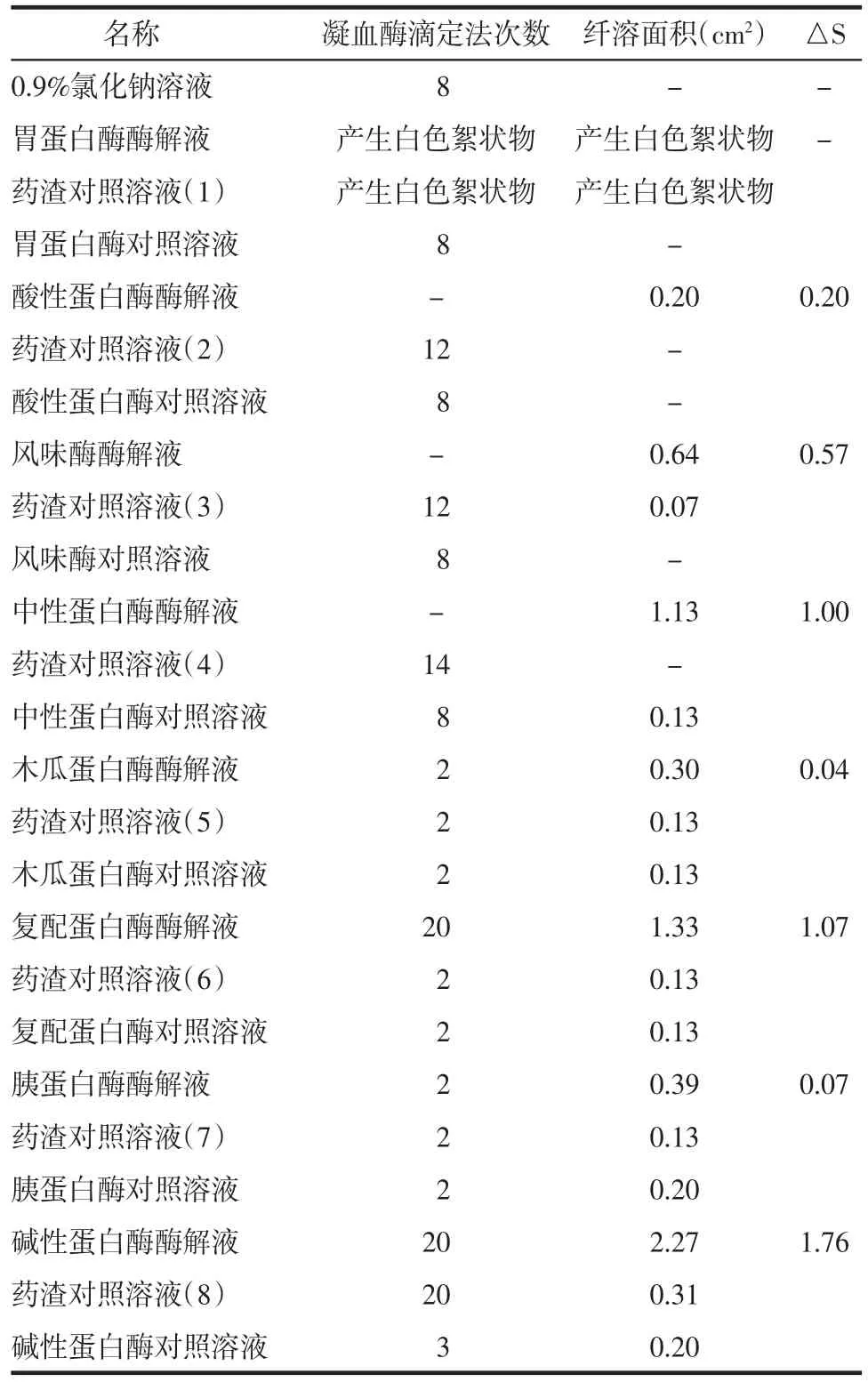
表2 不同酶水解水蛭地龙混合药渣产物抗凝活性对比Tab.2 Comparison of anticoagulant activity of hirudo and pheretima residue hydrolyzed by different enzymes
2.3 结果 通过表中数据可以发现,0.9%氯化钠溶液进行8次凝血酶滴定后产生凝固现象,而溶圈法中没有溶圈出现,在结果分析过程中需要将两种抗凝实验的结果综合进行分析。同时,以0.9%氯化钠溶液的实验结果为参照,采用凝血酶滴定法8次以内出现凝固现象的视为无抗凝活性。
在弱酸性环境中,采用酸性蛋白酶、风味酶和中性蛋白酶对混合药渣进行酶解后,凝血酶滴定法显示两种酶解液均未发生凝固,而药渣对照组和酶对照组分别在12次左右和8次后发生凝固。结合溶圈法的△S值分析,可以发现,纤溶面积由小到大依次为:酸性蛋白酶<风味酶<中性蛋白酶,即进行酶解后混合药渣溶液中含有抗凝活性成分,且中性蛋白酶的酶解效果更好。
在碱性环境中,采用木瓜蛋白酶、复配蛋白酶、胰蛋白酶和碱性蛋白酶对混合药渣进行酶解。结合凝血酶滴定法和溶圈法分析可发现,木瓜蛋白酶和胰蛋白酶酶解后,溶液的抗凝活性没有明显提高,酶解效果较差。复配蛋白酶和碱性蛋白酶的滴定次数和纤溶面积都远大于药渣对照组和蛋白酶对照组,这说明酶解液比药渣和酶对照组表现出更强的抗凝活性。
综合以上数据分析,将△S值进行对比可以发现碱性蛋白酶酶解的效果最好。在碱性环境中蛋白酶对水蛭和地龙混合药渣的酶解效果远好于在酸性环境中蛋白酶的酶解效果,且碱性越强,酶解液的抗凝活性越强,具体原因尚需要进一步研究分析。通过以上实验可以确定碱性蛋白酶为酶解水蛭地龙混合药渣最佳酶,并进一步考察其酶解水蛭地龙混合药渣的工艺条件。
2.4 碱性蛋白酶酶解水蛭地龙混合药渣工艺优化 考察工艺条件:溶液pH值、酶底比、酶解时间和酶解温度,采用纤维蛋白原平板溶圈法评价酶解产物的抗凝活性。
2.4.1 样品制备方法 称取5 g药渣,加入一定量碱性蛋白酶,于70 mL生理盐水中混合均匀,在恒温振荡培养器中进行反应,实验条件见表3。待反应结束,离心,取上清液,于4℃保存备用。
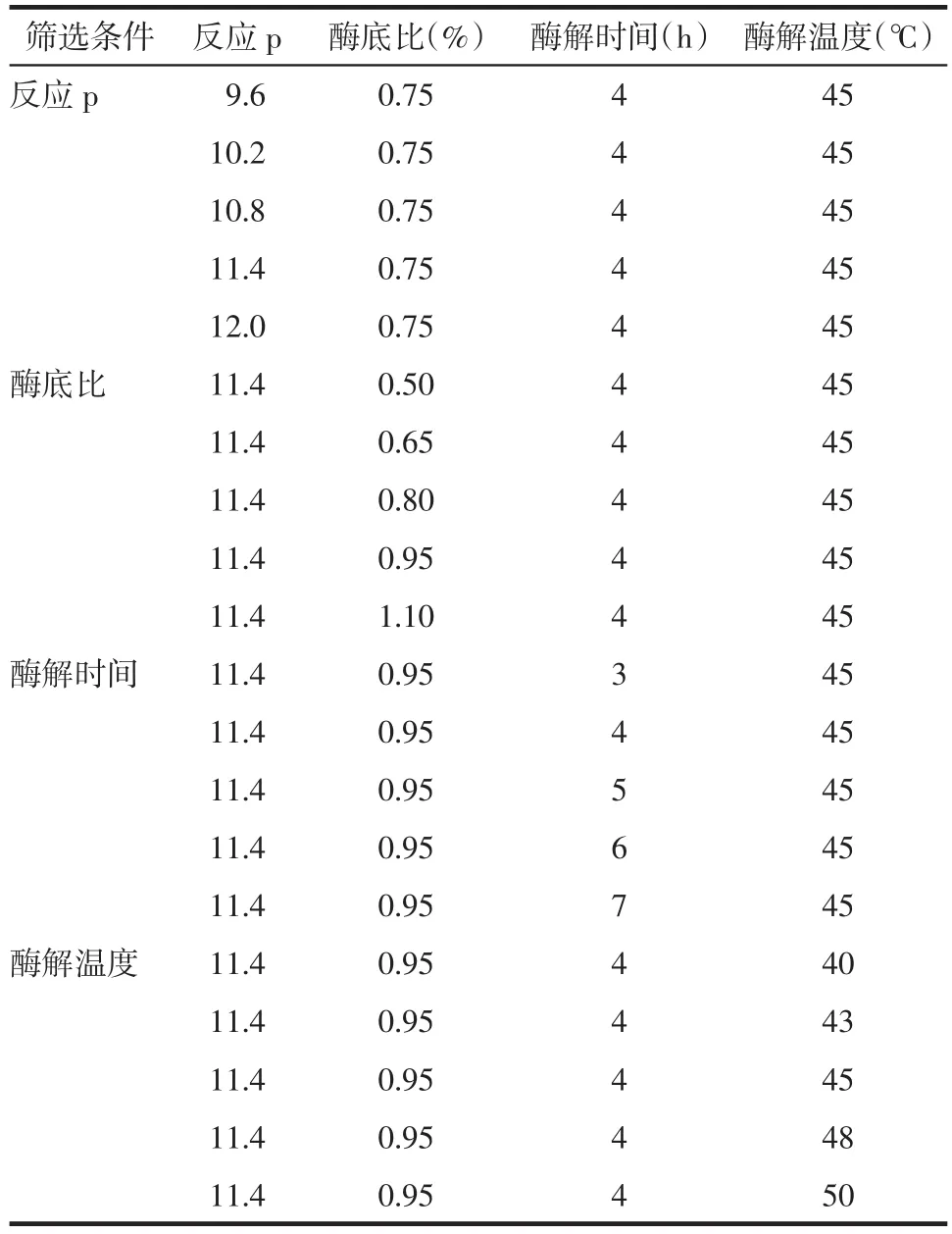
表3 单因素实验优化碱性蛋白酶水解水蛭地龙混合药渣反应条件设计表Tab.3 Optimization of reaction conditions for hydrolysis of hirudo and pheretima residue by alkaline protease by single factor experiment
设置药渣对照组(药渣+生理盐水)及酶对照组(酶+生理盐水),反应条件分别与样品组保持一致。
2.4.2 产物体外抗凝活性对比 采用纤维蛋白原平板溶圈法对酶解产物进行抗凝活性评价,以纤溶面积为评价指标。纤维蛋白原平板制作方法参照2.2.2。
取5 μL 0.9%氯化钠溶液、不同梯度条件下的酶解液及其平行对照溶液进行点样,间距大于2 cm,放入恒温培养箱中,37℃温育6 h,记录直径大小,计算纤溶面积。
3 实验结果
3.1 溶液pH值 根据碱性蛋白酶厂家提供的最优实验条件,确定溶液pH值的考察范围是9.6~12.0,每隔0.6设置一个梯度。在酶底比0.75%、酶解时间4 h、酶解温度45℃的条件下,考察pH值对酶解液抗凝活性的影响,样品液、酶对照组和药渣对照组的纤溶面积如图1所示。从图中可以看出,随着pH值的增大,样品组和酶对照组的纤溶面积呈现先降低后升高的过程。而药渣对照组的纤溶面积随着pH值的增大而逐步减小。从图中可以发现,随着pH值的升高,△S值出现先升高再降低的趋势。当pH值为11.4时,△S值最大为1.60 cm2,即碱性蛋白酶酶解水蛭地龙混合药渣的最佳pH值为11.4。
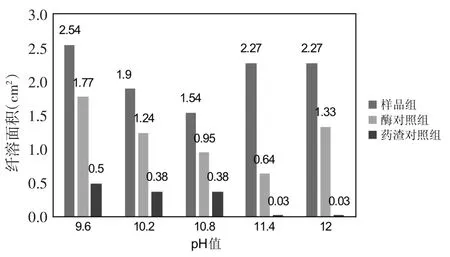
图1 不同pH值下各溶液的纤溶面积Fig.1 The fibrinolysis area of each solution at different pH values
3.2 酶底比 在pH值11.4、酶解时间4 h、酶解温度45℃的条件下,考察酶底比对酶解纤溶面积液抗凝活性的影响。从图2中可以看出,酶解液和酶对照组的纤溶面积随着酶底比的增加呈现先升高后降低的趋势,当酶底比为0.95%时,纤溶面积达到最大,即溶液的抗凝活性最强。因此,选择0.95%最为最佳的酶底比。
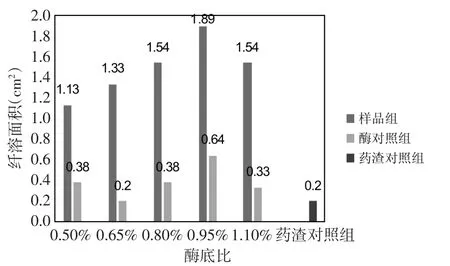
图2 不同酶底比下各溶液的纤溶面积Fig.2 The fibrinolysis area of each solution under different enzyme substrate ratio
3.3 酶解时间 在pH值11.4、酶底比0.95%、酶解温度45℃的条件下,考察酶解时间对酶解液抗凝活性的影响。结果见图3。随着酶解时间的延长,酶对照组和药渣对照组的纤溶面积变化不大;而样品组的纤溶面积出现了先升高后降低的趋势,但变化范围不大。这说明酶解时间对反应液抗凝活性的影响较小。当酶解时间为4 h时,酶解液的纤溶面积最大,对应的△S值也最大,如表4所示。因此确定4 h为最佳酶解时间。
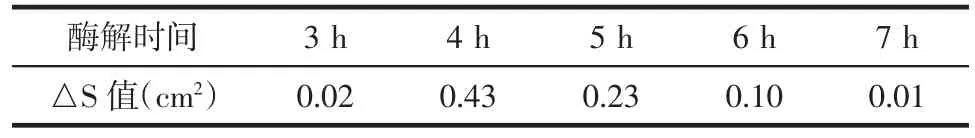
表4 不同酶解时间下的△S值Tab.4 The△S value under different enzymolysis time
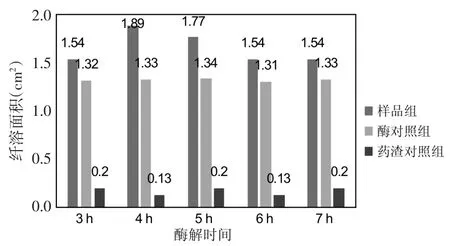
图3 不同酶解时间下各溶液的纤溶面积Fig.3 The fibrinolysis area of each solution under different enzymolysis time
3.4 酶解温度 在pH值11.4、酶底比0.95%、酶解时间4 h的条件下,考察酶解温度对酶解液抗凝活性的影响。从图4中可以看出,随着酶解温度的变化,样品组的纤溶面积出现先升高后降低的趋势,但整体的变化范围不大;药渣对照组的纤溶面积基本没有变化,也就是说温度对药渣的影响不大;酶对照组的纤溶面积出现逐渐降低的趋势。各酶解温度下的△S值列于表5。从表中可以看出,酶解温度从40℃升高到43℃后,△S值明显增加;此后,随着温度的进一步上升,△S值的升高趋于缓和。当酶解温度为45℃时,△S值达到最大,即抗凝活性最强。因此确定45℃为最佳酶解温度。
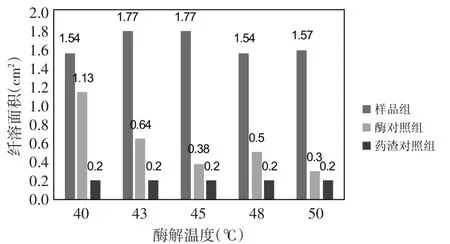
图4 不同酶解温度下各溶液的纤溶面积Fig.4 The fibrinolysis area of each solution at different enzymolysis temperature
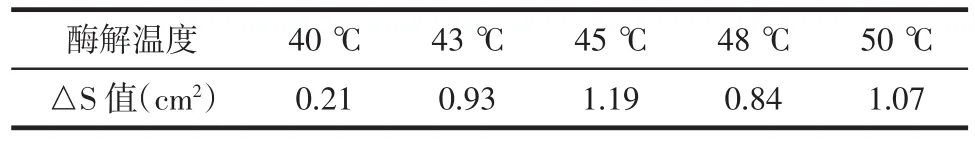
表5 不同酶解温度下的△S值Tab.5 The△S values at different enzymolysis temperatures
4 讨论与结论
4.1 不同种类蛋白酶对水解液抗凝活性影响的原因分析 采用不同的蛋白酶对其进行酶解,主要的不同之处在于溶液的pH值。随着溶液pH值的增加,混合药渣酶解液的抗凝效果逐渐增强。在强酸溶液中进行酶解时,酶解液和药渣对照组均出现了白色絮状沉淀。究其原因,可能是由于水蛭地龙混合药渣在强酸性环境中发生反应,生成的物质导致纤维蛋白原溶解性降低从而析出,或者生成的物质与纤维蛋白原发生反应。具体原因待进一步研究和分析。
4.2 碱性蛋白酶酶解混合药渣工艺条件考察 采用单因素法考察碱性蛋白酶对混合药渣酶解的工艺条件,得到抗凝活性最强的工艺条件为:酶底比0.95%、pH 11.4、酶解温度45℃、酶解时间4 h。在考察过程中发现,酶解液的抗凝活性随着溶液pH值和酶底比的改变而有较大的变化,而随着酶解时间和酶解温度的变化改变较小。这说明,4个酶解条件中溶液的pH值和酶底比对酶解液的抗凝活性影响最大。
4.3 水蛭地龙混合药渣的再利用展望 水蛭地龙混合药渣中主要含有大量蛋白质、少量多糖和淀粉等营养成分,以及多种氨基酸和微量元素等。除了采用酶解的方法得到抗凝活性物质外,还可针对不同的物质设计不同的再利用方式,提高药渣废弃物的再利用效率,提高企业经济效益的同时,实现资源的节约利用和环境的保护。
