甘遂中的新三萜及其抗氧化活性
2022-04-19王嘉霖王铖博孟宪华杨军丽
马 丽,王嘉霖,柴 甜,王铖博,孟宪华,杨军丽*
•化学成分 •
甘遂中的新三萜及其抗氧化活性
马 丽1, 2,王嘉霖3,柴 甜1,王铖博1,孟宪华1,杨军丽1*
1. 中国科学院兰州化学物理研究所,中国科学院西北特色植物资源化学重点实验室,甘肃省天然药物重点实验室,甘肃 兰州 730000 2. 中国科学院大学,北京 100049 3. 西北民族大学,甘肃 兰州 730030
对甘遂块根中的三萜化学成分和抗氧化活性进行研究。采用多种柱色谱法进行分离纯化,并运用谱学分析鉴定化合物的结构。通过CCK-8法,对分离的化合物在SH-SY5Y细胞中的抗氧化活性进行了筛选。从甘遂块根甲醇提取物中分离鉴定出5个三萜,其中包括3个大戟烷型,分别为大戟-8,24-二烯-3β-醇-7,11-二酮(1)、(24)-大戟-8,25-二烯-3β,24-二醇(2)、大戟二烯醇(3);2个羊毛脂烷型三萜,3β,11β-二羟基羊毛脂-8,24-二烯-7-酮(4)、3β,7β-二羟基羊毛脂-8,24-二烯-11-酮(5)。化合物5为新化合物,为羊毛脂烷型三萜,命名为甘遂羊毛脂酮A;化合物1和4为首次从该植物中分离得到;化合物2和5在SH-SY5Y细胞中具有一定的抗氧化能力和潜在的神经保护活性。
甘遂;三萜;大戟烷型三萜;羊毛脂烷型三萜;甘遂羊毛脂酮A;大戟二烯醇;抗氧化活性;神经保护活性
甘遂是大戟科大戟属植物甘遂S.L.Liou ex S.B.Ho的干燥块根,是我国特有的植物,主要分布在甘肃、河南、山西、陕西和青海等地。甘遂干燥的块根为其主要入药部分,广泛地被用于治疗各种疾病,如癌症、水肿、腹水和哮喘[1-3]。目前,从甘遂中分离得到的化学成分为三萜、二萜和甾醇类化合物,其他成分包括香豆素、脂肪酸、蔗糖、鞣质和树脂等[4-7]。其中,二萜和三萜类是甘遂的主要化学成分,具有广泛的药理活性,如抗病毒、抗炎、抗肿瘤等活性[8-13]。通过对甘遂甲醇提取物进一步分离纯化,共分离出5个三萜类化合物(图1),甘遂-8,24-二烯-3β-醇-7,11-二酮(eupha-8,24-diene-3β-ol-7,11-dione,1)、(24)-甘遂- 8,25-二烯-3β,24-二醇 [(24)-eupha-8,25-diene-3β, 24-diol,2]、大戟二烯醇(euphol,3)、3β,11β-二羟基羊毛脂-8,24-二烯-7-酮(3β,11β-dihydroxy- lanosta-8,24-dien-7-one,4)、3β,7β-二羟基羊毛脂- 8,24-二烯-11-酮(3β,7β-dihydroxylanosta-8,24-dien- 11-one,5)。化合物1~3为大戟烷型三萜,化合物4和5为羊毛脂烷型三萜,其中化合物5为新化合物,命名为甘遂羊毛脂酮A(euphokansuione A)。化合物1和4为首次从该植物中分离得到。对化合物的抗氧化活性进行了筛选,发现化合物2和5在SH-SY5Y细胞中具有一定的抗氧化能力和潜在神经保护活性。

图1 化合物1~5的化学结构
1 仪器与材料
Bruker Avance III 400核磁共振波谱仪(美国Bruker公司);Bruker microTOF-Q II质谱仪(美国Bruker公司);IFS120HR 670 FT-IR(德国布鲁克公司);UV-vis spectrophotometer(美国珀金埃尔默公司)。反相色谱Lichroprep RP18(40~63 μm,美国Merck公司)。薄层硅胶板和柱色谱用正相硅胶(200~300目)均为青岛海洋化工厂生产。制备型HPLC C18色谱柱(250 mm×10 mm,10 μm)、ODS-2色谱柱(250 mm×20 mm,10 μm)(中国汉邦公司)。
药材2017年从兰州黄河药材市场购买,经中国科学院兰州化学物理研究所戚阳欢副研究员鉴定为甘遂S.L.Liou ex S.B.Ho的块根,植物样本(GS-HHTS-201701)存放在中国科学院西北植物资源化学重点实验室。
2 提取与分离
将甘遂的干燥块根粉碎并用甲醇在室温下浸泡3次,每次7 d,共提取3次。合并提取液,减压浓缩干燥,得到总浸膏(1031 g)。然后,将其分散在水中,依次用石油醚、醋酸乙酯和正丁醇进行萃取,每相萃取3次。合并萃取液蒸干溶剂后,得到石油醚萃取物(354.4 g),用等量硅胶拌样,干法装柱,以石油醚-丙酮(10∶1~0∶1)梯度洗脱,薄层色谱进行检测,合并相同组分,共得到11个组分(Fr. 1~11)。
Fr. 4(9.1 g)用反相C18柱色谱,甲醇-水(50%~100%)洗脱,得到6个亚组分(Fr. 4a~4f)。通过反相制备HPLC(90%甲醇-水)进一步分离和纯化Fr. 4a(158.1 mg),得到化合物1(11.7 mg,R=22.8 min)和2(5.9 mg,R=25.4 min)。通过反相制备HPLC(88%甲醇-水)纯化Fr. 4e(148.6 mg),得到化合物3(5.1 mg,R=35.1 min)。
Fr. 6(13.5 g)用反相C18柱色谱,用甲醇-水(50%~100%)洗脱;然后用正相硅胶柱色谱,以石油醚-丙酮(10∶1~0∶1)梯度洗脱进行纯化,得到化合物4(10.3 mg)和5(5.5 mg)。
3 结构鉴定
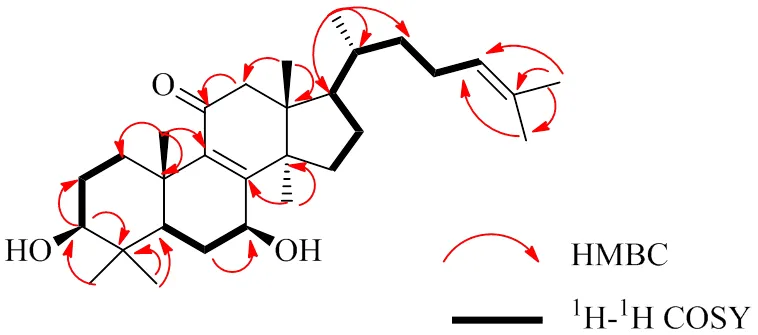
化合物5:无色胶状物,HR-ESI-MS准分子离子/495.340 4 [M+K]+(计算值C30H48O3K,495.340 6),表明分子式为C30H48O3,存在7个不饱和度。(nm): 254 (3.38);(cm−1): 3439, 2968, 2931, 1670, 1458, 1378, 1185。3439和1670 cm−1处的强红外吸收表明存在羟基和羰基。254 nm处的紫外吸收是共轭羰基的特征峰。1H-和13C-NMR数据见表1,化合物5的13C-NMR数据显示共有30个碳信号,1H-NMR谱中显示化合物5中含有2个羟基,4.27 (1H, brs, H-7), 3.32 (1H, dd,= 11.2, 5.6 Hz, H-3), 4.27 (1H, brs, H-7) 和1个不饱和双键5.07 (1H, d,= 6.4 Hz, H-24)。通过谱学数据对比,发现化合物5与已知化合物3β,7α-二羟基羊毛脂-8,24-二烯-11-酮的分子结构相似[5],仅在C-7处的羟基构型不同,化合物5中C-7处的羟基的相对构型被指定为β取向,在NOE谱图中H-3和H3-28与H-7和H3-30的相关性(图2)可进一步证明。故化合物1的结构鉴定为3β,7β-二羟基羊毛脂-8,24-二烯-11-酮,经Sci-Finder检索,为1个新化合物,命名为甘遂羊毛脂酮A。
表1 化合物5的核磁共振数据(400/100 MHz, CDCl3)
Table 1 1H- and 13C-NMR spectral data of compound 5 (400/100 MHz,CDCl3)
碳位δHδC 1α1.01 (m)33.9 1β2.55 (m) 21.69 (m)28.1 33.32 (dd, J = 11.2, 5.6 Hz)78.8 4 38.6 51.41 (m)45.6 61.80 (m)28.6 74.27 (brs)65.6 8 157.3 9 141.6 10 38.5 11 200.4 12α2.56 (d, J = 17.2 Hz)51.8 12β2.37 (d, J = 17.2 Hz) 13 51.1 14 44.3 15α1.36 (m)29.7 15β1.24 (m) 16α2.02 (m)27.9 16β1.40 (m) 171.72 (m)50.9 180.92 (s)18.3 191.17 (s)18.1 201.43 (m)36.0 210.88 (d, J = 6.4 Hz)18.6 220.95, 1.44 (m)35.3 231.86, 2.04 (m)25.3 245.07 (d, J = 6.4 Hz)124.8 25 131.4 261.67 (s)25.9 271.60 (s)17.8 281.05 (s)28.3 290.85 (s)16.2 301.01 (s)26.0
化合物1:黄色胶状物。1H-NMR (400 MHz, CDCl3): 0.91 (3H, s, H-18), 1.02 (3H, s, H-29), 1.07 (3H, s, H-30), 0.87 (3H, d,= 6.6 Hz, H-21), 0.90 (3H, s, H-28), 1.30 (3H, s, H-19), 1.68 (3H, s, H-26), 1.60 (3H, s, H-27), 3.29 (1H, dd,= 10.5, 5.8 Hz, H-3), 5.07 (1H, m, H-24);13C-NMR (100 MHz, CDCl3): 34.0 (C-1), 27.6 (C-2), 78.1 (C-3), 38.7 (C-4), 48.6 (C-5), 35.8 (C-6), 200.1 (C-7), 149.9 (C-8), l54.9 (C 9), 38.2(C-10), 202.2 (C-11), 51.7 (C-12), 45.2(C-13), 48.0 (C-14), 31.9 (C-15), 28.3 (C-16), 49.5 (C-17), 18.5 (C-18), l7.9 (C-19), 35.9 (C-20), 18.6 (C-21), 35.3 (C-22), 25.2 (C-23), 124.7 (C-24), l31.5 (C-25), 25.9 (C-26), 17.8 (C-27), 15.2 (C-28), 27.7 (C-29), 24.2 (C-30)。以上波谱数据与文献报道一致[14-15],故鉴定化合物1为甘遂-8,24-二烯-3β-醇-7,11-二酮。
化合物2:白色无定形粉末。1H-NMR (400 MHz, CDCl3): 4.92, 4.83 (2H, brs, H-26), 4.01 (1H, t,= 6.1 Hz, H-24), 3.23 (1H, dd,= 4.5, 11.7 Hz, H-3), 1.72 (3H, brs, H-27), 0.99 (3H, s, H-19), 0.94 (3H, s, H-28), 0.86 (3H, s, H-30), 0.85 (3H, d,= 6.2 Hz, H-21), 0.79 (3H, s, H-29), 0.75 (3H, s, H-18);13C-NMR (100 MHz, CDCl3): 35.3 (C-1), 27.9 (C-2), 79.0 (C-3), 38.9 (C-4), 51.0 (C-5), 18.9 (C-6), 27.7 (C-7), 134.0 (C-8), 133.5 (C-9), 37.3 (C-10), 21.5 (C-11), 30.9 (C-12), 44.1 (C-13), 50.0 (C-14), 31.1 (C-15), 28.0 (C-16), 49.7 (C-17), 15.7 (C-18), 20.1 (C-19), 36.0 (C-20), 19.0 (C-21), 37.3 (C-22), 31.6 (C-23), 76.6 (C-24), 147.6 (C-25), 111.1 (C-26), 17.4 (C-27), 28.0 (C-28), 15.5 (C-29), 24.5 (C-30)。以上波谱数据与文献报道一致[6],故鉴定化合物2为(24)-甘遂-8,25-二烯-3β,24-二醇。
化合物3:白色无定形粉末;1H-NMR (400 MHz, CDCl3):0.75 (3H, s, H-18), 0.79 (3H, s, H-29), 0.84 (3H, s, H-30), 0.86 (3H, d,= 6.4 Hz, H-21), 0.95 (3H, s, H-28), 1.00 (3H, s, H-19), 1.60 (3H, s, H-26), 1.66 (3H, s, H-27), 3.21 (1H, dd,= 11.5, 4.5 Hz, H-3), 5.08 (1H, t,= 7.0 Hz, H-24);13C-NMR (100 MHz, CDCl3): 35.7 (C-1), 24.3 (C-2), 79.1 (C-3), 39.0 (C-4), 50.6 (C-5), 18.4 (C-6), 27.9 (C-7), 134.6 (C-8), l33.5 (C-9), 36.3 (C-10), 21.1 (C-11), 28.2 (C-12), 44.7(C-13), 49.9 (C-14), 30.9 (C-15), 31.2 (C-16), 50.6 (C-17), 15.8 (C-18), l9.2 (C-19), 36.4 (C-20), 18.7 (C-21), 35.6 (C-22), 25.0 (C-23), 125.3 (C-24), l31.0 (C-25), 17.6 (C-26), 25.6 (C-27), 26.6 (C-28), 28.0 (C-29), 15.4 (C-30)。以上波谱数据与文献报道一致[6],故鉴定化合物3为大戟二烯醇。
化合物4:无色胶状物;1H-NMR (400 MHz, CDCl3): 0.71 (3H, s, H-18), 0.91 (3H, s, H-29), 1.14 (3H, s, H-30), 0.87 (3H, d,= 6.4 Hz, H-21), 0.99 (3H, s, H-28), 1.26 (3H, s, H-19), 1.68 (3H, s, H-26), 1.61 (3H, s, H-27), 3.32 (1H, dd,= 11.2, 5.6 Hz, H-3), 4.70 (1H, t,= 7.2 Hz, H-11), 5.09 (1H, t,= 7.2 Hz, H-24);13C-NMR (100 MHz, CDCl3): 33.8 (C-1), 28.0 (C-2), 78.4 (C-3), 39.2 (C-4), 49.4 (C-5), 36.0 (C-6), 200.2 (C-7), 140.6 (C-8), l61.3 (C-9), 39.7 (C-10), 68.3 (C-11), 43.0 (C-12), 48.2 (C-13), 46.3 (C-14), 32.0 (C-15), 27.5 (C-16), 48.8 (C-17), 16.4 (C-18), l9.8 (C-19), 35.9 (C-20), 18.9 (C-21), 35.9 (C-22), 25.0 (C-23), 125.0 (C-24), l31.3 (C-25), 25.9 (C-26), 17.9 (C-27), 27.7 (C-28), 15.3(C-29), 25.9 (C-30)。以上波谱数据与文献报道一致[5],故鉴定化合物4为3β,11β-二羟基羊毛脂- 8,24-二烯-7-酮。
4 生物活性研究
对分离出的化合物进行抗氧化活性筛选。首先,利用SH-SY5Y细胞建立氧化损伤模型[16],筛选化合物的抗氧化活性。通过初步筛选,发现化合物2和5在一定程度上具有保护SH-SY5Y细胞免受氧化损伤的活性,化合物2与模型组(H2O2)相比有显著差异(图3)。然后,通过对化合物2和5(图4)的进一步抗氧化研究,发现化合物2和5在1、5、10 μmol/L浓度下与模型组的抗氧化活性存在显著差异。它可以显著增强SH-SY5Y细胞对氧化损伤的耐受性,表明化合物2和5具有一定的抗氧化能力和潜在的神经保护活性。

与模型组比较,*P<0.05

与模型组比较,**P<0.01 ***P<0.001
5 讨论
本实验从甘遂的甲醇提取物中分离出5个三萜化合物,包括2个羊毛脂烷三萜和3个大戟烷型三萜,其中化合物5为新的羊毛脂烷型三萜,化合物1和4为首次从该植物中分离得到。此外,用CCK-8法对分离得到的5个化合物进行了抗氧化活性筛选,结果表明化合物2和5具有一定的抗氧化活性。
利益冲突 所有作者均声明不存在利益冲突
[1] Zhang J S, Weng H Z, Huang J L,. Anti-inflammatory ingenane diterpenoids from the roots of[J]., 2018, 84(18): 1334-1339.
[2] Lee J W, Jin Q H, Jang H,. Jatrophane and ingenane-type diterpenoids frominhibit the LPS-induced NO production in RAW 264.7 cells [J]., 2016, 26(14): 3351-3354.
[3] Meng X H, Wang K, Chai T,. Ingenane and jatrophane diterpenoids fromand their antiproliferative effects [J]., 2020, 172: 112257.
[4] Wang L Y, Wang N L, Yao X S,. Euphane and tirucallane triterpenes from the roots ofand theireffects on the cell division of[J]., 2003, 66(5): 630-633.
[5] Lu Z Q, Chen G T, Zhang J Q,. Four new lanostane triterpenoids from[J]., 2007, 90(11): 2245-2250.
[6] Guo J, Zhou L Y, He H P,. Inhibition of 11β-HSD1 by tetracyclic triterpenoids from[J]., 2012, 17(10): 11826-11838.
[7] Cheng F F, Yang Y J, Zhang L,. A natural triterpene derivative frominhibits cell proliferation and induces apoptosis against rat intestinal epithelioid cell line[J]., 2015, 16(8): 18956-18975.
[8] Yan X J, Zhang L, Guo J M,. Processing of Kansui roots stir-baked with vinegar reduces Kansui-induced hepatocyte cytotoxicity by decreasing the contents of toxic terpenoids and regulating the cell apoptosis pathway [J]., 2014, 19(6): 7237-7254.
[9] Zheng W F, Cui Z, Zhu Q. Cytotoxicity and antiviral activity of the compounds from[J]., 1998, 64(8): 754-756.
[10] Shi Q W, Su X H, Kiyota H. Chemical and pharmacological research of the plants in genus[J]., 2008, 108(10): 4295-4327.
[11] Zhang Q, Zhou Q R, Lou J W,. Chemical constituents from[J]., 2017, 22(12): 2176.
[12] Peng Q, Li G Y, Ma Y P,. Chemical constituents of[J]., 2012, 43: 64-66.
[13] Shen J, Kai J, Tang Y P,. The chemical and biological properties of[J]., 2016, 44(2): 253-273.
[14] Lu C J, Guo Y Y, Yan J,. Design, synthesis, and evaluation of multitarget-directed resveratrol derivatives for the treatment of Alzheimer's disease [J]., 2013, 56(14): 5843-5859.
[15] Yuan F Y, Xu F, Fan R Z,. Structural elucidation of three 9, 11-tetracyclic triterpenoids enables the structural revision of euphorol J [J]., 2021, 86(11): 7588-7593.
[16] 王书云, 李国玉, 张珂, 等. 维吾尔族药大戟脂中三萜类化学成分研究 [J]. 中国中药杂志, 2018, 43(18): 3688-3693.
New triterpenes from roots ofand their antioxidant activities
MA Li1, 2, WANG Jia-lin3, CHAI Tian1, WANG Cheng-bo1, MENG Xian-hua1, YANG Jun-li1
1. CAS Key Laboratory of Chemistry of Northwestern Plant Resources, Gansu Key Laboratory for Natural Medicine, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China 2. University of Chinese Academy of Sciences, Beijing 100049, China 3. Northwest Minzu University, Lanzhou 730030, China
To isolate compounds from the roots ofand investigate their antioxidant activities.Various column chromatography techniques were used to isolate and purify the compounds and their structures were identified by spectral data. Meanwhile, the isolated compounds were evaluated for antioxidant activity in SH-SY5Y cells.Five triterpenes were isolated and identified from the methanol extract of the roots of, including three euphane triterpenes, namely eupha-8,24-diene-3β-ol-7,11-dione(1), (24)-eupha-8,25-diene-3β,24-diol (2), euphol (3), and two lanostane triterpenes namely 3β,11β-dihydroxylanosta-8,24-dien-7-one (4), 3β,7β-dihydroxylanosta-8,24-dien-11-one(5).Compound 5 is a new compound named euphokansuione A and compounds 1 and 4 are isolated from this plant for the first time. Compounds 2 and 5 have certain antioxidant capacity in SH-SY5Y cells and potential neuroprotective activity.
S.L.Liou ex S.B.Ho; triterpenes; euphane triterpene; lanostane triterpene; euphokansuione A;euphol; antioxidant activity; potential neuroprotective activity
R284.1
A
0253 - 2670(2022)08 - 2269 - 05
10.7501/j.issn.0253-2670.2022.08.001
2022-01-05
甘肃省自然科学基金项目(21JR7RA075);甘肃省自然科学基金项目(20JR5RA570)
马 丽,硕士研究生,研究方向为甘遂的活性成分研究。E-mail: mali@licp.cas.cn
杨军丽,博士生导师,研究员,从事中草药活性成分和新药研究。E-mail: yangjl@licp.cas.cn
[责任编辑 王文倩]
