YTHDF2通过诱导IGFBP7的mRNA衰变激活PI3K/AKT信号转导通路促进胶质母细胞瘤进展的研究
2022-04-15刁新峰李新茂魏志玄
刁新峰,李新茂,候 亮,魏志玄
1.南阳医学高等专科学校第一附属医院神经外科,河南 南阳 473000;2.武安市第一人民医院神经外科,河北 武安 056300
胶质母细胞瘤(glioblastoma,GBM)是常见的原发性脑肿瘤之一,占脑部肿瘤的80%以上[1]。尽管可采用手术和放化疗等多模式综合治疗,但GBM患者的预后仍然较差[2]。GBM形成和发展过程中的复杂分子变化使得识别参与GBM病理生理学过程的关键靶点具有重要意义。
表观遗传修饰与肿瘤发展密切相关,RNA的N6-甲基腺苷(N6-methyladenosine,m6A)修饰是一种可逆的动态表观遗传学改变[3]。据研究[4]报道,YTHDF2作为m6A修饰过程的重要识别蛋白,能够对结合m6A修饰的RNA进行识别,进而促进RNA降解,如YTHDF2通过识别m6A甲基化调节的OCT4基因进而影响OCT4的mRNA表达,促进肝细胞癌转移。YTHDF2可能通过靶向不同基因的mRNA转录物对不同的癌症发挥作用,而YTHDF2及其新靶点在GBM发展中的作用仍需要进一步阐明。胰岛素样生长因子(insulin-like growth factor,IGF)能够参与细胞生长,并受一组IGF结合蛋白及其受体调控,IGF结合蛋白7(IGF binding protein 7,IGFBP7)是一种分泌性蛋白,可作为IGF依赖和非依赖的细胞生长调节剂进而发挥作用[5]。IGFBP7被发现在GBM中表达显著降低,具有肿瘤抑制特性[6]。然而,IGFBP7在GBM中的分子机制尚未完全明确。本研究旨在探讨YTHDF2是否通过影响m6A修饰的方式调节IGFBP7的mRNA稳定性,明确YTHDF2在GBM进展中的重要作用及其潜在机制。
1 材料和方法
1.1 仪器与试剂
人GBM细胞系(LN229和U251细胞)和正常星形胶质细胞系(NHA细胞)购自中国科学院典型培养物保藏委员会细胞库。含有10%胎牛血清(fetal bovine serum,FBS)的DMEM培养基购自武汉普诺赛生命科技有限公司。100 μg/mL链霉素-100 U/mL青霉素混合溶液购自苏州新赛美生物科技有限公司。LipofectamineTM3000试剂购自赛因百奥生物技术(北京)有限公司。RIPA裂解缓冲液购自上海尚宝生物科技有限公司。放线菌素D和二辛可宁酸(bicinchoninic acid,BCA)法蛋白定量试剂盒购自上海联祖生物科技有限公司。YTHDF1、IGFBP1、p-磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)、PI3K、p-蛋白激酶B(protein kinase,AKT)、AKT、β-actin、m6A、免疫球蛋白G(immunoglobulin G,IgG)和HRP结合的二级抗体均购自英国Abcam公司。超敏型电化学发光(electrochemical luminescence,ECL)底物试剂盒购自上海炎熙生物科技有限公司。TRIzol试剂购自上海博湖生物科技有限公司。反转录试剂盒购自北京百奥莱博科技有限公司。YTHDF2、IGFBP7和GAPDH的聚合酶链反应(polymerase chain reaction,PCR)引物均购自德国Qiagen公司。SYBR Green Realtime PCR Master Mix购自北京索莱宝科技有限公司。PolyATtract®mRNA纯化系统购自上海前尘生物科技有限公司。RNA免疫沉淀(RNA immunoprecipitation,RIP)试剂盒购自广州伯信生物科技有限公司。MeRIP试剂盒购自上海玉博生物科技有限公司。碘化丙啶(propidium iodide,PI)和Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒购自大连美仑生物技术有限公司。流式细胞仪购自北京盛科信德科技有限公司。
1.2 生物信息学分析
GEPIA网站(http://gepia.cancer-pku.cn)用于预测基因在GBM中的表达水平及相关性分析。GSCA网站(http://bioinfo.life.hust.edu.cn/web/GSCALite/)用于预测基因在GBM中可能参与的生物学过程。CGGA数据库(http://www.cgga.org.cn)用于预测YTHDF2的表达水平与GBM患者临床特征的相关性。从UALCAN网站(http://ualcan.path.uab.edu/index.html)获取与YTHDF2在GBM具有负相关性的基因。从StarBase网站(http://starbase.sysu.edu.cn/index.php)获取可与YTHDF2结合的mRNA。通过RMVAR数据库(http://rmvar.renlab.org/index.html)预测IGFBP7的m6A修饰位点及识别蛋白。LinkedOmics网站(http://www.linkedomics.org/admin.php)用于预测YTHDF2与PTEN在GBM中表达的相关性。
1.3 样本采集
从2020年3月—2021年3月于南阳医学高等专科学校第一附属医院确诊为GBM的患者中收集40对肿瘤组织及匹配的癌旁组织(距离肿瘤组织边缘≥2 cm)。所有患者术前均未接受放疗或化疗等治疗。手术结束后,立即将组织冷冻在液氮中,于-80 ℃保存。本研究得到南阳医学高等专科学校第一附属医院伦理委员会的批准。所有患者在研究开始前均签署书面知情同意书。
1.4 细胞培养
LN229、U251和NHA细胞均保存在DMEM培养基中,添加10%FBS和100 μg/mL链霉素-100 U/mL青霉素混合溶液,细胞培养在37 ℃、CO2体积分数为5%的加湿培养箱中。
1.5 细胞转染
构建并合成靶向YTHDF2的小干扰RNA(si-YTHDF2)、siRNA阴性对照(si-NC)、IGFBP7 shRNA(shIGFBP7)和shRNA阴性对照(shRNA)。将U251细胞接种在96孔板中,待细胞融合至80%,将上述siRNA或shRNA通过LipofectamineTM3000试剂转染至U251细胞中,转染48 h后,通过实时荧光定量PCR(real-time fluorescence quantitative PCR,RTFQ-PCR)检测目的基因的表达水平。
1.6 细胞周期检测
采用流式细胞术检测细胞周期分布。将转染后的细胞悬浮在含有10%FBS的磷酸缓冲盐溶(phosphate-buffered saline,PBS)中,在室温下将细胞固定在无水乙醇中24 h。在室温下以3 000×g离心30 s,弃上清液。将细胞悬浮在100 µL RNase A溶液(1 mg/mL)中,在37 ℃下消化10 min。在黑暗中使用400µL PI(50 µg/mL)在室温下对细胞染色10 min,采用流式细胞术分析G0/G1、S和G2/M期细胞的比例。
1.7 细胞凋亡检测
使用Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒检测细胞凋亡率变化。将转染后的U251细胞以1×105个/孔的密度接种于6孔板中,培养24 h后在室温下以1000×g离心5 min。弃上清液,将细胞重新悬浮在200 µL结合缓冲液中。用10 µL膜联蛋白Annexin Ⅴ-FITC和10 µL PI对细胞进行染色,在4 ℃避光条件下培养30 min。采用流式细胞术检测细胞凋亡,并使用CXP2.1软件进行分析。通过早期和晚期凋亡细胞的百分比计算凋亡率。
1.8 蛋白质印迹法(Western blot)
使用RIPA裂解缓冲液从组织和细胞中分离总蛋白,使用BCA法对蛋白浓度进行定量。50 µg蛋白质裂解物经8%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)转移到聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,用5%脱脂奶粉 在室温下封闭1h。将蛋白条带与YTHDF1(1∶1000)、IGFBP1(1∶1000)、p-PI3K(1∶1000)、PI3K(1∶1000)、p-AKT(1∶1000)、AKT(1∶1000)和β-actin(1∶1000)抗体在4 ℃下温育过夜。弃一抗,加入含吐温-20磷酸缓冲盐溶液(phosphate-buffed saline with Tween-20,PBST)洗涤3次。在室温下与HRP结合的二级抗体(1∶2000)温育2 h。通过超敏型ECL底物试剂盒显色,使用Image Lab软件进行定量分析。
1.9 RIP实验
使用RIP试剂盒进行RIP分析。IP裂解缓冲液用于裂解U251细胞。细胞裂解物与涂有5 µg特异性抗体(YTHDF2抗体或IgG抗体)的磁珠在4 ℃下温育过夜。洗涤后,裂解物用蛋白酶K消化,纯化与免疫沉淀蛋白质结合的RNA。使用RTFQPCR测定IGFBP7的mRNA表达水平。
1.10 mRNA稳定性检测
将转染si-NC或si-YTHDF2的U251细胞接种于6孔板中,用放线菌素D(5 µg/mL)处理细胞0、3或6 h。通过RTFQ-PCR测定IGFBP7的mRNA表达水平。
1.11 RTFQ-PCR
使用TRIzol试剂从GBM组织和细胞中提取总RNA。使用反转录试剂盒将mRNA反转录成cDNA。使用SYBR Green Realtime PCR Master Mix进行RTFQ-PCR。以GAPDH作为内参。相对表达水平使用2-ΔΔCt法进行计算。本实验中使用的PCR引物序列如下:YTHDF2的上游引物序列为5′-CATGAATGGGAAGGGTCCCG-3′,下游引物序列为5′-GACGAATGTGTCGCAGT TGG-3′;IGFBP7的上游引物序列为5′-TGG AACAAGGTAAAAAGGGGT-3′,下游引物序列为5′-TGGTATTTCATGTAAGGCATAC-3′;GAPDH的上游引物序列为5′-CGCTCTGCTCC TGTTTC-3′,下游引物序列为5′-ATCCGTT GATCCGACCTTCAC-3′。
1.12 统计学处理
使用SPSS 22.0软件对实验数据进行分析。采用t检验或Mann-WhitneyU检验比较两组之间的差异。方差分析或Kruuskal-Wallis检验用于多组间的比较分析。P<0.05为差异有统计学意义。
2 结果
2.1 YTHDF2在GBM组织和细胞中高表达
利用GEPIA数据库评估正常和GBM样本中m6A识别蛋白(YTHDF1、YTHDF2、YTHDF3、YTHDC1和YTHDC2)的表达水平。发现与正常大脑组织样本相比,GBM组织样本中的YTHDF1、YTHDF2和YTHDF3表达较高(图1A)。在GSCA网站对YTHDF1、YTHDF2、YTHDF3、YTHDC1和YTHDC2在GBM进展中参与的生物学过程进行预测,结果显示,仅YTHDF2在GBM中参与多个生物学过程(图1B)。此外,在CGGA数据库中预测得到YTHDF2的表达与GBM患者的组织学分级(P=9.8×10-38)、世界卫生组织(World Health Organization,WHO)分级(P=1.8×10-24)和IDH突变(P=2×10-10)显著相关(图1C)。RTFQ-PCR和Western blot显示,与正常组相比,GBM组织中的YTHDF2表达水平显著升高(图1D、1E,P<0.05),与NHA细胞相比,LN229和U251细胞中的YTHDF2也呈高表达(P均<0.05,图1F)。由于YTHDF2在U251细胞中的表达最为显著,因此选用U251细胞进行后续实验。
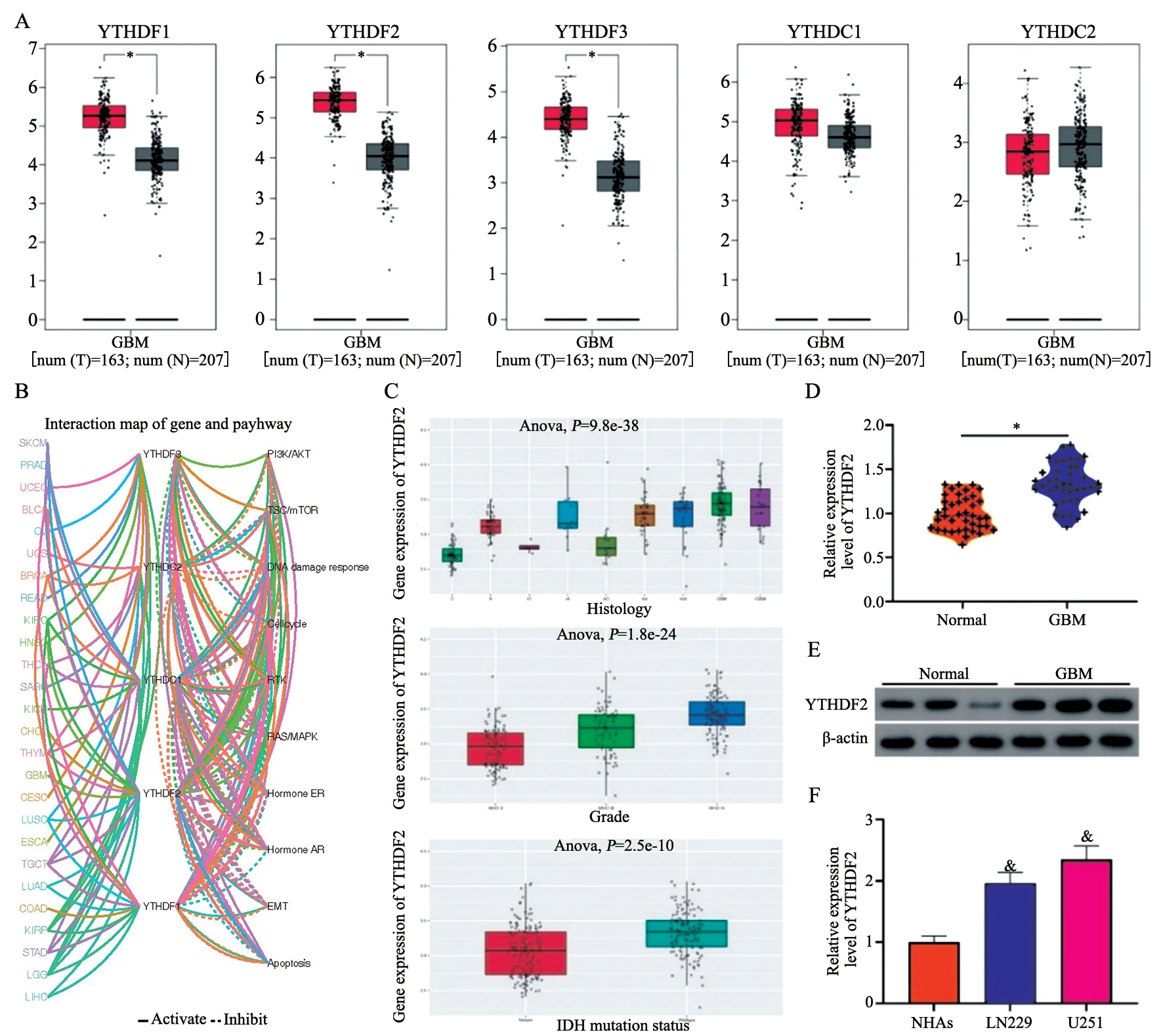
图1 YTHDF2在GBM组织和细胞中表达上调Fig.1 The expression of YTHDF2 is up-regulated in GBM tissue and cells
2.2 敲减YTHDF2可诱导GBM细胞周期阻滞和细胞凋亡
为探究YTHDF2在GBM细胞中的作用,用si-YTHDF2和si-NC转染U251细胞。与si-NC组相比,si-YTHDF2组的YTHDF2表达降低(P<0.05,图2A)。采用流式细胞术检测U251细胞的细胞周期,si-YTHDF2组较si-NC组的G0/G1期细胞比例显著增加,S期减少(P<0.05,图2B、2C)。细胞凋亡实验显示,与si-NC组相比,si-YTHDF2组细胞凋亡率明显升高(P<0.05,图2D、2E),

图2 敲减YTHDF2可诱导GBM细胞周期阻滞和细胞凋亡Fig.2 Knockdown of YTHDF2 can induce GBM cell cycle arrest and apoptosis
2.3 YTHDF2能够识别m6A修饰的IGFBP7进而促进其降解
为探究YTHDF2的下游靶点,将StarBase网站获取的可与YTHDF2结合的mRNA与UALCAN网站获取的与YTHDF2在GBM具有负相关性的基因取交集(图3A),结果为CYBA、TMEM223、RNASEK、IGFBP7、ATP6V0E1和PNKD,将IGFBP7纳入本研究。RTFQ-PCR检测发现,IGFBP7在GBM组织和细胞系中的表达均低于癌旁组织和NHA细胞(P均<0.05,图3B、3C)。在RMVAR数据库预测得到IGFBP7上存在多个m6A修饰位点,其中YTHDF2可作为RBP识别IGFBP7的m6A修饰位点(图3D)。RIP分析证实了U251细胞中YTHDF2和IGFBP7 mRNA之间的相互作用(P<0.05,图3E)。此外,敲减YTHDF2可增加U251细胞中IGFBP7的mRNA表达和蛋白水平(P均<0.05,图3F~3H)。对U251细胞进行mRNA稳定性分析,与si-NC组细胞相比,si-YTHDF2组细胞中IGFBP7的中位半衰期显著延长(P<0.05,图3I)。
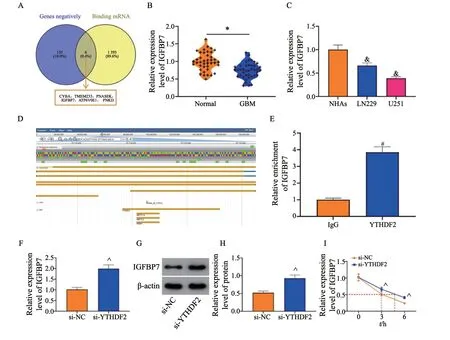
图3 YTHDF2识别m6A修饰的IGFBP7进而促进IGFBP7降解Fig.3 YTHDF2 promotes the degradation of IGFBP7 via recognizing m6A modified IGFBP7
2.4 下调IGFBP7可部分地挽救敲减YTHDF2对GBM细胞周期分布和凋亡的调控作用
进一步研究YTHDF2调控IGFBP7在GBM细胞活性中的潜在作用。首先采用RTFQ-PCR确认IGFBP7在si-YTHDF2+shIGFBP7组细胞中的表达较si-YTHDF2+shNC组降低(P<0.05,图4A)。细胞周期检测结果显示,与si-YTHDF2+shNC组相比,si-YTHDF2+shIGFBP7组细胞在G0/G1期比例减少。在细胞分裂的S和G2/M期,si-YTHDF2+shIGFBP7组细胞增加(P<0.05,图4B、4C)。流式细胞术测定数据显示,与转染shNC的细胞相比,细胞凋亡率在转染shIGFBP7后明显降低(P<0.05,图4D、4E)。上述结果表明,抑制IGFBP7可部分地挽救敲减YTHDF2诱导的GBM细胞周期阻滞和凋亡增加。
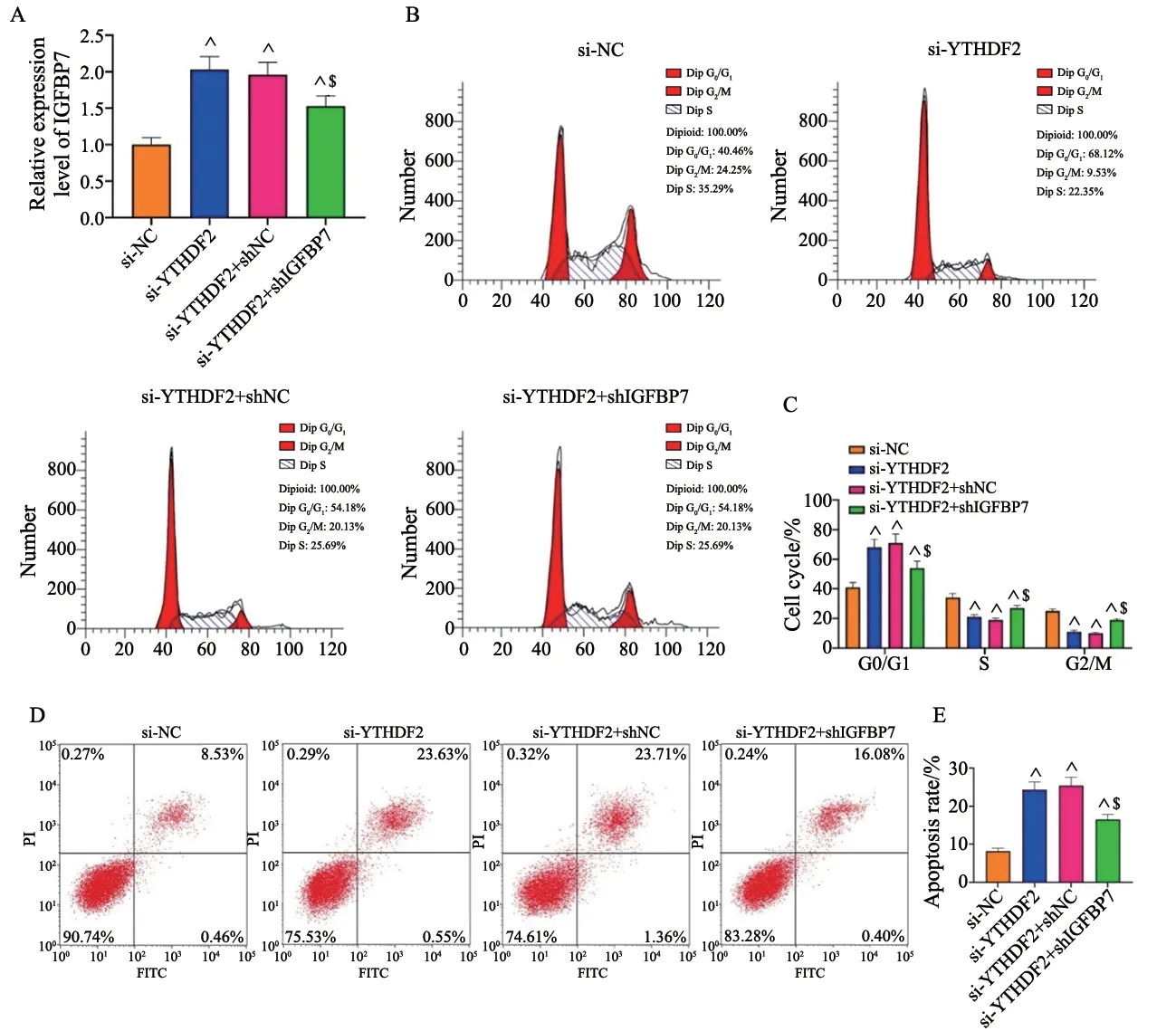
图4 下调IGFBP7可部分挽救敲减YTHDF2对GBM细胞周期分布和凋亡的调控作用Fig.4 Downregulation of IGFBP7 could partially rescue the regulatory effects of YTHDF2 knockdown on GBM cell cycle distribution and apoptosis
2.5 YTHDF2通过抑制IGFBP7诱导PI3K/AKT活化
由图1B得知,YTHDF2可能通过激活PI3K/AKT信号转导通路促进GBM的发生。在GEPIA和LinkedOmics网站得到IGFBP7与PI3K/AKT信号转导通路中的关键基因PIK3CA在GBM中显著负相关,而与PI3K/AKT信号转导通路负调节因子PTEN正相关(图5A、5B)。在U251细胞中用Western blot检测p-AKT、AKT、p-PI3K和PI3K蛋白水平,结果显示,过表达IGFBP7可降低p-AKT和p-PI3K的蛋白水平,抑制IGFBP7则相反(P均<0.05)。进一步分析YTHDF2和IGFBP7是否能调控PI3K/AKT信号转导通路,结果表明,p-AKT和p-PI3K的蛋白水平因敲减YTHDF2而显著降低,因抑制IGFBP7而部分恢复(P均<0.05,图5E、5F)。上述数据表明,PI3K/AKT信号转导通路可能由YTHDF2通过IGFBP7进行调节。
3 讨 论
RNA的m6A修饰是研究GBM的一个新兴领域[7]。先前研究[8]表明,m6A“写入器”、“擦除器”和“识别器”的表达与GBM的恶性进展和预后高度相关。本研究中,作为m6A“识别器”的YTHDF2在GBM组织和细胞中表达升高。敲减YTHDF2基因能够通过提高IGFBP7的mRNA表达,抑制PI3K/AKT信号转导通路,诱导GBM细胞周期阻滞和凋亡率升高。
据研究[9]报道,YTHDF2对GBM细胞增殖、侵袭和肿瘤的发生具有促进作用。YTHDF2通过诱导细胞质中的靶mRNA稳定性降低来执行其功能,如YTHDF2介导肿瘤抑制因子的mRNA降解,促进前列腺癌的恶性进展[10]。YTHDF2下调IRS1的mRNA水平在子宫内膜癌中发挥肿瘤抑制作用[11]。本研究借助一系列生物信息学预测网站发现YTHDF2在GBM中表达升高,并通过RTFQ-PCR和Western blot得以证实。通过CSCA网站预测YTHDF2可能参与调控GBM细胞周期进展和凋亡过程,本研究的实验数据显示,敲减YTHDF2在GBM细胞中的表达可有效地抑制GBM细胞的周期分布,增加细胞凋亡,提示YTHDF2可作为GBM中的有效治疗靶点。
借助StarBase和UALCAN网站获取YTHDF2可特异性结合的mRNA和与YTHDF2在GBM中具有负相关性的基因,筛选得到IGFBP7。IGFBP7先前被发现在多种恶性肿瘤中充当肿瘤抑制因子发挥作用[12-14]。研究[15]表明,IGFBP7在GBM中的低表达与患者预后不良显著相关。IGFBP7在GBM组织和细胞系中的低表达水平通过RTFQPCR得到证实。在RMVAR数据库预测得到YTHDF2可识别IGFBP7的m6A修饰位点,本实验通过RIP分析证实YTHDF2可特异性地结合GBM细胞中的IGFBP7,敲减YTHDF2可有效地提高IGFBP7的mRNA稳定性。功能性实验数据显示,敲减YTHDF2对GBM细胞周期分布的抑制和凋亡的促进可通过敲减IGFBP7实现部分消除,表明YTHDF2通过抑制IGFBP7的表达在GBM中发挥促癌作用。此外,CSCA网站还显示,YTHDF2可能通过调节PI3K/AKT信号转导通路参与GBM进程。既往研究[16]表明,m6A水平的降低激活致癌的PI3K/AKT信号转导通路促进胃癌细胞的恶性表型。抑制PI3K/AKT信号转导通路的激活可抑制GBM细胞增殖和耐药性增加[17]。本研究采用Western blot检测证实,敲减YTHDF2可降低p-PI3K和p-AKT的蛋白水平。IGFBP7先前被报道可抑制PI3K/AKT信号转导通路的激活进而抑制乳腺癌细胞的生长[18]。IGFBP7抑制甲状腺癌中的AKT活性来抑制癌细胞增殖[19]。此外,GEPIA和LinkedOmics数据库显示,IGFBP7与PI3K/AKT信号转导通路中的关键基因PIK3CA在GBM中显著负相关,而与PI3K/AKT信号转导通路负调节因子PTEN呈正相关[20]。Western blot检测结果显示,过表达IGFBP7可降低p-PI3K和p-AKT蛋白水平,敲减IGFBP7则相反。此外,下调IGFBP7可部分地挽救因敲减YTHDF2降低的p-PI3K和p-AKT蛋白水平,提示YTHDF2可能通过抑制IGFBP7激活PI3K/AKT信号转导通路参与调节GBM进展。
本实验的局限性在于未对YTHDF2在GBM中的作用展开体内实验的验证。此外,下游信号转导通路的作用也有待进一步探索。本研究证实,敲减YTHDF2可通过识别m6A修饰的IGFBP7,降低其mRNA的稳定性,阻断PI3K/AKT信号转导通路的激活,抑制GBM细胞周期分布,诱导细胞凋亡。这些发现初步阐明了m6A“识别器”调控GBM肿瘤发生的潜在机制,有望为GBM的有效治疗提供新的思路。
利益冲突声明:所有作者均声明不存在利益冲突。中国癌症杂志,2020,30(5):328-334.
