快速精确获取小鼠角膜神经三维图像及其参数的技术方案研究
2022-04-13傅婷黄奕嘉刘俊李志杰
傅婷 黄奕嘉 刘俊 李志杰
1暨南大学基础医学院 眼表疾病协同创新研究实验室&眼科研究所,广州 510632;2暨南大学第一临床医学院眼科,广州 510632
角膜是一种无血管、无淋巴管的透明组织,其屈光力约占整个视觉系统屈光力的2/3。角膜任何结构和功能的改变均可显著影响外界物体在视网膜成像的准确性[1]。角膜中分布着大量神经纤维,角膜神经纤维可通过复杂的感觉、瞬目和刺激泪液分泌来维持眼表的自身稳态[2]。另外,角膜神经亦可通过释放多种营养因子来调节角膜上皮细胞的分裂和创伤修复以维持角膜上皮层的完整性[3]。当角膜神经纤维功能受损时将导致多种眼表疾病,如干眼、角膜神经营养不良、角膜上皮溃疡等,严重者可致盲。此外,角膜神经纤维感觉过敏还可能导致角膜神经性疼痛[4]。因此,研究角膜的神经分布和生理特征不仅有利于了解正常的角膜结构和生理功能,而且对于研究神经相关性角膜病的发生机制以及制定相关的防治措施均具有重要意义。鉴定角膜神经纤维的方法包括早期经典的神经组织学方法,如氯化金和氯化银染色,以及后来的免疫荧光组织化学方法、采用透射电子显微镜技术对离体角膜神经进行超微结构观察和采用激光扫描共聚焦显微镜对活体角膜神经进行研究等[5-11]。上述方法各有利弊,如角膜组织切片后采用氯化金染色法虽然可以看到角膜上皮神经末梢,但不能对角膜神经进行整体观察;普通光学显微镜分辨率低,难以提供高清神经结构图像。近十年来,本研究团队采用高分辨率去卷积显微镜进行小鼠完整角膜神经纤维图像获取,并结合交互式显微镜图像分析软件Imaris的丝状追踪模块对正常和创伤角膜的神经分布特征及其各种参数进行分析[12-16]。角膜神经的可视化研究对角膜多种疾病的发病机制和病理学机制的研究具有重要意义。本研究拟探讨获取角膜神经分布和分析参数的实验方法,为相关研究工作提供新的方法学支撑。
1 材料与方法
1.1 材料
1.1.1实验动物 选取8周龄健康无眼疾SPF级雌性C57BL/6小鼠4只,购于广东省医学实验动物中心。实验过程严格遵循视觉眼科学研究学会制定的科研动物使用规范,本研究方案经暨南大学实验动物福利委员会审核批准(批文号:JN-A-2002-01)。
1.1.2主要试剂及仪器 抗神经元特异性β-Ⅲ微管蛋白NorthernLightsTMNL557荧光标记抗体(美国R&D Systems公司);Triton-X100、牛血清白蛋白(bovine serum albumin,BSA)、4’,6-二脒基-2-苯基吲哚二盐酸盐(4’,6-diamidine-2’-phenylindole dihydrochloride,DAPI)(美国Sigma公司);磷酸盐缓冲液(phosphate buffered saline,PBS)(上海碧云天生物技术有限公司);乙醚(广州化学试剂厂);质量分数4%多聚甲醛(上海索莱宝生物科技有限公司);抗荧光衰减封片剂(武汉博士德生物工程有限公司)。体视显微镜(桂林桂光仪器有限公司);脱色摇床(海门其林贝尔仪器制造有限公司);高尔夫样刀(美国Accutome公司);高分辨率去卷积显微镜(DeltaVision Elite,美国GE医疗集团)。
1.2 方法
1.2.1角膜组织的获取 按照文献[17]描述的方法获取小鼠角膜。吸入过量乙醚麻醉后使小鼠安乐死,立刻取下4只小鼠完整右眼眼球置于质量分数4%多聚甲醛中4 ℃固定过夜(图1A),在PBS中漂洗3次,每次5 min,剖取具有完整角膜缘的角膜片。
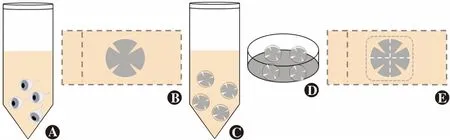
图1 角膜组织的获取、固定、免疫荧光染色和角膜整铺片流程图 A:眼球固定 B:角膜组织切开成梅花状 C:梅花状角膜组织的抗体孵育 D:孵育后梅花状角膜组织的漂洗 E:梅花状角膜组织整铺片Figure 1 Flowchart of the acquisition,fixation,immunofluorescence staining of corneal tissue and whole-mounted cornea preparation A:Fixation of the eyeball B:The corneal tissue cut into a plum blossom shape C:Antibody incubation of plum-shaped corneal tissue D:Rinsing of plum-shaped corneal tissue after incubation E:A plum-shaped corneal whole-mount
1.2.2免疫荧光染色及角膜整铺片 将漂洗后的角膜片置于载玻片上,在显微镜下放射状切开成梅花状,将梅花状角膜组织放入200 μl质量分数2% BSA溶液中封闭15~20 min后置于含体积分数0.1% Triton X-100的PBS中透膜15~20 min;在含有2% BSA和0.1% Triton X-100的PBS混合溶液中按照10∶ 1的比例加入抗神经元特异性β-Ⅲ微管蛋白NorthernLightsTMNL557荧光标记抗体;将透膜后的角膜组织置于含抗体的混合液中,放在40 r/min的脱色摇床上,4 ℃环境下避光孵育过夜;将角膜组织置于培养皿中,PBS漂洗3次,每次5 min;将角膜组织置于载玻片上,内皮面朝下,在体式显微镜下将角膜铺平;滴加含有DAPI的抗荧光衰减封片剂后用超薄盖玻片封片,用螺钉夹平并置于避光环境下风干(图1)。
1.2.3整个角膜神经纤维分布图像的获取 将封片好的角膜片置于DeltaVision Elite高分辨率去卷积显微镜60倍油镜下;通过调节焦距,将角膜上皮层定位扫描最高点,内皮层定位扫描最低点,2点之间的距离为扫描的纵向(Z)间距,通过移动载物台确定扫描横向距离X轴和Y轴,确定扫描范围,囊括完整的角膜组织;每个图像扫描的Z轴间距(dZ)、X轴长度(dX)和Y轴宽度(dY)可根据角膜厚度及大小进行调整;采用科学互补性金属氧化物半导体探测器捕获图像,当扫描程序接收后即可获得所扫描区域的图像文件;为了获得更为清晰的图像,一般可将上述图像文件采用DeltaVision Elite系统自带的去卷积功能进行还原型三维(three dimension,3D)去卷积运算;采用缝合(Stitch)模块可将获得的上述图像进行拼接并最终得到完整的角膜神经纤维图像文件[由于所获取的图像文件巨大,可选择用于缩减的倍数(10倍或更大的倍数)功能缩减文件大小以避免运算过载,造成过程终止或黑屏];根据需要可采用计算机自带投射功能将Z轴获得的数据投射成一个平面图像;在View模式下进行“Volume Viewer”可对获取的图片进行3D可视化。
1.2.4角膜神经纤维的自动统计
1.2.4.1角膜分区 为了分析角膜中神经纤维在生理和病理状态下的分布和改变,将完整的角膜从角膜中央到角膜缘分为5个环形区,依次为1区(Center)、2区(Paracentral)、3区(Original wound edge)、4区(Peripheral)和5区(Limbus)(图2)。以方便统计不同区域内角膜神经纤维的不同参数。
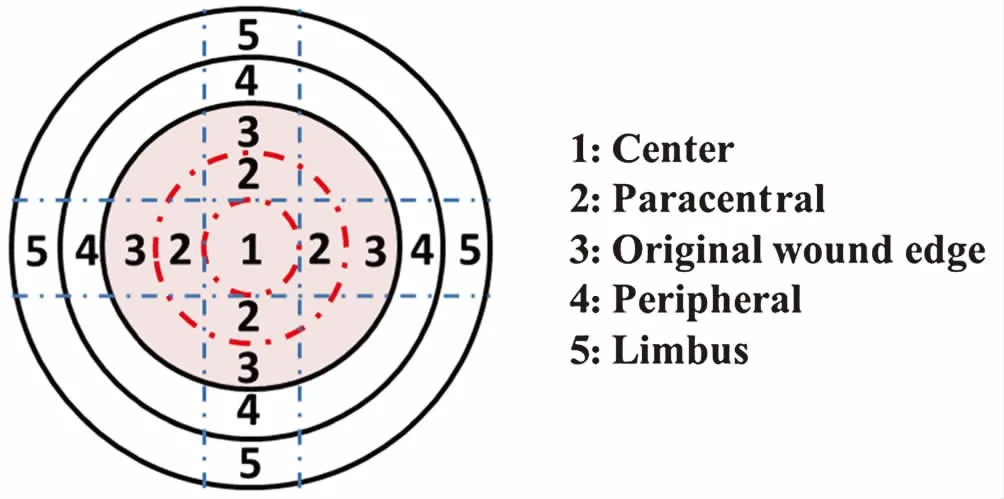
图2 完整角膜分区示意图 含有角膜缘的完整角膜从角膜中央到角膜缘可分为5个区Figure 2 Schematic diagram of cornea zones The cornea with complete limbus could be divided into five annular zones (1-5) from the central cornea to the limbal area
1.2.4.2角膜不同分区内角膜神经纤维的自动统计 采用交互式显微镜图像分析软件Imaris(Bitplane AG,Zurich,Switzerland)中丝状物追踪(Filament Tracer)模块下的自动检测(Automatic Detection)模式进行角膜不同分区内神经纤维的自动统计。具体步骤为:(1)感兴趣区域的创建 采用Surpass视图模式打开图片(注意所打开图像格式应为TIF格式),用工具栏“Edit”中的“Crop 3D”模块选择确定一个感兴趣区域(region of interest,ROI)(图3A);(2)细丝结构的创建 在Surpass目录栏上点击新建细丝结构(Add New Filament)图标加入一个新的细丝结构;(3)算法创建 以自动路径(非回路)[Autopath (no loops)]作为算法,并选择图像计算细丝直径(Calculate Diameter of Filament from Image);(4)起始点及终止点直径的创建 通过设置起始点最大直径(Starting Points Largest Diameter)及终止点最小直径(End Piont Diameter)来构建ROI中丝状物结构的起始点和终止点直径;(5)分类点的创建 通过手动调节起始点阈值(Starting Poind Threshold)和终止点阈值(Seed Poind Threshold),将自动检测到细丝结构的起始点和终止点进行分类;(6)树突直径的创建 通过手动调节树突直径阈值(Dendrite Diameter Threshold)将神经丝状物相应地显示出来;(7)细丝显像设置 通过更改细丝样式(Style)以及是否显示树突结构(Show Dendrites)来改变细丝视觉效果图,从而获取待检测角膜神经纤维可视化图像(图3B);(8)数据处理 通过点击统计图标(Statistics)可以自动得到角膜神经纤维不同的统计变量以及统计类别,选择详细标签(Detailed)下的所有值(All Values),通过“Export All Statistics to File”导出所有自动统计的数据。
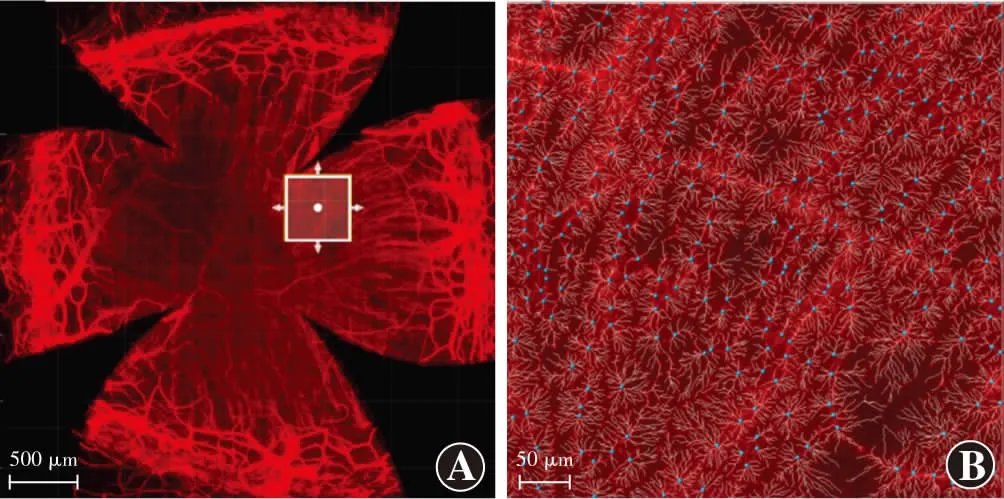
图3 Imaris软件自动检测模式下分析的角膜神经图像 抗神经元特异性β-Ⅲ微管蛋白NorthernLightsTMNL557荧光标记抗体标记角膜神经纤维,红色为神经纤维 A:完整角膜神经纤维图像ROI(方框)的确定(标尺=500 μm) B:待测区域神经丝状物细丝(标尺=50 μm) 蓝色点代表待测神经纤维的起始点Figure 3 Corneal nerve images analyzed with Imaris software under the automatic detection module The corneal nerve fibers were immunostained by NorthernLightsTMNL557,the anti-β-Ⅲ tubulin fluorescent-conjugated antibody,and color red indicated nerve fibers A:The identification of ROI (square) of the complete corneal nerve image (bar=500 μm) B:Visualized corneal nerve filament in the area to be tested (bar=50 μm) The blue dots showed the starting points of the nerve filament
1.2.4.3自动路径模式下指定起始点至终止点神经纤维长度的自动统计 自动检测模式是根据设置细丝结构的起始点以及终止点阈值对不同ROI内角膜神经纤维信息的自动统计,当需要测定指定神经纤维起始点至终止点纤维长度时,选择丝状物追踪模块中的自动路径(AutoPath)模式进行操作。(1)细丝结构的创建 Surpass视图模式打开图片,在3D View模式下创建新的细丝结构;(2)算法创建 创建算法时点击“跳过自动创建,手动编辑(Skip automatic creation,edit manually)”,即停止起始点和终止点自动检测;(3)待测神经纤维的绘制 点击绘制(Draw)标签,选择方法(Method)参数为自动路径,改变鼠标指针模式为“Select”,按下Shift和鼠标右键确定待测神经纤维起始点,沿着神经纤维路径移动鼠标光标至待测神经纤维终止点,按下Shift和鼠标左键固定终止点;(4)数据处理 统计图标导出数据中的“_Filament_Length_(sum)”文件即为待测神经纤维的长度。
1.3 统计学方法

2 结果
2.1 角膜神经纤维图像
角膜3D图像中可见角膜基质神经丛、角膜基底下神经丛、由角膜基底下神经分支向角膜上皮层延伸的神经末梢以及不同角膜层面上的完整角膜神经纤维结构。小鼠角膜缘处神经纤维进入角膜基质层后分成许多细小的分支,向角膜中心伸展,并向上延伸至角膜前间质层,部分角膜基质神经相互交织形成神经网络,但大部分角膜基质神经分支穿过角膜基底膜形成角膜基底下神经丛。角膜上皮神经由角膜基底下神经丛及游离的神经末梢组成,构成角膜基底下神经纤维。角膜缘处呈密集网络状的基质层神经纤维在进入前弹力层后开始发出密集的分枝,形成直的或串珠状角膜基底下神经丛,角膜基底下神经丛向角膜中心伸展交织形成神经网络,在角膜顶点汇聚成漩涡状结构,少部分纤维垂直进入上皮层,并发出许多微小的神经末梢分枝(图4)。
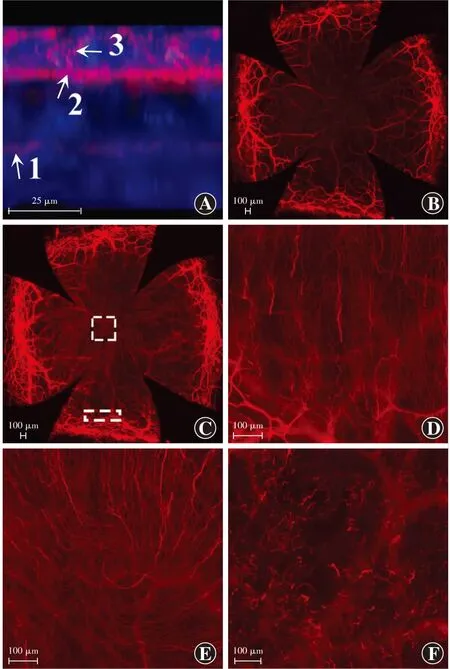
图4 DeltaVision Elite高分辨率去卷积显微镜下获取的角膜神经图像 抗神经元特异性β-Ⅲ微管蛋白NorthernLightsTMNL557荧光标记抗体标记角膜神经纤维,红色表示神经纤维,蓝色表示细胞核 A:角膜神经纤维3D图像的纵切面(标尺=25 μm) 1:角膜基质神经丛;2:角膜基底下神经丛;3:角膜神经末梢分枝 B:小鼠角膜基质神经纤维图(标尺=100 μm) 可见部分角膜基质神经相互交织形成神经网络 C:小鼠角膜基底下神经纤维图(标尺=100 μm) 可见角膜基底下神经丛(白色虚线框代表ROI) D:角膜基底下神经丛(标尺=100 μm) 角膜基质神经分支穿过角膜基底膜形成直的或串珠状角膜基底下神经丛 E:角膜基底层下神经纤维在角膜顶点汇聚成漩涡状结构(标尺=100 μm) F:位于角膜上皮层内的角膜神经末梢分枝(标尺=100 μm)Figure 4 Corneal nerve images obtained with the DeltaVision Elite high-resolution deconvolution microscope The corneal nerve fibers were immunostained by NorthernLightsTMNL557,the anti-β-Ⅲ tubulin fluorescent-conjugated antibody,and color blue showed cell nuclei and color red indicated nerve fibers A:The longitudinal section of a 3D image of a corneal nerve (bar=25 μm) 1:Corneal stromal nerve plexus;2:Corneal subbasal nerve plexus;3:Branch of corneal nerve endings B:Corneal stromal nerve image of mouse (bar=100 μm) Some intertwined corneal stromal nerves formed a neural network C:Corneal subbasal nerves image (bar=100 μm) Nerve plexus at the bottom of the corneal basement membrane were seen (The white dotted frames showed ROI) D:Corneal subbasal nerve plexus image (bar=100 μm) Branches of corneal stromal nerve went through the corneal basement membrane to form straight or bead-like corneal subbasal nerve plexus E:Corneal subbasal nerves converging into a vortex-like structure at the apex of the cornea (bar=100 μm) F:Branches of corneal nerve endings in the epithelium (bar=100 μm)
2.2 小鼠角膜神经纤维密度和长度影像
2.2.1角膜不同分区内角膜神经纤维密度 4区角膜上皮神经末梢密度为(2 488.88±282.84)μm/μm2,角膜神经纤维向角膜中央1区逐渐增多,中央1区密度为(5 766.66±298.55)μm/μm2;4区角膜基质层神纤维密度为(40.99±0.99)μm/μm2,基质层神经纤维向角膜中央1区逐渐减少,中央1区密度为(34.57±1.28)μm/μm2;角膜基底下神经纤维密度从角膜缘向角膜中央呈现先增加后减少的趋势。
2.2.2指定起始点至终止点角膜神经纤维长度 自动路径模式下可见,角膜缘处呈密集网络状的基质层神经纤维进入前弹力层(151.36±20.72)μm处开始发出密集的分枝,形成基底下神经丛(图5)。
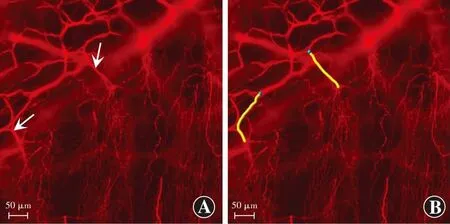
图5 Imaris软件自动路径检测模式下分析的角膜神经图像(标尺=50 μm) 抗神经元特异性β-Ⅲ微管蛋白NorthernLightsTMNL557荧光标记抗体标记角膜神经纤维,可见角膜缘处呈密集网络状的基质层神经纤维进入前弹力层约151 μm处开始发出密集的分枝,形成基底下神经丛,红色为神经纤维 A:白色箭头指待测神经纤维 B:黄色线段显示待测角膜神经纤维显像,蓝色点代表待测神经纤维的起始点Figure 5 Corneal nerve images analyzed with Imaris software under the autopath module (bar=50 μm) The corneal nerve fibers were immunostained by NorthernLightsTMNL557,the anti-β-Ⅲ tubulin fluorescent-conjugated antibody,and the stromal nerve fibers in a dense network at the limbus entered the Bowman membrane for about 151 μm and then began to branch to form subbasal nerve plexus.The color red indicated nerve fibers A:The white arrows showed the nerve to be measured B:The yellow lines showed the visualized corneal nerve fibers to be tested,and the blue dots showed the starting points of the nerve filament to be tested
3 讨论
本研究团队在角膜整铺片下采用高分辨率去卷积显微镜对小鼠角膜神经分布和3D结构进行分析,可以清晰地显示角膜上皮层神经末梢、角膜基底层下神经丛以及角膜基质层神经纤维的分布和基本结构特征。本研究还发现,通过图像分析软件Imaris的丝状物追踪模块可以快速和自动检测特定区域的角膜神经纤维相关参数,主要包括神经纤维密度和单一神经纤维长度。该实验方案为相关研究人员评估正常和病理状态下角膜神经的分布和形态特征以及各种疾病状态下神经纤维的动态变化过程提供了重要的技术支持和方法学依据。
角膜神经起源于三叉神经节,含有薄髓鞘的Aδ类神经和无髓鞘的C类神经[18]。角膜缘有髓神经纤维进入角膜基质浅层后在角膜内脱髓鞘形成透明的角膜上皮下神经丛,并跨越角膜上皮层形成垂直纤维神经以及角膜基质神经。角膜基质层神经纤维主要位于角膜基质的前中部[2,6],角膜上皮层的垂直神经末梢与角膜的感觉敏感度密切相关。角膜基底下神经丛由串珠状神经纤维组成,这些串珠样结构在电子显微镜下呈现神经纤维内的线粒体结构,其主要功能是为神经纤维的代谢和功能活动提供能量。因此,角膜神经纤维串珠的大小和数量与角膜神经纤维的代谢状态相关[13,19]。此外,角膜神经在维持眼表的稳态过程中发挥着重要作用[4]。角膜感觉神经可刺激泪腺生成泪液,以维持眼表湿润状态,其分泌的神经肽物质可促进角膜上皮细胞的有丝分裂[20]。角膜神经结构和功能的破坏可造成角膜组织的神经营养不良性角膜病变。角膜神经属于外周神经系统,不具有完全的再生能力,其主要包括创口内神经纤维的出芽及创口周围神经主干生长出神经纤维2种方式。角膜受到损伤后短期内创伤区神经纤维即可发生变性,创伤区周围的神经轴索生成新生轴突[5]。因此,探索不同生理和病理状态下角膜神经纤维的改变对于角膜相关疾病的及时诊疗具有重要的临床意义。
本研究团队在过去10年内采用免疫荧光技术对角膜神经纤维的染色方法进行了反复的技术改进,积累了许多可以借鉴的经验。需要指出的是,基于角膜的组织结构特征,实验过程中处理角膜的操作应注意下述问题:(1)为了获取完整的角膜神经纤维图像,在取材过程中应尽量避免使用锐利器械,以免损伤角膜组织,特别是角膜上皮层;(2)角膜中的神经纤维都是起自于角膜缘神经的分支,为了获得完整的角膜神经图像,必须保留足够且完整的角膜缘结构;(3)为了保证荧光标记抗体向角膜组织的渗透并防止孵育期间多个角膜之间的叠加,在抗体孵育过程中置于转速为40 r/min的脱色摇床上4 ℃环境下至少过夜(12 h)处理;(4)为了减少荧光成分的脱失,孵育后的角膜组织用PBS漂洗过程中应缓慢振荡,每次5 min,共3次;(5)为了确保角膜整铺片处于平整状态,铺片过程中须确保角膜内皮层向下、角膜上皮层向上,按图1E的方式平铺;(6)为了防止荧光在拍照过程中淬灭,应用商业抗荧光衰减封片剂或自制抗荧光衰减胶水封片;(7)在获取图像时其曝光强度不易过高;(8)用Imaris的丝状物追踪模块自动检测模式自动统计不同区域角膜神经相关信息时应注意调节起始点阈值、终止点阈值和树突直径阈值;(9)正常角膜神经密度和某些分布特征随小鼠鼠龄的增加会发生衰老性下降[16,21],因此比较分析上述各种角膜神经参数时应注意小鼠鼠龄的影响。
本研究采用的获取高清完整角膜神经分布和各种图像分析参数实验方案的主要优点包括:(1)采用整铺片技术和高分辨率去卷积显微镜以及自携带的图像拼接处理技术可获得所有神经纤维在整个角膜的3D分布特征,从而解决了传统技术对了解角膜神经结构和分布特征的局限性;(2)交互式显微镜图像分析软件Imaris的丝状物追踪模块可自动和快速获取特定区域内角膜神经纤维的相关参数。基于本研究方法建立的实验方案可为研究角膜神经的生理和病理特征提供重要的技术支持。
利益冲突所有作者均声明不存在任何利益冲突
作者贡献声明傅婷:文章选题及撰写、实验研究、分析数据;黄奕嘉:实验研究、分析数据;刘俊:论文修改;李志杰:文章选题及撰写
