骆驼乳对葡聚糖硫酸钠诱导小鼠结肠炎的保护作用
2022-04-12郭坤杰吉日木图
郭坤杰,何 静,吉日木图,2*
(1 内蒙古农业大学 乳品生物技术与工程教育部重点实验室 呼和浩特 010018 2 内蒙古骆驼研究院 内蒙古阿拉善 750306)
炎性肠病 (Inflammatory bowel disease,IBD)主要包括克罗恩病(Crohn's disease,CD)和溃疡性结肠炎(ulcerative colitis,UC),而UC 是一种慢性非特异性肠道炎症性疾病。在UC 中,病变主要在直肠和结肠发生,导致肠上皮表面损伤;而CD 在胃肠道的任何部位均可发生[1]。两者的临床症状都涉及腹痛、肠道出血、便血、体重减轻和腹泻等。目前IBD 的病因尚未完全明确,可归因于与遗传、免疫和环境因素有关[2-3]。有研究表明,其发病机制主要包括肠上皮屏障破坏、固有免疫防御失控和肠道微生物失调[4-5]。近年来,IBD 发病率逐年攀升,无法彻底根治。越来越多的人喜欢通过天然食物来预防结肠炎[6]。
骆驼乳(camel milk,CM)具有多种生物活性成分,因具有多种保健功能而被广泛食用,被作为一种基本营养补充剂来帮助免疫缺陷患者[7]。与其它反刍动物乳相比,CM 还可以被乳糖不耐受患者和牛奶过敏患者食用[8],其脂肪、胆固醇和乳糖含量低,钙、镁、铜、锌等矿物质含量高,维生素A、B2、C、E 等含量高[9]。除了分泌型IgA 和IgM 的含量高外,CM 还含有多种抗菌和抗病毒活性的纳米抗体,并含有多种具有免疫调节特性的生物活性蛋白,包括溶菌酶、乳糖过氧化物酶和N-乙酰氨基葡萄糖酶[10]。此外,CM 中含有低聚糖,低聚糖是一种益生元,它可以减少致病性微生物附着于结肠黏膜并有利于双歧杆菌数量增加。同时,CM 富含乳铁蛋白,具有较好的抗氧化和抗炎特性。据报道,CM 对糖尿病[11-12]、肾病[13]和酒精性肝损伤[14-15]具有保护和减轻作用。然而,关于CM 对IBD 保护作用的研究还很有限。本研究旨在探究CM 对葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导小鼠结肠炎的预防作用。
1 材料与方法
1.1 材料与试剂
驼乳,内蒙古自治区阿拉善右旗所属的牧区。
试验动物购于北京维通利华实验动物技术有限公司,6~8 周雄性C57BL/6 小鼠60 只 (许可证编号:SCXK(京)2016-0001,SPF 级);饲料购于北京科澳协力公司。
葡聚糖硫酸钠,美国MPBiomedicals 公司;白介素6(IL-6)、白介素1β(IL-1β)、白介素10(IL-10)、脂多糖(LPS)和髓过氧化物酶(MPO)ELISA试剂盒,上海酶联生物科技有限公司;石蜡、甲醛、二甲苯,上海国药集团;动物组织总RNA 提取试剂盒,成都福际生物技术有限公司;中性树脂,北京索莱宝公司;反转录试剂盒,苏州宇恒生物科技有限公司;SYBR Green 荧光定量PCR,苏州宇恒生物科技有限公司;苏木素、伊红,BASO 公司。
1.2 仪器与设备
Bio Tack 酶标仪,美国伯腾仪器有限公司;ZJ-4IVC 动物实验系统,苏州冯氏实验动物设备有限公司;高速冷冻离心机,德国Eppencbrf 公司;实时荧光定量PCR 仪,瑞士Roche 公司;PCR 仪,美国赛默飞世尔科技公司;2014-181Ab 真空冷冻干燥机,上海东富龙科技股份有限公司;Bead Ruptor 24 Elit 多功能生物样品均质器,美国Omni International 公司;GHP-9270 隔水式恒温培养箱,上海一恒科学仪器有限公司;各型号微量加样器,德国Eppencbrf 公司。
1.3 方法
1.3.1 结肠炎小鼠模型的构建和分组 6~8 周龄雄性C57BL/6 小鼠,饲养于清洁级动物房,适应环境1 周,喂食普通饲料,自由进食及饮水。将60 只小鼠随机分成空白组、模型组、CM 组和CM+DSS组(见图1)。空白组和模型组,连续灌胃生理盐水21 d,从第15~21 天开始,模型组自由饮用2.5%DSS 溶液;CM 组和CM+DSS 组,连续灌胃CM 21 d,从第15~21 天开始,CM+DSS 组自由饮用2.5%DSS 溶液。试验结束后处死小鼠,收集小鼠的结肠组织、血清和粪便。血清和一半结肠在-80 ℃保存,另一半结肠固定在4%缓冲甲醛中进行组织学观察。

图1 各组小鼠处理方案示意图Fig.1 Schematic diagram of the treatment plan of each group of mice
1.3.2 疾病活动指数评价组织病理学评分 如表1所示,按照Hamamoto 等[16]标准计算各组小鼠的DAI 评分,每日称重,观察大便性状和隐血情况。

表1 DAI 评分表Table 1 DAI score sheet
体重变化率=(起始体重-试验当天体重)/起始体重×100%
DAI=大便性状+大便隐血+体重下降
1.3.3 组织病理学评分 结肠通过4%多聚甲醛进行固定,脱水透明,石蜡包埋后,切片、脱蜡和苏木精-伊红 (hematoxylin-eosin staining,H&E)染色,透明并封片,镜检观察。如表2所示,根据Cooper 标准计算病理组织学评分[17]。

表2 组织病理学评分表Table 2 Histopathology score sheet
1.3.4 TUNEL 法检测细胞凋亡 先将组织切片进行脱蜡,然后将稀释后的蛋白酶K 滴加至切片37 ℃,PBS 洗涤3 次;滴加50 μL 检测液,37 ℃孵育60 min,PBS 洗涤3 次;滴加10 μg/mL Hoechst 33342 孵育1 min,PBS 洗涤3 次;使用荧光显微镜观察并拍照。
1.3.5 免疫组织化学检测紧密连接蛋白的表达 先将切片进行脱蜡水化,再进行高压抗原修复,使用3%的H2O2去离子水37 ℃孵育,PBS 洗涤3次;采用山羊血清孵育30 min,然后滴加一抗4 ℃过夜,PBS 洗涤3 次,滴加二抗37 ℃孵育30 min,PBS 洗涤3 次。使用DAB 显色,并用苏木素进行复染,中性树胶封片,胞浆呈黄色细颗粒状则判断为阳性产物,用电子显微镜观察并拍照。
1.3.6 MPO 活性及血清IL-1β、IL-6 和IL-10 含量的检测 取结肠组织匀浆于pH 7.4 PBS 缓冲液中,14 000 g,4 ℃离心15 min,收集上清液。小鼠眼球取血后,室温放置3~4 h,3 000 r/min 20 min离心,收集上清,-80 ℃保存作进一步分析。结肠MPO 活性及血清IL-1β、IL-6 和IL-10 含量检测按照上海酶联试剂盒说明书进行测定。
1.3.7 实时荧光定量PCR 检测结肠组织中IL-1β、IL-6 和IL-10 的mRNA 水平 取小鼠结肠组织提取RNA,按照Animal Total RNA Isolation Kit 说明书方法操作,并测定总RNA 浓度及纯度;按照UEIris II RT-PCR System for First-Strand cDNA Synthesis 说明书进行反转录,合成cDNA后于-20 ℃保存。引物基因序列由北京博迈德基因技术有限公司合成。引物序列见表3。依据2-ΔΔCT法计算mRNA 的表达。每个样本设置为3 个复孔,总反应体系为20 μL,其反应条件为95 ℃30 s,95 ℃5 s,57 ℃30 s,72 ℃30 s。根据样本CT值做相关计算,根据熔解曲线判断PCR 产物是否具有特异性。

表3 引物序列Table 3 Primer sequence
1.4 统计学分析
通过SPSS 19.0 统计软件对各组数据及数据间差异显著水平进行统计学分析,所有数据都以±s 表示,P<0.05 为统计学上有显著差异。图表采用Graphpad 6.01 软件制作。
2 结果与分析
2.1 小鼠体重和DAI 变化
研究表明,DSS 诱导的小鼠结肠炎与人类的IBD 症状相似[18]。处死小鼠前,每天对各组小鼠进行称重,每组小鼠体重无显著差异。如图2所示,随2.5% DSS 的饮用,空白组和CM 组小鼠体重每天缓慢增长,模型组和CM+DSS 组均表现出体重下降趋势,到第7 天时分别下降了14.2%和6.1%。与空白组相比,模型组小鼠从第4 天开始体重变化率具有显著差异 (P<0.05)。相比模型组,CM+DSS 组小鼠体重下降程度相对减小,且后期下降趋势减缓,从第4 天开始体重变化率具有显著的统计学差异(P<0.05),表明CM 干预后可以缓解结肠炎小鼠体重减轻症状。
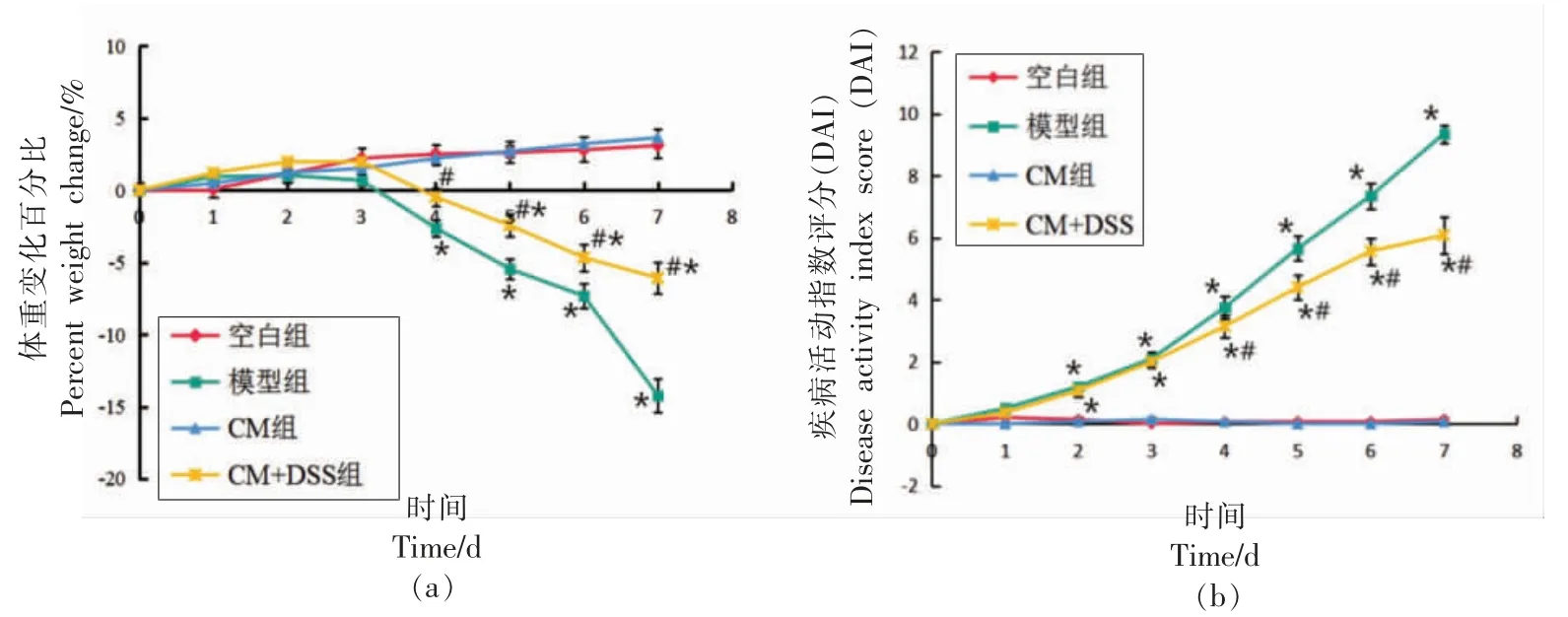
图2 驼乳对结肠炎小鼠体重变化率和DAI 评分的影响Fig.2 The effect of camel milk on the weight change rate and DAI score of colitis mice
在处死小鼠前1 天,DAI 评分由观察者通过结合体重变化情况、大便隐血和性状等情况综合性进行评估。除体重外,随DSS 的饮用模型组和CM+DSS 组的饮食和饮水量也开始减少,且第3天时小鼠开始腹泻,第4 天时逐渐开始便血。从第2 天开始,与空白组相比,模型组DAI 评分具有显著的统计学差异(P<0.05),至第7 天DAI 评分达到最高,高达9.6 分。与模型组相比,CM+DSS 组DAI 评分均低于模型组(P<0.05),到第7 天时评分为6.1 分,且增加幅度相对缓慢,从第4 天开始与模型组相比具有显著的统计学差异 (P<0.05)。此外,补充CM 缓解了结肠炎小鼠的其它病理学特征,包括大便隐血和腹泻。
2.2 结肠长度和病理组学评分
解剖小鼠后,取出结肠组织观察结肠长度变化。结肠长度变化是衡量炎症的一个重要标准,炎症加剧,结肠会肿胀缩短。如图3所示,空白组小鼠结肠组织长度最长,表面光滑且未见肿胀,肠内粪便成型,而模型组结肠长度最短,与空白组结肠长度相比具有显著统计学差异(P<0.05),且表现出明显水肿,肠内粪便呈黄色水样脓液。通过CM干预后,结肠缩短情况有所缓解,CM+DSS 组小鼠结肠长度与模型组相比具有显著的统计学差异(P<0.05),表明CM 可以缓解结肠炎小鼠结肠缩短的症状。

图3 驼乳对结肠炎小鼠结肠长度的影响Fig.3 The effect of camel milk on the colon length of mice with colitis
如图4所示,通过H&E 染色结果表明,空白组和CM 组小鼠结肠组织腺体排列整齐,结肠黏膜完整,隐窝正常,未见病变;模型组小鼠结肠组织腺体排列紊乱,肠黏膜被破坏,弥漫性溶解坏死,隐窝和杯状细胞明显减少,炎性细胞浸润情况严重,病变严重,导致组织损伤评分显著升高,与空白组相比具有显著的统计学差异 (P<0.05);CM+DSS 组小鼠结肠组织黏膜破坏程度减少,组织较完整,小部分腺体缺失,炎性细胞浸润少,炎症程度较模型组减轻,组织损伤评分降低,与模型组相比具有显著的统计学差异(P<0.05),表明CM可以明显改善结肠炎小鼠的组织损伤情况。
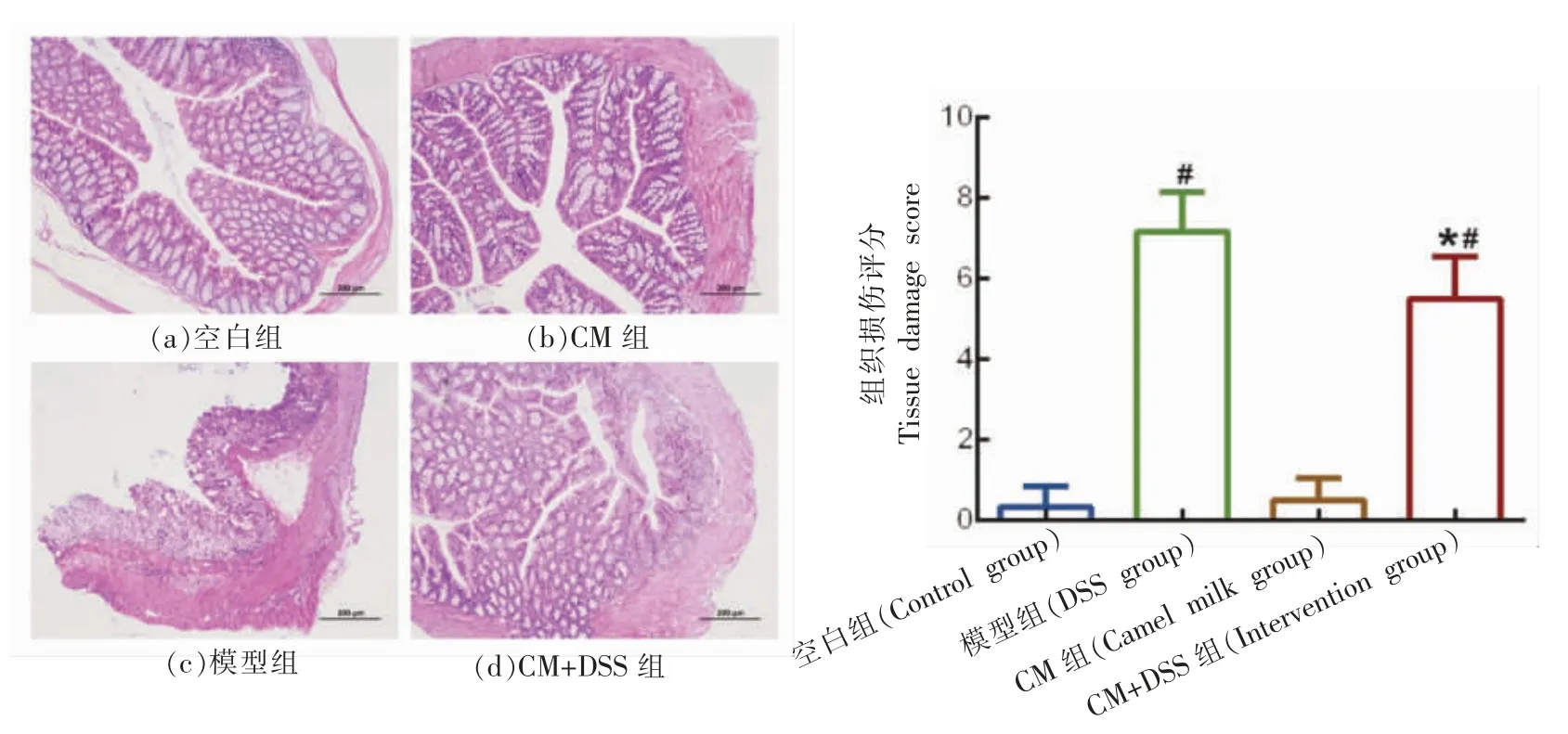
图4 小鼠结肠组织HE 染色病理图及组织损伤评分Fig.4 HE staining pathology and tissue damage score of mouse colon tissue
2.3 TUNEL 法检测肠上皮细胞凋亡
肠上皮细胞的凋亡和增殖是维持肠道内缓解稳态的关键[19]。由病理切片结果得知结肠炎小鼠肠黏膜被破坏,因此通过TUNEL 法进一步检测肠上皮细胞的凋亡情况,探讨CM 是否通过调节细胞凋亡来维持上皮的完整性。如图5所示,TUNEL检测结果发现,空白组和CM 组小鼠结肠上皮组织无细胞凋亡特征;模型组小鼠肠上皮组织伴有组织损伤的细胞凋亡特征,细胞凋亡数最多;CM+DSS 组小鼠肠上皮组织细胞凋亡明显减少,说明CM 可能通过抑制肠上皮细胞凋亡来改善肠道屏障功能的完整性。

图5 驼乳对结肠炎小鼠组织细胞凋亡的影响Fig.5 The effect of camel milk on cell apoptosis in mice with colitis
2.4 紧密连接蛋白Claudin-1、Occludin 和ZO-1 的表达
由于肠上皮黏液层是抵御病原体入侵的第一道防线,其功能在很大程度上依赖于细胞间紧密连接,因此检测了紧密连接蛋白Claudin-1、Occludin 和ZO-1 在结肠组织中的表达与分布。如图6、图7和图8,免疫组化染色结果所示,在空白组和CM 组中Claudin-1、Occludin 和ZO-1 的表达量较高,主要分布在肠上皮细胞顶端的表面与隐窝之间,排列整齐,呈连续性分布;在模型组中Claudin-1、Occludin 和ZO-1 的表达量明显减少,还有少量阳性细胞,排列紊乱,呈不连续性分布,部分区域出现完全丢失的情况;在CM+DSS 组中Claudin-1、Occludin 和ZO-1 的表达量和阳性细胞数量显著高于模型组。

图6 各组小鼠结肠组织中Claudin-1 蛋白的免疫组化染色Fig.6 Immunohistochemical staining of Claudin-1 protein in the colon tissue of mice in each group

图7 各组小鼠结肠组织中Occludin 蛋白的免疫组化染色Fig.7 Immunohistochemical staining of Occludin protein in the colon tissue of mice in each group

图8 各组小鼠结肠组织中ZO-1 蛋白的免疫组化染色Fig.8 Immunohistochemical staining of ZO-1 protein in colon tissue of mice in each group
2.5 小鼠结肠MPO 活性及血清IL-1β、IL-6 和IL-10 含量
MPO 是中性粒细胞浸润的重要标志。如图9所示,饮用2.5% DSS 后,模型组小鼠的结肠MPO活性最高,与空白组相比具有显著的统计学差异(P<0.05)。通过驼乳干预后,CM+DSS 组的MPO活性明显低于模型组,且与模型组具有显著的统计学差异(P<0.05),表明CM 可能通过减少炎性细胞的浸润从而改善炎症。
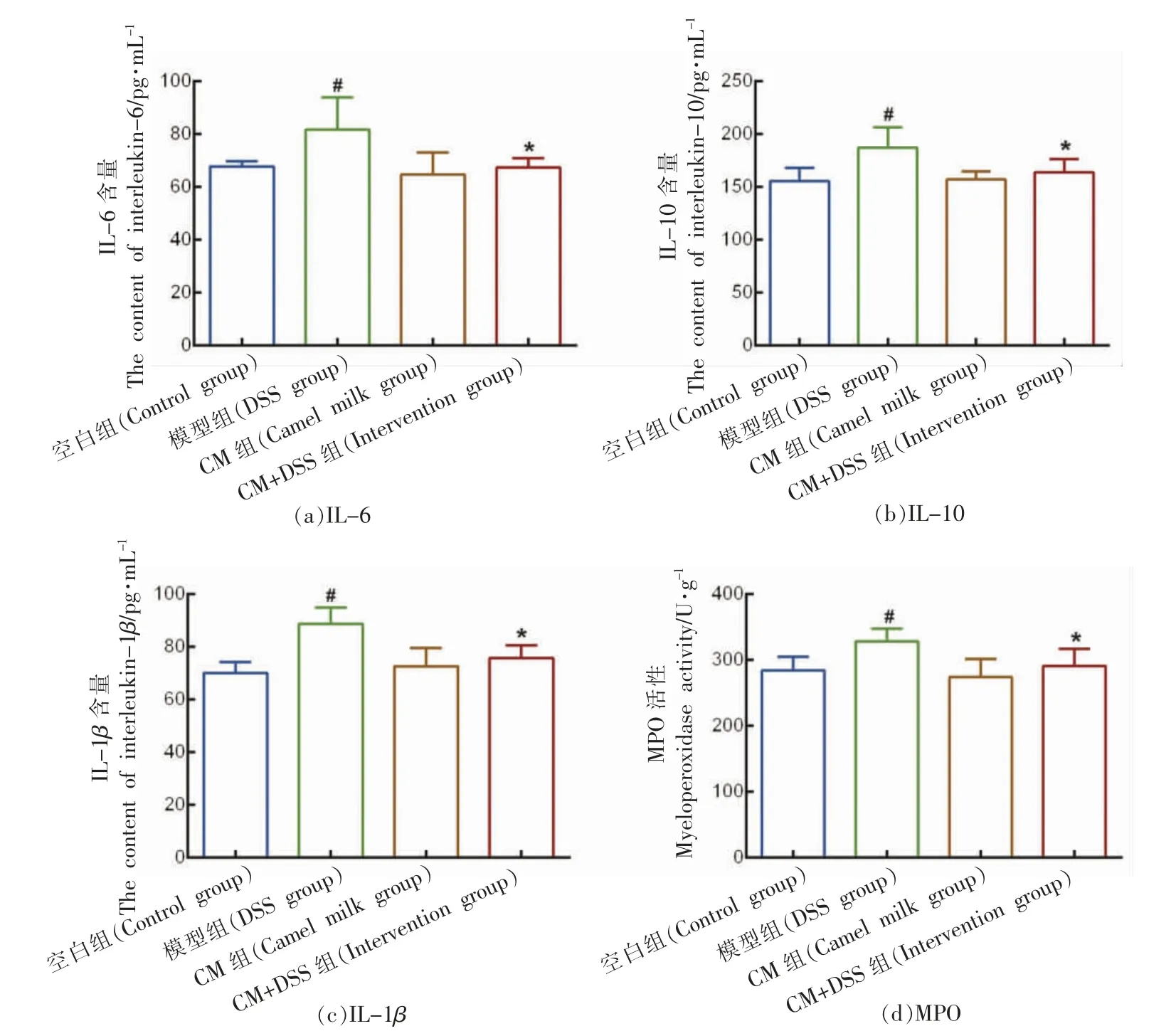
图9 驼乳对结肠炎小鼠血清炎性细胞因子含量的影响Fig.9 The effect of camel milk on serum inflammatory cytokine levels in colitis mice
ELISA 检测结果所示,与空白组相比,模型组小鼠中结肠组织的炎性细胞因子IL-6、IL-10 和IL-1β 水平升高,且具有显著的统计学差异(P<0.05),表明模型组小鼠具有炎症;通过驼乳干预后,CM+DSS 组小鼠结肠组织中的炎性细胞因子水平明显下调(P<0.05),且与模型组具有显著的
统计学差异(P<0.05),水平接近空白组,表明CM可能通过降低炎性细胞因子水平从而抑制炎症。此外,空白组与CM 组之间没有显著的统计学差异。
2.6 实时荧光定量PCR 检测结肠组织中IL-1β、IL-6 和IL-10 的mRNA 水平
为进一步确定CM 对DSS 诱导小鼠结肠炎的保护作用,检测的典型促炎细胞因子IL-1β 和IL-6 以及抗炎细胞因子IL-10 在结肠组织中mRNA的相对表达量。如图10a 所示,与空白组相比,模型组具有最高丰度的IL-6 mRNA,且与空白组具有显著的统计学差异(P<0.05),而CM+DSS 组小鼠的IL-6 mRNA 水平显著低于模型组(P<0.05)。如图10b 所示,空白组和CM 组的IL-10 mRNA表达量相对较小,而模型组的IL-10 mRNA 水平达到最高,且与空白组具有显著的统计学差异(P<0.05)。与模型组相比,CM+DSS 组的IL-10 mRNA水平显著低于模型组(P<0.05)。如图10c 所示,空白组和CM 组的IL-1β mRNA 相对表达量较小,而模型组具有最高丰度的IL-1β mRNA,且与空白组具有显著的统计学差异(P<0.05)。与模型组相比,CM+DSS 组小鼠的IL-1β mRNA 水平显著降低(P<0.05)。
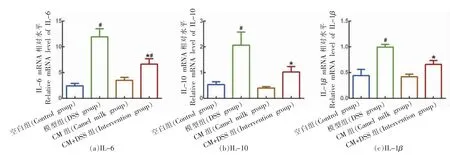
图10 驼乳对结肠炎小鼠炎性细胞因子的mRNA 影响Fig.10 The effect of camel milk on the mRNA of inflammatory cytokines in mice with colitis
3 讨论
驼乳是一种重要的膳食补充剂,可以维持身体健康,增强体力,提高疾病预防能力[7]。本研究表明,DSS 诱导的结肠炎小鼠会出现食欲不振、体重下降、腹泻、便血和结肠缩短等症状[20-21]。本试验通过给小鼠自由饮用含2.5% DSS 的水进行造模,连续饮用7 d,在第3 天开始出现腹泻,第4 天开始出现便血症状,直至第7 天时小鼠结肠炎症状加重。解剖后,结肠炎小鼠结肠组织明显水肿充血,长度缩短,HE 染色发现肠上皮黏膜被破坏、腺体排列紊乱、隐窝消失和炎性细胞浸润等症状。而通过CM 干预的小鼠,上述症状均有所改善。在改善结肠损伤的同时,驼乳还减少了肠上皮细胞的凋亡以及紧密连接蛋白Claudin-1、Occludin 和ZO-1 的缺失。因此,本研究推测CM 的保护作用归因于它的抗炎特性。
先前有研究表明,降低炎性细胞因子水平是治疗IBD 的一个重要指标[22],如TNF-α、IL-6、IL-1β 和IL-10 在IBD 的形成中起主导作用。此外,这些炎性细胞因子的基因都有NF-κB 的结合位点,并受这些因子的转录调控[23]。经本研究证实CM 干预后可明显降低促炎细胞因子IL-6 和IL-1β 水平,从而有效减缓IBD 症状。同时,本研究结果显示,随DSS 饮用抗炎细胞因子IL-10 水升高。虽然之前有研究报道结肠炎小鼠的IL-10 水平降低[24],但仍有研究表明在IBD 患者以及TNBS 和DSS 诱导的小鼠结肠炎中存在IL-10 水平升高的情况[25]。Barada 等[25]研究指出,在诱导结肠炎3 h后IL-10 水平就开始升高,1 周后达到高峰,3 周后升高4.5 倍。由于IL-10 可以下调MHC II 类抗原呈递和促炎细胞因子如TNF-a、IL-1β 和IL-6,所以认为IL-10 水平升高是一种对结肠损伤的代偿机制,可以抑制黏膜炎症。
经Su 等[26]研究证实,肠上皮屏障破坏也是IBD 形成的重要因素之一,屏障功能受损后,黏膜免疫系统暴露于肠内微生物,导致细菌和其它抗原进入,从而进一步扩大炎症。肠上皮细胞如分泌黏液并产生三叶草因子的杯状细胞和产生抗菌肽和生长因子的潘氏细胞[27],其分泌物共同构成保护性黏液层,是发挥肠屏障功能的关键。因此,维持肠上皮屏障的紧密性和完整性也是IBD 治疗的重要目标[28]。诸多研究证实,紧密连接蛋白如ZO-1、Occlutdin 和Claudin-1 与上皮屏障功能受损有关,其中ZO-1 是紧密连接中的主要蛋白,与肠上皮完整性相关[29],可作为肠道机械屏障的标志物。Occludin 对紧密连接稳定性和屏障功能十分重要[30]。Claudin-1 是一种完整的膜蛋白,是紧密连接链的组成部分[31]。本研究通过免疫组化检测紧密连接蛋白表达,结果表明,CM+DSS 组的紧密连接蛋白表达量显著增加。此外,越来越多的研究表明,肠上皮细胞凋亡参与了UC 的形成过程,并与IBD 的发病机制有关[32-33]。本研究结果表明,模型组小鼠促进肠上皮细胞凋亡,导致肠道屏障破坏,易受微生物感染。相反,CM 干预后小鼠肠上皮细胞凋亡明显减少,推测可能通过抑制细胞凋亡对肠道屏障起到保护作用。
综上所述,本研究结果揭示CM 能够通过调节肠道通透性、紧密连接蛋白表达等方式来缓解DSS 对小鼠结肠机械屏障的破坏,通过抑制炎性细胞因子的分泌来缓解结肠的炎症反应,实现对肠黏膜屏障的保护作用。
