甘肃野生羊肚菌根际土壤真菌群落与环境因子相互关系
2022-04-11赵玉卉杨阿丽魏甲乾冉永红陈志荣路等学
赵玉卉, 郭 瑞, 杨阿丽, 秦 鹏, 金 辉,魏甲乾, 冉永红, 陈志荣, 路等学*
(1.甘肃省科学院 生物研究所,甘肃 兰州 730000;2.中国科学院 兰州化学物理研究所 中国科学院西北特色植物资源化学重点实验室,甘肃 兰州 730000;3.定西市农业科学研究院,甘肃 定西 743000;4.温州医科大学 生物医学工程学院,浙江 温州 325000)
羊肚菌(Morchellaspp.)属子囊菌门(Ascomycota)盘菌纲(Pezizomycetes)盘菌目(Pezizales)羊肚菌科(Moechellaceae)羊肚菌属(Morchella),因其外形似羊肚而得名[1]。羊肚菌富含蛋白质、大量人体必需氨基酸,多种维生素和高含量的铁、锌以及多种矿质元素[2-3],具有抗射线、抗肿瘤、抗氧化、抗疲劳作用以及降血压、降血脂、调节免疫力的功效[4]。羊肚菌经济价值和科研价值高,人工栽培一直是研究的热点。2012年后,我国羊肚菌大田种植技术取得重要进展,在全国范围内得到推广,种植面积陡增。经过10多年的发展,出菇不稳定、不出菇、产量不高等问题依然普遍存在,且有新的问题不断出现,如病虫害[5-8]和连作障碍[9-10]等问题。究其原因是羊肚菌基础理论的研究不够,羊肚菌的生活史、菌核的机理、分生孢子的作用等有待进一步研究;羊肚菌是一种土生菌,不覆土羊肚菌无法出菇,可见土壤中含有特定刺激其结实的有益因子[11]。土壤中除了营养物质,丰富的土壤微生物对其生长有一定的影响。已有研究者对羊肚菌内生细菌、根际土壤细菌多样性等进行了研究[12-15],结果表明羊肚菌根际土壤的细菌多样性指数和丰度比非根际土壤的高。关于羊肚菌根际土壤真菌群落方面的研究较少,何培新等[16]对羊肚菌内生真菌进行了研究,结果表明粗柄羊肚菌的内生真菌中,毛壳属是3个发生地的共有内生真菌,其他内生真菌均为发生地特异种类。有研究显示真菌群落中,高丰度的孔球孢属(Gilmaniella)似乎与室内红褐羊肚菌(Morchellarufobrunnea)的结实有关,而优势菌群头束霉属(Cephalotrichum)与不出菇有关[17]。土壤理化性质与土壤酶是影响土壤微生物群落数量、结构的主要因素之一[18],但羊肚菌根际土壤理化性质及酶活性与真菌群落相互关系的研究未见相关报道。本研究采用高通量测序技术,对甘肃不同地区羊肚菌根际土壤真菌群落组成、多样性等结构特征进行系统研究,并结合土壤理化性质和酶活性,分析羊肚菌根际微生态各要素之间的相互关系,以期揭示根际微生态系统对羊肚菌生态适应的内在机制,并为羊肚菌的人工种植及生态功能研究提供参考。
1 材料与方法
1.1 材料
1.1.1 样品来源 根据羊肚菌在甘肃省不同区域的分布情况,设置9个采样点,在相同经纬度分别设置DS、DC采样点和LC、LK采样点。原因是DS、LC采样点的羊肚菌属黑色系,而DC、LK采样点的羊肚菌属黄色系,其他采样点羊肚菌均为黑色系,具体信息见表1。每个采样点内设置3个10 m×10 m样方,作为平行重复,每个样方内选取长势良好的羊肚菌,用干净的铁铲采集子实体及其半径5 cm、深度0~5 cm的土壤,从距离羊肚菌根际最近的位置用无菌毛刷收集土壤,混合土样,低温带回实验室,放入-80 ℃冰箱冷冻备用。
1.1.2 试剂与仪器 土壤DNA提取试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit(OMEGA公司);土壤酶活试剂盒(苏州科铭生物技术有限公司)。pH计(PHS-3C,上海越平);紫外分光光度计(TU-1950,北京普析通用仪器有限责任公司);高频红外碳硫测定仪(COREY-200,德阳市科瑞仪器设备厂); 自动定氮仪(K12,上海晟声自动化分析仪器有限公司);电感耦合等离子体直读光谱仪(ICAP-7400,赛默飞世尔科技有限公司); 原子荧光光谱仪(AFS-2000,北京海光仪器有限公司);离子色谱仪(Aquion,赛默飞世尔科技有限公司); 火焰原子吸收仪(Z-2000,日本日立公司)。
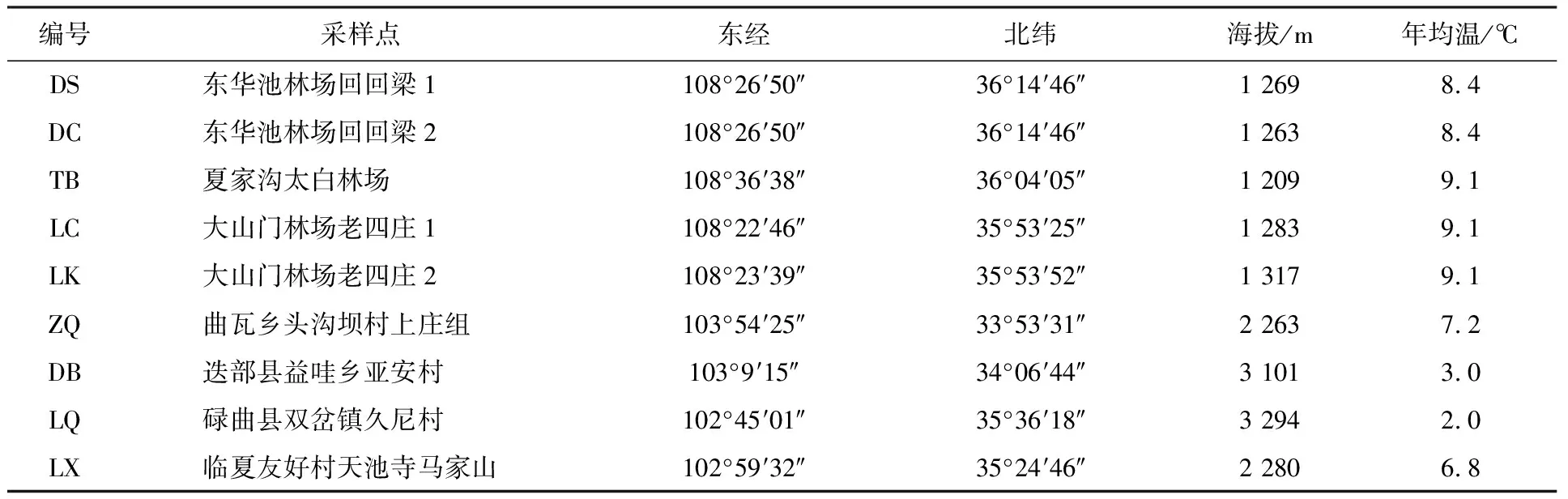
表1 野生羊肚菌采样地信息表
1.2 方法
1.2.1 土壤理化性质及酶活性测定 土壤pH值采用酸度计测定[19],以去除CO2的纯水为浸提剂,V水∶V土=2.5∶1;土壤温度使用土壤温度计测定;采用重铬酸盐法[20]测定土壤有机质含量;采用重铬酸钾硫酸消化法[21]测定土壤全氮含量;全碳使用高频红外碳硫测定仪测定;铵态氮采用自动定氮仪测定;硝态氮采用离子色谱仪测定;有效磷采用紫外分光光度计测定;速效钾采用火焰原子吸收仪测定;土壤微量元素(Fe、Ca、Mg)含量采用电感耦合等离子体直读光谱仪测定;Se测定采用原子荧光光谱仪测定。土壤含水量采用烘干法测定,用0.1 g 精度的天平称取土样重量,记作土样湿质量重M,105 ℃烘干土样6~8 h至恒重,记作土样干质量重Ms。土壤含水量(%)=((烘干前铝盒及土样质量-烘干后铝盒及土样质量)/(烘干后铝盒及土样质量-烘干空铝盒质量))×100%。土壤多酚氧化酶活性采用没食子素比色法测定;土壤过氧化物酶活性采用邻苯三酚比色法测定;土壤脲酶活性采用靛酚蓝比色法测定;脱氢酶活性采用三苯基四氮唑氯化物(TTC) 比色法测定;土壤碱性磷酸酶活性采用磷酸苯二钠比色法测定;芳基硫酸酯酶活性采用对-硝基苯酚比色法测定;谷氨酰胺酶活性采用氨比色法测定;β-葡萄糖苷酶活性采用对-硝基苯酚比色法测定。
1.2.2 土壤样品总DNA提取与Mi-Seq测序 对采集到的羊肚菌根际土壤样品,利用土壤DNA提取试剂盒E.Z.N.ATM Mag-Bind Soil DNA Kit对土壤总基因组DNA进行提取,采用琼脂糖凝胶电泳检测DNA的纯度和浓度。扩增区域为ITS1-2,通用引物ITS1F:CCCTACACGACGCTCTTCCG-ATCTN (barcode) CTTGGTCATTTAGAGGAAGTA-
A,ITS2-R引物:GTGACTGGAGTTCCTTGGCACC-CGAGAATTCCAGCTGCGTTCTTCATCGATGC。扩增体系:15 μL×Taq2 master Mix,1 μL Bar- PCR primer F(10 μmol/L), 1 μL primerR(10 μmol/L),Genomic DNA 10~20 ng,加H2O补足至30 μL。扩增条件为94 ℃ 3 min,94 ℃ 30 s、45 ℃ 20 s、65 ℃ 30 s 5个循环,94 ℃ 20 s、55 ℃ 20 s、72 ℃ 30 s 20个循环,72 ℃ 5 min。第二轮扩增引入Illuminn桥式PCR兼容引物。扩增体系:15 μL 2×Taqmaster Mix,1 μL Bar-PCR primerF(10 μmol/L), 1 μL primerR(10 μmol/L),PCR products(上一轮)20 ng,加H2O补足至30 μL。扩增条件为95 ℃ 3 min,94 ℃ 20 s、55 ℃ 20 s,72 ℃ 30 s 5个循环,72 ℃ 5 min。PCR扩增产物经琼脂糖凝胶电泳检测后回收纯化,应用Illumina MiSeq 2×300 bp平台进行宏基因组测序。测序服务和生物信息分析工作由上海生工生物工程有限公司完成。
1.2.3 生物信息学分析 Illumina Mi-seqTM得到的原始图像数据文件经CASAVA碱基识别 (Base Calling) 分析转化为原始测序序列(Sequenced Reads),称之为 Raw Data或Raw Reads。Miseq测序序列中含有barcode序列,以及测序时加入的引物和接头序列,首先需要去除引物接头序列,再根据PE reads之间的overlap关系,将成对的reads 拼接 (merge) 成一条序列,然后按照barcode标签序列识别并区分样品得到各样本数据,最后对各样本数据的质量进行质控过滤,得到各样本有效数据(clean reads)。用Usearch 5.2.236软件对所有样品的全部clean reads序列进行OTUs聚类(97%的一致性)。用Qiime 中的 BLAST方法与 RDP数据库进行物种注释分析,OTUs 的丰度初步表明样品的物种丰度。获得的数据提交GenBank,登录号:DS(SRR11905350、SRR11905361、SRR11905362), DC(SRR11905340、SRR11905341、SRR11905342), TB (SRR11905337、SRR11905338、SRR11905339), LC(SRR11905336、SRR11905359、SRR11905360), LK(SRR11905356、SRR11905357、 SRR11905358), ZQ(SRR11905353、SRR11905354、SRR11905355), DB(SRR11905349、SRR11905351、SRR11905352), LQ(SRR11905346、SRR11905347、SRR11905348), LX(SRR11905343、SRR11905344、SRR11905345)。
1.2.4 数据分析 采用QIIME计算的指数,利用软件R进行稀释度曲线绘制;利用Mothur 软件进行单个样品的α多样性分析(Alpha Diversity),
基于OTU的结果,对Shannon、Chao1、ACE指数进行计算,用以进行生物多样性分析。用RDP classifier分析方法,基于Bergey′s taxonomy,采用Naïve Bayesian assignment算法对每条序列在不同层级水平上计算其分配到此rank中的概率值。用Qiime 中的 BLAST方法与 Unite数据库进行物种注释分析,各组样品在不同水平上的分类比较柱形图、单个样品的群落分布柱形图使用R软件获得。
2 结果与分析
2.1 野生羊肚菌根际土壤理化性质及酶活性
由表2可知,ZQ、DB、LQ、LX采样点羊肚菌根际土壤呈酸性,DS、DC、TB、LC、LK采样点羊肚菌根际土壤呈碱性,pH范围6.46~8.19。大量元素随海拔升高有逐渐增加的趋势,DB采样点含量最高,DC采样点含量最低,各采样点微量元素变化各异。9个采样点中,土壤多酚氧化酶(PPO)、过氧化物酶(POD)、脲酶(UE)、芳基硫酸酯酶(ASF)随海拔升高而降低;而β-葡萄糖苷酶(β-GC)、脱氢酶(DHA)、碱性磷酸酶(AKP)随着海拔升高而升高;β-葡萄糖苷酶的酶活性在DB采样点显著高于其他采样点;谷氨酰胺酶(GLS)在各采样点变化不大。
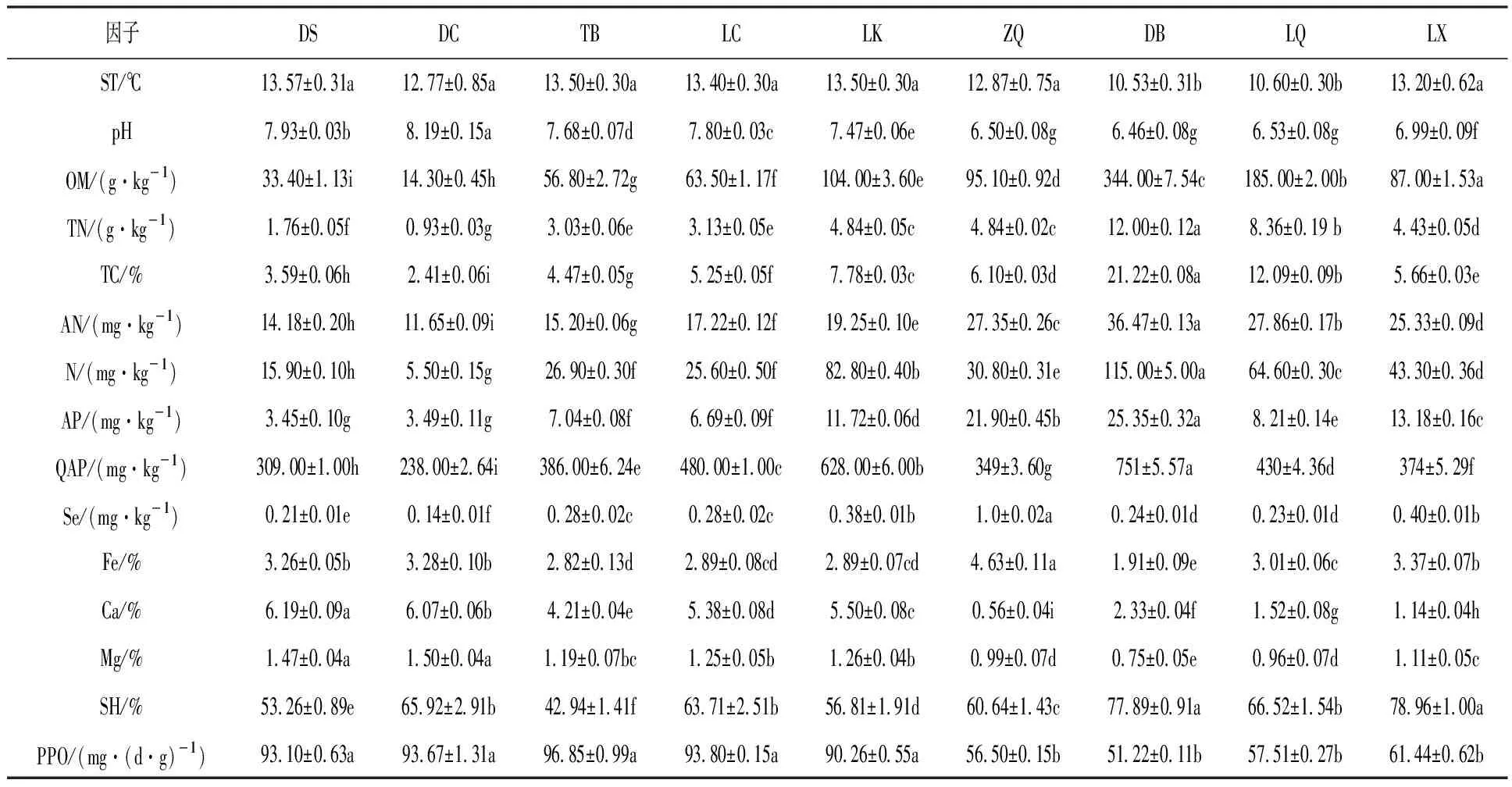
表2 野生羊肚菌采样点根际土壤理化性质及酶活性
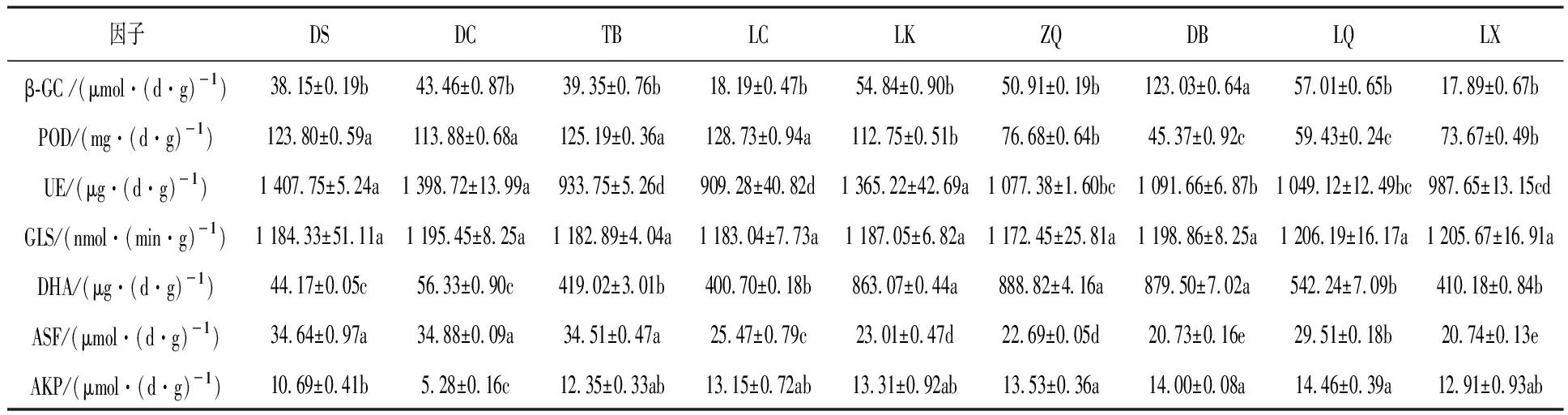
续表2
2.2 野生羊肚菌根际土壤真菌群落丰度
9个羊肚菌根际土壤样品,以大于97%相似性聚类得到21 846个真菌OTU,统计结果见表3。各样品测序覆盖度在98.92%以上,样品稀释曲线显示,随着测序样品数目的增加,9个样品的OTUs稀释曲线趋于平缓,表明本实验测序的数据量渐进合理,能较全面地反映测序样品的真菌群落组成,数据量的增多对于发现新的OTU数目的贡献变小(图1)。
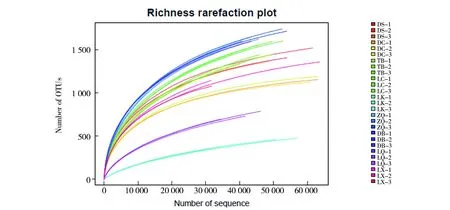
图1 野生羊肚菌根际土壤真菌OTU稀疏度曲线图Fig.1 Curve of fungi OTU thinning in rhizosphere soil of wild morels
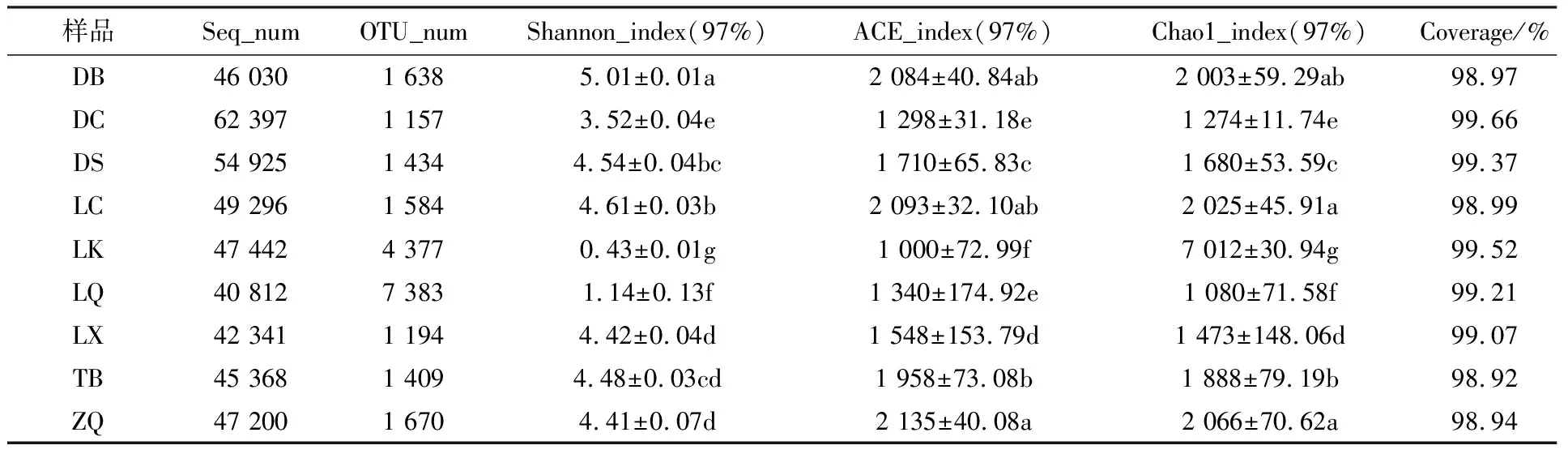
表3 野生羊肚菌根际土壤测序结果及Alpha多样性分析
2.3 不同采样点真菌多样性及相关性分析
Shannon指数反应群落的多样性受样品群落中物种丰富度和物种均匀度的影响,Chao1指数和ACE指数反映样品中群落的丰富度。9个采样点羊肚菌根际土壤真菌Alpha分析结果见表3,Shannon指数分析结果为DB>LC>DS>TB>LX >ZQ>DC>LQ>LK; Chao1指数分析结果为LK>ZQ>LC>DB>TB>DS>LX>DC>LQ;ACE指数分析结果为ZQ>LC>DB>TB>DS>LX>LQ>DC>LK;DB、LC采样点羊肚菌根际土壤真菌多样性最高,Shannon指数分别为5.01和4.61; LK、ZQ 、LC采样点根际土壤真菌丰富度最高。
在97%相似度下得到每个样品的OTU个数,利用Python绘制韦恩图,展示出多样品间相同的和特有的OTU数以及重叠情况,如图2所示,9个采样点共有的OTU数32个,特有的OTU数较多。
2.4 野生羊肚菌根际土壤真菌群落组成分析
不同采样点羊肚菌根际土壤在门水平的物种组成结果见图3,9个采样点中共检测到18个门的真菌。采样点DS、TB、LC、LK、ZQ、DB、LQ、LX优势菌门为子囊菌门,DC采样点优势菌门为担子菌门,其次是子囊菌门;除DC采样点,其他采样点子囊菌门的占比均在45%以上,LK、LQ子囊菌门的占比达到96%以上;未分类真菌在LK采样点占比最低为0.38%,在LC采样点占比最高为23.38%;在所有采样点中担子菌和子囊菌的占比最高的是LQ采样点,为98.13%,最低的是ZQ采样点,为60.94%。
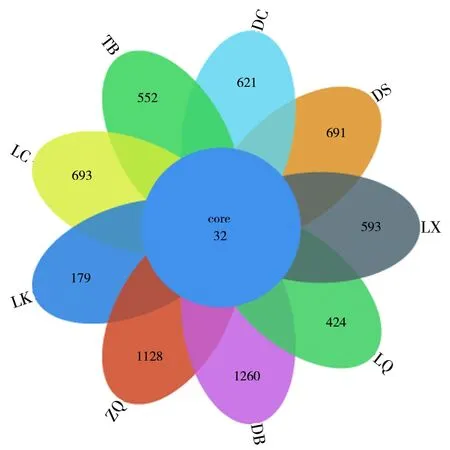
图2 不同采样点真菌多样性的相关性分析Fig.2 The similarity analysis of fungal diversity among samples
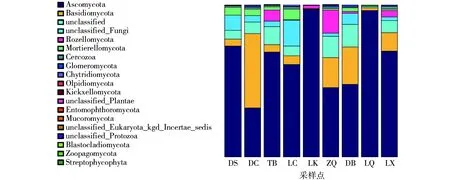
图3 野生羊肚菌根际土壤真菌在门水平上的分类比较Fig.3 Taxonomic comparison of fungal in rhizosphere soil of wild morels at phylum level
不同采样点羊肚菌根际土壤在纲水平的物种组成结果见图4,9个采样点中共检测到55个纲的真菌。DS、DC、TB、LC采样点共有的优势菌纲是座囊菌纲(Dothideomycetes)和粪壳菌纲(Sordariomycetes);DC、ZQ、DB、LQ、LX采样点的共有优势菌纲是伞菌纲(Agarico-mycetes);LK、LQ采样点共有的优势菌纲是占比很高的盘菌纲(Pezizomycetes);DB、LQ、LX、LC采样点共有的优势菌纲是锤舌菌纲(Leotiomycetes);ZQ采样点独有的优势菌纲是散囊菌纲(Euroti-omycetes)。
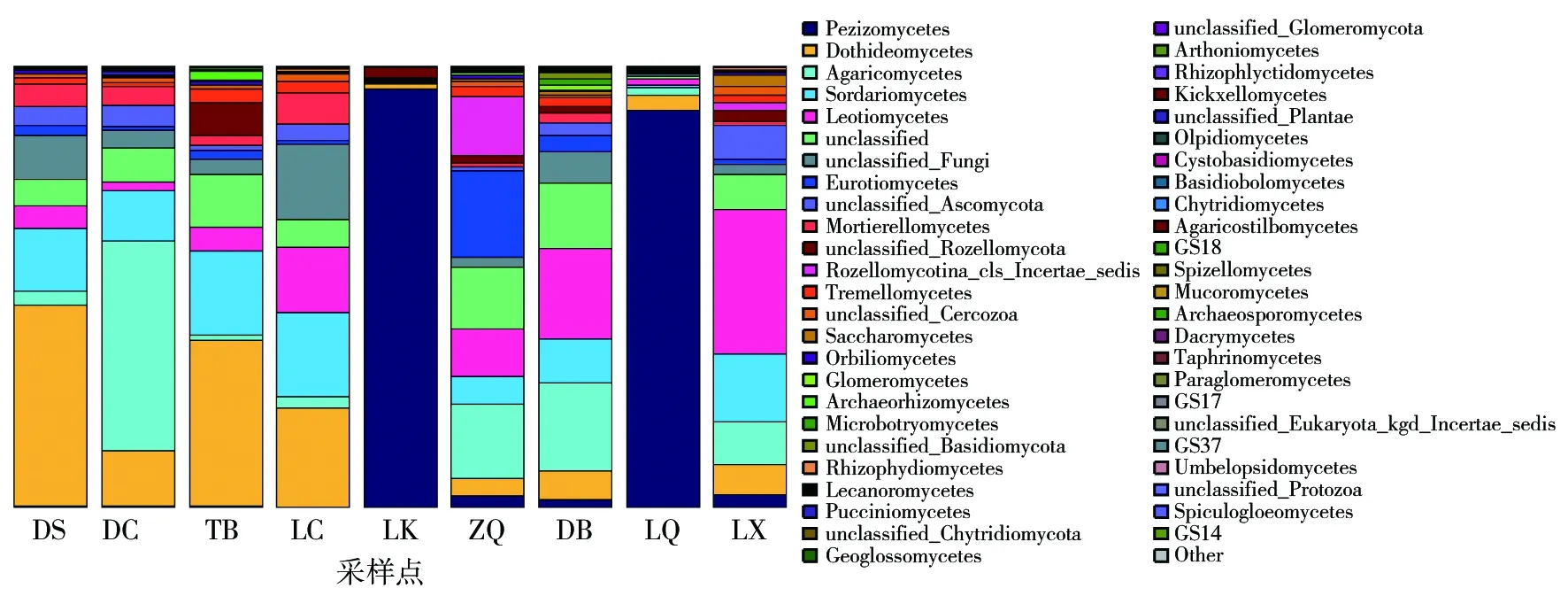
图4 野生羊肚菌根际土壤真菌在纲水平上的分类比较Fig.4 Taxonomic comparison of fungal in rhizosphere soil of wild morels at class level
不同采样点羊肚菌根际土壤在科水平的物种组成结果见图5,9个采样点中共检测到350个科的真菌。在科水平,不同采样点的优势菌科差异较大,DS、TB、LC采样点,存在共同的优势菌科亚隔孢壳科小双腔菌科(Didymellaceae);所有采样点中,均存在一定量的unclassified,说明羊肚菌根际土壤存在一些未知的真菌;DS采样点的优势菌科为小双腔菌科(Didymellaceae)(23.03%)、暗壳腔菌科(Phaeosphaeriaceae)(10.63%)、unclassified_Fungi(9.75%)、unclassified(5.96%);DC采样点的优势菌科为未分类的木耳目(unclassified_Auriculariales)(40.54%)、unclassified (7.65%)、格孢腔菌科(Sporormiaceae)(7.26%)、绿核虫草(Cordycipitaceae)(5.21%);TB采样点优势菌科为unclassified(11.96%)、小双腔菌科(Didymellaceae)(10.15%)、球腔菌科(Mycosphaerellaceae)(9.49%),枝孢霉科(Cladosporiaceae)(7.66%);LC采样点的优势菌科为 unclassified_Fungi(17.11%)、unclassified_Leotiomycetes(13.58%)、小双腔菌科(Didymellaceae)(8.56%)、unclassified (7.27%);LK采样点的优势菌科为盘菌科(Pezizaceae) (94.58%)、unclassified_Rozellomycota(2.31%);ZQ采样点的优势菌科为曲霉科(Aspergillaceae)(19.18%)、unclassified(14.07%)、unclassified_GS11(13.13%);蜡伞科(Hygrophoraceae)(12.36%);DB采样点的优势菌科为蜡壳耳科(Sebacinaceae)(16.36%)、unclassified(14.96%)、晶杯菌科(Hyaloscyphaceae)(8.34%)、unclassified_Fungi(7.10%);LQ采样点的优势菌科为羊肚菌科(Morchellaceae)(89.96%)、荚胞腔菌科(Sporormiaceae)(0.98%);LX采样点的优势菌科为柔膜菌科(Helotiaceae)(18.97%)、unclassified(7.86%)、unclassified_Ascomycota(7.81%)、unclassified_Leotiomycetes(6.82%)。
不同采样点羊肚菌根际土壤在属水平的物种组成结果见图6,9个采样点中共检测到775个属的真菌。DS采样点Paraboeremia(15.56%)、unclassified_phaeosphaeriaceae未分类的暗壳腔菌科(10.45%)、unclassified_Fungi(9.75%)、Nothophoma(6.25%);DC未分类的木耳属类unclassified_Auriculariales(40.54%)、unclassified(7.65%)、光黑壳属(Preussia)(7.08%)、白僵菌属(Beauveria)(5.13%);TB采样点未分类的木耳属类unclassified_Auriculariales(20.31%)、Paraboeremia(7.78%)、unclassified_Fungi(6.86%)、unclassified(6.81%);LC采样点未分类的真菌unclassified_Fungi(17.11%)、未分类的锤舌菌纲(unclassified_Leotiomycetes)(13.58%)、unclassified(6.27%)、被孢霉属(Mortierella)(5.68%);LK采样点盘菌属(Peziza)(94.58%)、未分类的罗兹菌门unclassified_Rozellomycota(2.31%);ZQ采样点青霉属(Penicillium)(19.17%)、unclassified(14.07%)、unclassified_GS11(13.13%)、湿伞属(Hygrocybe)(12.31%);DB采样点蜡壳菌属(Sebacina)(16.35%)、unclassified(14.96%)、未分类的真菌门类unclassified_Fungi(7.10%)、Gyoerffyella(6.24%);LQunclassified_Morchellaceae(89.34%)、LXunclassified_Helotiaceae(17.51%)、unclassified(7.86%)、unclassified_Ascomycota(7.81%)。
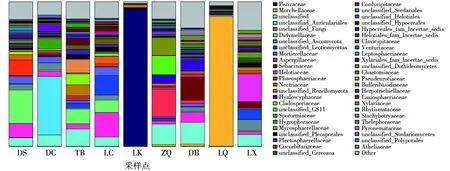
图5 野生羊肚菌根际土壤真菌在科水平上的分类比较Fig.5 Taxonomic comparison of fungal in rhizosphere soil of wild morels at family level
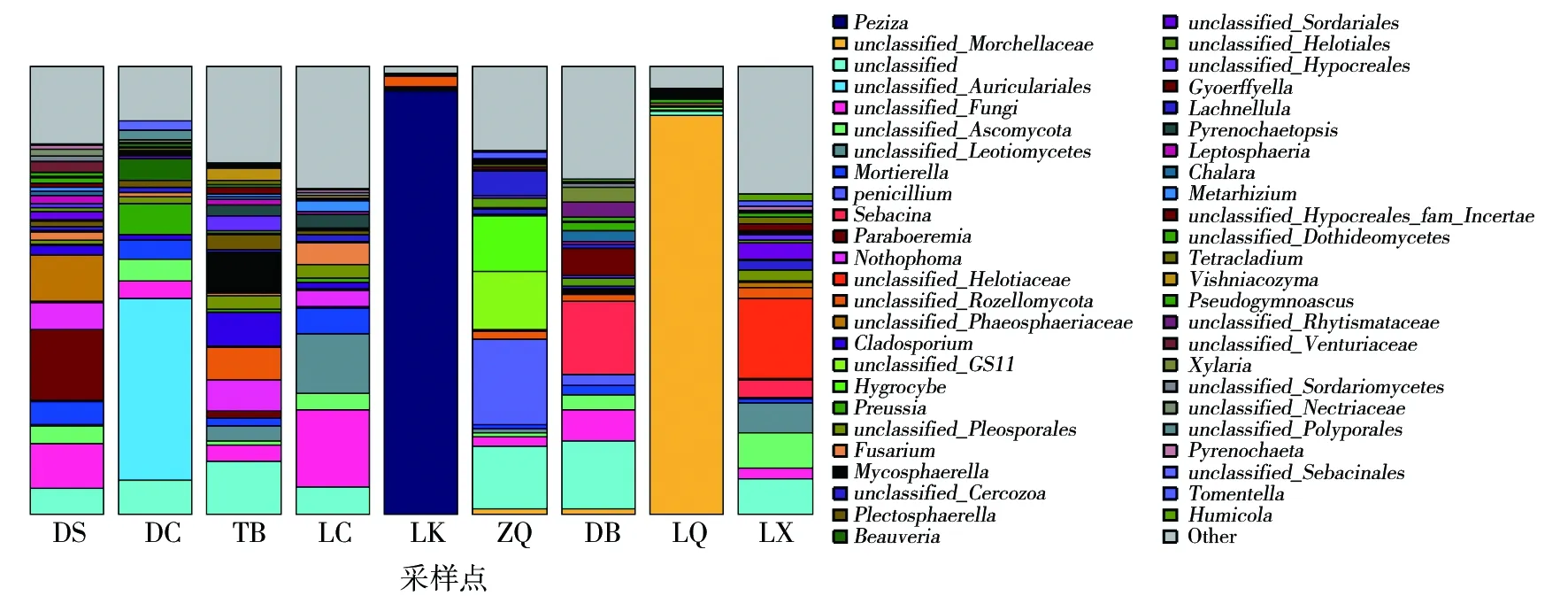
图6 野生羊肚菌根际土壤真菌在属水平上的分类比较Fig.6 Taxonomic comparison of fungal in rhizosphere soil of wild morels at genus level
2.5 野生羊肚菌土壤真菌群落结构与土壤环境因子相互关系
对9个采样点野生羊肚菌根际土壤真菌群落进行主成分分析,结果见图7。真菌群落受主坐标成分PCA1与PCA2的影响分别达到67%和16%。DS、LC、DB、DC、LX、TB采样点真菌群落在PCA2轴上,ZQ采样点距离PCA2轴很近,表明这6个采样点的真菌群落结构相似,受主成分PCA2的影响;LQ 采样点在PCA1轴上,距离PCA2轴较远,受主成分PCA1的影响较大;LK采样点距离PCA2轴较远,受主成分PCA1的影响较大;LQ和LK两个采样点的真菌群落与其他6个采样点的真菌群落差异较大,LQ和LK采样点真菌群落的差异最大。
通过RDA分析,探明土壤环境因子与羊肚菌根际土壤真菌群落的相关关系,结果见图8。第一、二排序轴累计解释率分别为 55.2%和29.7%, 累计解释率达到84.9%,说明第一、二排序轴能较好地反映真菌群落与土壤理化性质、酶活性之间的相关关系。主要的真菌类群中,子囊菌门与速效钾、谷氨酰胺酶、脲酶、硝态氮、碱性磷酸酶箭头方向一致,说明子囊菌与速效钾、谷氨酰胺酶、脲酶、硝态氮、碱性磷酸酶和脱氢酶正相关;Rozellomycota和Olpidiomycota与硒、铁、有效磷、氨态氮、脱氢酶呈正相关,与钙、多酚氧化酶、镁、pH呈负相关;壶菌门、unclassified_Fungi、Mortierellomycota与脱氢酶、碱性磷酸酶、硝态氮呈负相关。子囊菌门在LK与LQ采样点优势明显;LC、DS采样点相聚较近,真菌菌群结构相近;DC、DB采样点相距较近,真菌菌群结构相近;ZQ采样点的真菌群落组成与其它采样点差异较大。
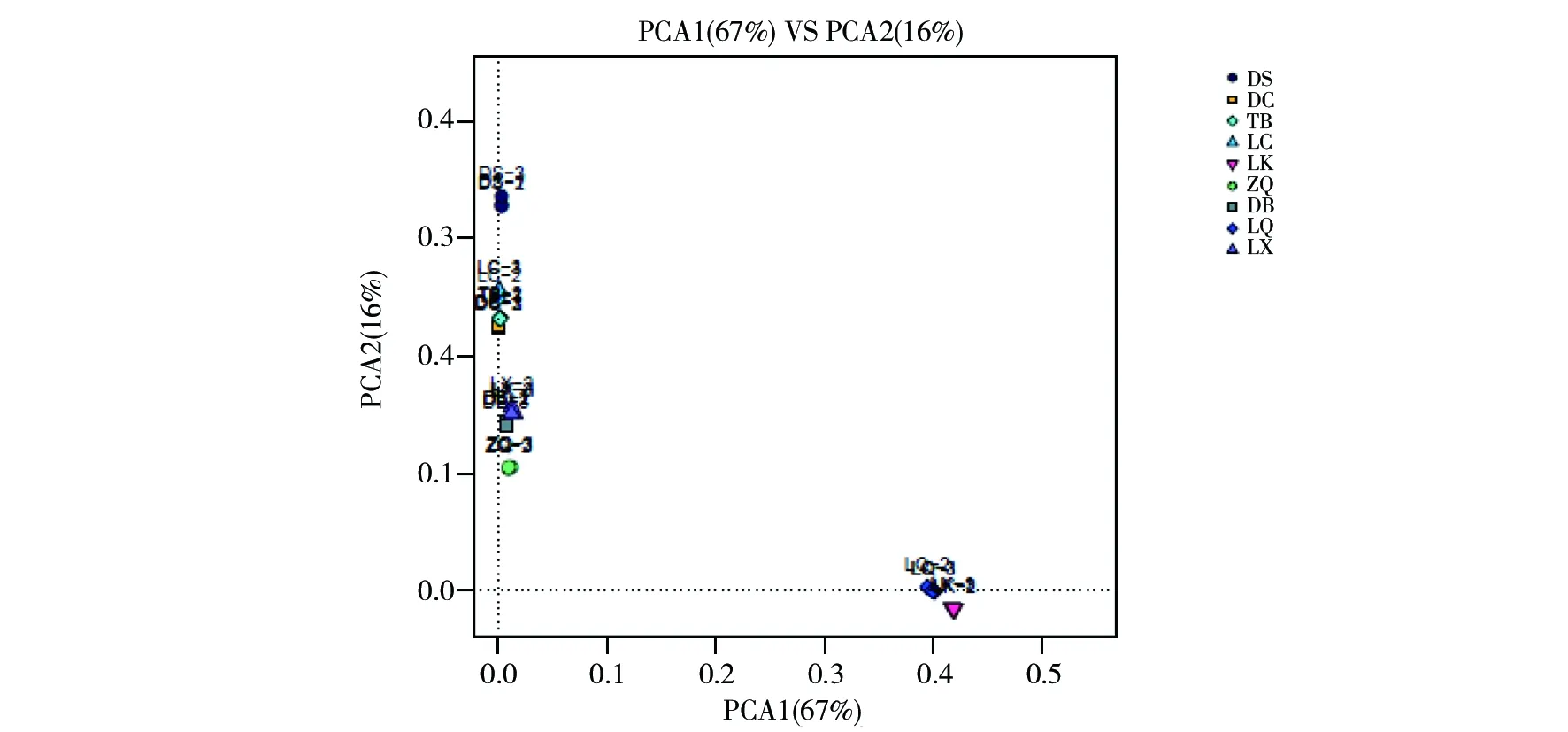
图7 野生羊肚菌土壤真菌群结构PCA分析Fig.7 PCA analysis of soil fungal community structure of wild morels
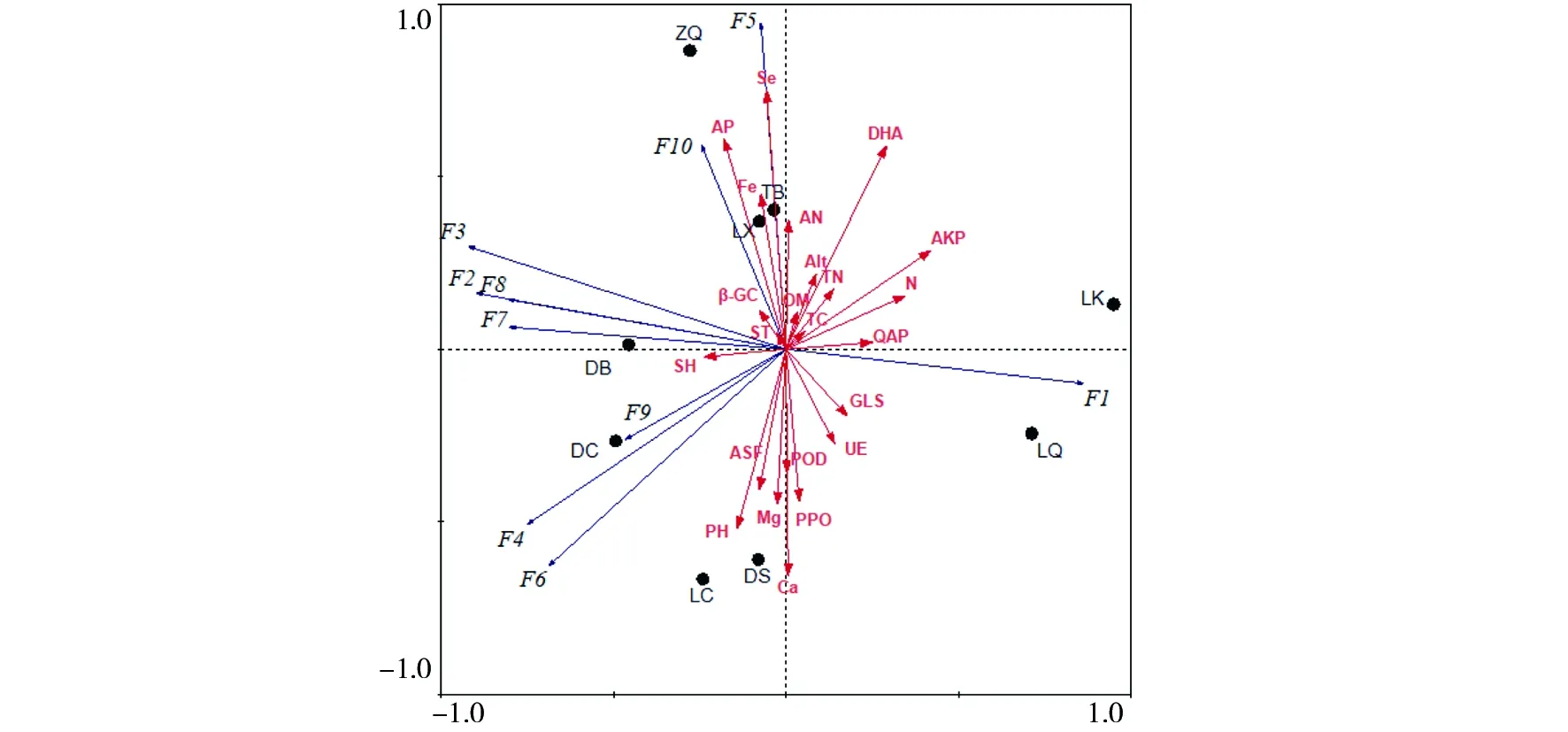
图8 野生羊肚菌根际土壤门水平真菌群落与环境因子的相关性RDA分析Fig.8 RDA analysis of the correlation between the fungal community and environmental factors in the rhizosphere soil phylum of wild morels红色箭头代表土壤酶活和理化性质在水平面上的相对位置,箭头与排序轴的夹角不同,则其余弦值不同,即二者的相关性强度也不同。夹角越小,相关性越大;箭头的长度越长,代表该环境因子发挥的作用越大;蓝色箭头代表门水平上的物种分布,箭头越长代表物种在样品中的影响越大;黑色圆点代表不同采样点。各真菌编号代表: F1:子囊菌门;F2:担子菌门;F3:unclassified;F4:unclassified_Fungi;F5:Rozellomycota;F6:Mortierellomycota;F7:Cercozoa;F8:Glomeromycota;F9:壶菌门;F10:Olpidiomycota;AN:氨态氮;AP:有效磷;QAP:速效钾;N:硝态氮;SH:含水率;ST:土壤温度;TC:全碳;OM:有机质;PPO:多酚氧化酶;POD:过氧化物酶;UE:脲酶;ASF:芳基硫酸酯酶;β-GC:β-葡萄糖苷酶;DHA:脱氢酶;AKP:碱性磷酸酶;GLS:谷氨酰胺酶The red arrow represent the relative position of soil physical and chemical properties and enzyme activity on the horizontal plane, the angle between the arrow and the sort axis is different, the correlation strength is also different, the smaller the angle, the greater the correlation; The longer the length of the arrow, the greater the effect of the environmental factor; The blue arrow represents the species distribution at the class level, and the longer the arrow, the greater the impact of the species in the sample.F1:Ascomycota;F2:Basidiomycota;F3:unclassified;F4:unclassified_Fungi;F5:Rozellomycota;F6:Mortierellomycota;F7:Cercozoa;F8:Glomeromycota;F9:Chytridiomycota;F10:Olpidiomycota;AN:Ammonia nitrogen;AP:Available phosphorus;QAP:Rapidly available potassium;N:Nitrate;SH:Soil humidity;ST:Soil temperature;TC:Total carbon;OM:Organic material;PPO:Polyphenol oxidase;POD:Peroxidase;UE:Urease;ASF:Arylsulfatase;β-GC:β-glucosidase;DHA:Dehydrogenase;AKP:Alkaline phosphatase;GLS:glutaminase
3 讨 论
土壤中微生物的种类、群落结构对生态系统的结构和功能具有重要的影响,土壤微生物与植物的互作已有很多的研究,而关于大型真菌与微生物互作的研究很少。本研究通过对甘肃不同地区羊肚菌根际真菌群落组成进行系统分析,发现子囊菌门和担子菌门在9个采样地的真菌类群中均占优势地位,有研究显示[22-23]子囊菌门是真菌丰度最高的真菌类群,在偏碱与偏酸性的土壤中均能大量生存,对土壤的适应性较强,这与本研究的结果一致;在纲、科、属水平土壤真菌群落组成差异明显,这与阎威文等[24]的研究结果一致。阎威文等的研究显示野生羊肚菌根际土壤真菌优势菌属为被孢霉属(Mortierella),我们的研究结果中,只有在LC采样点被孢霉属是优势真菌群落之一。毋校辉[25]对四川8个地区羊肚菌种植根际土壤的高通量测序结果显示有两个采样点的优势真菌类群为被孢霉属,阎威文等[24]研究显示栽培羊肚菌根际土壤真菌优势菌属为红菇属(Russula)。由此可见,无论是野生羊肚菌还是栽培羊肚菌,其根际土壤真菌群落的差异均较大,另外,根际土壤的采集时间不同,真菌群落组成也有差异。
研究表明,土壤微生物多样性以及群落组成结构受土壤理化性质的影响显著[26]。本研究中,羊肚菌在偏酸与偏碱的环境均可生长,pH值随海拔的增加而减小。RDA分析结果显示,除pH值外,有效磷、Ca、Se含量与真菌群落相关性较大,其他土壤理化性质对根际土壤真菌群落的影响很小;尤其是土壤中的大量元素与真菌群落相关性小,其原因有待进一步分析。有研究表明土壤微生物群落的空间变异因土壤化学性质的不同而异[27],各地区土壤化学性质存在差异,致使其土壤原始菌群不同,使各地羊肚菌生长受侵扰程度不同,说明了羊肚菌栽培中土壤选择的重要性。
土壤酶是生态系统物质循环以及能量转化过程中重要的参与者[28],其主要来源为微生物。脱氢酶发挥的作用较大,脱氢酶能酶促脱氢反应,起着氢的中间传递体的作用;多酚氧化酶与优势真菌群落结构呈负相关,能将土壤中芳香族化合物氧化成醌,是表征对土壤中污染物净化能力的指标之一[29];磷酸酶是表征土壤碳、氮、磷等元素循环的因素之一,碱性磷酸酶与优势真菌群落子囊菌有显著的相关性,其他酶活性对真菌群落的影响不大。通过比较,认为土壤酶活性对真菌群落的影响较理化性质影响大。
羊肚菌人工种植的过程中,羊肚菌利用的碳源主要来源于外援营养袋,羊肚菌菌丝在地下如何代谢、与微生物的相互作用及如何积累营养物质支持出菇还不清楚,进一步开展野生羊肚菌菌丝生长期、原基形成期、子囊果成熟期土壤微生物组成与环境因子的相关性研究,能够为人工种植羊肚菌提供理论参考。